修回日期: 2015-03-10
接受日期: 2015-03-18
在线出版日期: 2015-04-28
目的: 观察氧化苦参碱(oxymatrine, OM)对转化生长因子β1(transforming growth factor-β1, TGF-β1)刺激的胰腺星状细胞株LTC-14细胞株Smad通路信号分子Smad2/3/4/7的影响.
方法: 取大鼠胰腺星状细胞株LTC-14细胞, 分别分为对照组、TGF-β1刺激组、OM干预组[TGF-β1+OM(1 mg/mL)]组. 12 h后提取细胞RNA及蛋白, 应用实时定量PCR及Western blot检测基因及蛋白表达量的变化情况.
结果: OM干预组与TGF-β1刺激组相比, OM干预组均可降低Smad2/3/4基因及蛋白表达, 结果有统计学意义(OM干预组 vs TGF-β1刺激组, P<0.05). OM干预组与TGF-β1刺激组相比, OM干预组使Smad7基因表达降低(OM干预组 vs TGF-β1刺激组, P<0.05), Smad7蛋白表达升高(OM干预组 vs TGF-β1刺激组, P<0.05).
结论: 体外实验中OM可以干预TGF-β1/Smad通路相关信号因子的基因蛋白表达; 可能对TGF-β1介导的胰腺星状细胞为核心的胰腺纤维化过程存在治疗作用.
核心提示: 氧化苦参碱(oxymatrine, OM)通过影响转化生长因子β(transforming growth factor-β)/Smad通路下的Smad3、Smad7等信号因子的基因、蛋白表达来影响胰腺星状细胞的功能, 从而研究OM治疗慢性胰腺炎的可能机制.
引文著录: 陈凯, 荣亚梅, 曹卫丽, 宗林飞, 冀润利. 氧化苦参碱对TGF-β1刺激的胰腺星状细胞Smad通路相关因子表达的影响. 世界华人消化杂志 2015; 23(12): 1883-1889
Revised: March 10, 2015
Accepted: March 18, 2015
Published online: April 28, 2015
AIM: To investigate the effect of oxymatrine (OM) on the expression of molecules of the Smad signal pathway in pancreatic stellate cell line (LTC-14 cells) stimulated with transforming growth factor-β1 (TGF-β1).
METHODS: LTC-14 cells were divided into a normal control group, a TGF-β1 stimulated group and a TGF-β1 + OM (1 mg/mL) group. The mRNA and protein were extracted from LTC-14 cells 12 h after treatment. The mRNA and protein expression of Smad2/3/4/7 was detected by real-time PCR and Western blot, respectively.
RESULTS: Compared with the TGF-β1 stimulated group, the mRNA and protein expression of Smad2/3/4 was dramatically reduced in the OM treated group (P < 0.05). Compared with the TGF-β1 stimulated group, the mRNA expression of Smad7 was significantly decreased in the OM treated group (P < 0.05), whereas the Smad7 protein expression was increased.
CONCLUSION: OM might exert a therapeutic effect against pancreatic fibrosis in pancreatic stellate cells stimulated with TGF-β1 by interfering with the mRNA and protein expression of molecules of the TGF-β1/Smad pathway.
- Citation: Chen K, Rong YM, Cao WL, Zong LF, Ji RL. Effect of oxymatrine on expression of molecules of Smad signal pathway in pancreatic stellate cells stimulated with TGF-β1. Shijie Huaren Xiaohua Zazhi 2015; 23(12): 1883-1889
- URL: https://www.wjgnet.com/1009-3079/full/v23/i12/1883.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i12.1883
慢性胰腺炎(chronic pancreatitis, CP)的典型病理表现为以胰腺实质纤维化为主. 胰纤维化的形成主要由于以胶原为主的细胞外基质(extracellular matrix, ECM)合成与沉积增加, 降解减少, 两者失去动态平衡所致[1].
近来发现胰腺星状细胞(pancreatic stellate cells, PSC)的活化是CP胰腺纤维化的中心环节, PSC是ECM的主要来源细胞, 激活的PSC可以产生Ⅰ型、Ⅲ型胶原及纤连蛋白等主要的ECM成分[2]. 目前认为, 在正常胰腺组织中, PSC处于静止状态, 他能表达细胞骨架蛋白如结蛋白、波形蛋白、胶质原纤维酸性蛋白. 当PSC激活时, 其形态和功能都发生变化, 胞内储维生素A的脂滴减少, PSC大量增殖, 转化为成肌纤维细胞样细胞, 合成和分泌多种ECM成分[3].
转化生长因子β1(transforming growth factor-1, TGF-β1)是最强效的致纤维化细胞因子, 在PSC激活活化中扮演重要角色, TGF-β1下游的Smad通路是其经典通路[4]. 在信号转导过程中, 磷酸化的转化生长因子受体(transforming growth factor receptor, TβR)激活Smad2和Smad3羧基端4个氨基酸的保守序列(S-S-X-S), 磷酸化的Smad2和Smad3结合Smad4形成异聚体, 并移位至细胞核. 在细胞核中Smad复合物利用Smad同家族序列CAGAC直接识别目的基因, 调节基因的转录. Smad7是TGF-β1信号转导抑制分子, 可与Smad2或Smad3竞争结合TGF-β1型受体或Smad4, 阻断Smad2或Smad3被磷酸化并转位至细胞核内, 抑制信号的转导[5].
苦参系药用豆科槐属植物苦参(sophora flavescens ait)的干燥根, 性寒味苦, 始载于我国最早的药学文献《神农本草经》. 随着分离提取技术的进步, 发现在苦参、苦豆子、广豆根中存在同一类以氧化苦参碱(oxymatrine, OM)为代表的生物碱. 近年大量的实验和临床研究[6-8]结果表明OM具有明显的抗器官纤维化作用, 其在抗肝脏纤维化中的作用被广泛研究和证实, 但在胰腺中其是否通过影响TGF-β1/Smad通路干预PSC活化、胰腺组织纤维化进程尚未见文献报道.
胎牛血清购自Gibco公司; 青链霉素混合液购自Solarbio公司; IMDM培养基购自HyClone公司; TGF-β1购自Peprotech公司; OM购自Sigma公司; 胰酶消化液购自北京鼎国昌盛生物技术有限责任公司; TRIzol购自Invitrogen公司; 750 mL/L乙醇(分析纯)、氯仿(分析纯)、异丙醇(分析纯)、DEPC水购自北京鼎国昌盛生物技术有限责任公司; MTT试剂购自Invitrogen公司; 实时荧光定量PCR扩增试剂盒和逆转录试剂盒购自北京全式金生物技术有限公司. Smad2、3、4、7多克隆抗体、β-actin单克隆抗体购自Proteintech公司; DMSO购自Sigma公司; BCA蛋白定量试剂盒购自北京鼎国昌盛生物技术有限责任公司.
1.2.1 细胞培养: LTC-14细胞株是由德国Rostock大学医院的Robert Jaster教授惠赠[9]. 细胞在含10%胎牛血清的IMDM培养基中, 置于37 ℃、50 mL/L CO2的孵育箱(相对湿度为95%)中培养. 将细胞培养于含10%胎牛血清的IMDM培养基中, 待细胞生长到培养瓶约70%-80%密度时, 用0.25%胰酶消化液将细胞消化后传代. 取对数生长期细胞用于试验研究.
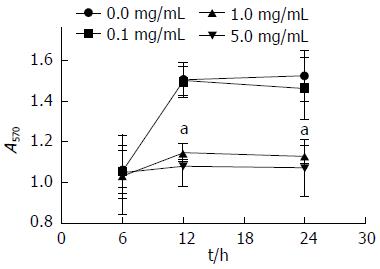
1.2.2 细胞增殖试验(MTT法): 参考Ling等[10]PANC-1细胞试验中OM浓度, 按照倍比稀释原则将OM分为0、0.1、1.0、5.0 mg/mL浓度分为4组, 每组按照培养时间分为6、12、24 h 3组, 每组设3个重复孔. 将传代培养的LTC-14细胞株用胰酶消化液消化之后, 稀释成1×103个/L的细胞悬液, 并接种于96孔细胞板, 每孔加入100 μL培养基, 培养24 h后, 换入100 μL无血清无双抗的IMDM培养基饥饿4 h, 然后每孔分别加入含相应浓度OM, 30 min后加入预实验摸出的最佳刺激浓度的TGF-β1继续培养. 分别于相应时间点取出96孔板, 加入含0.5%浓度的MTT(5 mg/mL)的培养基100 μL, 4 h后终止培养, 弃去培养基, 每个孔中加入150 μL DMSO, 置于摇床上低速振荡10 min, 用酶联免疫检测仪570 nm测定各孔吸光度值(A570).
1.2.3 Real-time PCR检测细胞基因表达: 于6孔板培养细胞, 分对照组、TGF-β1组、TGF-β1+OM组3组使用预实验及上述实验最佳TGF-β1刺激浓度以及最佳OM干预浓度、时间培养细胞. 终止培养后, TRIzol法提取细胞RNA, 逆转录cDNA后使用SYBR green染料法进行Real-time PCR检测Smad2、3、4、7基因表达量的变化. 引物设计经由PubMed下引物合成程序Primer-BLAST设计, 如表1.
| 引物名称 | DNA序列 | |
| β-actin | 上游引物 | 5'-AGATCCTGACCGAGCGTGGC-3' |
| 下游引物 | 5'-CCAGGGAGGAAGAGGATGCG-3' | |
| Smad2 | 上游引物 | 5'-CTGCCGCCTCTGGATGACT-3' |
| 下游引物 | 5'-TGGTGGTGTTTCTGGGATGTAA-3' | |
| Smad3 | 上游引物 | 5'-GGCAGGAGGAGAAGTGGT-3' |
| 下游引物 | 5'-AGTGACCTGGGGATGGTA-3' | |
| Smad4 | 上游引物 | 5'-CAGGTGCCTCAGTGACCAGC-3' |
| 下游引物 | 5'-CCAGGACCAGGGATGTTTCC-3' | |
| Smad7 | 上游引物 | 5'-AACTGCAGACTGTCCAGACG-3' |
| 下游引物 | 5'-TCCCCACTCGAGTCTTCTCC-3' | |
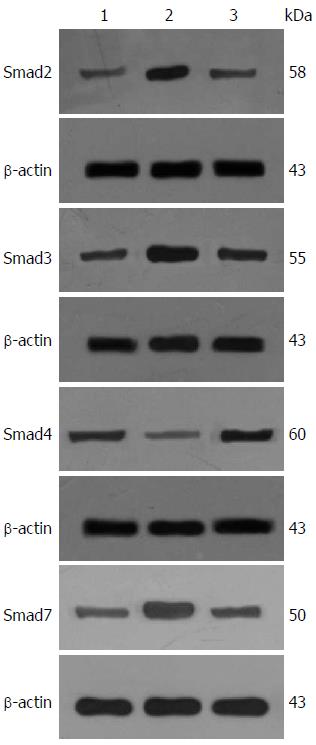
1.2.4 Western blot检测细胞蛋白表达: 于100 mm培养皿中培养细胞, 分对照组、TGF-β1组、TGF-β1+OM组3组使用预实验及MTT实验最佳TGF-β1刺激浓度以及最佳OM干预浓度、时间培养细胞. 终止培养后, RIPA裂解提取细胞总蛋白, 经BSA蛋白定量法蛋白定量, 经变性蛋白电泳、转膜, 一抗4 ℃孵育过夜, TBST摇床洗膜15 min×4次, 二抗室温摇床孵育2 h, TBST摇床洗膜15 min×4次, ECL法化学发光, 暗室底物显影压片, ImageJ软件灰度比较分析.
统计学处理 使用GraphPad Prism 6统计学软件分析处理数据, 数据用mean±SD表示, 组间比较用单因素方差分析. P<0.05为差异具有统计学意义.
不同浓度OM于不同时间点MTT法检测LTC-14细胞增殖活性, OM浓度1.0、5.0 mg/mL在12、24 h时较低浓度(0、0.1 mg/mL)时A570 nm结果差异有统计学意义(P<0.01)(图1).
与对照组相比, 加入预实验得出最佳TGF-β1浓度8 ng/mL处理12 h后, Smad2表达量上调1.72倍, Smad3上调116.1倍, Smad4上调1.31倍, Smad7上调8.97倍(均P<0.05).
加入TGF-β1前30 min预加入1.0 mg/mL OM, 处理12 h后与对照组相比Smad2下降至0.41倍, Smad3下降至12.9倍, Smad4下降至0.49倍, Smad7下降至5.32倍, 较TGF-β1组, 差异有统计学意义(均P<0.05)(表2).
| 分组 | Smad2 | Smad3 | Smad4 | Smad7 |
| Normal组 | 1.00±0.00 | 1.00±0.00 | 1.00±0.00 | 1.00±0.00 |
| TGF-β1组 | 1.72±0.41a | 116.1±27.61b | 1.31±0.12a | 8.97±0.88b |
| TGF-β1+OM组 | 0.41±0.11d | 12.9±7.15d | 0.49±0.18d | 5.32±1.54c |
与对照组相比, 加入8 ng/mL TGF-β1处理12 h后, Smad2蛋白表达量上调2.96倍, Smad3上调3.19倍, Smad4上调1.65倍, Smad7下调0.19倍(均P<0.05).
加入TGF-β1前30 min预加入1.0 mg/mL OM, 处理12 h后与对照组相比Smad2下降至1.19倍, Smad3下降至1.58倍, Smad4下降至0.73倍, Smad7回复至0.72倍, 较TGF-β1组, 差异有统计学意义(均P<0.05)(表3, 图2).
| 分组 | Smad2 | Smad3 | Smad4 | Smad7 |
| Normal组 | 0.26±0.13 | 0.31±0.10 | 0.63±0.09 | 0.85±0.31 |
| TGF-β1组 | 0.77±0.11b | 0.99±0.11b | 1.04±0.13a | 0.16±0.05b |
| TGF-β1+OM组 | 0.31±0.10d | 0.49±0.14d | 0.46±0.14d | 0.62±0.05d |
CP的主要病理机制是胰腺组织纤维化. 研究[11,12]表明, PSC活化、增殖在CP胰腺纤维化中处于核心地位. PSC活化后通过自分泌、旁分泌途径分泌多种细胞因子, 使ECM合成增多, 而降解相对减少, 过多的ECM沉积导致胰腺纤维化的发生发展. 在胰腺纤维化发生、发展过程中, 有多种转录因子和信号转导通路参与, 其中TGF-β是胰腺纤维化中的最强刺激因子[13,14], 而TGF-β又是主要通过TGF-β/Smad通路发挥他的生物学作用的. 信号传导中, TβR先与TGF-β结合. 其中, TβR为必需的信号传导介质[15]. TGF-β信号传导的过程是: TGF-β先后与TβRⅠ/Ⅱ分子结合形成复合物; 从而使TGF-β信号向下游传导激活Smad通路. 根据Smad蛋白在TGF-β家族中信号传导中的作用可以分为3类: (1)途径限制型Smad(pathway-restricted Smad); (2)共同介质型Smad; (3)抑制型Smad[16,17]. 本实验中研究的信号分子Smad2、Smad3为途径限制性, Smad4为共同介质型, Smad7为抑制型. 他们的表达量及激活情况可以反映该条通路的激活与否, 信号是否经由该条通路下传.
有研究[18,19]指出, 经过转基因技术体内过度表达TGF-β的小鼠胰腺有相当程度的纤维化, 表现出类似CP的病理特征. 当胰腺组织受到理化刺激时, 胰腺腺泡细胞分泌TGF-β使PSC活化, 细胞内脂滴消失, 向间质细胞转化, 分泌多种ECM[20,21]. 而活化后的PSC细胞又能自分泌包括TGF-β在内的多种细胞因子, 而自激活, 持续性的自激活导致了纤维化的进展[22]. 从这点出发, 本实验设计了外源性的TGF-β1作为体外培养PSC模拟纤维化的刺激物来进行试验, 在8 ng/mL时可见明显的Smad2、Smad3基因高表达, 提示TGF-β1/Smad通路的启动, 而Smad7基因也出现了升高, 提示负反馈调控机制也在发挥作用 .
在人体多数器官中Smad信号通路作为TGF-β信号转导的经典通路也参与到了TGF-β诱导的纤维化中来. Liang等[23]研究发现熊去氧胆酸可通过抑制Smad3的表达、增加Smad7的表达来作用于TGF-β/Smad通路从而发挥其抑制组织纤维化的作用. Latella等[24]采用腹腔注射二甲基亚硝胺的方法诱导Smad3基因敲除小鼠和野生型小鼠发生肝纤维化结果发现野生型小鼠肝纤维化程度高于Smad3敲除小鼠, 表明Smad3信号因子缺失能够对组织纤维化起到抵抗作用. 徐新保等[25]发现反义Smad4基因能有效减少Smad4基因的表达部分阻断TGF-β信号传导系统, 以阻止HSC的活化, 减少ECM的产生, 从而减缓组织纤维化的发展. 在胰腺中Ohnishi等[26]发现, TGF-β通过Smad2依赖途径促进PSCs的活化, 使用病毒转染抑制Smad2信号分子表达后PSC的活化被抑制了. Zion等[27]对体外培养PSC和在体实验通过腹腔注射雨蛙肽制备的胰腺纤维化模型小鼠, 经药物干预Smad3信号分子表达, 降低其磷酸化激活, 降低了胰腺纤维化, 提示Smad3信号的激活与胰腺纤维化密切相关. 马松林等[28]通过对34例胰腺纤维化患者组织标本免疫组织化学染色发现TGF-β1、Smad3表达升高, Smad7表达降低, 提示TGF-β1和Smad3的高表达以及Smad7的低表达可能促进胰腺纤维化的发生发展, 提示通过靶向性阻断TGF-β/Smad信号通路的传导可能会阻断胰腺纤维化的进展, 从而达到治疗胰腺纤维化、CP的目的.
在OM的研究中, 学者们也发现其能通过干预TGF-β/Smad通路各信号分子抑制组织纤维化. 曾维政等[29]研究发现, 对于CCl4诱导的大鼠肝纤维化模型中加入OM干预能降低Smad4分子的蛋白表达, 提高Smad7分子的蛋白表达, Masson染色显示组织纤维化程度相应的降低. 我们前期研究也发现OM能降低由DDC诱导的大鼠胰腺纤维化程度, 但其的主要作用机制还不明确[30].
本实验发现加入一定浓度OM可以降低星状细胞活性, 抑制PSC增殖, MTT试验发现1.0 mg/mL的OM浓度可以很明显的抑制LTC-14细胞的细胞活性, 减少其增殖. 对于该现象机制研究发现加入外源性TGF-β1后Smad2、3、4均有不同程度的表达升高, 这种升高说明整条通路的激活, 而加入OM后表达降低, 说明OM在一定程度上抑制了该条通路上信号的传导; Smad7在加入TGF-β1后基因表达也出现了升高, 而蛋白表达降低, 这可能与负反馈调控和蛋白水平上的消耗有关, 加入OM后Smad7蛋白表达明显增多, 这种现象提示OM可能是通过增加Smad7信号分子的蛋白表达来抑制TGF-β/Smad信号通路的.
OM通过降低Smad2、3、4的表达, 升高Smad7蛋白表达, 多方面抑制TGF-β/Smad信号通路的转导, 从而抑制PSC细胞的增殖活化. 而信号分子之间具体的相互作用机制以及OM明确的结合位点还需要后续实验深入讨论. 深入研究TGF-β/Smad信号通路在PSC活化中的作用以及OM在其中处于何种角色, 不仅有助于进一步阐明胰腺纤维化的发病机制, 也可为临床治疗CP提供关键靶标和有效的治疗药物.
慢性胰腺炎(chronic pancreatitis, CP)胰腺纤维化缺乏有效的治疗药物, 氧化苦参碱(oxymatrine, OM)作为传统中药, 具有广泛的抗器官纤维化的作用. 转化生长因子β1(transforming growth factor-β1, TGF-β1)/Smad通路在疾病中的作用越来越引起人们关注, OM是否可以通过该通路来发挥抗纤维化的作用亟待研究证实.
周力, 主任医师, 贵阳医学院附属医院消化内科
近年来许多研究发现OM在各种脏器中的抗纤维化作用, 在肝、肾、肺等器官对TGF-Smad通路下某些因子的研究亦见发表, 但对胰腺纤维化中对相关通路的系统研究仍有待进一步研究.
Zion等对体外培养胰腺星状细胞(pancreatic stellate cells, PSC)和在体实验通过腹腔注射雨蛙肽制备的胰腺纤维化模型小鼠, 经药物干预Smad3信号分子表达, 降低其磷酸化激活, 降低了胰腺纤维化, 提示Smad3信号的激活与胰腺纤维化密切相关.
本文探讨了体外星状细胞在TGF-β/Smad经典通路下途径限制、抑制及共同介质型Smad分子在外源性TGF-β1激活、OM干预下的变化情况, 已阐述OM在治疗CP胰腺纤维化的可能机制.
通过对OM对PSC中TGF-β/Smad经典通路的影响, 对OM治疗胰腺纤维化的可能机制进行研究, 为治疗胰腺纤维化提供可能的作用靶点.
LTC-14细胞株: 由德国Rostock大学医院的Robert Jaster教授杂交成功的永生化大鼠PSC株.
相关研究国内仍较少, 对CP今后的治疗探讨或进一步研究有指导意义.
编辑: 郭鹏 电编:闫晋利
| 1. | Muniraj T, Aslanian HR, Farrell J, Jamidar PA. Chronic pancreatitis, a comprehensive review and update. Part I: epidemiology, etiology, risk factors, genetics, pathophysiology, and clinical features. Dis Mon. 2014;60:530-550. [PubMed] [DOI] |
| 2. | Cooper MA, Makary MA, Ng J, Cui Y, Singh VK, Matsukuma K, Andersen DK. Extent of pancreatic fibrosis as a determinant of symptom resolution after the Frey procedure: a clinico-pathologic analysis. J Gastrointest Surg. 2013;17:682-687. [PubMed] |
| 3. | Long D, Lu J, Luo L, Guo Y, Li C, Wu W, Shan J, Li L, Li S, Li Y. Effects of octreotide on activated pancreatic stellate cell-induced pancreas graft fibrosis in rats. J Surg Res. 2012;176:248-259. [PubMed] [DOI] |
| 4. | Zhang H, Liu C, Kong Y, Huang H, Wang C, Zhang H. TGFβ signaling in pancreatic ductal adenocarcinoma. Tumour Biol. 2014; Oct 31. [Epub ahead of print]. [PubMed] |
| 5. | Ungefroren H, Sebens S, Giehl K, Helm O, Groth S, Fändrich F, Röcken C, Sipos B, Lehnert H, Gieseler F. Rac1b negatively regulates TGF-β1-induced cell motility in pancreatic ductal epithelial cells by suppressing Smad signalling. Oncotarget. 2014;5:277-290. [PubMed] |
| 6. | Yang J, Hou Y, Ji G, Song Z, Liu Y, Dai G, Zhang Y, Chen J. Targeted delivery of the RGD-labeled biodegradable polymersomes loaded with the hydrophilic drug oxymatrine on cultured hepatic stellate cells and liver fibrosis in rats. Eur J Pharm Sci. 2014;52:180-190. [PubMed] |
| 7. | Chai NL, Fu Q, Shi H, Cai CH, Wan J, Xu SP, Wu BY. Oxymatrine liposome attenuates hepatic fibrosis via targeting hepatic stellate cells. World J Gastroenterol. 2012;18:4199-4206. [PubMed] [DOI] |
| 8. | Liu L, Lu W, Ma Z, Li Z. Oxymatrine attenuates bleomycin-induced pulmonary fibrosis in mice via the inhibition of inducible nitric oxide synthase expression and the TGF-β/Smad signaling pathway. Int J Mol Med. 2012;29:815-822. [PubMed] |
| 9. | Tsang SW, Zhang H, Lin C, Xiao H, Wong M, Shang H, Yang ZJ, Lu A, Yung KK, Bian Z. Rhein, a natural anthraquinone derivative, attenuates the activation of pancreatic stellate cells and ameliorates pancreatic fibrosis in mice with experimental chronic pancreatitis. PLoS One. 2013;8:e82201. [PubMed] [DOI] |
| 10. | Ling Q, Xu X, Wei X, Wang W, Zhou B, Wang B, Zheng S. Oxymatrine induces human pancreatic cancer PANC-1 cells apoptosis via regulating expression of Bcl-2 and IAP families, and releasing of cytochrome c. J Exp Clin Cancer Res. 2011;30:66. [PubMed] |
| 11. | Masamune A, Watanabe T, Kikuta K, Shimosegawa T. Roles of pancreatic stellate cells in pancreatic inflammation and fibrosis. Clin Gastroenterol Hepatol. 2009;7:S48-S54. [PubMed] |
| 12. | Uchida M, Ito T, Nakamura T, Hijioka M, Igarashi H, Oono T, Kato M, Nakamura K, Suzuki K, Takayanagi R. Pancreatic stellate cells and CX3CR1: occurrence in normal pancreas and acute and chronic pancreatitis and effect of their activation by a CX3CR1 agonist. Pancreas. 2014;43:708-719. [PubMed] [DOI] |
| 13. | Gressner AM, Weiskirchen R. Modern pathogenetic concepts of liver fibrosis suggest stellate cells and TGF-beta as major players and therapeutic targets. J Cell Mol Med. 2006;10:76-99. [PubMed] [DOI] |
| 14. | Sanvito F, Nichols A, Herrera PL, Huarte J, Wohlwend A, Vassalli JD, Orci L. TGF-beta 1 overexpression in murine pancreas induces chronic pancreatitis and, together with TNF-alpha, triggers insulin-dependent diabetes. Biochem Biophys Res Commun. 1995;217:1279-1286. [PubMed] [DOI] |
| 15. | Lee UE, Friedman SL. Mechanisms of hepatic fibrogenesis. Best Pract Res Clin Gastroenterol. 2011;25:195-206. [PubMed] [DOI] |
| 16. | Suzuki H, Yagi K, Kondo M, Kato M, Miyazono K, Miyazawa K. c-Ski inhibits the TGF-beta signaling pathway through stabilization of inactive Smad complexes on Smad-binding elements. Oncogene. 2004;23:5068-5076. [PubMed] [DOI] |
| 17. | Lu N, Liu Y, Tang A, Chen L, Miao D, Yuan X. Hepatocyte-Specific Ablation of PP2A Catalytic Subunit α Attenuates Liver Fibrosis Progression via TGF-β1/Smad Signaling. Biomed Res Int. 2015;2015:794862. [PubMed] [DOI] |
| 18. | Vogelmann R, Ruf D, Wagner M, Adler G, Menke A. Effects of fibrogenic mediators on the development of pancreatic fibrosis in a TGF-beta1 transgenic mouse model. Am J Physiol Gastrointest Liver Physiol. 2001;280:G164-G172. [PubMed] |
| 19. | Zhang J, Ning X, Cui W, Bi M, Zhang D, Zhang J. Transforming growth factor (TGF)-β-induced microRNA-216a promotes acute pancreatitis via Akt and TGF-β pathway in mice. Dig Dis Sci. 2015;60:127-135. [PubMed] [DOI] |
| 20. | Apte MV, Haber PS, Darby SJ, Rodgers SC, McCaughan GW, Korsten MA, Pirola RC, Wilson JS. Pancreatic stellate cells are activated by proinflammatory cytokines: implications for pancreatic fibrogenesis. Gut. 1999;44:534-541. [PubMed] [DOI] |
| 21. | Lee H, Lim C, Lee J, Kim N, Bang S, Lee H, Min B, Park G, Noda M, Stetler-Stevenson WG. TGF-beta signaling preserves RECK expression in activated pancreatic stellate cells. J Cell Biochem. 2008;104:1065-1074. [PubMed] [DOI] |
| 22. | Shek FW, Benyon RC, Walker FM, McCrudden PR, Pender SL, Williams EJ, Johnson PA, Johnson CD, Bateman AC, Fine DR. Expression of transforming growth factor-beta 1 by pancreatic stellate cells and its implications for matrix secretion and turnover in chronic pancreatitis. Am J Pathol. 2002;160:1787-1798. [PubMed] [DOI] |
| 23. | Liang TJ, Yuan JH, Tan YR, Ren WH, Han GQ, Zhang J, Wang LC, Qin CY. Effect of ursodeoxycholic acid on TGF beta1/Smad signaling pathway in rat hepatic stellate cells. Chin Med J (Engl). 2009;122:1209-1213. [PubMed] |
| 24. | Latella G, Vetuschi A, Sferra R, Catitti V, D'Angelo A, Zanninelli G, Flanders KC, Gaudio E. Targeted disruption of Smad3 confers resistance to the development of dimethylnitrosamine-induced hepatic fibrosis in mice. Liver Int. 2009;29:997-1009. [PubMed] |
| 26. | Ohnishi H, Miyata T, Yasuda H, Satoh Y, Hanatsuka K, Kita H, Ohashi A, Tamada K, Makita N, Iiri T. Distinct roles of Smad2-, Smad3-, and ERK-dependent pathways in transforming growth factor-beta1 regulation of pancreatic stellate cellular functions. J Biol Chem. 2004;279:8873-8878. [PubMed] [DOI] |