修回日期: 2015-02-12
接受日期: 2015-03-06
在线出版日期: 2015-04-08
目的: 观察联合应用复方阿嗪米特肠溶片和复合营养素(Noveliver), 对失代偿期肝硬化患者血清白蛋白(albumin, ALB)、前白蛋白(pre-albumin, PA)水平及腹水的发生情况和严重程度的影响.
方法: 共有35例失代偿期肝硬化纳入研究, 包括20例治疗组患者接受复方阿嗪米特肠溶片联合复合营养素(Noveliver)治疗加常规药物治疗, 15例只接受常规药物治疗. 随访12 wk, 随访期限内, 收集两组患者腹水的发生情况及严重程度; 检测两组患者血清ALB及PA水平.
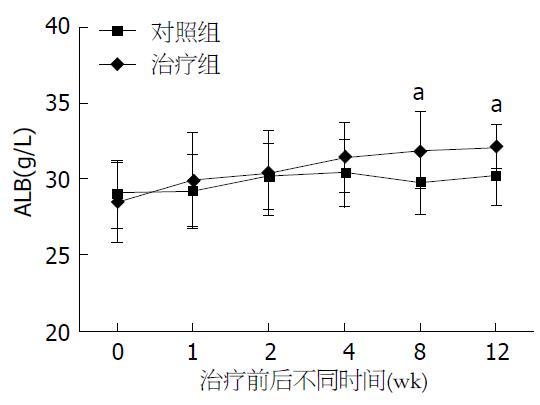
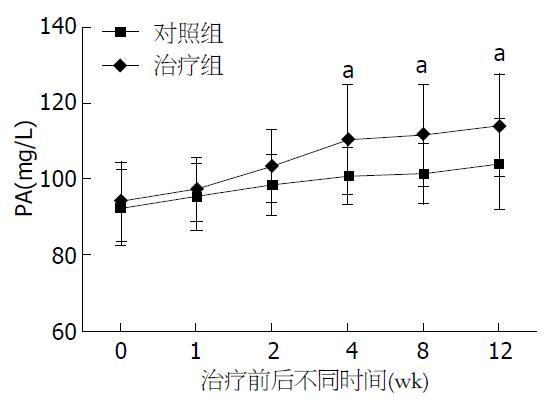
结果: 在治疗后12 wk, 复方阿嗪米特肠溶片联合复合营养素(Noveliver)治疗组腹水改善情况显著优于对照组(P<0.05). 治疗组血清PA及ALB水平逐渐增加, 其中血清PA水平在治疗后4 wk时(110.3 mg/L±14.6 mg/L vs 100.8 mg/L±7.5 mg/L, P<0.05)、ALB在治疗后8 wk时(31.9 g/L±2.5 g/L vs 29.8 g/L±2.1 g/L, P<0.05)即显著高于对照组, 两组差异有统计学意义(P<0.05), 并持续至12 wk.
结论: 复方阿嗪米特肠溶片联合复合营养素(Noveliver)改善失代偿期肝硬化患者的营养状况, 提高血清ALB及PA的水平, 改善腹水的发生情况及严重程度.
核心提示: 我们的研究结果表明, 在失代偿期肝硬化患者, 在常规饮食及肝硬化常规治疗的基础上给予复方阿嗪米特肠溶片联合复合营养素(Noveliver)营养支持治疗, 可以改善失代偿期肝硬化患者腹水的发生情况, 并可以改善肝细胞血清白蛋白及前白蛋白的合成, 提高失代偿期肝硬化患者血清白蛋白及前白蛋白的水平.
引文著录: 杨雅阁, 张孟徐, 郑晓永, 李鸿彬, 白阳秋, 杨玉秀, 张炳勇. 复方阿嗪米特肠溶片联合复合营养素(Noveliver)对失代偿期肝硬化患者血清白蛋白及前白蛋白水平的影响. 世界华人消化杂志 2015; 23(10): 1644-1648
Revised: February 12, 2015
Accepted: March 6, 2015
Published online: April 8, 2015
AIM: To observe the effect of compound azintamide enteric-coated tablet combined with compound nutrients (Noveliver) on serum albumin (ALB) and pre-albumin (PA) levels in patients with decompensated liver cirrhosis.
METHODS: A total of 35 inpatients with decompensated liver cirrhosis were enrolled in this trial, including 20 patients treated with compound azintamide enteric-coated tablet combined with compound nutrients (Noveliver) plus routine medical treatment, and 15 patients receiving routine medical treatment only as controls. The efficacy of compound azintamide enteric-coated tablet combined with compound nutrients (Noveliver) was monitored during a 12-week follow-up period.
RESULTS: After treatment with compound azintamide enteric-coated tablet combined with compound nutrients (Noveliver), serum PA and ALB levels increased gradually. PA levels at 4 wk after treatment were 110.3 mg/L ± 14.6 mg/L vs 100.8 mg/L ± 7.5 mg/L (P < 0.05) in the treatment group and control group. ALB levels at 8 wk after treatment and 31.9 g/L ± 2.5 g/L vs 29.8 g/L ± 2.1 g/L (P < 0.05) in the treatment group and control group. The efficacy continued to 12 wk after treatment.
CONCLUSION: Compound azintamide enteric-coated tablet combined with compound nutrients (Noveliver) improves the nutritional status of patients with decompensated cirrhosis, increases serum ALB and PA levels, and reduces the incidence and severity of ascites.
- Citation: Yang YG, Zhang MX, Zheng XY, Li HB, Bai YQ, Yang YX, Zhang BY. Effect of compound azintamide enteric-coated tablet combined with compound nutrients (Noveliver) on serum albumin and pre-albumin levels in patients with decompensated liver cirrhosis. Shijie Huaren Xiaohua Zazhi 2015; 23(10): 1644-1648
- URL: https://www.wjgnet.com/1009-3079/full/v23/i10/1644.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i10.1644
肝硬化患者肝细胞合成功能障碍, 普遍存在低蛋白血症, 血清白蛋白(albumin, ALB)水平是肝硬化患者腹水形成、继发感染、肝功能好坏的重要指标[1-3]. 在CCl4诱导的肝纤维化大鼠, 给予以蜂花粉为基础的复合营养素(Noveliver)进行营养治疗能提高肝纤维化大鼠血清ALB水平[4]. 同时相关研究[5]报道复方阿嗪米特肠溶片可显著改善肝硬化患者腹胀症状. 复方阿嗪米特肠溶片联合复合营养素(Noveliver)在肝硬化患者中应用尚未见报道, 本研究通过联合应用复方阿嗪米特肠溶片和复合营养素(Noveliver), 观察其对失代偿期肝硬化患者血清ALB及前白蛋白(pre-albumin, PA)水平的影响.
治疗组: 20例失代偿期肝硬化为2012-03/2014-03在郑州大学人民医院消化内科住院治疗的患者, 男13例, 女7例, 年龄24-64岁, 平均年龄47.6岁, 其中乙型肝炎肝硬化18例, 酒精性肝硬化2例. 对照组: 15例失代偿期肝硬化为2012-03/2014-03在郑州大学人民医院消化内科住院治疗的患者, 男10例, 女5例, 年龄28-66岁, 平均年龄47.7岁, 其中乙型肝炎肝硬化14例, 酒精性肝硬化1例. 两组患者均确诊为肝硬化失代偿期, Child-Pugh分级为B或C级. 入选标准: 有明确的肝硬化及门静脉高压的影像学证据; 肝功异常(ALB、胆红素及凝血功能异常); 甲胎蛋白(alpha-fetoprotein, AFP)正常, 肝动脉造影无肝癌. 排除标准: 合并心、肺功能异常; 血液系统疾病; 获得性免疫缺陷病; 其他的恶性肿瘤的患者; 肝静脉或门静脉急性或慢性血栓形成; 近2 mo内失代偿期肝硬化患者合并严重并发症(如严重感染、难治性腹水、曲张静脉破裂出血、中重度肝性脑病). 所有患者神志清楚, 生命体征稳定, 无可能威胁生命的急性病症, 控制血清转氨酶在200 U/L以下、总胆红素在100 μmol/L以下、血小板在30 × 109/L以上. 该项目通过了郑州大学人民医院伦理委员会的审查批准, 所有患者及家属了解该治疗的目的和方法, 并签订知情同意书.
1.2.1 治疗: 治疗组和对照组均给予常规饮食. 治疗组给予肝硬化常规治疗+复方阿嗪米特肠溶片联合复合营养素(Noveliver)治疗. 对照组给予肝硬化常规治疗.
肝硬化常规治疗方案: 抗乙型肝炎病毒、保肝、降酶、退黄等, 有腹水者给予利尿治疗.
复方阿嗪米特肠溶片联合复合营养素(Noveliver)治疗: 复方阿嗪米特肠溶片, 给药3次/d, 2粒/次, 餐后服用, 疗程为12 wk; 复合营养素(Noveliver)15 g, 早晚各口服1次, 疗程为12 wk.
1.2.2 随访与检测: 随访期限为12 wk. 随访期限内, 收集两组患者腹水的发生情况及严重程度; 于不同时间(治疗前、治疗后l、2、4、8、12 wk), 检测两组患者血清ALB及PA水平.
腹水严重程度分级: 轻度, 经彩超或CT才能发现, 体格检查未发现阳性改变; 中度, 经肉眼或者体格检查, 腹部可见中度对称性腹部膨胀, 腹部移动性浊音阳性; 重度, 腹部可见明显的腹胀, 部分患者可并发脐疝等. 有无腹水及腹水严重程度, 分为无/轻度、中/重度.
统计学处理 数据采用SPSS17.0统计软件进行统计分析, 数据以mean±SD表示, 组间定量资料比较采用t检验, 组间定性资料比较采用χ2检验, P<0.05为差异有统计学意义.
在治疗前, 治疗组与对照组腹水情况对比差异无统计学意义. 在治疗后, 治疗组腹水改善情况较对照组明显, 差异有统计学意义(P<0.05)(表1).
| 分组 | n | 治疗前 | 治疗后12 wk | ||
| 无/轻度 | 中/重度 | 无/轻度 | 中/重度 | ||
| 对照组 | 15 | 6 | 9 | 8 | 7 |
| 治疗组 | 20 | 9 | 11 | 17 | 3 |
| χ2值 | 0.088 | 4.212 | |||
| P值 | 0.767 | 0.040 | |||
复方阿嗪米特肠溶片联合复合营养素(Noveliver)治疗后, 治疗组血清ALB及PA水平逐渐增加, 其中PA水平在治疗后4 wk时(110.3 mg/L±14.6 mg/L vs 100.8 mg/L±7.5 mg/L, P<0.05)、ALB在治疗后8 wk时(31.9 g/L±2.5 g/L vs 29.8 g/L±2.1 g/L, P<0.05)即显著高于对照组, 两组差异有统计学意义(P<0.05), 并持续至12 wk(表2, 表3, 图1, 图2).
| 分组 | n | 治疗前 | 1 wk | 2 wk | 4 wk | 8 wk | 12 wk |
| 对照组 | 15 | 29.0±2.2 | 29.2±2.4 | 30.2±2.2 | 30.4±2.2 | 29.8±2.1 | 30.2±1.9 |
| 治疗组 | 20 | 28.5±2.6 | 29.9±3.1 | 30.4±2.8 | 31.4±2.3 | 31.9±2.5 | 32.1±1.4 |
| 统计值 | 0.688 | 0.740 | 00.167 | 1.379 | 2.644 | 2.570 | |
| P值 | 0.496 | 0.464 | 0.868 | 0.177 | 0.012 | 0.015 |
| 分组 | n | 治疗前 | 1 wk | 2 wk | 4 wk | 8 wk | 12 wk |
| 对照组 | 15 | 92.4±10.0 | 95.4±8.9 | 98.6±7.8 | 100.8±7.5 | 101.4±7.80 | 103.8±11.9 |
| 治疗组 | 20 | 93.9±10.3 | 97.1±8.3 | 103.3±9.5 | 110.3±14.6 | 111.6±13.4 | 114.1±13.5 |
| 统计值 | 0.446 | 0.598 | 1.534 | 2.304 | 2.644 | 2.344 | |
| P值 | 0.658 | 0.554 | 0.135 | 0.028 | 0.012 | 0.025 |
肝硬化患者普遍存在蛋白质-能量营养不良[6,7], 而且肝病患者的营养状况与疾病的进展相关[8]. 因此, 营养干预可以作为肝脏疾病其他治疗方法的重要补充, 在肝硬化患者的综合治疗中是至关重要的一环.
既往研究[9,10]表明基于复方蜂花粉的营养支持能明显改善肝功能, 可作为肝病营养支持治疗的较好的材料. 复合营养素(Noveliver)就是基于蜂花粉的复合营养制剂, 复合营养素(Noveliver)是由美国加州Myer Otec生物国际公司肝细胞基质研究所研制的基于蜂花粉的复方营养素. 复合营养素(Noveliver)是目前国际上唯一针对慢性肝病患者的新型复合营养和免疫调节素, 主要由超微蜂花粉、乳清蛋白、富硒酵母、磷脂等组成. 复合营养素(Noveliver)的配方比较适合肝病患者, 其成分中含有丰富的花粉蛋白, 是ALB合成必不可少的营养物质, 同时可提供肝脏营养代谢所需的复合营养.
因此, 如果通过改善肝功能、促进肝细胞再生修复而改善肝脏ALB合成, 既减少患者治疗费用, 又可提高患者生存质量, 减少严重并发症的发生率, 减少住院次数, 延长生存期.
我们的研究结果表明, 在复方阿嗪米特肠溶片联合复合营养素(Noveliver)治疗后的第4周, 治疗组的血清PA较对照组显著增加, 两组间差异有统计学意义(P<0.05); 在治疗后的第8周, 治疗组血清PA及ALB水平均明显高于对照组(P<0.05), 并持续至12 wk, 这表明复方阿嗪米特肠溶片联合复合营养素(Noveliver)可以促进失代偿期肝硬化患者血清ALB及PA的合成, 改善肝硬化患者营养不良状况.
腹水是失代偿期肝硬化患者的标志性体征[11]. 肝硬化失代偿期患者, 血清ALB往往很低, 随着腹水的进一步加重, 血清ALB进一步下降. 通过改善患者的血清ALB水平, 提高胶体渗透压, 从而减少腹水形成[12-16]. 本研究观察患者腹水情况, 按腹水严重程度分为无/轻度、中/重度, 在治疗前, 治疗组与对照组腹水情况对比差异无统计学意义(P>0.05). 在治疗后, 治疗组腹水改善情况较对照组明显, 差异有统计学意义(P<0.05). 治疗后12 wk两组患者的腹水情况都有所改善, 治疗组患者腹水改善情况较对照组明显, 说明复方阿嗪米特肠溶片联合复合营养素(Noveliver)能够显著改善失代偿期肝硬化患者腹水的发生情况及严重程度.
我们的研究结果表明, 在失代偿期肝硬化患者, 在常规饮食及肝硬化常规治疗的基础上给予复方阿嗪米特肠溶片联合复合营养素(Noveliver)营养支持治疗, 不仅可以改善失代偿期肝硬化患者腹水的发生情况及严重程度, 而且可以改善肝细胞血清ALB及PA的合成, 提高失代偿期肝硬化患者血清ALB及PA的水平. 我们的研究, 为失代偿期肝硬化患者的治疗提供了新的线索和思路.
20%的代偿期肝病和>80%的失代偿期肝硬化患者均存在不同程度的营养不良. 营养状态被认为是失代偿期肝硬化患者严重并发症发病率和死亡率的独立预测因子. 对肝硬化患者, 评估营养状态, 纠正营养不良, 可减少严重并发症的发病率及其严重程度, 提高患者短期及长期生活质量, 改善预后. 近年来研究表明, 基于复方蜂花粉的营养支持能明显改善肝功能, 可作为肝病营养支持治疗的较好的材料. 同时相关研究报道复方阿嗪米特肠溶片可显著改善肝硬化患者腹胀症状. 然而, 复方阿嗪米特肠溶片联合复合营养素(Noveliver)在肝硬化患者中的研究, 国内外尚未见文献报道.
张一, 教授, 主任医师, 南昌大学第一附属医院感染科
肝硬化患者的营养支持治疗是目前研究热点.
近年来, 研究表明, 在CCl4诱导的肝纤维化大鼠, 给予以蜂花粉为基础的复合营养素(Noveliver)进行营养支持治疗能提高肝硬化大鼠血清白蛋白水平, 这可能与营养干预促进肝硬化大鼠肝脏再生修复相关.
本研究在失代偿期肝硬化患者, 在常规饮食及肝硬化常规治疗的基础上给予复方阿嗪米特肠溶片联合复合营养素(Noveliver)营养支持治疗, 观察对失代偿期肝硬化患者血清白蛋白及前白蛋白水平的影响, 为失代偿期肝硬化患者的治疗提供了新的线索和思路.
本研究表明复方阿嗪米特肠溶片联合复合营养素(Noveliver)营养支持治疗, 可以改善失代偿期肝硬化患者腹水的发生情况及严重程度, 并可以改善肝细胞血清白蛋白及前白蛋白的合成, 为失代偿期肝硬化患者的治疗提供了一定治疗手段.
复合营养素(Noveliver): 是国际上目前唯一针对慢性肝病患者的新型复合营养素和免疫调节素, 主要由超微蜂花粉、乳清蛋白、磷脂、富硒酵母等组成, 从配方上看比较适合慢性肝病患者, 可提供肝细胞代谢所需要的复合营养.
本文具备科学性和可读性, 具有一定的创新性. 能较好地反映我国肝硬化治疗相关方面的先进水平.
编辑: 韦元涛 电编:闫晋利
| 1. | Cheung K, Lee SS, Raman M. Prevalence and mechanisms of malnutrition in patients with advanced liver disease, and nutrition management strategies. Clin Gastroenterol Hepatol. 2012;10:117-125. [PubMed] [DOI] |
| 2. | Hayashi F, Momoki C, Yuikawa M, Simotani Y, Kawamura E, Hagihara A, Fujii H, Kobayashi S, Iwai S, Morikawa H. Nutritional status in relation to lifestyle in patients with compensated viral cirrhosis. World J Gastroenterol. 2012;18:5759-5770. [PubMed] [DOI] |
| 3. | Koretz RL, Avenell A, Lipman TO. Nutritional support for liver disease. Cochrane Database Syst Rev. 2012;5:CD008344. [PubMed] [DOI] |
| 4. | Shi H, Shi H, Kong M, Chen G, Zhao J, Ding M, Chen Y, Duan Z. [Compound nutrients promote liver rehabilitation and regeneration in rats with CCl4; -induced liver cirrhosis]. Xibao Yu Fenzi Mianyixue Zazhi. 2013;29:1237-1241. [PubMed] |
| 6. | Koretz RL. The evidence for the use of nutritional support in liver disease. Curr Opin Gastroenterol. 2014;30:208-214. [PubMed] [DOI] |
| 7. | Rivera Irigoin R, Abilés J. [Nutritional support in patients with liver cirrhosis]. Gastroenterol Hepatol. 2012;35:594-601. [PubMed] [DOI] |
| 8. | Lerschmacher O, Koch A, Streetz K, Trautwein C, Tacke F. [Management of decompensated liver cirrhosis in the intensive care unit]. Med Klin Intensivmed Notfmed. 2013;108:646-656. [PubMed] [DOI] |
| 9. | Pérez-Pérez EM, Vit P, Rivas E, Sciortino R, Sosa A, Tejada D, Rodríguez-Malaver AJ. Antioxidant activity of four color fractions of bee pollen from Mérida, Venezuela. Arch Latinoam Nutr. 2012;62:375-380. [PubMed] |
| 10. | Tohamy AA, Abdella EM, Ahmed RR, Ahmed YK. Assessment of anti-mutagenic, anti-histopathologic and antioxidant capacities of Egyptian bee pollen and propolis extracts. Cytotechnology. 2014;66:283-297. [PubMed] [DOI] |
| 12. | Peres WA, Lento DF, Baluz K, Ramalho A. Phase angle as a nutritional evaluation tool in all stages of chronic liver disease. Nutr Hosp. 2012;27:2072-2078. [PubMed] [DOI] |
| 13. | Starr SP, Raines D. Cirrhosis: diagnosis, management, and prevention. Am Fam Physician. 2011;84:1353-1359. [PubMed] |
| 14. | Facciorusso A, Nacchiero MC, Rosania R, Laonigro G, Longo N, Panella C, Ierardi E. The use of human albumin for the treatment of ascites in patients with liver cirrhosis: item of safety, facts, controversies and perspectives. Curr Drug Saf. 2011;6:267-274. [PubMed] [DOI] |
| 15. | Fede G, D'Amico G, Arvaniti V, Tsochatzis E, Germani G, Georgiadis D, Morabito A, Burroughs AK. Renal failure and cirrhosis: a systematic review of mortality and prognosis. J Hepatol. 2012;56:810-818. [PubMed] [DOI] |
| 16. | Kalaitzakis E. Gastrointestinal dysfunction in liver cirrhosis. World J Gastroenterol. 2014;20:14686-14695. [PubMed] [DOI] |