修回日期: 2015-02-08
接受日期: 2015-03-06
在线出版日期: 2015-04-08
目的: 通过建立高脂血症大鼠模型, 以胆盐输出泵(bile salt export pump, BSEP)为研究对象, 探讨BSEP在高脂血症大鼠肝脏中的表达状况, 初步思考其与高脂血症形成的相关性, 为治疗高脂血症找到新的方向.
方法: 取♂Wistar大鼠60只, 体质量145 g±7.5 g, 随机分为2组, 每组30只: 普通饮食对照组(简称对照组)予以普通饮食、高脂饮食实验组(简称实验组)予以高脂饮食. 喂食90 d, 建立高脂血症模型, 定期取血用自动生化仪检测胆固醇及胆汁酸含量, 应用逆转录-聚合酶链反应(RT-polymerase chain reaction, RT-PCR)技术检测两组模型肝脏组织的Bsep基因表达的强度, 石蜡切片后用免疫组织化学SP(streptavidin-perosidase)法检测两组模型肝脏组织的BSEP表达的强度.
结果: 实验组胆固醇及胆汁酸含量明显高于对照组; 电泳结果显示: 实验中肝脏组织扩增产物都出现了内参β-actin基因的425 bp扩增带和Bsep基因的289 bp扩增带, 实验组Bsep基因扩增带亮度强于对照组; 免疫组织化学SP法结果显示, 实验组Bsep表达阳性率为76.7%, 对照组Bsep表达阳性率为12.5%, 他们之间的差异有统计学意义(χ2 = 10.773, P<0.05).
结论: 实验组大鼠的Bsep基因的表达较对照组明显增加, 提示我们可发展作用于Bsep的药物, 为高脂血症及其相关疾病找到新的治疗方法.
核心提示: 建立高脂血症大鼠模型, 以胆盐输出泵(bile salt export pump, Bsep)为研究对象, 探讨Bsep在高脂血症大鼠肝脏中的表达状况, 经研究发现实验组大鼠的Bsep基因的表达较对照组明显增加.
引文著录: 张孟瑜, 王洁萍, 贺凯, 李波, 夏先明. BSEP在高脂血症大鼠肝组织中表达的状况. 世界华人消化杂志 2015; 23(10): 1615-1620
Revised: February 8, 2015
Accepted: March 6, 2015
Published online: April 8, 2015
AIM: To investigate the expression of bile salt export pump (BSEP) in hepatic tissue in a rat model of hyperlipidemia.
METHODS: Sixty wistar rats were randomly divided into two groups (n = 30 for each): a control group that was fed an ordinary diet, and an experimental group fed a high fat diet. Cholesterol and bile acid levels were regularly monitored. Liver tissue samples were taken for detecting the gene expression of BSEP by reverse transcription polymerase chain reaction (RT-PCR) and the protein expression of BSEP by immunohistochemistry.
RESULTS: The levels of cholesterol and bile acid were significantly higher in the experimental group than in the control group. RT-PCR analysis showed that the expression of BSEP mRNA was significantly higher in the experimental group than in the control group. Immunohistochemistry analysis showed that in the experimental group, the positive expression rate of BSEP was 76.7%, significantly higher than that in the control group (12.5%).
CONCLUSION: The expression of Bsep increases significantly in rat hyperlipidemia, which suggests that we can develop drugs acting on BSEP to find new treatment methods and means for hyperlipidemia and related diseases.
- Citation: Zhang MY, Wang JP, He K, Li B, Xia XM. BSEP expression in liver tissue of hyperlipidemia rats. Shijie Huaren Xiaohua Zazhi 2015; 23(10): 1615-1620
- URL: https://www.wjgnet.com/1009-3079/full/v23/i10/1615.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i10.1615
由于脂质代谢异常, 血浆中一种或多种脂质出现紊乱, 其水平高于正常范围, 我们称其为高脂血症. 一般成年人空腹血清中总胆固醇和甘油三脂超过正常水平的上限, 可诊断为高脂血症. 从目前所进行的研究[1,2]来看, 大多数心脏和脑血管疾病的基础病因是动脉粥样硬化, 而与动脉硬化关系最为密切的则是脂代谢紊乱, 而尤其高脂血症是动脉硬化的主要因素, 除引起动脉粥样硬化, 高脂血症还可诱发胆结石、胰腺炎, 出现加重肝功能损害等情况. 目前降脂治疗的方法和手段有限, 因胆盐输出泵(bile salt export pump, BSEP)与胆汁酸的排出有密切关系, 如BSEP功能障碍, 则出现胆汁酸代谢紊乱, 所以为寻找新的治疗方法, 本项目拟以BSEP为研究对象, 研究在高脂血症大鼠肝细胞中Bsep基因表达的状况, 尝试为高脂血症及其相关疾病治疗提供新的思路.
取♂Wistar大鼠60只, 体质量145 g±7.5 g, 随机分为2组, 每组30只: 普通饮食对照组(简称对照组)、高脂饮食实验组(简称实验组). 大鼠入选前无高脂血症﹑糖尿病、畸形等疾病存在, 未进食其他影响血脂的药物. 高脂饮食的原料及配制: (1)胆固醇(4%); (2)去氧胆酸钠(0.5%); (3)丙硫氧嘧啶片(0.2%); (4)猪油(10%); (5)基础饲料. 研细丙硫氧嘧啶片, 备用. 加热融化猪油, 在基础饲料中加入上述百分比含量的高脂饮食原料, 加水混合充分搅拌, 制成高脂饮食食物. 主要仪器有冰冻切片机, HFsafe生物安全柜, 显微摄像系统(PM-10A)等; 主要试剂有过氧化物酶标记的链霉卵白素染色试剂盒, Bsep单克隆抗体等.
1.2.1 制备高脂血症大鼠模型: 根据文献[3,4]的方法制备高脂血症大鼠模型, 喂食90 d, 定期取血用自动生化仪检测胆固醇及胆汁酸含量, 待到实验组血脂相关各项指标与对照组产生统计学差异, 确定建立高脂血症模型成功.
1.2.2 PCR测定Bsep基因的表达: 分别取对照组和实验组肝脏组织, 设定引物及内参照序列, Bsep的上游引物: 5'-CCCTCAACTGATGGGGGCTCCAGT-3', 下游引物: 5'-CCCATGTCTGACTCAGTGATTCTT-3'; β-actin作为内对照, 上游引物: 5'-GATGGTGGGTATGGGTCAGAA-3', 下游引物: 5'-CTAGGAGCCAGGGCAGTAATC-3'[5]. 制备PCR产物, 取100 μL Loading Dye和100 μL DNA Loader(1 kb)混合后加入400 μL蒸馏水做成600 μL混合液. 取产物10 μL进行1%琼脂糖凝胶电泳, 确认PCR反应产物. Quantity One软件计算比较每一泳道中PCR产物条带的光密度值, 计算Bsep基因与β-actin条带的光密度的相对比值, 通过半定量分析, 最终得出其在肝脏组织中RNA表达相对含量.
1.2.3 免疫组织化学检测BSEP蛋白的表达: 石蜡切片后用SP(streptavidin-perosidase)法检测两组模型肝脏组织的BSEP蛋白表达的强度. 肝脏组织中BSEP蛋白出现黄色染色颗粒为阳性细胞, 每张切片随机选取6个视野, 每个视野内观察80个细胞, 阳性细胞≥10%为阳性, 否则为阴性[6,7].
统计学处理 采用SPSS19.0统计软件进行分析, 统计学方法测得数据用mean±SD表示, 判断组间差异采用t检验, 免疫组织化学SP法染色结果采用χ2检验, P<0.05为差异有统计学意义.
各组大鼠喂食90 d后均存活, 无1例死亡, 其血清指标如表1. 从表1可知, 实验组血液中总胆固醇(total cholesterol, TC)升高和低密度脂蛋白胆固醇(low density lipoprotein cholesterol, LDL-C)、甘油三酯(triglyceride, TG)升高, 而高密度脂蛋白胆固醇(high density lipoprotein cholesterol, HDL-C)降低; 与对照组比较, 差异有统计学意义(P<0.05).
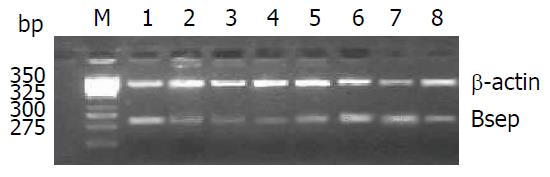
2.2.1电泳情况: 实验中对照组和实验组扩增产物都出现了β-actin基因的425 bp扩增带和Bsep基因的289 bp扩增带, 实验组Bsep基因扩增带亮度均明显强于对照组(图1).
2.2.2 半定量结果分析: 对照组Bsep基因mRNA表达较低(0.3840±0.0369), 实验组Bsep基因mRNA表达较高(0.8641±0.0221); Bsep基因在对照组和实验组中表达差异有统计学意义(P<0.05).
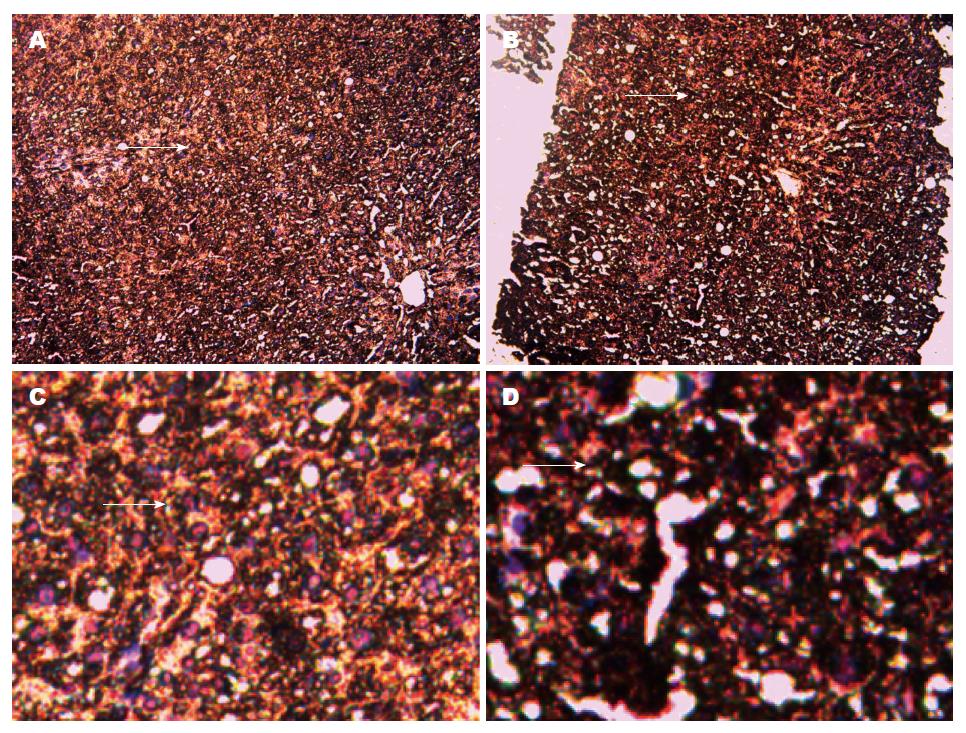
光学高倍(100倍)物镜下: 肝脏组织中Bsep基因出现黄色染色颗粒为阳性细胞(箭头所指). 每张切片随机选取6个视野, 每个视野内观察80个细胞, 阳性细胞≥10%为阳性, 否则为阴性. χ2检验显示: 实验组Bsep基因表达阳性率为76.7%, 对照组Bsep基因表达阳性率为12.5%(χ2 = 10.773, P<0.05), 差异有统计学意义(图2).
血脂是人体血液中所含各种成分脂质的总称, 主要的脂质有胆固醇(包括HDL-C、LDL-C)、TG. 高脂血症(hyperlipidemia)是指脂肪代谢产生紊乱后使血浆中的一种或几种脂质高于正常, 可表现为高胆固醇血症、高甘油三脂血症, 或两者兼有(混合型高脂血症)[8,9]. 近年来, 随着经济的发展, 由于人们生活习惯特别是饮食习惯的改变, 高蛋白、高脂肪饮食的摄入增加, 从而导致高脂血症的发病率有更明显的增高趋势. 经过大量的基础和临床研究, 寻找其发病原因, 明确了高脂血症的形成与多种因素的参与和作用有关, 而胆汁酸、胆固醇的过高分泌和代谢障碍、中性脂肪的蓄积是其重要的形成条件, 那么, 我们是否能从胆汁酸、胆固醇的代谢途径入手, 找到新的治疗高脂血症的方法呢[10,11]? 所以, 与胆汁酸、胆固醇相关的基因, 包括法尼基衍生物X受体(farnesyl derivatives X receptor, FXR)、Bsep、牛黄胆酸钠转运蛋白(sodium/taurocholate cotransporting polypeptide, Ntcp)进入了我们的观察范围并设计了实验.
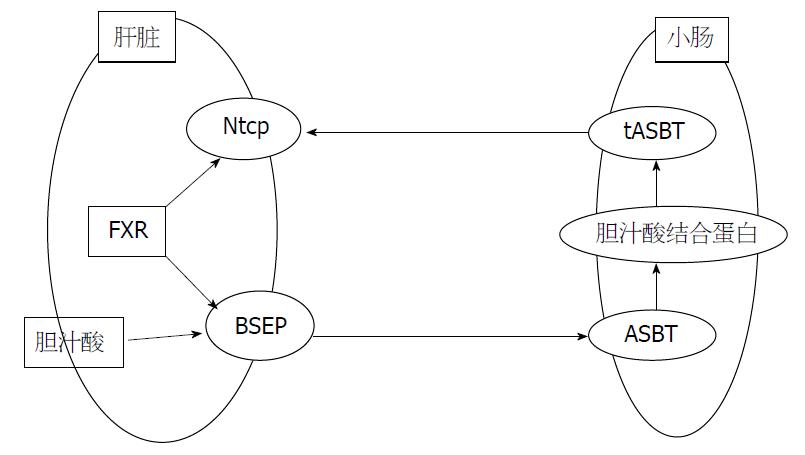
我们已有实验证实FXR在高脂血症大鼠肝脏中的表达增强, 那么, 作为FXR的靶基因, Bsep是否出现了相似的变化, 继续引导我们深入研究和观察[12,13]. BSEP属于ATP结合盒超家族蛋白(ATP binding cassette, ABC), 其基因位于人类第2条染色体长臂上2q24-31, 其编码的蛋白叫ABCB11蛋白, 也称BSEP, 对胆汁酸盐的排泄、浓度稳定的维持和胆汁酸盐的肠肝循环等生理功能具有重要作用. 胆汁酸的肝肠循环需要各种转运体的配合和相互调节来完成, 首先肝细胞合成的胆汁酸经BSEP主动分泌后转运至胆道, 而当胆汁酸进入肠道后, 不同胆汁酸具有不同的吸收途径, 其中游离胆汁酸(石胆酸除外)在小肠和结肠通过扩散作用被动重吸收, 结合胆汁酸在回肠首先被主动重吸收入小肠黏膜细胞, 随后在细胞内产生变化, 与胆汁酸结合蛋白(ileum bile acid binding protein, IBABP)结合, 最后实现胆汁酸从小肠黏膜细胞的肠腔面向基底侧面的转运[14,15]. 其间所需要的介质分别为小肠刷状缘钠盐依赖的胆汁酸转运体(apical sodium-dependent bile acid transporter, ASBT), 胆汁酸结合蛋白和基侧膜的终末腔面钠盐依赖的胆汁酸转运体(terminal apical sodium-dependent bile acid transporter, tASBT). 最终重吸收入门静脉[16,17]. 从图3中我们可以看出BSEP在胆汁酸的代谢中起到了重要的作用, 一旦胆汁酸的排泄过程受到了阻断, 则可能导致人或动物实验体出现黄染, 进而出现肝功能及脂质代谢紊乱.
本实验在90 d的时间内我们通过高脂饮食对大鼠进行喂养, 成功建立高脂血症大鼠模型, 并且在试验中通过使用PCR、免疫组织化学等方法进行检测, 从而证实高脂血症时大鼠的肝脏组织中Bsep基因出现了明显的变化, 表达大为提高, 较对照组明显增加, 而高脂血症时血脂出现的变化情况为TC、TG、LDL-C显著升高, HDL-C逐步下降, 由此我们初步考虑胆固醇、胆汁酸的增加会伴随Bsep基因表达增强[18,19], 可能与增加胆固醇及胆汁酸的排泄有关. 上述也就提示我们, Bsep的发现可能会成为高脂血症治疗新的靶点, 但Bsep在肝脏组织中还有相关的基因Ntcp, 此基因在高脂血症时是否与Bsep发生了同步的变化, 是否调节了Bsep的作用, 尚需进一步的研究. 在目前所用降脂药物普遍存在不同种类的问题, 比如不能完全达到治疗目的、服用量大、胃肠道反应明显、患者耐受性差等缺点, 而这些缺点又阻碍了其作为临床治疗药物的广泛应用, 对Bsep基因表达状况及代谢调节作用的研究将可能有助于人们更好地认识胆固醇及胆汁酸代谢紊乱机制[20], 并为基础研究和临床治疗高脂血症与相关疾病提供新的药物治疗靶点, 思考并找到一种新的治疗措施.
目前我国患高脂血症的病员数量在逐渐增多, 需进行降脂治疗, 而现有降脂治疗的方法和手段有限, 且效果并非十分理想.
施宝民, 教授, 上海同济医院普外科, 同济大学附属同济医院普外科
目前研究的热点和重点为新型的降脂方法和降脂药物, 而基因治疗是一个非常有前途但又尚未在临床广泛应用的领域.
在"雌孕激素对孕鼠肝脏、胎盘组织FXR/BSEP受体系统表达的影响研究"一文介绍了雌激素和孕激素可诱导孕鼠肝内胆汁淤积症. 雌激素诱导的机制可能是通过上调肝脏FXR的表达及下调肝脏BSEP的表达来影响胆汁酸的合成与代谢, 进而导致了肝内胆汁淤积的发生; 孕激素引起肝内胆汁淤积症可能因为某些孕酮代谢产物诱导了BSEP的传输抑制作用致胆汁酸淤积. 初步阐明了雌孕激素诱导妊娠期肝内胆汁淤积症过程中FXR和BSEP的作用机制.
通过初步发现Bsep在高脂血症大鼠肝组织中的表达状况, 为进一步寻找作用于Bsep基因的药物打下基础, 从而改善高脂血症治疗的现状.
通过大鼠实验初步证实了Bsep基因与高脂血症的关系, 设计科学, 分组合理, 结论可信.
编辑: 郭鹏 电编:闫晋利
| 1. | 王 君. 老年颈动脉粥样硬化性疾病诊断和治疗策略. 中华老年心脑血管病杂志. 2015;17:109-110. |
| 6. | 杨 威, 杨 红杰, 莫 瑞祥, 李 西融, 廖 文胜, 张 慧明, 崔 凌飞. Beclin1在人肝癌组织中的表达及TGF-β对肝癌细胞增殖的影响. 国际检验医学杂志. 2015;36:108-109. |
| 7. | 薛 亚峰, 仇 松. 肝细胞肝癌组织中B细胞淋巴瘤因子9的表达及临床意义. 南通大学学报(医学版). 2015;35:45-47. |
| 8. | Kenna JG, Stahl SH, Eakins JA, Foster AJ, Andersson LC, Bergare J, Billger M, Elebring M, Elmore CS, Thompson RA. Multiple compound-related adverse properties contribute to liver injury caused by endothelin receptor antagonists. J Pharmacol Exp Ther. 2015;352:281-290. [PubMed] [DOI] |
| 9. | Meng Q, Chen X, Wang C, Liu Q, Sun H, Sun P, Peng J, Liu K. Alisol B 23-acetate promotes liver regeneration in mice after partial hepatectomy via activating farnesoid X receptor. Biochem Pharmacol. 2014;92:289-298. [PubMed] [DOI] |
| 10. | Zollner G, Thueringer A, Lackner C, Fickert P, Trauner M. Alterations of canalicular ATP-binding cassette transporter expression in drug-induced liver injury. Digestion. 2014;90:81-88. [PubMed] [DOI] |
| 11. | Wu ZT, Qi XM, Sheng JJ, Ma LL, Ni X, Ren J, Huang CG, Pan GY. Timosaponin A3 induces hepatotoxicity in rats through inducing oxidative stress and down-regulating bile acid transporters. Acta Pharmacol Sin. 2014;35:1188-1198. [PubMed] [DOI] |
| 12. | Davit-Spraul A, Oliveira C, Gonzales E, Gaignard P, Thérond P, Jacquemin E. Liver transcript analysis reveals aberrant splicing due to silent and intronic variations in the ABCB11 gene. Mol Genet Metab. 2014;113:225-229. [PubMed] [DOI] |
| 13. | Vilarinho S, Erson-Omay EZ, Harmanci AS, Morotti R, Carrion-Grant G, Baranoski J, Knisely AS, Ekong U, Emre S, Yasuno K. Paediatric hepatocellular carcinoma due to somatic CTNNB1 and NFE2L2 mutations in the setting of inherited bi-allelic ABCB11 mutations. J Hepatol. 2014;61:1178-1183. [PubMed] [DOI] |
| 14. | Kong J, Liu BB, Wu SD, Wang Y, Jiang QQ, Guo EL. Enhancement of interaction of BSEP and HAX-1 on the canalicular membrane of hepatocytes in a mouse model of cholesterol cholelithiasis. Int J Clin Exp Pathol. 2014;7:1644-1650. [PubMed] |
| 15. | Treiber A, Äänismaa P, de Kanter R, Delahaye S, Treher M, Hess P, Sidharta P. Macitentan does not interfere with hepatic bile salt transport. J Pharmacol Exp Ther. 2014;350:130-143. [PubMed] [DOI] |
| 16. | Song X, Vasilenko A, Chen Y, Valanejad L, Verma R, Yan B, Deng R. Transcriptional dynamics of bile salt export pump during pregnancy: mechanisms and implications in intrahepatic cholestasis of pregnancy. Hepatology. 2014;60:1993-2007. [PubMed] [DOI] |
| 17. | Ritschel T, Hermans SM, Schreurs M, van den Heuvel JJ, Koenderink JB, Greupink R, Russel FG. In silico identification and in vitro validation of potential cholestatic compounds through 3D ligand-based pharmacophore modeling of BSEP inhibitors. Chem Res Toxicol. 2014;27:873-881. [PubMed] [DOI] |
| 18. | Guyot C, Hofstetter L, Stieger B. Differential effects of membrane cholesterol content on the transport activity of multidrug resistance-associated protein 2 (ABCC2) and of the bile salt export pump (ABCB11). Mol Pharmacol. 2014;85:909-920. [PubMed] [DOI] |
| 19. | Saber S, Vazifehmand R, Bagherizadeh I, Kasiri M. A novel ABCB11 mutation in an Iranian girl with progressive familial intrahepatic cholestasis. Indian J Hum Genet. 2013;19:366-368. [PubMed] [DOI] |
| 20. | Garzel B, Yang H, Zhang L, Huang SM, Polli JE, Wang H. The role of bile salt export pump gene repression in drug-induced cholestatic liver toxicity. Drug Metab Dispos. 2014;42:318-322. [PubMed] [DOI] |