修回日期: 2014-11-29
接受日期: 2014-12-15
在线出版日期: 2015-04-08
目的: 探讨胃间质瘤组织中钾通道四聚化结构域-12(potassium channel tetramerization domain-containing 12, KCTD-12)蛋白的表达及其临床意义.
方法: 应用免疫组织化学SP法检测39例胃间质瘤患者手术或内镜下切除标本中KCTD-12蛋白的表达情况, 分析KCTD-12表达与患者临床病理特征、NIH危险度分级及Ki-67标记指数(labeling index, LI)的关系, 并结合对胃间质瘤患者术后随访3年的结果, 单因素和多因素分析影响胃间质瘤患者术后3年无复发生存率的因素.
结果: 39例胃间质瘤患者中KCTD-12阳性表达29例(74.4%). 统计分析结果显示, KCTD-12蛋白的表达与胃间质瘤的肿瘤大小、核分裂像及NIH危险度分级有关(均P<0.05), 肿瘤直径越大、核分裂像越多、NIH危险度分级越高, 则KCTD-12表达的阳性率越低. 39例胃间质瘤患者, 3年内发生复发转移10例, 3年无复发生存率为74.4%. 单因素分析结果显示, 影响胃间质瘤患者术后3年无复发生存率的因素包括患者肿瘤大小、NIH危险度分级、KCTD-12表达及Ki-67 LI(均P<0.05). Cox多因素分析结果则显示, KCTD-12是胃间质瘤患者术后3年无复发生存率的独立影响因素(P = 0.007). KCTD-12表达阳性的胃间质瘤患者, 其术后3年无复发生存率为89.7%, 明显高于KCTD-12表达阴性的患者30.0%(P = 0.001). 另外还发现, KCTD-12表达阳性且Ki-67 LI≤5%的胃间质瘤患者, 其术后3年无复发生存率达到95.7%; 而KCTD-12表达阴性且Ki-67 LI>5%的胃间质瘤患者, 其术后3年无复发生存率仅为20.0%.
结论: KCTD-12可能成为一项有效判断胃间质瘤预后的分子标志物, 与Ki-67联合检测更能准确地评估预后.
核心提示: 钾通道四聚化结构域-12蛋白(potassium channel tetramerization domain-containing 12, KCTD-12)表达阳性的胃间质瘤患者, 其术后3年无复发生存率明显高于KCTD-12表达阴性的患者(89.7% vs 30.0%); KCTD-12与Ki-67蛋白联合检测则更加有利于判断胃间质瘤患者的预后.
引文著录: 周军, 张红杰. KCTD-12蛋白在胃间质瘤中的表达及临床意义. 世界华人消化杂志 2015; 23(10): 1577-1584
Revised: November 29, 2014
Accepted: December 15, 2014
Published online: April 8, 2015
AIM: To investigate the expression of potassium channel tetramerization domain-containing 12 (KCTD-12) protein in gastrointestinal stromal tumors (GISTs) of the stomach and its clinical significance.
METHODS: The expression of KCTD-12 was immunohistochemically examined in 39 gastric GIST tissues, and its correlations with the clinicopathological parameters, National Institutes of Health (NIH) risk classification and Ki-67 labeling index were analyzed. Univariate and Cox multivariate analyses were used to evaluate the factors associated with 3-year recurrence-free survival (RFS) rate of patients with gastric GISTs.
RESULTS: Positive KCTD-12 expression was detected in 29 (74.4%) of the 39 gastric GIST tissues. The absence of KCTD-12 expression was associated with large tumor size, high mitotic count and NIH high-risk classification (P < 0.05). GISTs recurred after surgery in 10 of the 39 cases during the follow-up, and the 3-year RFS rate was 74.4%. Univariate analysis showed that tumor size, NIH risk classification, KCTD-12 expression and Ki-67 labeling index had an impact on the 3-year RFS rate of patients with GISTs of the stomach. On multivariate analysis, KCTD-12 [relative risk (RR) = 0.014; 95%CI: 0.001-0.320, P = 0.007] was shown to be a highly correlated predictor. The 3-year RFS rate of patients without KCTD-12 expression was only 30% compared with 89.7% in those with KCTD-12 expression (P = 0.001). The 3-year RFS rate of patients with KCTD-12 expression and a Ki-67 labeling index of 5% or less was 95.7%. The 3-year RFS rate of patients without KCTD-12 expression and a Ki-67 labeling index more than 5% was only 20%.
CONCLUSION: KCTD-12 is a useful and reliable biomarker for the prognosis of GISTs of the stomach, especially when combined with Ki-67 labeling index.
- Citation: Zhou J, Zhang HJ. Clinical significance of expression of KCTD-12 in gastrointestinal stromal tumors of the stomach. Shijie Huaren Xiaohua Zazhi 2015; 23(10): 1577-1584
- URL: https://www.wjgnet.com/1009-3079/full/v23/i10/1577.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i10.1577
胃肠道间质瘤(gastrointestinal stromal tumors, GISTs)是消化系最常见的间叶源性肿瘤, 其发病机制目前尚不清楚, 准确地预测其生物学行为及判断预后仍较为困难. 钾通道四聚化结构域-12蛋白(potassium channel tetramerization domain-containing 12, KCTD-12)是近年来国外学者发现的与GISTs危险度呈负相关的分子标志物[1]. 目前国内尚未报道KCTD-12蛋白在GISTs中的研究. 我们通过检测KCTD-12和Ki-67在胃间质瘤组织中的表达情况, 并结合对胃间质瘤患者术后随访3年的结果, 探讨KCTD-12蛋白在判断胃间质瘤患者预后方面的价值.
收集2010-01/2011-01经南京医科大学第一附属医院确诊胃间质瘤并行手术或内镜下切除的患者病理标本39例, 胃间质瘤诊断标准参照中国胃肠间质瘤诊断治疗共识(2013年版)[2]. 纳入标准为: 首次行胃间质瘤手术治疗, 未接受辅助放射治疗或化学治疗; 排除标准为: 术前服用格列卫等分子靶向治疗药物, 合并有胃间质瘤以外的其他肿瘤以及临床资料不完整.
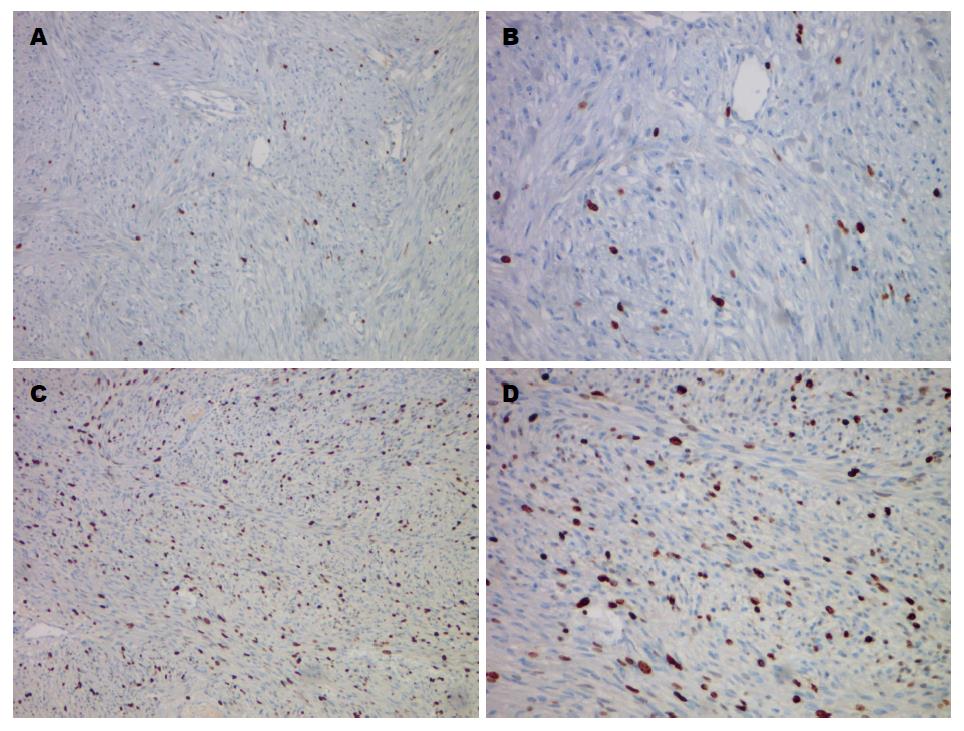
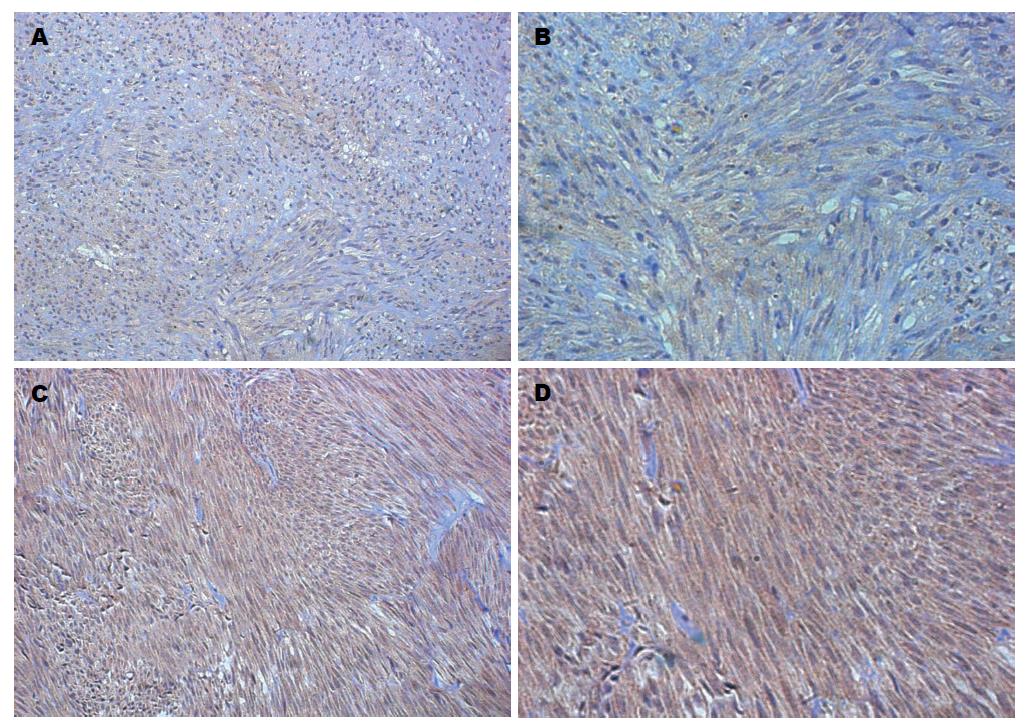
1.2.1 免疫组织化学染色及结果判定: 采用免疫组织化学SP法检测KCTD-12、Ki-67在胃间质瘤组织中表达. 用已知组织表达抗体作阳性对照, PBS代替一抗作为阴性对照. 结果判断标准: Ki-67表达判断采用标记指数(labeling index, LI), 阳性细胞为细胞核内出现棕色颗粒, 在40倍物镜下, 计数500-1000个肿瘤细胞中的阳性细胞数, 求出平均每100个细胞中的阳性细胞数, 记为Ki-67 LI[3]. KCTD-12阳性染色为胞质着色明显强于血管内皮细胞, 超过20%肿瘤细胞阳性染色则为KCTD-12表达阳性[1].
1.2.2 危险度分级及随访: 参照改良的美国国家卫生研究院(National Institutes of Health, NIH)标准[4], 依据肿瘤大小、核分裂像数量、肿瘤发生部位和肿瘤是否破裂进行危险度分级(表1). 随访从术后第1天起计算, 每3-6 mo患者复查1次腹部CT, 记录每例患者的复查结果及复发患者的复发时间, 并计算3年无复发生存率[5].
| 危险度分级 | 肿瘤大小(cm) | 核分裂像(/50HPF) | 原发肿瘤部位 |
| 极低危 | <2 | ≤5 | 任意部位 |
| 低危 | 2-5 | ≤5 | 任意部位 |
| 中危 | 2-5 | >5 | 胃 |
| <5 | 6-10 | 任意部位 | |
| 5-10 | ≤5 | 胃 | |
| 高危 | 任意 | 任意 | 肿瘤破裂 |
| >10 | 任意 | 任意部位 | |
| 任意 | >10 | 任意部位 | |
| >5 | >5 | 任意部位 | |
| 2-5 | >5 | 非胃来源 | |
| 5-10 | ≤5 | 非胃来源 |
统计学处理 采用SPSS17.0进行分析. 各组KCTD-12阳性表达率的比较采用χ2检验和Fisher确切概率法. 单因素生存分析采用Kaplan-Meier法和Log-rank检验, 采用Cox回归进行复发的多因素分析, 仅单因素分析有统计学意义的变量进入多因素分析模型. P<0.05为差异有统计学意义.
39例胃间质瘤患者, 其中男18例, 女21例, 年龄32-75岁, 平均年龄56.92岁. 肿瘤直径0.7-15 cm, 平均直径5.37 cm. 39例胃间质瘤按NIH标准分级, 其中极低危10例, 低危9例, 中危10例, 高危10例.
Ki-67 LI>5%共11例(28.2%)(图1). 免疫组织化学检测KCTD-12在胃间质瘤组织中表达, 发现KCTD-12主要表达在细胞浆内, 如图2, 39例患者中29例呈阳性表达(74.4%), 且KCTD-12阳性表达率随其NIH危险度分级的增加而减低(极低危组、低危组、中危组及高危组的阳性表达率分别为100%、100%、70%和30%).
分析KCTD-12表达与患者临床病理特征、NIH危险度分级及Ki-67表达的关系, 结果显示, KCTD-12蛋白表达阳性组与表达阴性组在性别、年龄方面差异均无统计学意义(均P>0.05)(表2). 然而, KCTD-12蛋白在不同肿瘤大小、核分裂像及危险度分级组之间的表达差异均有统计学意义(P<0.0.5), 肿瘤直径越大, 核分裂像越多, 危险度分级越高, 则KCTD-12表达的阳性率越低. KCTD-12在Ki-67 LI≤5%、>5%组的阳性表达率分别为82.1%和54.5%, 但两组差异无统计学意义(P = 0.109)(表3).
| 参数 | KCTD-12 | P值 | |
| 阳性 | 阴性 | ||
| 性别(男/女) | 12/17 | 6/4 | 0.465 |
| 年龄(岁) | 56.58±13.21 | 57.90±13.80 | 0.790 |
| 项目 | n | KCTD-12 | P值 | |
| 阳性 | 阴性 | |||
| 肿瘤直径(cm) | 0.002 | |||
| ≤2 | 12 | 10 | 2 | |
| >2且≤5 | 13 | 13 | 0 | |
| >5且≤10 | 7 | 4 | 3 | |
| >10 | 7 | 2 | 5 | |
| 核分裂像(/50HPF) | 0.019 | |||
| ≤5 | 27 | 23 | 4 | |
| 6-10 | 10 | 6 | 4 | |
| >10 | 2 | 0 | 2 | |
| 危险度分级 | 0.001 | |||
| 极低 | 10 | 10 | 0 | |
| 低 | 9 | 9 | 0 | |
| 中 | 10 | 7 | 3 | |
| 高 | 10 | 3 | 7 | |
| Ki-67标记指数(%) | 0.109 | |||
| ≤5 | 28 | 23 | 5 | |
| >5 | 11 | 6 | 5 | |
随访年限为2011-02/2014-02, 随访时间为14-36 mo, 平均随访时间32.2 mo, 随访率100%. 39例胃间质瘤患者, 发生复发转移10例, 无死亡病例, 3年无复发生存率为74.4%.
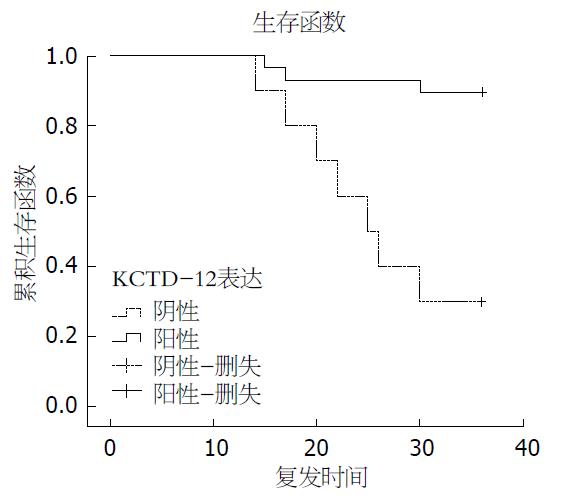
对39例胃间质瘤患者随访3年, 共有10例患者出现肿瘤复发或转移, 3年无复发生存率为74.4%. 单因素预后分析(Log-rank检验)结果显示, 肿瘤大小、NIH危险度分级、KCTD-12表达和Ki-67 LI与胃间质瘤术后3年无复发生存有关(均P<0.05)(表4). 将上述单因素预后分析中有统计学意义的变量纳入Cox回归模型进行多因素预后分析, 结果显示, KCTD-12是影响胃间质瘤患者术后3年无复发生存率的独立因素(P = 0.007)(表5). 通过生存曲线可以看到, KCTD-12表达阳性的胃间质瘤患者, 其3年无复发生存率达到89.7%, 而KCTD-12表达阴性的患者, 其3年无复发生存率仅为30.0%, 差异有统计学意义(P = 0.001)(图3).
| 因素 | n | 3年无复发生存率(%) | P值 |
| 肿瘤直径(cm) | 0.001 | ||
| ≤2 | 12 | 83.3 | |
| >2且≤5 | 13 | 100.0 | |
| >5且≤10 | 7 | 57.1 | |
| >10 | 7 | 28.6 | |
| 核分裂像(/50HPF) | 0.407 | ||
| ≤5 | 27 | 77.8 | |
| 6-10 | 10 | 60.0 | |
| >10 | 2 | 100.0 | |
| 危险度分级 | 0.002 | ||
| 极低 | 10 | 100.0 | |
| 低 | 9 | 100.0 | |
| 中 | 10 | 60.0 | |
| 高 | 10 | 40.0 | |
| Ki-67标记指数(%) | 0.007 | ||
| ≤5 | 28 | 85.7 | |
| >5 | 11 | 45.5 | |
| KCTD-12 | 0.001 | ||
| 阳性 | 29 | 89.7 | |
| 阴性 | 10 | 30.0 |
| 因素 | 偏回归系数 | 标准误 | Wald值 | 自由度 | P值 | RR值(95%CI) |
| 肿瘤大小 | 0.906 | 0.644 | 1.976 | 1 | 0.160 | 2.474(0.700-8.746) |
| 危险度分级 | -0.331 | 0.957 | 0.120 | 1 | 0.729 | 0.718(0.110-4.681) |
| Ki-67 | -1.398 | 1.010 | 1.915 | 1 | 0.166 | 0.247(0.034-1.789) |
| KCTD-12 | -4.255 | 1.590 | 7.165 | 1 | 0.007 | 0.014(0.001-0.320) |
Ki-67 LI≤5%的胃间质瘤患者, 其3年无复发生存率为85.7%, 高于Ki-67 LI>5%的患者45.5%(P = 0.007). 但若Ki-67 LI≤5%, 同时KCTD-12表达阳性, 此类胃间质瘤患者术后3年无复发生存率达到95.7%; 而Ki-67 LI>5%且KCTD-12表达阴性的患者, 其3年无复发生存率仅为20.0%.
GISTs是一类起源于胃肠道间质干细胞(Cajal细胞)的肿瘤, 呈非定向性分化, 由未分化或多潜能的梭形细胞或上皮样细胞组成, 是胃肠道最常见的间叶源性肿瘤[6,7]. GISTs约占胃肠道肿瘤的1%-4%, 年发病率约20/100万人, 发病年龄主要在40-70岁, 中位年龄58岁, 男女发病差异均无统计学意义. GISTs多发于胃部(52%-58%)和小肠(25%-35%), 结直肠占2.5%-11%, 食管占0%-5%, 偶有发生于胃肠道以外的部位, 如系膜、网膜等处[8]. GISTs特征性的表现为c-kit或PDGFRA基因的突变, 这些基因的突变导致酪氨酸激酶受体发生磷酸化, 从而参与肿瘤的形成[9,10].
GISTs的生物学行为难以预测, 即使行手术切除后其复发转移率仍较高. 有文献报道, 原发性GISTs行单纯手术治疗后约70%-84%会出现复发转移[11,12]. 因此准确评估其恶性潜能, 有助于制订正确的治疗方案. 目前大多数研究认为GISTs均有潜在恶性倾向, 应当依据其侵袭危险性高低来进行分类. 改良的NIH标准是目前GISTs最常用的危险度分级指标[4], 改良后的NIH标准加入肿瘤部位和肿瘤破裂两项危险度评估指标, 并且强调只要出现肿瘤破裂即归入高危组. 该方案比较简明, 易于操作, 临床实用性强, 是目前GISTs最常用的危险度分级指标. 但是, 某些突变如c-kit基因的密码子557-558上的外显子11缺失以及肿瘤生物学等因素与肿瘤的预后不良有关[13], 均未纳入到目前的危险度分级方案中, 故将危险度分级与基因突变、分子生物学指标综合分析, 更有利于判断GISTs预后.
以往常用的分子标志物如CD117、CD34, 都是在GISTs的诊断方面发挥重要作用, 其中CD117阳性率可达94%以上, CD34阳性率约为60%-80%[14]. 一般情况下, 组织病理学结合免疫组织化学检测即可对GISTs作出正确诊断, 但一小部分CD117阴性的GISTs患者可能会被漏诊. 近年来研究[15]发现, GISTs中DOG(delay of germination)1的阳性率可达90%以上, 对于CD117阴性的GISTs患者具有重要的补充诊断作用, 也可以作为GISTs诊断的重要分子标志物. 另外有研究[16]发现, 蛋白激酶C亚型(PKCθ)在GISTs中阳性率为82%, 其对CD117、CD34均阴性的GISTs患者的诊断也具有协助作用. 上述分子标志物对于GISTs的诊断和鉴别诊断具有重要的意义, 但并不能用于判断GISTs的危险程度. 因此, 寻找实用且有效的分子生物学指标来判断GISTs侵袭危险性高低具有重要的临床意义.
细胞异常增殖是肿瘤的发生、发展过程中的重要机制, 因此检测肿瘤细胞的增殖活性, 对于预见其生物学行为、判断其恶性潜能及评估预后具有十分重要的意义. 随着免疫组织化学的发展应用, 一些与细胞增殖有关的标志物, 如Ki-67、CyclinD1等被广泛用于多种肿瘤的基础与临床研究[17].
细胞核相关抗原Ki-67是一种与细胞增殖有关的核蛋白, 参与了细胞周期的调节, 其功能与细胞的有丝分裂密切相关. Ki-67在细胞周期G1后期出现, 在S期、G2期升高, 于M期达到高峰, 随后又迅速下降. Ki-67在细胞周期的G0期和G1早期不表达, 且不表达于DNA修复状态的细胞, Ki-67的表达水平可以反映肿瘤细胞的增殖活性, 因此间接反映了肿瘤恶性潜能的高低[18]. 国内外已经将Ki-67应用于各类肿瘤的分级、发展以及预后等各方面的研究当中, 认为Ki-67在判断肿瘤恶性程度和评估预后等方面较为有效[19,20]. 在GISTs的研究中同样认为Ki-67可以反映GISTs恶性潜能[21,22], 并与GISTs患者的预后密切相关[23,24]. Ki-67标记的界值在4.92%-22%之间, 但对于如何界定目前尚无统一的标准[25]. 本研究参照以往文献中的研究[23], 将Ki-67 LI定为以5%为界, 分为两组进行观察.
KCTD-12是近年发现的与GISTs危险度呈负相关的分子标志物[26,27]. 最初发现KCTD-12在胎儿耳蜗和大脑中高度表达[28], 并为GABA受体的组成部分[29]. 本研究检测KCTD-12在胃间质瘤中的阳性表达率为74.4%, 与以往研究[5]较为一致. 统计分析显示, KCTD-12蛋白表达与肿瘤大小、核分裂像及NIH危险度分级有关, 肿瘤直径越大、核分裂像越多、NIH危险度分级越高, 则KCTD-12表达的阳性率越低, 而肿瘤大小、核分裂像及NIH危险度分级是目前用于判断胃间质瘤预后的常用指标, 那么表明KCTD-12亦可作为判断胃间质瘤恶性程度的参考指标. 研究还发现, KCTD-12在Ki-67 LI≤5%组的阳性表达率82.1%高于Ki-67 LI>5%组的54.5%, 但结果尚无统计学差异, 可能与样本量较小有关.
有文献报道, 发生于胃的GISTs预后要优于小肠及其他部位起源者, 其3年无复发生存率可达76%-86%[30]. 本研究中39例胃间质瘤患者, 3年内发生复发转移10例, 无死亡病例, 3年无复发生存率为74.4%, 与文献报道较为相似.
单因素分析结果显示, 影响胃间质瘤患者术后3年无复发生存率的因素包括肿瘤大小、NIH危险度分级、KCTD-12表达和Ki-67 LI, 而不包括核分裂像, 可能与样本例数较少有关, 本研究中核分裂像>10/50HPF的样本仅有2例. Cox多因素分析结果则显示, KCTD-12对3年无复发生存率影响显著, 是胃间质瘤术后3年无复发生存率的独立影响因素, 并且从生存曲线图中可以看到, KCTD-12表达阳性的胃间质瘤患者术后3年无复发生存率明显高于KCTD-12表达阴性的患者(89.7% vs 30.0%, P<0.001). 以上结果均提示KCTD-12能用于判断胃间质瘤预后, KCTD-12阳性表达的胃间质瘤患者预后优于阴性表达患者.
另外本研究还发现, KCTD-12表达阳性且Ki-67 LI<5%的患者, 其3年无复发生存率达到95.7%, KCTD-12表达阴性且Ki-67 LI>5%的患者, 其3年无复发生存率仅为20.0%, 表明KCTD-12与Ki-67蛋白联合检测更有利于判断胃间质瘤患者的预后.
本研究的研究对象均为胃间质瘤, 较为局限, 且样本量较小, 未来亟待开展更多的大样本、长期随访的研究来进一步探讨KCTD-12在判断GISTs预后方面的价值.
总之, KCTD-12可能成为一项有效判断胃间质瘤预后的分子标志物, 与Ki-67蛋白联合检测更能准确地评估预后. 对于KCTD-12表达阴性且Ki-67 LI>5%的胃间质瘤患者, 术后应进行密切随访.
胃肠道间质瘤(gastrointestinal stromal tumors, GISTs)是消化系最常见的间叶源性肿瘤, 多发于胃和小肠, 其次是结直肠和食管, 偶有发生于胃肠道以外的部位, 如系膜、网膜等处. 目前手术切除是其主要的治疗方式, 但是其生物学行为难以预测, 即使手术切除后其复发转移率仍然较高.
樊晓明, 教授, 主任医师, 复旦大学附属金山医院消化科
GISTs发病机制尚不清楚, 如何准确地预测其生物学行为及判断预后仍较为困难. NIH危险度分级和Ki-67标记指数是目前最常用的指标, NIH分级越高或者Ki-67标记指数越高, 则预后越差, 但两者都存在一定的局限性. 因此寻找实用且有效的分子生物学指标来判断GISTs侵袭危险性高低具有重要的临床意义.
方洧靖等收集了148例完全切除术后的GISTs标本, 通过免疫组织化学技术检测Ki-67、E-cadherin、MMP7、CDd4、nm23、P53、Survivin、Cyclin D1、COX-2和VEGF共10个生物指标, 研究其表达与GISTs完全切除术后复发转移和预后的关系. 研究结果表明Ki-67、CD44和P53与GISTs完全切除术后复发转移密切相关, Ki-67还能提示预后. 该研究的样本量大, 随访时间长, 结论较为可靠.
目前国内尚未报道钾通道四聚化结构域-12(potassium channel tetramerization domain-containing 12, KCTD-12)蛋白在GISTs中的研究. 我们通过检测KCTD-12和Ki-67在胃间质瘤组织中的表达情况, 并结合对胃间质瘤患者术后随访3年的结果, 探讨KCTD-12蛋白在判断胃间质瘤患者预后方面的价值. 本研究的研究对象均为胃间质瘤患者, 排除了肿瘤部位对结果的影响, 使得结论更为可靠.
目前对于如何准确地预测GISTs生物学行为及判断预后仍较为困难. 本研究通过分析发现, KCTD-12可能成为一项有效判断胃间质瘤预后的分子标志物, 与Ki-67蛋白联合检测更能准确地评估预后. 并且未来亟待开展更多的大样本、长期随访的研究来进一步探讨KCTD-12在判断小肠等其他部位间质瘤预后方面的价值.
3年无复发生存率: 从术后第1天起计算, 每3-6 mo患者复查1次腹部CT, 记录每例患者的复查结果及复发患者的复发时间, 以此来计算3年后没有发生复发转移的存活患者在全部研究对象中所占的比例, 即为3年无复发生存率.
KCTD-12蛋白在胃间质瘤中的表达及临床意义一文探讨了胃间质瘤组织中KCTD-12蛋白的表达及其临床意义. 该文结果表明KCTD-12可能成为一项有效判断胃间质瘤预后的分子标志物.
编辑: 郭鹏 电编:闫晋利
| 1. | Kubota D, Okubo T, Saito T, Suehara Y, Yoshida A, Kikuta K, Tsuda H, Katai H, Shimada Y, Kaneko K. Validation study on pfetin and ATP-dependent RNA helicase DDX39 as prognostic biomarkers in gastrointestinal stromal tumour. Jpn J Clin Oncol. 2012;42:730-741. [PubMed] [DOI] |
| 4. | Joensuu H. Risk stratification of patients diagnosed with gastrointestinal stromal tumor. Hum Pathol. 2008;39:1411-1419. [PubMed] [DOI] |
| 5. | Hasegawa T, Asanuma H, Ogino J, Hirohashi Y, Shinomura Y, Iwaki H, Kikuchi H, Kondo T. Use of potassium channel tetramerization domain-containing 12 as a biomarker for diagnosis and prognosis of gastrointestinal stromal tumor. Hum Pathol. 2013;44:1271-1277. [PubMed] [DOI] |
| 6. | Rubin BP, Heinrich MC, Corless CL. Gastrointestinal stromal tumour. Lancet. 2007;369:1731-1741. [PubMed] [DOI] |
| 7. | Patil DT, Rubin BP. Gastrointestinal stromal tumor: advances in diagnosis and management. Arch Pathol Lab Med. 2011;135:1298-1310. [PubMed] [DOI] |
| 8. | Nilsson B, Bümming P, Meis-Kindblom JM, Odén A, Dortok A, Gustavsson B, Sablinska K, Kindblom LG. Gastrointestinal stromal tumors: the incidence, prevalence, clinical course, and prognostication in the preimatinib mesylate era--a population-based study in western Sweden. Cancer. 2005;103:821-829. [PubMed] |
| 9. | Hirota S, Isozaki K, Moriyama Y, Hashimoto K, Nishida T, Ishiguro S, Kawano K, Hanada M, Kurata A, Takeda M. Gain-of-function mutations of c-kit in human gastrointestinal stromal tumors. Science. 1998;279:577-580. [PubMed] [DOI] |
| 10. | Heinrich MC, Corless CL, Duensing A, McGreevey L, Chen CJ, Joseph N, Singer S, Griffith DJ, Haley A, Town A. PDGFRA activating mutations in gastrointestinal stromal tumors. Science. 2003;299:708-710. [PubMed] [DOI] |
| 11. | Demetri GD, Benjamin R, Blanke CD, Choi H, Corless C, DeMatteo RP, Eisenberg BL, Fletcher CD, Maki RG, Rubin BP. NCCN Task Force report: optimal management of patients with gastrointestinal stromal tumor (GIST)--expansion and update of NCCN clinical practice guidelines. J Natl Compr Canc Netw. 2004;2 Suppl 1:S-1-26; quiz 27-30. [PubMed] |
| 13. | 李 超亿, 梁 小波, 马 俊杰, 姜 慧员, 胡 学忠, 闫 栋, 侯 生槐, 王 立平. C-kit与血小板源性生长因子受体基因突变特征与胃肠间质瘤患者预后的关系. 中华胃肠外科杂志. 2012;15:271-275. |
| 14. | Lucas DR. Clinicopathology and molecular diagnostics of gastrointestinal stromal tumors. Curr Probl Cancer. 2011;35:233-244. [PubMed] [DOI] |
| 15. | Miettinen M, Wang ZF, Lasota J. DOG1 antibody in the differential diagnosis of gastrointestinal stromal tumors: a study of 1840 cases. Am J Surg Pathol. 2009;33:1401-1408. [PubMed] [DOI] |
| 16. | Ríos-Moreno MJ, Jaramillo S, Pereira Gallardo S, Vallejo A, Mora M, García-Escudero A, Amérigo J, González-Cámpora R. Gastrointestinal stromal tumors (GISTs): CD117, DOG-1 and PKCθ expression. Is there any advantage in using several markers? Pathol Res Pract. 2012;208:74-81. [PubMed] [DOI] |
| 17. | 方 洧靖, 张 荣欣, 罗 容珍, 区 庆坚, 万 德森, 潘 志忠, 伍 小军. 影响胃肠间质瘤完全切除术后复发转移及预后的相关生物标志物研究. 中华胃肠外科杂志. 2013;16:242-246. |
| 18. | Scholzen T, Gerdes J. The Ki-67 protein: from the known and the unknown. J Cell Physiol. 2000;182:311-322. [PubMed] [DOI] |
| 19. | Dowsett M, Smith IE, Ebbs SR, Dixon JM, Skene A, A'Hern R, Salter J, Detre S, Hills M, Walsh G. Prognostic value of Ki67 expression after short-term presurgical endocrine therapy for primary breast cancer. J Natl Cancer Inst. 2007;99:167-170. [PubMed] |
| 20. | Koljonen V, Tukiainen E, Haglund C, Böhling T. Proliferative activity detected by Ki67 correlates with poor outcome in Merkel cell carcinoma. Histopathology. 2006;49:551-553. [PubMed] |
| 22. | Ozgüç H, Yilmazlar T, Yerci O, Soylu R, Tümay V, Filiz G, Zorluoglu A. Analysis of prognostic and immunohistochemical factors in gastrointestinal stromal tumors with malignant potential. J Gastrointest Surg. 2005;9:418-429. [PubMed] [DOI] |
| 23. | Koon N, Schneider-Stock R, Sarlomo-Rikala M, Lasota J, Smolkin M, Petroni G, Zaika A, Boltze C, Meyer F, Andersson L. Molecular targets for tumour progression in gastrointestinal stromal tumours. Gut. 2004;53:235-240. [PubMed] [DOI] |
| 25. | Huang HY, Huang WW, Lin CN, Eng HL, Li SH, Li CF, Lu D, Yu SC, Hsiung CY. Immunohistochemical expression of p16INK4A, Ki-67, and Mcm2 proteins in gastrointestinal stromal tumors: prognostic implications and correlations with risk stratification of NIH consensus criteria. Ann Surg Oncol. 2006;13:1633-1644. [PubMed] [DOI] |
| 26. | Kikuta K, Gotoh M, Kanda T, Tochigi N, Shimoda T, Hasegawa T, Katai H, Shimada Y, Suehara Y, Kawai A. Pfetin as a prognostic biomarker in gastrointestinal stromal tumor: novel monoclonal antibody and external validation study in multiple clinical facilities. Jpn J Clin Oncol. 2010;40:60-72. [PubMed] [DOI] |
| 27. | Kubota D, Orita H, Yoshida A, Gotoh M, Kanda T, Tsuda H, Hasegawa T, Katai H, Shimada Y, Kaneko K. Pfetin as a prognostic biomarker for gastrointestinal stromal tumor: validation study in multiple clinical facilities. Jpn J Clin Oncol. 2011;41:1194-1202. [PubMed] [DOI] |
| 28. | Resendes BL, Kuo SF, Robertson NG, Giersch AB, Honrubia D, Ohara O, Adams JC, Morton CC. Isolation from cochlea of a novel human intronless gene with predominant fetal expression. J Assoc Res Otolaryngol. 2004;5:185-202. [PubMed] [DOI] |
| 29. | Schwenk J, Metz M, Zolles G, Turecek R, Fritzius T, Bildl W, Tarusawa E, Kulik A, Unger A, Ivankova K. Native GABA(B) receptors are heteromultimers with a family of auxiliary subunits. Nature. 2010;465:231-235. [PubMed] [DOI] |
| 30. | Miettinen M, Sobin LH, Sarlomo-Rikala M. Immunohistochemical spectrum of GISTs at different sites and their differential diagnosis with a reference to CD117 (KIT). Mod Pathol. 2000;13:1134-1142. [PubMed] [DOI] |