修回日期: 2015-03-13
接受日期: 2015-03-18
在线出版日期: 2015-04-08
目的: 探讨miR-19b对结肠癌细胞HT-29增殖的影响及可能的机制.
方法: 生物信息学软件预测miR-19b的靶基因, 采用脂质体介导的转染方法将miR-19b模拟物或抑制物转染到人结肠癌细胞系HT-29; 检测转染后miR-19b和靶基因的表达; 利用CCK8试剂盒检测细胞的增殖能力, 流式细胞术检测miR-19b对细胞增殖周期的影响.
结果: 在结肠癌细胞HT-29中高表达miR-19b可显著降低细胞因子信号转导抑制蛋白3(suppressor of cytokine signaling, SOCS3)的表达(P<0.01), 促进信号转导与转录激活子3(signal transducer and activator of transcription 3, STAT3)的磷酸化及细胞周期蛋白D1(cyclinD1)的表达(P<0.01); 相反, 抑制miR-19b后细胞内SOCS3蛋白的表达显著增加(P<0.01), STAT3的磷酸化及cyclinD1的表达均下降(P<0.01). HT-29细胞内miR-19b的变化不影响细胞中SOCS3的mRNA水平. 同时, CCK8检测发现升高miR-19b的水平可促进细胞的增殖(P<0.05或P<0.01), 流式结果表明高表达miR-19b后处于增殖期细胞比例较对照组升高(P<0.01), 降低miR-19b的水平, 增殖期的细胞比例下降(P<0.05或P<0.01), 抑制细胞的增殖(P<0.01).
结论: miR-19b的表达可影响结肠癌细胞周期, 促进结肠癌细胞的增殖活性, 可能通过靶向调控SOCS3的表达来实现.
核心提示: miR-19b可能通过负性调控细胞因子信号转导抑制蛋白3(suppressor of cytokine signaling)的表达影响信号转导与转录激活子3(signal transducer and activator of transcription 3)的磷酸化, 促进细胞增殖, 诱导结肠癌的发生.
引文著录: 程秀琴, 张迎娣, 张红杰. miRNA-19b对结肠癌细胞增殖活性的影响. 世界华人消化杂志 2015; 23(10): 1568-1576
Revised: March 13, 2015
Accepted: March 18, 2015
Published online: April 8, 2015
AIM: To investigate whether miR-19b influences the proliferation of human colon cancer cell line HT-29 and the possible mechanisms.
METHODS: Potential targets of miR-19b were predicted using computer-aided algorithms TargetScan, PicTar and microRNA.org. We transfected HT-29 cells with synthetic miR-19b mimic or miR-19b inhibitor using Lipofectamine 2000 to up-regulate or down-regulate miR-19b. Protein levels of suppressor of cytokine signaling 3 (SOCS3), cyclinD1, signal transducer and activator of transcription 3 (STAT3) and phosphorylated-STAT3 (p-STAT3) were determined by Western blot. CCK8 and flow cytometry were conducted for the detection of proliferation ability and cell cycle of the treated cells.
RESULTS: Compared to control cells, overexpression of miR-19b in HT-29 cells down-regulated the protein level of SOCS3 (P < 0.01), but not that of SOCS3 mRNA. Furthermore, down-regulation of SOCS3 by miR-19b caused phosphorylation of STAT3 (P < 0.01) as well as induced expression of cyclinD1 (P < 0.01), which could promote cell proliferation (P < 0.01) by transition from G1 phase to S and G2 phase (P < 0.05 or P < 0.01). On the contrary, down-regulation of miR-19b in HT-29 cells could restrain cell proliferation (P < 0.01), restore cell arrest (P < 0.05 or P < 0.01), activate STAT3 (P < 0.01) and induce expression of cyclinD1 (P < 0.01) due to up-regulated expression of SOCS3 (P < 0.01).
CONCLUSION: Expression of miR-19b not only regulates the proliferation but also influences the cell cycle of HT-29 cells, possibly by inhibiting the expression of SOCS3.
- Citation: Cheng XQ, Zhang YD, Zhang HJ. miRNA-19b regulates proliferation of human colon cancer cell line HT-29. Shijie Huaren Xiaohua Zazhi 2015; 23(10): 1568-1576
- URL: https://www.wjgnet.com/1009-3079/full/v23/i10/1568.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i10.1568
近年随着人们生活水平的提高, 饮食结构的改变, 我国结肠癌发病率上升[1,2]. 其死亡率在我国也明显增加[3]. 目前结肠癌发生机制尚未完全阐明, 其发生发展与遗传、饮食、环境等因素密切相关. 因而开展结肠癌发病机制研究, 为寻找新的诊断及治疗靶点具有重要意义.
近年来, 微小RNA(micro RNA, miRNA)作为新的研究切入点, 为癌症的诊断与治疗开辟了一条新途径[4,5]. miRNA是一类非编码单链小分子RNA, 约20-23个核糖核苷酸, 可与靶基因mRNA的3'端非翻译区(3' untranslated region, 3'UTR)互补结合, 降解靶基因的mRNA或抑制其翻译, 在转录后水平负性调控靶基因的表达, 参与个体发育、细胞凋亡、增殖等生命活动[6-8].
大部分miRNA在基因组上定位于与肿瘤相关的脆性位点(fragile site)[9], 提示miRNA在肿瘤发生过程中起着至关重要的作用, 其功能可能类似于抑癌基因和原癌基因. miR-19b是致癌基因簇miR-17-92中的一员[10], 该基因簇可通过调节某些靶基因而发挥促癌作用[11], 参与癌症的发生, 如miR-92a在结肠癌中明显升高, 可靶向调节B细胞慢性淋巴细胞白血病/淋巴瘤(B-cell CLL/lymphoma 2, Bcl-2)蛋白家族促凋亡成员之一Bim基因的表达, 影响细胞凋亡参与结肠癌发生发展[10]. 有研究[12]表明, miR-19b在结肠癌组织中呈高表达. miR-19b对细胞增殖有着怎样的影响尚不明确. 本研究旨在探讨miR-19b对结肠癌细胞增殖的影响及其可能机制, 为寻找结肠癌新治疗途径提供新的视角.
HT-29细胞购自上海细胞库; McCoy's 5A培养基和胎牛血清(FBS)(Gibco, 美国); Lipofectamine 2000(Invitrogen, 美国); miR-19b模拟物(mimic)、模拟物对照(mimic nc)、抑制物(inhibitor)、抑制物对照(inhibitor nc)(GenePharma, 上海); 细胞因子信号转导抑制蛋白3(suppressor of cytokine signaling, SOCS3) mRNA primer(Invitrogen); TRIzol(Invitrogen); 强效蛋白裂解液(Beyotime, 中国); 兔SOCS3抗体(Abcam, 美国); 兔细胞周期蛋白D1(cyclinD1)、信号转导与转录激活子3(signal transducer and activator of transcription 3, STAT3)、p-STAT3(CST, 美国); 鼠α-Tublin(Beyotime, 中国); HRP标记的羊抗兔、羊抗鼠二抗(Santa Cruz, 美国); AMV酶、dNTP、Taq酶(TaKaRa, 中国); 显影液(Thermo, 美国); CCK8试剂盒(上海和元生物); PI染液(Invitrogen).
1.2.1 HT-29细胞的培养及细胞转染: HT-29细胞接种于10%FBS的McCoy's 5A培养基中, 37 ℃、50 mL/L CO2培养箱中培养, 至对数生长期用于实验. 细胞铺于6孔板中, 待细胞长至70%密度时根据Lipofectamine 2000说明书转染等量的miR-19b mimic和mimic nc、miR-19b inhibitor和inhibitor nc, 6 h后换成2%FBS培养基, 培养24 h或48 h后检测RNA或蛋白SOCS3、STAT3、p-STAT3、cyclinD1的表达.
1.2.2 实时荧光定量PCR(qRT-PCR): 从转染miR-19b mimic或inhibitor 24 h后的HT-29细胞中提取总RNA, 1 μg总RNA用于逆转录, 反应条件为16 ℃ 30 min, 42 ℃ 30 min及85 ℃ 5 min. 1 μL RT产物构建20 μL PCR体系扩增miR-19b、U6、SOCS3 mRNA及GAPDH, 引物序列: SOCS3(sense): 5'-GGAGTTCCTGGACCAGTACG-3', SOCS3(antisense): 5'-TTCTTGTGCTTGTGCCATGT-3'; GAPDH(sense): 5'-AGAAGGCTGGGGCTCATTTG-3'; GAPDH(antisense): 5'-AGGGGCCATCCACAGTCTTC-3'. mRNA扩增参数为95 ℃预变性5 min, 95 ℃ 15 s, 55 ℃ 30 s, 72 ℃ 30 s, 扩增40个循环. miRNA扩增参数为95 ℃预变性5 min, 95 ℃ 15 s , 60 ℃ 1 min, 扩增40个循环. 相对表达量用2-△△Ct表示, 其中SOCS3 mRNA的△Ct = CtSOCS3 mRNA-CtGAPDH, miR-19b的△Ct = CtmiR-19b-CtU6, 两者的△△Ct = △Ct处理组-△Ct对照组.
1.2.3 Western blot分析: 细胞处理后去掉培养液, 用PBS洗1遍, 胰酶消化后低速离心, 用PBS再洗2遍, 离心收集细胞. 加入裂解液后冰上裂解30 min, 提取细胞总蛋白. 所有样本均用BCA蛋白定量试剂盒进行蛋白定量, 加入Loading buffer后煮沸变性. 用10%SDS-PAGE进行凝胶电泳, 经电转移至PVDF膜上, 5%脱脂奶粉室温封闭1 h, 加入SOCS3抗体(1:1000)、STAT3抗体(1:1000)、磷酸化STAT3抗体(1:1000)或cyclinD1抗体(1:1000), 4 ℃过夜. TBST洗膜3次 × 10 min后, 加入羊抗兔抗体(1:4000), 37 ℃孵育1 h, 再行TBST洗膜3次 × 10 min, 加入显影液后孵育曝光. 实验在相同的条件下重复3次.
1.2.4 CCK8测细胞增殖能力: 取对数生长期细胞1 × 105/mL悬液每孔100 μL接种于96孔板中随机分组, 每组设6个复孔. 培养24 h后弃去培养基. 按说明书对照组加入Lipofectamine 2000及miR-19b mimic nc或inhibitor nc, 实验组加入Lipofectamine 2000及miR-19b mimic或inhibitor. 余加上无血清培养基补足到每孔100 μL. 6 h后换成2%FBS的培养基. 于转染后12、24、36、48 h给予每孔10 μL的CCK8试剂. 各组37 ℃孵育2 h后在450 nm波长下的酶联免疫检测仪上测定各孔吸光度取各组平均吸光度. 每组实验重复3次.
1.2.5 流式细胞术测定细胞周期: 取对数生长期细胞悬液每孔500 μL接种于24孔板中培养24 h弃去培养基随机分组. 按照说明书对照组加入Lipofectamine 2000和miR-19b mimic nc或inhibitor nc, 实验组加入Lipofectamine 2000及miR-19b mimic或inhibitor. 无血清培养基补足各孔至500 μL, 6 h后换成2%FBS的培养基, 再培养24 h后收集细胞. 低速离心5 min加入PBS洗涤细胞2次, 离心去除PBS加入1 mL预冷乙醇4 ℃过夜. 低速离心5 min后加入PBS洗涤细胞2次, 加入含0.3% Triton和50 μg/mL RNaseA的PBS, 37 ℃孵育30 min. 离心后PBS洗2遍, 收集细胞加入PI染液700 μL 37 ℃避光染色15 min. 取104个细胞在BD FACS流式细胞仪分析每个样品. FlowJo软件进行曲线拟合分析计算DNA含量得出细胞周期百分比.
统计学处理 受试样品数据以mean±SD表示. 所有数据采用SPSS20.0处理, 进行统计学分析. 两组之间比较用t检验, 以P<0.05表示差异有统计学意义.
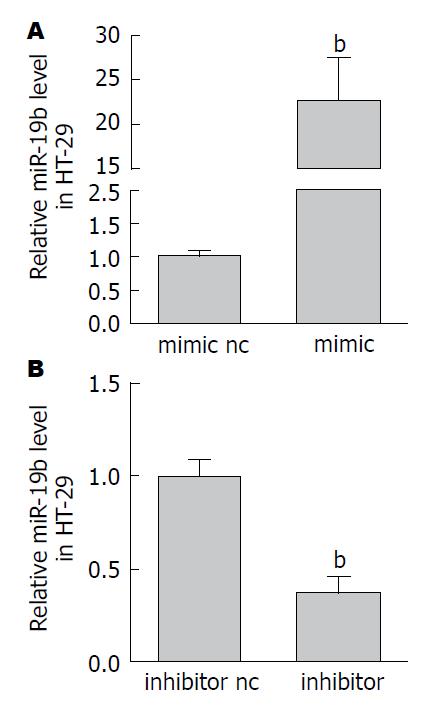
HT-29细胞转染miR-19b mimic 24 h后, 经qRT-PCR检测发现细胞内的miR-19b水平较对照组明显升高(P<0.01). 反之, 转染miR-19b inhibitor后, HT-29细胞内的miR-19b水平较对照组显著下降(P<0.01). 说明脂质体介导的miR-19b细胞转染成功(图1).
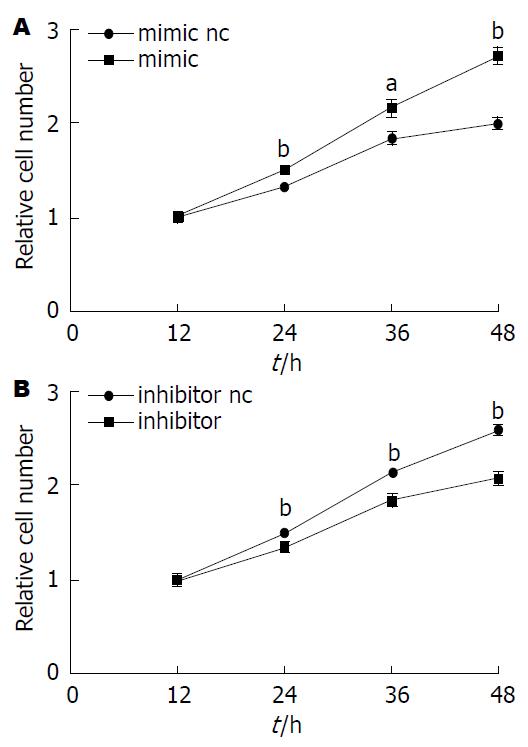
采用CCK8检测法, 观察miR-19b对HT-29细胞增殖活力的影响. 结果显示高表达miR-19b, 结肠癌HT-29细胞的增殖能力在24、36、48 h均较对照组明显升高, 差异有统计学意义(P<0.05或P<0.01). 反之, 降低miR-19b水平, HT-29细胞增殖能力在24、36、48 h均较对照组明显下降(P<0.01). 提示miR-19b与结肠癌HT-29细胞的增殖能力成正相关(图2).
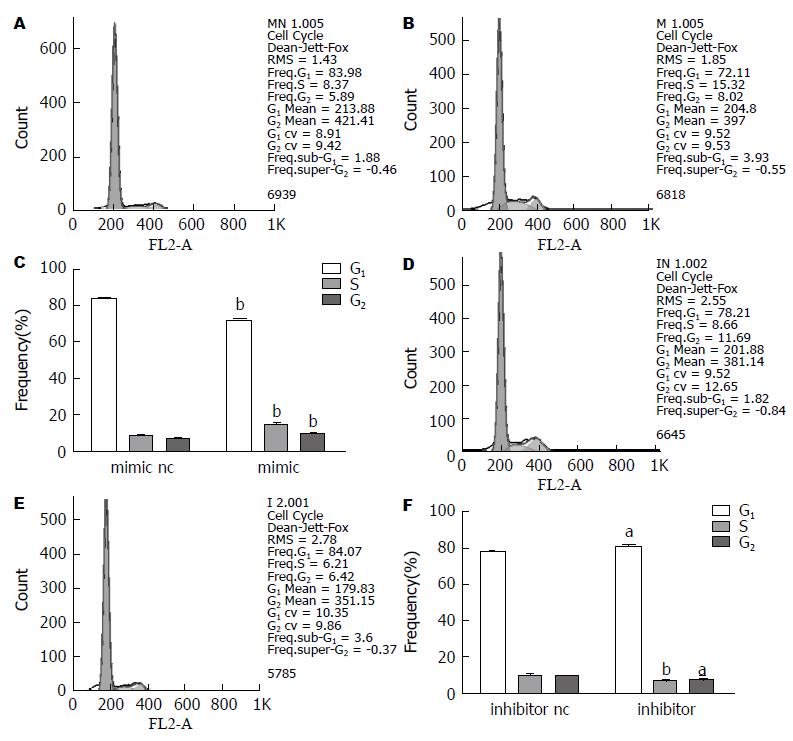
HT-29细胞转染miR-19b mimic和mimic nc 24 h后进行流式细胞术分析, 结果显示miR-19b mimic组G1期细胞的比例低于对照组(72.45%±0.58% vs 83.77%±0.43%), S期及G2期细胞比例分别占14.67%±0.98%、9.85%±0.64%, 明显高于与对照组(8.08%±1.05%、6.14%±0.63%). 提示过表达miR-19b可使结肠癌HT-29细胞G1期的细胞比例减少, 促进细胞向增殖周期(S+G2)期转变(P<0.01). 同时, 用流式细胞术检测HT-29细胞转染miR-19b inhibitor和inhibitor nc 24 h后的细胞周期变化. miR-19b inhibitor组G1期的细胞比例(83.27%±0.75%)高于对照组(77.18%±0.79%), 细胞S期及G2期分别占6.21%±0.68%、6.47%±0.22%, 明显低于与对照组(10.96%±0.37%、10.52%±1.14%). 说明抑制miR-19b可以抑制HT-29细胞增殖, 使G1期的细胞比例增多, 抑制细胞向增殖周期(S+G2)期转变(P<0.05或P<0.01). 综上实验结果说明, miR-19b可通过影响细胞周期而改变细胞的增殖活性(图3).
SOCS3是细胞增殖相关的重要细胞因子. 同时经生物信息学预测SOCS3可能是miR-19b的靶基因. 本研究推测miR-19b对细胞增殖能力的影响是否是通过负性调控细胞内SOCS3的表达而发挥作用.
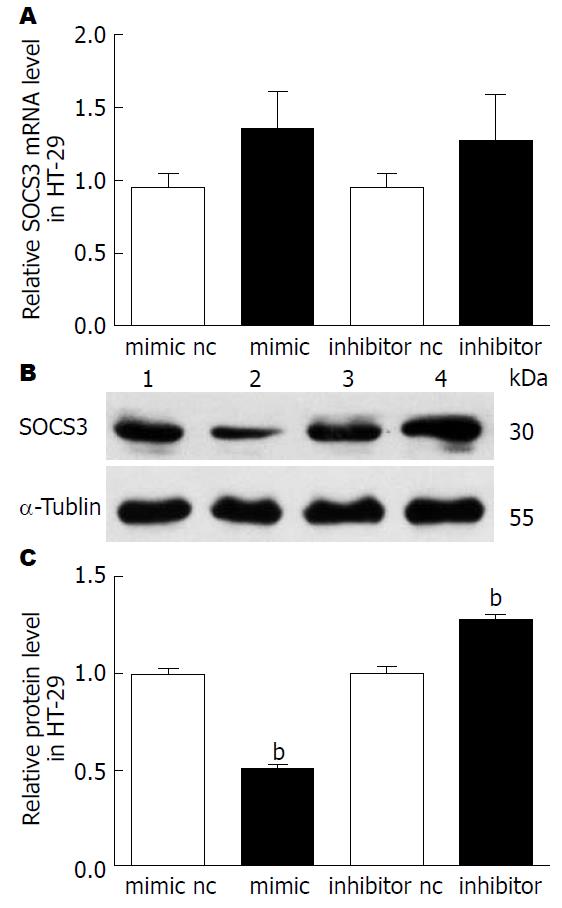
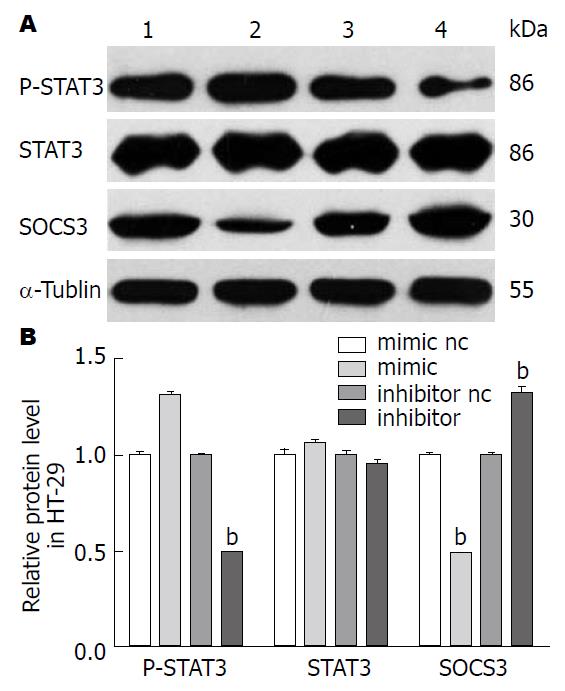
HT-29细胞转染miR-19b mimic或inhibitor 24 h后, 用qRT-PCR检测细胞内的SOCS3 mRNA, 发现SOCS3 mRNA在mimic或inhibitor组中较对照组差异均无统计学意义. 转染后48 h提取细胞总蛋白, 用Western blot检测细胞内SOCS3的蛋白水平. 过表达miR-19b可明显抑制HT-29细胞内SOCS3蛋白的表达(P<0.01), 抑制miR-19b则促进HT-29细胞内SOCS3蛋白的表达(P<0.01). 结合图4所示, 改变HT-29细胞内的miR-19b不影响SOCS3 mRNA的表达, 但可影响SOCS3的蛋白水平, 提示miR-19b可能在转录后水平抑制SOCS3的表达, 与miRNA的经典生物调控方式一致[6,7](图4).
SOCS3是JAK/STAT3的负性调控者[13,14]. 高表达miR-19b可抑制HT-29细胞内SOCS3蛋白的表达, 同时促进细胞内STAT3的磷酸化(P<0.01). 降低HT-29细胞中miR-19b可促进SOCS3蛋白的表达, 进而抑制STAT3的磷酸化(P<0.01). 提示miR-19b对SOCS3的负性调控可能介导STAT3的磷酸化(图5).
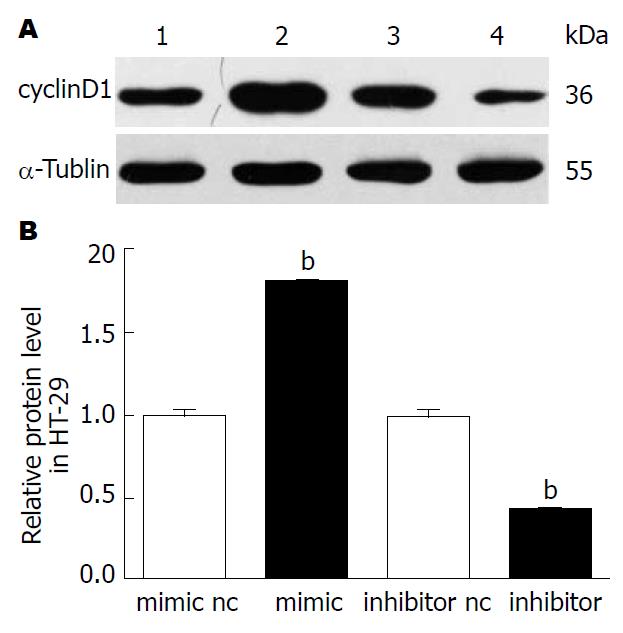
CyclinD1是STAT3通路的重要下游基因, 可以调控细胞周期, 促进细胞向增殖期S+G2期转变[15-17]. 过表达miR-19b的HT-29细胞内的STAT3磷酸化明显增加, 同时其细胞内cyclinD1的表达同步升高(P<0.01), 抑制miR-19b则减少HT-29细胞内STAT3的磷酸化, 进而减少细胞内cyclinD1的表达(P<0.01). 而我们之前的结果2和结果3均提示miR-19b有促进细胞向增殖周期转化, 增殖能力提高, 提示miR-19b可能是通过改变细胞内cyclinD1的表达从而调控细胞周期, 影响细胞增殖(图6).
结肠癌是消化系常见的恶性肿瘤, 其发病在世界范围内男性居各恶性肿瘤第3位, 女性居第2位[18]. 目前结肠癌发生发展的确切机制尚未完全明了. miRNA是新发现的一类小分子RNA. 研究[19,20]表明, 血清中特异性表达的miRNA有望成为结肠癌新的早期监测指标. 另外, 在肿瘤组织中, 不同的组织来源和分期可能存在不同的miRNA表达谱[21], 异常表达的miRNA与细胞周期的调控[22]及癌细胞对化疗药物的敏感性相关[23], 并可根据miRNA的表达谱对多种低分化肿瘤进行分类[24], 表明miRNA在结肠癌的筛选、早期诊断、肿瘤缓解和防止复发等方面有着重要的应用前景[25].
miR-17-92是首个发现的非编码致癌基因族[26], 包括6个成熟的miRNA: miR-17、miR-18a、miR-19a、miR-20a、miR-19b和miR-92a[10]. 在多种癌症中高表达, 抑制细胞凋亡[26,27], 在B细胞淋巴瘤中, 过表达的miR-19可以抑制抑癌基因同源性磷酸酶-张力蛋白(phosphatase and tensin homolog, PTEN)的表达, 进而促进细胞的增殖和恶变[28]. 5-氟尿嘧啶(5-fluorouracil, 5-FU)可以影响肿瘤细胞的细胞周期发挥抗肿瘤的作用, 而miR-19b在DLD-1/R结肠癌细胞系中升高, 作用于细胞增殖相关蛋白人脯氨酸/谷氨酸富含性剪切因子(splicing factor proline/glutamine-rich, SFPQ)和禽急性成髓细胞白血病病毒致癌基因同源基因2(v-myb avian myeloblastosis viral oncogene homolog-like 2, MYBL2), 导致5-FU的抗肿瘤作用失效[29]. 说明miR-19b可能介导了化疗药物的耐药性[10,12,28,29]. miR-19b可促进结肠腺瘤向结肠腺癌转变[30], 与癌症患者的生存率成负相关[12]. 在正常肠上皮中, miR-17-92基因簇参与肠上皮的分化成熟和自我更新. 但在结肠癌组织中, 升高的miR-17-92可以抑制转录因子E2F1(E2F transcription factor 1)的表达, 促进细胞增殖及抑制细胞凋亡[10]. miR-19b作为此基因簇中的一员, 也是重要的致癌基因, 与多种癌症的发生相关[31]. 文献[18,20]报道, miR-19b在结肠癌中高表达, 而SOCS3蛋白在结肠癌中表达减少[32].
SOCS3是JAK/STAT3通路的负性调控者[13,14]. 在多种癌症(如肺癌及胆管癌)中, SOCS3基因启动子的超甲基化会沉默SOCS3的生物学功能, 诱导STAT3的磷酸化, 有利于肿瘤细胞的增殖及存活, 促进癌症的发生[33-35]. 而肠上皮细胞中STAT3的磷酸化可诱导上皮细胞的增殖及炎症诱导的癌症发生[36], 与肺癌及胆管癌中STAT3的高度磷酸化可诱导细胞癌变的作用相似[33-35]. CyclinD1是STAT3的重要下游基因, STAT3对细胞增殖的影响可能是通过诱导cyclinD1等的表达[15,16], 调节细胞的增殖周期[17], 抑制细胞凋亡, 诱导细胞的癌变.
经生物信息学预测软件Target Scan、PicTar及microRNA.org发现, miR-19b可靶向调控SOCS3. 另有研究[37]表明miR-19b可在转录后水平负性调控SOCS3的表达, 参与动脉粥样硬化的发生. 提示miR-19b可通过影响SOCS3的表达从而改变细胞的功能. 本研究发现, 在结肠癌HT-29细胞中, 过表达或抑制miR-19b(图1)可影响细胞的增殖能力(图2), 这一生物调节机制可能是通过在转录后水平抑制SOCS3的表达(图4)发挥作用, 而SOCS3水平的改变进一步影响STAT3的磷酸化(图5)及其下游靶基因之一细胞周期蛋白cyclinD1的表达(图6), 影响了细胞的增殖周期来调节细胞的增殖活性(图3). 以上研究提示miR-19b影响细胞增殖, 这一作用可能是通过对SOCS3的靶向调控作用, 介导了STAT3的磷酸化, 进而影响cyclinD1表达实现, 该研究与Han等[37]的研究结果类似.
总之, miR-19b的高表达能够促进结肠癌细胞的增殖活性, 影响细胞周期, 提示miR-19b在结肠癌中可能扮演致癌基因的角色, 这与其在结肠癌组织中表达上调时的生物作用一致. SOCS3可能为miR-19b的促癌作用靶点, miR-19b作为新的研究靶点也为结肠癌病因的探讨及治疗提供了新的研究方向.
微小RNA(micro RNA, miRNA)是一类非编码单链小分子RNA, 可在转录后水平调控靶基因的表达, 参与个体发育、细胞凋亡、增殖等生命活动. miR-17-92是首个发现的非编码致癌基因族. miR-19b是该基因簇中的一员, 在结肠癌组织中高表达. 经生物信息学预测发现, 细胞因子信号转导抑制蛋白3(suppressor of cytokine signaling, SOCS3)是miR-19b的靶基因之一. SOCS3在结肠癌中低表达. miR-19b的促癌作用可能与靶向调控SOCS3相关.
卢宁, 副主任医师, 中国人民解放军兰州军区乌鲁木齐总医院肿瘤科
SOCS3与细胞增殖相关, 在结肠癌中低表达. miR-19b是致癌基因, 在结肠癌中高表达, 其具体致癌机制仍不明确. 寻找新的结肠癌研究靶点是亟需解决的问题.
Han等发现miR-19b可在转录后水平负性调控SOCS3的表达, 参与动脉粥样硬化的发生. SOCS3在多种癌症低表达, 可诱导信号转导与转录激活子3(signal transducer and activator of transcription 3)的磷酸化, 有利于肿瘤细胞的增殖及存活, 促进癌症的发生.
本研究首次探讨了结肠癌中高表达的miR-19b对SOCS3蛋白的调控及可能机制, 进一步证实了miR-19b可能参与结肠癌的发生, 为结肠癌的诊疗提供新的研究方向.
本研究发现, miR-19b可在转录后水平靶向调控SOCS3的表达, 高表达miR-19b可抑制SOCS3的表达, 促进细胞增殖. 与结肠癌组织中miR-19b及SOCS3的表达一致, 从而为临床上结肠癌的治疗提供可能的新途径.
MicroRNA(miRNA): 是在真核生物中发现的一类内源性的具有调控功能的非编码RNA, 其大小长约20-25个核苷酸. 成熟的miRNAs是由较长的初级转录物经过一系列核酸酶的剪切加工而产生的, 随后组装进RNA诱导的沉默复合体, 通过碱基互补配对的方式识别靶mRNA, 并根据互补程度的不同指导沉默复合体降解靶mRNA或者阻遏靶mRNA的翻译.
本文研究设计合理, 方法正确, 结果可信, 具有一定的创新性和学术价值, 论文写作简洁、流畅, 数据分析合理正确. 为临床上结肠癌提供新的研究方向.
编辑: 韦元涛 电编:闫晋利
| 1. | Center MM, Jemal A, Ward E. International trends in colorectal cancer incidence rates. Cancer Epidemiol Biomarkers Prev. 2009;18:1688-1694. [PubMed] [DOI] |
| 3. | Wan DS. [Epidemiologic trend of and strategies for colorectal cancer]. Ai Zheng. 2009;28:897-902. [PubMed] [DOI] |
| 4. | Chen X, Wang K, Chen J, Guo J, Yin Y, Cai X, Guo X, Wang G, Yang R, Zhu L. In vitro evidence suggests that miR-133a-mediated regulation of uncoupling protein 2 (UCP2) is an indispensable step in myogenic differentiation. J Biol Chem. 2009;284:5362-5369. [PubMed] [DOI] |
| 5. | Chen X, Guo X, Zhang H, Xiang Y, Chen J, Yin Y, Cai X, Wang K, Wang G, Ba Y. Role of miR-143 targeting KRAS in colorectal tumorigenesis. Oncogene. 2009;28:1385-1392. [PubMed] [DOI] |
| 6. | Bartel DP. MicroRNAs: genomics, biogenesis, mechanism, and function. Cell. 2004;116:281-297. [PubMed] [DOI] |
| 7. | Chen K, Rajewsky N. Deep conservation of microRNA-target relationships and 3'UTR motifs in vertebrates, flies, and nematodes. Cold Spring Harb Symp Quant Biol. 2006;71:149-156. [PubMed] [DOI] |
| 9. | Calin GA, Sevignani C, Dumitru CD, Hyslop T, Noch E, Yendamuri S, Shimizu M, Rattan S, Bullrich F, Negrini M. Human microRNA genes are frequently located at fragile sites and genomic regions involved in cancers. Proc Natl Acad Sci U S A. 2004;101:2999-3004. [PubMed] [DOI] |
| 10. | Tsuchida A, Ohno S, Wu W, Borjigin N, Fujita K, Aoki T, Ueda S, Takanashi M, Kuroda M. miR-92 is a key oncogenic component of the miR-17-92 cluster in colon cancer. Cancer Sci. 2011;102:2264-2271. [PubMed] [DOI] |
| 11. | Monzo M, Navarro A, Bandres E, Artells R, Moreno I, Gel B, Ibeas R, Moreno J, Martinez F, Diaz T. Overlapping expression of microRNAs in human embryonic colon and colorectal cancer. Cell Res. 2008;18:823-833. [PubMed] [DOI] |
| 12. | Yu G, Tang JQ, Tian ML, Li H, Wang X, Wu T, Zhu J, Huang SJ, Wan YL. Prognostic values of the miR-17-92 cluster and its paralogs in colon cancer. J Surg Oncol. 2012;106:232-237. [PubMed] [DOI] |
| 13. | Suzuki A, Hanada T, Mitsuyama K, Yoshida T, Kamizono S, Hoshino T, Kubo M, Yamashita A, Okabe M, Takeda K. CIS3/SOCS3/SSI3 plays a negative regulatory role in STAT3 activation and intestinal inflammation. J Exp Med. 2001;193:471-481. [PubMed] [DOI] |
| 14. | Park EJ, Park SY, Joe EH, 15d-PGJ2 and rosiglitazone suppress Janus kinase-STAT inflammatory signaling through induction of suppressor of cytokine signaling 1 (SOCS1) and SOCS3 in glia. J Biol Chem. 2003;278:14747-14752. [PubMed] [DOI] |
| 15. | 李 敏, 周 颖, 彭 程, 冯 定庆, 李 彩荣, 凌 斌, 肖 卫华. STAT3、cyclinD1、cyclinB1在卵巢上皮性癌的表达及意义. 现代妇产科进展. 2008;17:745-747. |
| 16. | Alvarez JV, Frank DA. Genome-wide analysis of STAT target genes: elucidating the mechanism of STAT-mediated oncogenesis. Cancer Biol Ther. 2004;3:1045-1050. [PubMed] [DOI] |
| 17. | Michaud-Levesque J, Bousquet-Gagnon N, Béliveau R. Quercetin abrogates IL-6/STAT3 signaling and inhibits glioblastoma cell line growth and migration. Exp Cell Res. 2012;318:925-935. [PubMed] [DOI] |
| 18. | Compton CC. Colorectal carcinoma: diagnostic, prognostic, and molecular features. Mod Pathol. 2003;16:376-388. [PubMed] [DOI] |
| 19. | Ng EK, Chong WW, Jin H, Lam EK, Shin VY, Yu J, Poon TC, Ng SS, Sung JJ. Differential expression of microRNAs in plasma of patients with colorectal cancer: a potential marker for colorectal cancer screening. Gut. 2009;58:1375-1381. [PubMed] [DOI] |
| 20. | Huang Z, Huang D, Ni S, Peng Z, Sheng W, Du X. Plasma microRNAs are promising novel biomarkers for early detection of colorectal cancer. Int J Cancer. 2010;127:118-126. [PubMed] [DOI] |
| 21. | Schetter AJ, Leung SY, Sohn JJ, Zanetti KA, Bowman ED, Yanaihara N, Yuen ST, Chan TL, Kwong DL, Au GK. MicroRNA expression profiles associated with prognosis and therapeutic outcome in colon adenocarcinoma. JAMA. 2008;299:425-436. [PubMed] [DOI] |
| 22. | Calin GA, Croce CM. MicroRNA signatures in human cancers. Nat Rev Cancer. 2006;6:857-866. [PubMed] [DOI] |
| 23. | Nakajima G1, Hayashi K, Xi Y, Kudo K, Uchida K, Takasaki K, Yamamoto M, Ju J. Non-coding MicroRNAs hsa-let-7g and hsa-miR-181b are Associated with Chemoresponse to S-1 in Colon Cancer. Cancer Genomics Proteomics. 2006;3:317-324. [PubMed] |
| 24. | Blenkiron C, Goldstein LD, Thorne NP, Spiteri I, Chin SF, Dunning MJ, Barbosa-Morais NL, Teschendorff AE, Green AR, Ellis IO. MicroRNA expression profiling of human breast cancer identifies new markers of tumor subtype. Genome Biol. 2007;8:R214. [PubMed] |
| 26. | He L, Thomson JM, Hemann MT, Hernando-Monge E, Mu D, Goodson S, Powers S, Cordon-Cardo C, Lowe SW, Hannon GJ. A microRNA polycistron as a potential human oncogene. Nature. 2005;435:828-833. [PubMed] [DOI] |
| 27. | Hong L, Lai M, Chen M, Xie C, Liao R, Kang YJ, Xiao C, Hu WY, Han J, Sun P. The miR-17-92 cluster of microRNAs confers tumorigenicity by inhibiting oncogene-induced senescence. Cancer Res. 2010;70:8547-8557. [PubMed] [DOI] |
| 28. | Olive V, Bennett MJ, Walker JC, Ma C, Jiang I, Cordon-Cardo C, Li QJ, Lowe SW, Hannon GJ, He L. miR-19 is a key oncogenic component of mir-17-92. Genes Dev. 2009;23:2839-2849. [PubMed] [DOI] |
| 29. | Kurokawa K, Tanahashi T, Iima T, Yamamoto Y, Akaike Y, Nishida K, Masuda K, Kuwano Y, Murakami Y, Fukushima M. Role of miR-19b and its target mRNAs in 5-fluorouracil resistance in colon cancer cells. J Gastroenterol. 2012;47:883-895. [PubMed] [DOI] |
| 30. | Diosdado B, van de Wiel MA, Terhaar Sive Droste JS, Mongera S, Postma C, Meijerink WJ, Carvalho B, Meijer GA. MiR-17-92 cluster is associated with 13q gain and c-myc expression during colorectal adenoma to adenocarcinoma progression. Br J Cancer. 2009;101:707-714. [PubMed] [DOI] |
| 31. | Tanzer A, Stadler PF. Molecular evolution of a microRNA cluster. J Mol Biol. 2004;339:327-335. [PubMed] [DOI] |
| 32. | Shen A, Chen Y, Hong F, Lin J, Wei L, Hong Z, Sferra TJ, Peng J. Pien Tze Huang suppresses IL-6-inducible STAT3 activation in human colon carcinoma cells through induction of SOCS3. Oncol Rep. 2012;28:2125-2130. [PubMed] [DOI] |
| 33. | He B, You L, Uematsu K, Zang K, Xu Z, Lee AY, Costello JF, McCormick F, Jablons DM. SOCS-3 is frequently silenced by hypermethylation and suppresses cell growth in human lung cancer. Proc Natl Acad Sci U S A. 2003;100:14133-14138. [PubMed] [DOI] |
| 34. | Isomoto H. Epigenetic alterations in cholangiocarcinoma-sustained IL-6/STAT3 signaling in cholangio- carcinoma due to SOCS3 epigenetic silencing. Digestion. 2009;79 Suppl 1:2-8. [PubMed] [DOI] |
| 35. | Isomoto H, Mott JL, Kobayashi S, Werneburg NW, Bronk SF, Haan S, Gores GJ. Sustained IL-6/STAT-3 signaling in cholangiocarcinoma cells due to SOCS-3 epigenetic silencing. Gastroenterology. 2007;132:384-396. [PubMed] [DOI] |
| 36. | Grivennikov S, Karin E, Terzic J, Mucida D, Yu GY, Vallabhapurapu S, Scheller J, Rose-John S, Cheroutre H, Eckmann L. IL-6 and Stat3 are required for survival of intestinal epithelial cells and development of colitis-associated cancer. Cancer Cell. 2009;15:103-113. [PubMed] [DOI] |
| 37. | Han H, Wang YH, Qu GJ, Sun TT, Li FQ, Jiang W, Luo SS. Differentiated miRNA expression and validation of signaling pathways in apoE gene knockout mice by cross-verification microarray platform. Exp Mol Med. 2013;45:e13. [PubMed] [DOI] |