修回日期: 2014-11-07
接受日期: 2014-11-12
在线出版日期: 2015-01-08
目的: 通过对肿瘤微环境中相关成分的检测, 探索肿瘤微环境对大肠癌启动的意义.
方法: 在距离大肠癌病灶近端10、5、2 cm处分别取得组织样本, 依次命名为1、2、3号位组织样本. 通过常规石蜡切片-HE染色方法和免疫组织化学检测3个部位中Ⅰ型胶原(collagen type Ⅰ, Col-Ⅰ)、透明质酸酶(hyaluronidase-1, Hyal-1)、上皮性钙黏素(E-cadherin)、极性调控蛋白crumbs3(CRB3)的表达及分布情况.
结果: HE染色结果提示, 越靠近肿瘤病灶, 大肠隐窝的破坏越严重. 免疫组织化学实验结果表明, 在1、2、3号位中Col-Ⅰ和Hyal-1表达逐渐增高, E-cadherin和CRB3表达逐渐降低.
结论: 在大肠癌发生过程中, Col-Ⅰ和Hyal-1表达增高, 提示细胞外基质的改变可以促进肿瘤发生; 而E-cadherin和CRB3表达降低提示细胞极性的丧失也是促进肿瘤发生的一个重要因素.
核心提示: 在大肠癌发生过程中, 间质大分子Ⅰ型胶原(collagen type Ⅰ)和透明质酸酶(hyaluronidase-1)表达增高, 提示细胞外基质(extracellular matrix)的改变可以促进肿瘤发生; 而上皮性钙黏素(E-cadherin)和极性调控蛋白crumbs3表达降低提示细胞极性的丧失也是促进肿瘤发生的一个重要因素.
引文著录: 刘红, 文彬, 陈丹, 刘金元, 胡丰良. 人大肠癌癌旁不同部位组织细胞外基质分子和细胞极性分子表达差异比较. 世界华人消化杂志 2015; 23(1): 163-169
Revised: November 7, 2014
Accepted: November 12, 2014
Published online: January 8, 2015
AIM: To investigate the role of cancer micro-environment in colorectal carcinogenesis by detecting the expression of extracellular matrix and cell polarity proteins in tissues at different distances from colorectal cancer lesions.
METHODS: Samples were collected from sites 10, 5, and 2 cm away from colorectal cancer lesions. HE staining was used to observe the structure of crypts. Immunohistochemistry was used to detect the expression of collagen type Ⅰ (Col-Ⅰ), hyaluronidase-1 (Hyal-1), E-cadherin and crumbs3 (CRB3).
RESULTS: As the tissues were getting closer to the colorectal cancer lesions, the expression of Col-Ⅰ and Hyal-1 increased, while that of E-cadherin and CRB3 decreased.
CONCLUSION: Up-regulation of Col-Ⅰ and Hyal-1 and down-regulation of E-cadherin and CRB3 may contribute to the initiation of colorectal cancer.
- Citation: Liu H, Wen B, Chen D, Liu JY, Hu FL. Expression of extracellular matrix and cell polarity proteins in tissues at different distances from colorectal cancer lesions. Shijie Huaren Xiaohua Zazhi 2015; 23(1): 163-169
- URL: https://www.wjgnet.com/1009-3079/full/v23/i1/163.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i1.163
肿瘤是现今医学界一个棘手的难题. 目前, 发达国家对肿瘤的诊断与治疗多集中在早期, 并且把一些肿瘤标志物作为某些患者的必检项目. 研究肿瘤的启动机制也成为当下的一个研究热点. 随着对肿瘤的研究的深入研究, 人们发现, 肿瘤的启动与肿瘤细胞所处的内外环境有着密切关系. 早在19世纪末英国外科医师Stephen Paget就提出肿瘤转移的"种子与土壤"学说, 即肿瘤细胞(种子), 在具有促进肿瘤的细胞生长的特定器官微环境(土壤)中才能种植、存活、生长成功. 实际上Paget指出了肿瘤的发生发展与肿瘤和微环境的亲和力有密切关系. 每一个实体肿瘤就像一个独立而复杂的器官, 肿瘤的发生发展过程不仅与自身的突变和基因不稳定性相关, 更离不开肿瘤细胞与其所处的微环境之间的动态交换及反应的作用, 他们逐渐破坏邻近的细胞与基质之间的正常联系和组织的正常结构, 组织架构和内稳态的改变是肿瘤启动的早期信号. 微环境的稳定是保证细胞正常增殖、分化、代谢和功能活动的重要前提, 而肿瘤微环境对肿瘤细胞发生发展也起着非常重要的影响. 肿瘤微环境(cancer microenvironment)泛指组织细胞及其分泌的各种可溶性因子, 主要包括内皮细胞及其前体细胞、周细胞、平滑肌细胞、成纤维细胞、肿瘤相关性成纤维细胞等[1], 可溶性因子有细胞外基质(extracellular matrix, ECM)等[2]. 而肿瘤微环境特指由肿瘤细胞、内皮细胞、免疫细胞、ECM等相互作用形成的肿瘤细胞生长的特殊环境. 细胞与微环境的联接是细胞外环境作用于细胞的主要方式, 包括细胞与ECM大分子的连接和细胞与细胞的连接. Ⅰ型胶原(collagen type Ⅰ, Col-Ⅰ)和透明质酸酶(hyaluronidase-1, Hyal-1)是ECM的重要组分, 上皮性钙黏素(E-cadherin)和极性调控蛋白crumbs3(CRB3)是细胞极性的重要调节蛋白, 他们在癌变发生过程中均发生了变化, 这些肿瘤微环境成分的表达改变提示微环境的改变对肿瘤发生有重要意义. 因此本研究通过免疫组织化学方法观察癌旁不同部位组织中Col-Ⅰ、Hyal-1、E-cadherin和CRB3的表达变化, 来探讨肿瘤微环境在大肠癌启动过程中的意义.
标本取自广州中医药大学附属医院2013-11/2014-06手术切除的23位中分化结肠癌患者, 其中男16例, 女7例, 平均年龄56.8岁±10.6岁. 所有患者均是散发性大肠癌, 术前未接受任何放、化疗, 所有病例均经两位以上病理医师确诊. 标本获取位置如图1所示, 每例依次在距离大肠癌病灶近端10、5、2 cm处切取, 按顺序标记为1、2、3号位. SABC大鼠IgG试剂盒(SA1025)和SABC兔IgG试剂盒(SA1022)购自武汉博士德生物工程有限公司; 免疫组织化学选用的抗体均购自广州新晋生物科技有限公司, 包括Hyal-1(ab103977, Abcam)、Col-Ⅰ(ab6308, Abcam)、E-cadherin(ab15148)及CRB3(180835, Abcam); 二氨基联苯胺(3,3'-diamonbenzidine, DAB)显色试剂盒购自北京中杉金桥生物技术公司.
免疫组织化学: 所有标本均经4%多聚甲醛固定, 常规石蜡包埋, 采用4 μm厚连续切片. 常规脱蜡水化, PBS冲洗, 3%过氧化氢灭活内源性过氧化物酶, 微波修复15 min, 加入一抗4 ℃过夜; PBS冲洗2 min×3次, 滴加相应二抗37 ℃衡温箱孵育30 min, 具体步骤按试剂盒说明书操作. DAB显色, 苏木精复染, 常规乙醇脱水, 二甲苯透明, 中性树胶封片, 显微镜下观察结果. 每例标本均采用PBS代替一抗作为阴性对照组. 应用IPP6.0病理图像分析软件测定各组免疫阳性产物的吸光度A值, 每张切片随机测定6个视野, 同时测定同一张切片上组织的A值作为背景, 免疫反应产物的A值减去背景A值得到校正的A值(CA值), 即为各阳性产物的实际吸光度值, 然后求平均值作为该样本的CA值. 用CA值进行分析和比较, 以避免染色过程中的非特异性染色等导致的误差.
统计学处理 各组实验数据以mean±SD表示, 采用SPSS16.0统计软件, 计量资料进行均数间比较采用t检验或方差分析, P<0.05为差异有统计学意义.
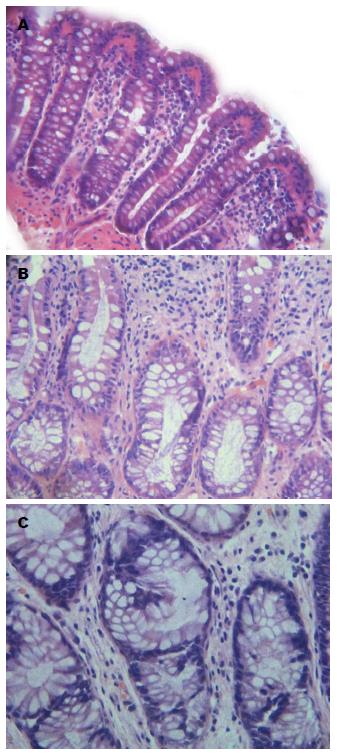
目前已有很多学者认为异常隐窝的出现是大肠癌发生的最早期事件, 并把他作为大肠癌早期诊断的观察指标之一[3]. 小肠隐窝细胞属具有增殖潜能的未分化肠上皮干细胞, 是成熟上皮细胞的前身. 正常隐窝和异常隐窝在形态学上有很大差异[4]. 与正常黏膜相比, 异常的隐窝增大变厚, 呈锯齿状; 排列紊乱, 裂隙状管腔, 开口呈椭圆状; 上皮细胞层增生染色加深; 细胞核大有异型性[5,6].
在本研究中, 通过HE染色对3个不同部位组织中隐窝结构的形态特征进行观察. 在距离大肠癌病灶最远的1号部位组织中, 隐窝结构基本正常无明显改变, 排列整齐, 腺腔直径正常, 单层排列, 细胞核大小正常(图2A). 而2号位则表现出较大的隐窝, 管腔有的呈锯齿状, 细胞核增大拉长, 表现出拥挤、分层的状态, 少部分细胞出现缺失, 隐窝间质细胞增多(图2B). 在距离癌变病灶最近的3号位中出现大量异常隐窝病灶, 隐窝异型增生明显, 腺管染色加深, 隐窝直径异常增大, 有的甚至隐窝结构完全消失, 间质细胞明显增多, 上皮层增厚, 细胞核增大, 细胞排列紊乱、重叠, 丧失组织正常结构(图2C).
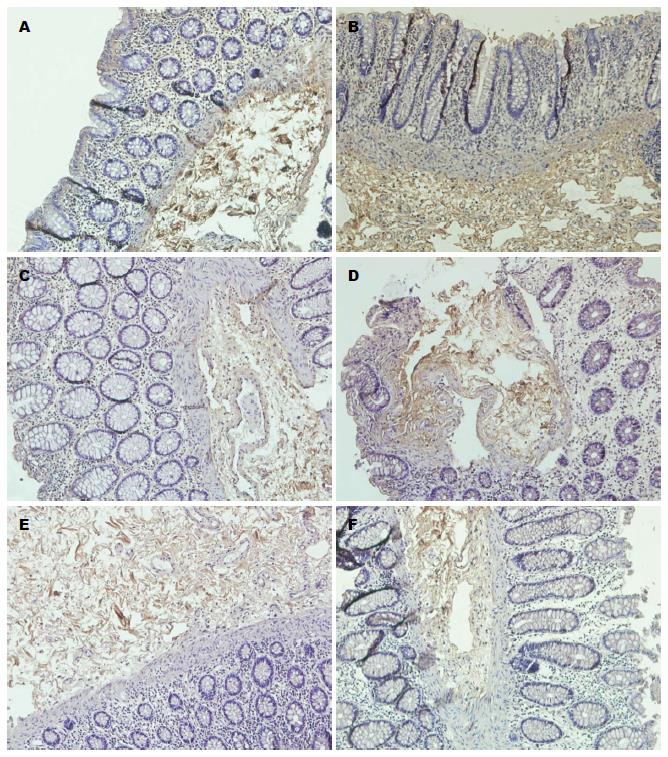
免疫组织化学结果表明1、2、3号部位组织中均有Col-Ⅰ表达(图3A-C), 主要分布于黏膜下层的结缔组织之间, 少量表达在黏膜上皮层. 应用IPP6.0病理图像分析软件测定各组免疫阳性产物的光密度值, 1、2、3号部位光密度值分别为1.8453±0.2586、2.1539±0.2353、1.9723±0.2091. 1号位的表达低于2、3号位, 差异有统计学意义(P<0.05).
免疫组织化学结果表明1、2、3号部位组织中均有Hyal-1表达(图3D-F), 主要分布在黏膜下层的结缔组织之间. 应用IPP6.0病理图像分析软件测定各组免疫阳性产物的光密度值, 1、2、3号部位光密度值分别为1.5823±0.2686、1.8715±0.2016、1.8095±0.1970. 1号位的表达低于2、3号位, 差异有统计学意义(P<0.05).
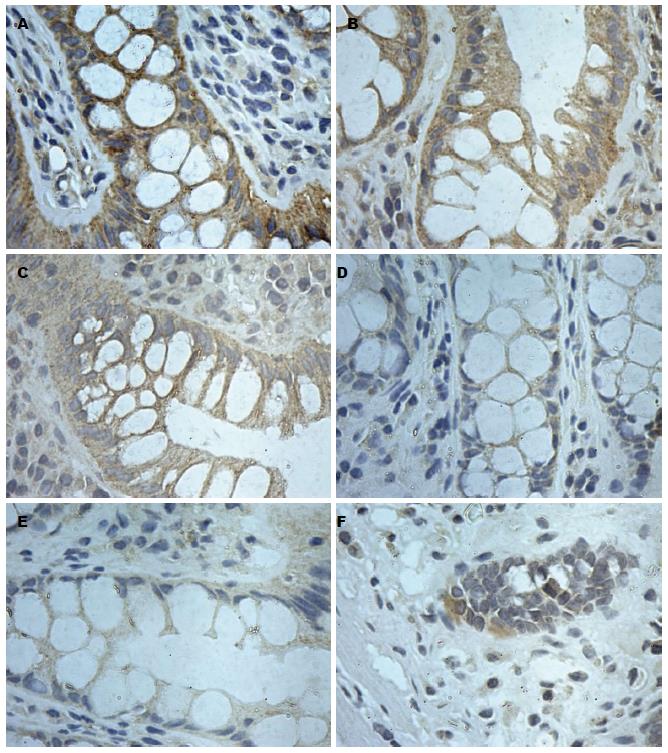
免疫组织化学结果表明1、2、3号部位组织中均有E-cadherin表达(图4A-C), 主要分布于上皮细胞膜上. 应用IPP6.0病理图像分析软件测定各组免疫阳性产物的光密度值, 1、2、3号部位光密度值分别为0.374055±0.027441、0.406566±0.038829、0.356538±0.036628. 1、2号位的表达都高于3号位, 差异有统计学意义(P<0.05).
免疫组织化学结果表明1、2、3号部位组织中均有CRB3表达(图4D-F), 主要分布于上皮细胞顶部, 应用IPP6.0病理图像分析软件测定各组免疫阳性产物的光密度值, 1、2、3号部位光密度值分别为0.301413±0.08249、0.285852±0.055672、0.253593±0.039438. 1、2号位的表达都高于3号位, 差异有统计学意义(P<0.05).
有研究发现, 不同病变时期的隐窝在形态学上存在很大差异, 他们的体积、形状、细胞核大小、表面光滑程度以及有无分支都与正常隐窝不同[4]. 异常的隐窝对大肠癌癌变的诊断有重要意义.
随着对肿瘤的深入研究, 越来越多人认识到肿瘤微环境对肿瘤的发生和发展至关重要[7-9]. 在肿瘤的启动过程中, 正常的组织原则性发生改变, 构建新的适合肿瘤生长的组织原则性. 肿瘤组织原则性的建立对肿瘤启动机制有着重要意义. 组织架构和内稳态的改变是肿瘤启动的早期信号.
ECM是分布于细胞外空间, 由细胞分泌的蛋白和多糖所构成的动态网络结构. 他能够维持多细胞生物结构的完整性, 参与细胞信号传导, 对细胞的生长、分化、黏附、扩散和移行有极其深远的影响, 经过重塑的ECM为肿瘤发生创造一个宽松的"土壤", 导致肿瘤细胞高增殖、低分化、凋亡抑制以及侵袭、转移[10]. ECM基本结构骨架是蛋白质, 由不同的氨基酸残基组成的特殊多肽序列形成不同的成分, 主要分为胶原、蛋白聚糖和糖蛋白三大类. ECM是组织中细胞微环境的重要组分, 为启动或维持细胞功能提供了关键的生化和物理信号. 透明质酸和胶原蛋白是ECM的重要组成成分. 透明质酸可以维持ECM的完整性, 在ECM与细胞表面相互作用. Hyal可以解聚和降解透明质酸, 使透明质酸分子从胶原细纤维间隙中释放出来并重新分布, 主要定位于ECM, 影响细胞的增殖及分化, 在肿瘤发生发展过程中发挥重要作用[11]. Hyal-1是人类体细胞组织中最重要的Hyal, 通过降解透明质酸而对肿瘤的生长转移起调节作用. 胶原是ECM中含量最高的成分, 刚性及抗张力强度最大, 构成细胞外的骨架结构. Col-Ⅰ是含量最多的结构蛋白, 参与构成ECM的主要成分. Col-Ⅰ具有广泛的生物学活性, 除了生物力学作用以外, 在确立细胞形状及行为、细胞分化与发育中起重要作用. Col-Ⅰ在骨骼与结缔组织中形成和保持骨架的完整性, 并且在形成特定的细胞外微环境中有重要作用, 对维持细胞的完整性及传递细胞外信号非常关键[12].
后生动物的发育和稳态都要求建立和维持正确的细胞极性. 柱状上皮细胞顶端和基底端的形态和结构的差别保障了他们的外分泌、吸收和屏障等功能; 细胞迁移也依赖于细胞的极性化. 细胞极性的破坏是肿瘤细胞的特征之一. 近年来的研究证明细胞极性的丧失与癌变过程密切相关, 一些关键的细胞极性蛋白是促癌物或抑癌物; 细胞极化的基本机制往往是致癌信号通路的靶点. E-cadherin是上皮细胞表型的标志性蛋白, 也是上皮细胞间黏附连接重要的黏附分子, 在维持上皮细胞极性和功能方面起重要的作用[13]. 他能够介导细胞与细胞、细胞与基质之间黏附的跨膜糖蛋白, 对于维持上皮细胞的结构和形态起到非常重要的作用. E-cadherin目前被普遍认为是一种抑癌因子, 其表达下调或缺失能够引发间质转化(epithelial mesenchymal transition, EMT), 即细胞由上皮类型向间质类型转化, EMT的发生使得细胞排列疏松, 运动能力变强. 目前已经发现E-cadherin在许多肿瘤中表达下调, 并且与预后等有密切的关系. 已经有研究[14,15]证实, 早期鳞状细胞癌中E-cadherin丢失的多少对其早期发生有重要作用. Crb复合物参与了上皮细胞极性的形成、建立和维持, 过表达的Crb会延迟紧密连接的形成. CRB3在视网膜和上皮组织中表达, 并在骨骼肌和大脑有微弱的存在[16]. 在哺乳动物中已被证实, Crumbs表达异常可导致细胞极性的丢失进而启动了肿瘤的发生[17]. CRB3主要存在于细胞顶膜部位, 是一种重要的顶端决定因子, 主要在具有上皮源性的组织和细胞中表达[18-20]. 在大肠癌启动过程中, 肠上皮细胞获得间充质细胞样的表型, 甚至是获得致瘤型细胞表型, 而使得上皮细胞的排列严重紊乱. 而极性蛋白与细胞表型有着必要联系. 在Crumbs基因敲除的小鼠中得到的证实, Crumbs在肠上皮细胞表型的发生发展中有着重要作用. 无论是CRB3-PDZ结合序列还是CRB3-FREM结合序列的突变都会阻碍紧密连接的形成和发育, 提示CRB3是一种重要的顶端决定因子[18,19]. 当极性蛋白的过表达或者缺失与上皮细胞表型的改变同时发生时, 这对肿瘤启动起着关键作用[21].
正常的ECM和细胞极性能维持组织的正常架构并发挥正常的生理功能. Hyal-1、Col-Ⅰ、E-cadherin和CRB3对维持组织正常的微环境有重要作用. 他们的表达和分布改变导致所处的微环境改变, 促进了肿瘤的发生发展. 所以, 研究Hyal-1、Col-Ⅰ、E-cadherin和CRB3在肿瘤进程中的表达和分布对研究肿瘤的启动有重要的意义. 但他们的具体调控机制仍需继续探索, 并且可以结合动物实验, 以完善此项研究.
癌症是一个不断发展的紊乱器官, 是生命进化到高度复杂性、多重细胞组织性所付出的代价. 作为一个器官, 肿瘤(包括癌前)组织微架构与微环境之间的互惠作用决定了其表型的转变.
李革, 副教授, 延边大学附属医院
本研究通过对肿瘤微环境(tumor microenvironment)中间质大分子和极性蛋白的检测, 探索肿瘤微环境对大肠癌启动的意义.
2000年, Hanahan与Weinberg提出了肿瘤6大获得性的生物学标志特性, 从而构建了使这种复杂疾病在机体内合理化的组织原则, 为我们理解人类100多种恶性肿瘤疾病提供了一个最基本的逻辑性组织框架. 接下来的十年, 得益于相关科学技术的进步, 肿瘤研究经历了前所未有的卓绝十年. 2011年, Hanahan与Weinberg再次梳理文献, 进一步完善了肿瘤的组织原则, 指出: 肿瘤是远远胜过正常健康组织而更能处理复杂功能的器官(异常器官).
本研究从微环境中的组织细胞外基质(extracellular matrix, ECM)分子和细胞极性分子两方面着手, 共同探讨微环境对大肠癌启动的意义. 内容丰富, 更为立体.
正常的ECM和细胞极性能维持组织的正常架构并发挥正常的生理功能. Ⅰ型胶原(collagen type Ⅰ, Col-Ⅰ)、透明质酸酶(hyaluronidase-1, Hyal-1)、上皮性钙黏素(E-cadherin)和极性调控蛋白crumbs3(CRB3)的表达和分布改变导致所处的微环境改变, 促进了肿瘤的发生发展. 所以, 研究Hyal-1、Col-Ⅰ、E-cadherin和CRB3在肿瘤进程中的表达和分布对研究肿瘤的启动有重要的意义. 但他们的具体调控机制仍需继续探索, 并且可以结合动物实验, 以完善此项研究.
肿瘤微环境: 由肿瘤细胞和肿瘤相关基质共同构成, 二者相对独立又相互作用、共同进化(coevolution).
本课题通过对肿瘤微环境中相关成分的检测, 探索肿瘤微环境对大肠癌启动的意义. 立题新颖, 实验设计合理, 结果和结论可信, 对大肠癌的研究有一定的意义.
编辑: 韦元涛 电编:都珍珍
| 2. | Bissell MJ, Radisky D. Putting tumours in context. Nat Rev Cancer. 2001;1:46-54. [PubMed] [DOI] |
| 3. | Gupta AK, Schoen RE. Aberrant crypt foci: are they intermediate endpoints of colon carcinogenesis in humans? Curr Opin Gastroenterol. 2009;25:59-65. [PubMed] [DOI] |
| 4. | Tamura S, Furuya Y, Tadokoro T, Higashidani Y, Yokoyama Y, Araki K, Onishi S. Pit pattern and three-dimensional configuration of isolated crypts from the patients with colorectal neoplasm. J Gastroenterol. 2002;37:798-806. [PubMed] [DOI] |
| 5. | Pretlow TP, Pretlow TG. Mutant KRAS in aberrant crypt foci (ACF): initiation of colorectal cancer? Biochim Biophys Acta. 2005;1756:83-96. [PubMed] |
| 6. | Cheng L, Lai MD. Aberrant crypt foci as microscopic precursors of colorectal cancer. World J Gastroenterol. 2003;9:2642-2649. [PubMed] |
| 7. | Siveen KS, Kuttan G. Role of macrophages in tumour progression. Immunol Lett. 2009;123:97-102. [PubMed] [DOI] |
| 8. | Liotta LA, Kohn EC. The microenvironment of the tumour-host interface. Nature. 2001;411:375-379. [PubMed] [DOI] |
| 9. | Kim BG, An HJ, Kang S, Choi YP, Gao MQ, Park H, Cho NH. Laminin-332-rich tumor microenvironment for tumor invasion in the interface zone of breast cancer. Am J Pathol. 2011;178:373-381. [PubMed] [DOI] |
| 10. | Brinckerhoff CE, Rutter JL, Benbow U. Interstitial collagenases as markers of tumor progression. Clin Cancer Res. 2000;6:4823-4830. [PubMed] |
| 11. | Csóka TB, Frost GI, Stern R. Hyaluronidases in tissue invasion. Invasion Metastasis. 1997;17:297-311. [PubMed] |
| 12. | Gelse K, Pöschl E, Aigner T. Collagens--structure, function, and biosynthesis. Adv Drug Deliv Rev. 2003;55:1531-1546. [PubMed] [DOI] |
| 13. | Kim NG, Koh E, Chen X, Gumbiner BM. E-cadherin mediates contact inhibition of proliferation through Hippo signaling-pathway components. Proc Natl Acad Sci U S A. 2011;108:11930-11935. [PubMed] [DOI] |
| 14. | Guebel DV, Schmitz U, Wolkenhauer O, Vera J. Analysis of cell adhesion during early stages of colon cancer based on an extended multi-valued logic approach. Mol Biosyst. 2012;8:1230-1242. [PubMed] [DOI] |
| 15. | Hanakawa Y, Amagai M, Shirakata Y, Yahata Y, Tokumaru S, Yamasaki K, Tohyama M, Sayama K, Hashimoto K. Differential effects of desmoglein 1 and desmoglein 3 on desmosome formation. J Invest Dermatol. 2002;119:1231-1236. [PubMed] [DOI] |
| 16. | Makarova O, Roh MH, Liu CJ, Laurinec S, Margolis B. Mammalian Crumbs3 is a small transmembrane protein linked to protein associated with Lin-7 (Pals1). Gene. 2003;302:21-29. [PubMed] |
| 17. | Ellenbroek SI, Iden S, Collard JG. Cell polarity proteins and cancer. Semin Cancer Biol. 2012;22:208-215. [PubMed] |
| 18. | Roh MH, Fan S, Liu CJ, Margolis B. The Crumbs3-Pals1 complex participates in the establishment of polarity in mammalian epithelial cells. J Cell Sci. 2003;116:2895-2906. [PubMed] [DOI] |
| 19. | Fogg VC, Liu CJ, Margolis B. Multiple regions of Crumbs3 are required for tight junction formation in MCF10A cells. J Cell Sci. 2005;118:2859-2869. [PubMed] [DOI] |
| 20. | Lemmers C, Michel D, Lane-Guermonprez L, Delgrossi MH, Médina E, Arsanto JP, Le Bivic A. CRB3 binds directly to Par6 and regulates the morphogenesis of the tight junctions in mammalian epithelial cells. Mol Biol Cell. 2004;15:1324-1333. [PubMed] [DOI] |
| 21. | Macara IG, McCaffrey L. Cell polarity in morphogenesis and metastasis. Philos Trans R Soc Lond B Biol Sci. 2013;368:20130012. [PubMed] |