修回日期: 2014-10-16
接受日期: 2014-11-12
在线出版日期: 2015-01-08
目的: 研究食管鳞状细胞癌组织中Gstp和HnRNPA2/B1的表达及其临床意义.
方法: 应用免疫组织化学SP(immuno-histochemical streptavidin-peroxidase)法检测68例食管鳞状细胞癌组织和48例癌旁切端正常食管组织, 观察Gstp和HnRNPA2/B1的表达, 并应用统计学方法分析其表达与临床病理学指标的意义.
结果: (1)食管鳞状细胞癌组织中Gstp和HnRNPA2/B1的阳性表达率分别为: 60.3%(41/68)和54.4%(37/68); 正常食管组织中阳性表达率分别为: 27.1%(13/48)和29.1%(14/48), 差异均有统计学意义(P<0.05); (2)食管鳞状细胞癌组织中Gstp在不同性别、年龄、民族、肿瘤大小及不同浸润深度组之间的表达差异无统计学意义(P>0.05); 在不同分化程度、有无淋巴结转移及不同临床分期组之间的表达有差异统计学意义(P<0.05); (3)食管鳞状细胞癌组织中HnRNPA2/B1在不同性别、年龄、民族、肿瘤大小、不同浸润深度及不同临床分期组之间的表达差异无统计学意义(P>0.05); 在不同分化程度、有无淋巴结转移组之间的表达差异有统计学意义(P<0.05).
结论: Gstp和HnRNPA2/B1在食管鳞状细胞癌的发生和发展中可能起到一定作用; Gstp可能对食管鳞状细胞癌恶性程度判断有一定的指导意义; HnRNPA2/B1可能与食管鳞状细胞癌的发生和发展密切相关.
核心提示: 该研究提示Gstp可能对食管鳞状细胞癌恶性程度判断有指导意义; HnRNPA2/B1在不同分化程度、有无淋巴结转移组之间的表达有显著差异, 提示其可能与食管鳞状细胞癌的发生和发展密切相关.
引文著录: 张艳, 蒲红伟, 谌宏鸣, 朱丽娟, 李晓梅, 陈晓. 食管鳞状细胞癌组织中Gstp和HnRNPA2/B1的表达及其临床意义. 世界华人消化杂志 2015; 23(1): 104-109
Revised: October 16, 2014
Accepted: November 12, 2014
Published online: January 8, 2015
AIM: To investigate the expression of Gstp and HnRNPA2/B1 in esophageal squamous cell carcinoma (ESCC) and to analyze their clinical significance.
METHODS: Immunohistochemical method was used to detect the expression of Gstp and HnRNPA2/B1 in 68 ESCC tissues and 48 normal esophageal tissues, and their correlations with the clinicopathologic characteristics of ESCC were analyzed.
RESULTS: The positive rates of Gstp and HnRNPA2/B1 expression were significantly higher in ESCC than in normal esophageal tissues (60.3% vs 27.1%, 54.4% vs 29.1%, P < 0.05). Gstp expression had no significant correlation with gender, age, ethnicity, tumor size or infiltration depth (P > 0.05), but was significantly correlated with tumor differentiation, lymph node metastasis and clinical stage (P < 0.05). HnRNPA2/B1 expression had no significant correlation with gender, age, national, tumor size or infiltration depth (P > 0.05), but was significantly correlated with tumor differentiation, lymph node metastasis and clinical stage (P < 0.05).
CONCLUSION: Gstp and HnRNPA2/B1 may play a role in the occurrence and development of ESCC. Gstp and HnRNPA2/B1 expression may be used to judge the malignant degree of ESCC.
- Citation: Zhang Y, Pu HW, Chen HM, Zhu LJ, Li XM, Chen X. Significance of expression of Gstp and HnRNPA2/B1 in esophageal squamous cell carcinoma. Shijie Huaren Xiaohua Zazhi 2015; 23(1): 104-109
- URL: https://www.wjgnet.com/1009-3079/full/v23/i1/104.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i1.104
新疆是中国食管癌的高发地区, 吕秀平等[1]在MALDI-TOF-MS分析新疆食管鳞状细胞癌的蛋白组学的研究中, 建立了食管鳞状癌细胞和食管正常上皮细胞的双向凝胶电泳2-DE图谱, 获得了43个差异蛋白点, 发现其中15种蛋白例如Gstp、HnRNPA2/B1、HSP27等在食管鳞状癌细胞中的表达上调[1]. Zhang等[2]也发现食管鳞状癌组织中Bmi-1蛋白表达明显上调. 本课题应用免疫组织化学SP法检测68例食管鳞状细胞组织Gstp和HnRNPA2/B1的表达, 并应用统计学方法分析表达与临床病理学指标的意义.
收集新疆医科大学第一附属医院病理科2010-01/2012-09经手术切除, 并且病理诊断确诊为食管鳞状细胞癌的石蜡包埋组织68例, 其中男35例, 女33例; 年龄<50岁17例, 年龄≥50岁51例; 哈萨克族36例, 汉族32例; 肿瘤<5 cm 27例, 肿瘤≥5 cm 41例; 分化程度(高分化鳞癌)24例, 分化程度(中分化鳞癌)33例, 分化程度(低分化鳞癌)11例; 肿瘤浸润结食管黏膜层或黏膜下层5例, 肿瘤浸润食管肌层26例, 肿瘤浸润结食管浆膜层有37例; 有淋巴结转移的病例52例, 无淋巴结转移的病例16例. 另外选取48例正常癌旁组织. 收集病例获取所有患者性别、年龄、民族等基本信息, 建立完整的数据资料, 并由两位高年资经验丰富的病理医师指导收集病理标本、阅片. 这项研究经国家自然科学基金支持, 通过新疆医科大学第一附属医院的医学伦理委员会审查, 向研究中涉及的参与人员解释, 并签署知情同意文件.
1.2.1 Gstp和HnRNPA2/B1检测: 采用SP免疫组织化学三步法进行Gstp和HnRNPA2/B1检测, 步骤严格按照试剂盒操作说明.
1.2.2 染色结果判断: Gstp和HnRNPA2/B1的阳性表达主要位于细胞胞浆, 出现明显棕黄色颗粒判断为阳性.
统计学处理 采用SPSS17.0统计软件包分析处理数据, 分析性别、年龄、民族、肿瘤大小、分化程度、浸润深度、淋巴结转移情况. 用χ2检验对实验数据结果进行分析, 检验水准α = 0.05. P<0.05为差异有统计学意义.
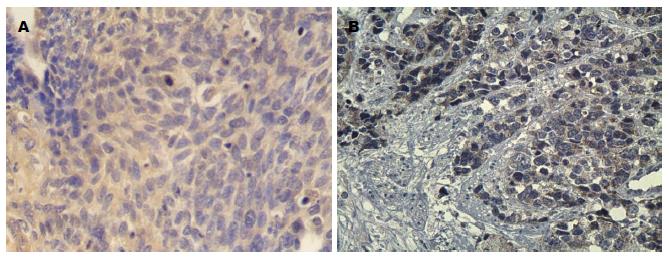
Gstp在食管鳞状细胞癌组织中的表达(图1A), Gstp蛋白的阳性表达率在食管鳞癌与食管正常黏膜组织中, 分别为60.3%(41/68)和27.1%(13/48), Gstp蛋白在食管鳞癌患者组织中的阳性表达显著高于在食管正常黏膜组织中的阳性表达, 两组之间差异有统计学意义(P<0.05)(表1).
| 分组 | n | - | + | 阳性率(%) | χ2值 | P值 |
| 食管鳞癌组织 | 68 | 27 | 41 | 60.3 | 12.473 | 0.001 |
| 正常食管黏膜 | 48 | 35 | 13 | 27.1 |
HnRNPA2/B1在食管鳞状细胞癌组织中的表达(图1B), HnRNPA2/B1蛋白在68例食管鳞癌组织的阳性表达率为54.4%(37/68), 在48例食管正常黏膜组织中HnRNPA2/B1的阳性表达率为29.1%(14/48), HnRNPA2/B1在食管鳞癌患者组织中的阳性表达显著高于在食管正常黏膜组织中的阳性表达, 两组之间差异有统计学意义(P<0.05)(表2).
| 分组 | n | - | + | 阳性率(%) | χ2值 | P值 |
| 食管鳞癌组织 | 68 | 31 | 37 | 54.4 | 7.279 | 0.006 |
| 正常食管黏膜 | 48 | 34 | 14 | 29.1 |
在高分化、中分化和低分化三组食管癌患者组织中Gstp的阳性表达率比较, 差异有统计学意义(P<0.05), 表明Gstp的表达可能与食管癌组织的分化程度有关, 表达率高恶性程度高, 与预后相关. 在有淋巴结转移和无淋巴结转移两组食管癌患者组织中Gstp的阳性表达率比较, 差异有统计学意义(P<0.05), 提示Gstp的表达与食管癌组织的淋巴结转移有关. 在临床分期Ⅰ-Ⅱ期和Ⅲ-Ⅳ期食管癌患者组织中Gstp的阳性表达率分别为41.4%和74.4%, χ2 = 7.556, 差异有统计学意义(P<0.05), 表明Gstp的表达可能与食管癌的临床分期有关. 性别、年龄、族别、肿瘤大小、浸润深度各组之间, 差异无统计学意义(P>0.05)(表3).
| 临床病理参数 | n | Gstp | ||
| 阳性n(%) | χ2值 | P值 | ||
| 性别 | 0.885 | 0.347 | ||
| 男 | 35 | 23(65.7) | ||
| 女 | 33 | 18(54.5) | ||
| 年龄(岁) | 1.003 | 0.317 | ||
| <50 | 17 | 12(70.6) | ||
| ≥50 | 51 | 29(56.9) | ||
| 民族 | 1.298 | 0.323 | ||
| 哈族 | 36 | 24(66.7) | ||
| 汉族 | 32 | 17(53.1) | ||
| 肿瘤大小(cm) | 0.133 | 0.715 | ||
| <5 | 27 | 17(63.0) | ||
| ≥5 | 41 | 24(58.5) | ||
| 分化程度 | 8.556 | 0.014 | ||
| 高分化 | 24 | 9(37.5) | ||
| 中分化 | 33 | 23(70.0) | ||
| 低分化 | 11 | 9(81.8) | ||
| 浸润深度 | 0.511 | 0.779 | ||
| 黏膜及黏膜下层 | 5 | 3(60.0) | ||
| 肌层 | 26 | 16(61.5) | ||
| 浆膜层 | 37 | 22(59.4) | ||
| 淋巴结转移 | 7.372 | 0.007 | ||
| 无 | 16 | 5(31.2) | ||
| 有 | 52 | 36(69.2) | ||
| 临床分期 | 7.556 | 0.006 | ||
| Ⅰ-Ⅱ期 | 29 | 12(41.4) | ||
| Ⅲ-Ⅳ期 | 39 | 29(74.4) | ||
在高分化、中分化和低分化的食管癌患者组织中HnRNPA2/B1的阳性表达率分别为37.5%、54.5%和90.9%, 差异有统计学意义(χ2 = 8.674, P<0.05), 表明HnRNPA2/B1可能在细胞分化过程中起着重要调控作用. 在有淋巴结转移和无淋巴结转移的食管癌患者组织中HnRNPA2/B1的阳性表达率分别为25.0%和63.5%, 两组之间差异有统计学意义(χ2 = 7.297, P<0.05), 提示HnRNPA2/B1的表达与食管癌组织淋巴结转移有关, 有淋巴结转移的食管癌组织中HnRNPA2/B1的阳性表达率高. 在临床分期Ⅰ-Ⅱ期和Ⅲ-Ⅳ期食管癌患者组织中HnRNPA2/B1的阳性表达率分别为48.3%和59.0%, χ2 = 0.767, 两组之间差异无统计学意义(P>0.05), 表明HnRNPA2/B1的表达可能与食管癌的临床分期无关. 性别、年龄、族别、肿瘤大小、浸润深度各组之间, 差异无统计学意义(P>0.05)(表4).
| 临床病理参数 | n | HnRNPA2/B1 | ||
| 阳性n(%) | χ2值 | P值 | ||
| 性别 | 0.908 | 0.465 | ||
| 男 | 35 | 21(60.0) | ||
| 女 | 33 | 16(48.4) | ||
| 年龄(岁) | 0.968 | 0.405 | ||
| <50 | 17 | 11(70.6) | ||
| ≥50 | 51 | 26(66.7) | ||
| 民族 | 1.384 | 0.330 | ||
| 哈族 | 36 | 22(61.1) | ||
| 汉族 | 32 | 15(46.9) | ||
| 肿瘤大小(cm) | 1.320 | 0.322 | ||
| <5 | 27 | 17(63.0) | ||
| ≥5 | 41 | 20(48.8) | ||
| 分化程度 | 8.674 | 0.013 | ||
| 高分化 | 24 | 9(37.5) | ||
| 中分化 | 33 | 18(54.5) | ||
| 低分化 | 11 | 10(90.9) | ||
| 浸润深度 | 0.504 | 0.778 | ||
| 黏膜及黏膜下层 | 5 | 2(40.0) | ||
| 肌层 | 26 | 14(53.8) | ||
| 浆膜层 | 37 | 21(56.8) | ||
| 淋巴结转移 | 7.297 | 0.008 | ||
| 无 | 16 | 4(25.0) | ||
| 有 | 52 | 33(63.5) | ||
| 临床分期 | 0.767 | 0.264 | ||
| Ⅰ-Ⅱ期 | 29 | 14(48.3) | ||
| Ⅲ-Ⅳ期 | 39 | 23(59.0) | ||
谷胱甘肽S-转移酶GSTs是一组多功能的超基因家族. 从人胎盘中分离出的Gstp即胎盘型谷胱甘肽硫转移酶, 他具有结合、解毒等功能[3]. Gstp蛋白通过催化谷胱甘肽与亲电子化合物结合减少机体的毒性作用从而起到保护亲核物质的作用[4]. 大量研究表明, Gstp蛋白常与癌基因INT-2、HSTF-1及bcl-1形成共扩增, 在人体多种肿瘤中均有异常表达[5]. 研究显示, Gstp蛋白在肺癌中有高表达[6], 在肝癌[7]、胃癌[8]等鳞癌组织中也有高表达. Jones等[9]研究发现, 在正常胃黏膜组织中Gstp蛋白呈低表达, 说明Gstp蛋白的高表达可能与胃癌原发性耐药密切相关. 在本组研究中, Gstp蛋白在食管鳞状细胞癌中呈高表达, 在不同组织分化程度、有无淋巴结转移、不同临床分期组之间的表达有显著差异, 提示Gstp蛋白在食管鳞状细胞癌的发生和发展中可能起一定作用, 并且对食管鳞状细胞癌恶性程度判断有一定的指导意义. Gstp能否作为食管鳞状细胞癌的早期诊断标志物, 是否与耐药密切相关, 以及能否成为指导个体化疗的参数, 还有待进一步的研究.
HnRNP是一组包含了将近30种分子量在30-120 kDa之间的RNA结合蛋白质. HnRNPA2/B1即核内不均一核糖核蛋白A2/B1, 是一种由HnRNPA2和HnRNPB1共同组成的RNA连接蛋白[10]. HnRNPA2/B1在胞浆及胞核中均可表达, 在不同的组织器官中的表达差异有统计学意义[11,12]. 很多研究指出HnRNPA2/B1在良性组织和恶性组织中的表达差异有统计学意义[13,14]. Torosyan等[15]研究显示, HnRNPA2/B1在细胞分化和增殖过程中起着重要调控作用. Zech等[16]研究发现HnRNPA2/B1在有淋巴结转移组的阳性表达率高于无淋巴结转移组, 指出HnRNPA2/B1蛋白与肺癌进展和预后密切相关. 韩军等[17]发现在非小细胞肺癌中HnRNPA2/B1的阳性表达显著高于癌旁组织及肺良性病变肺组织, HnRNPA2/B1的表达与分化程度和淋巴结转移有关, HnRNPA2/B1的表达在不同组织类型和临床分期间的表达虽然有差异但是无统计学意义, 此项结果在国内外报道不一, 需要扩大样本量进一步进行统计分析. 石园等[18]检测出HnRNPA2/B1的过表达对肺癌预测的敏感度是96%, 特异度是82%. HnRNPA2/B1在鳞化、发育异常等病变过程中均有过表达. 在本组研究中HnRNPA2/B1蛋白在食管鳞癌患者组织中高表达, 并且在有淋巴结转移组中的阳性表达率高于无淋巴结转移组, HnRNPA2/B1在不同分化程度、有无淋巴结转移组之间的表达有显著差异, 提示HnRNPA2/B1可能与食管鳞状细胞癌的发生和发展密切相关, 对其进一步研究有望成为食管鳞状细胞癌早期诊断的参考指标.
新疆哈萨克族食管癌具有明显的地区性和家族聚集性, 多年来对新疆食管癌流进行了多学科的研究, 发现食管癌是多因素作用, 多基因参与, 多阶段发展的疾病. 在分子生物学研究, 尤其标志物研究没有突破.
茅爱武, 教授, 上海同仁医院介入中心
大量研究表明, Gstp蛋白常与癌基因INT-2、HSTF-1和bcl-1形成共扩增, 在人体多种肿瘤中均有异常表达. 研究提示Gstp和HnRNPA2/B1蛋白与肿瘤的发生发展、预后和耐药关系密切.
大量研究表明, Gstp蛋白在人体多种肿瘤中均有异常表达. HnRNPA2/B1在癌细胞、增殖的细胞中过度的表达, 很可能是细胞癌变的重要原因之一.
研究提示Gstp和HnRNPA2/B1蛋白与肿瘤的发生发展、预后和耐药关系密切, 可能成为制定癌症个性化化疗方案选择的重要参考.
Gstp和HnRNPA2/B1的表达, 为食管癌的早期诊断、恶性程度和预后判断, 以及化疗方案的制定奠定理论和实验基础.
Gstp蛋白: 通过催化谷胱甘肽与亲电子化合物结合减少机体的毒性作用从而起到保护亲核物质的作用;
HnRNPA2/B1: 核内不均一核糖核蛋白A2/B1, 是一种由HnRNPA2和HnRNPB1共同组成的RNA连接蛋白.
题目较准确反映了研究工作的科学问题和特定内容, 对食管癌的分子标志物进行探索性研究.
编辑: 韦元涛 电编:都珍珍
| 2. | Zhang Y, Zhang YL, Chen HM, Pu HW, Ma WJ, Li XM, Ma H, Chen X. Expression of Bmi-1 and PAI-1 in esophageal squamous cell carcinoma. World J Gastroenterol. 2014;20:5533-5539. [PubMed] [DOI] |
| 3. | Xiang Z, Snouwaert JN, Kovarova M, Nguyen M, Repenning PW, Latour AM, Cyphert JM, Koller BH. Mice lacking three Loci encoding 14 glutathione transferase genes: a novel tool for assigning function to the GSTP, GSTM, and GSTT families. Drug Metab Dispos. 2014;42:1074-1083. [PubMed] [DOI] |
| 4. | Manevich Y, Hutchens S, Tew KD, Townsend DM. Allelic variants of glutathione S-transferase P1-1 differentially mediate the peroxidase function of peroxiredoxin VI and alter membrane lipid peroxidation. Free Radic Biol Med. 2013;54:62-70. [PubMed] [DOI] |
| 5. | Wang YJ, He L, Yuan M, Tsang WW, Hao L, Wang M, Chow LW, Cheung MN, Liu Q, Ng EL. Epigenetic changes of TIMP-3, GSTP-1 and 14-3-3 sigma genes as indication of status of chronic inflammation and cancer. Int J Biol Markers. 2014;29:e208-e214. [PubMed] [DOI] |
| 6. | Ke HG, Li J, Shen Y, You QS, Yan Y, Dong HX, Liu JH, Shen ZY. Prognostic significance of GSTP1, XRCC1 and XRCC3 polymorphisms in non-small cell lung cancer patients. Asian Pac J Cancer Prev. 2012;13:4413-4416. [PubMed] [DOI] |
| 7. | Li CG, Zhao ZM, Hu MG, Liu R. Predictive role of glutathione-S-transferase gene polymorphisms in risk and prognosis of hepatocellular carcinoma. Asian Pac J Cancer Prev. 2012;13:3247-3252. [PubMed] [DOI] |
| 8. | García-González MA, Quintero E, Bujanda L, Nicolás D, Benito R, Strunk M, Santolaria S, Sopeña F, Badía M, Hijona E. Relevance of GSTM1, GSTT1, and GSTP1 gene polymorphisms to gastric cancer susceptibility and phenotype. Mutagenesis. 2012;27:771-777. [PubMed] [DOI] |
| 9. | Jones BA, Christensen AR, Wise JP, Yu H. Glutathione S-transferase polymorphisms and survival in African-American and white colorectal cancer patients. Cancer Epidemiol. 2009;33:249-256. [PubMed] [DOI] |
| 10. | Zuccotti P, Colombrita C, Moncini S, Barbieri A, Lunghi M, Gelfi C, De Palma S, Nicolin A, Ratti A, Venturin M. hnRNPA2/B1 and nELAV proteins bind to a specific U-rich element in CDK5R1 3'-UTR and oppositely regulate its expression. Biochim Biophys Acta. 2014;1839:506-516. [PubMed] [DOI] |
| 11. | Shorter J, Taylor JP. Disease mutations in the prion-like domains of hnRNPA1 and hnRNPA2/B1 introduce potent steric zippers that drive excess RNP granule assembly. Rare Dis. 2013;1:e25200. [PubMed] [DOI] |
| 12. | Du YJ, Hou YL, Hou WR. Nucleotide sequences of an important functional gene hnRNPA2/B1 from Ailuropoda melanoleuca and Ursus thibetanus mupinensis and its potential value in phylogenetic study. Nucleosides Nucleotides Nucleic Acids. 2014;33:18-30. [PubMed] [DOI] |
| 13. | Hu J, Chen Z, Xia D, Wu J, Xu H, Ye ZQ. Promoter-associated small double-stranded RNA interacts with heterogeneous nuclear ribonucleoprotein A2/B1 to induce transcriptional activation. Biochem J. 2012;447:407-416. [PubMed] [DOI] |
| 14. | Wang G, Xiao Q, Luo Z, Ye S, Xu Q. Functional impact of heterogeneous nuclear ribonucleoprotein A2/B1 in smooth muscle differentiation from stem cells and embryonic arteriogenesis. J Biol Chem. 2012;287:2896-2906. [PubMed] [DOI] |
| 15. | Torosyan Y, Dobi A, Glasman M, Mezhevaya K, Naga S, Huang W, Paweletz C, Leighton X, Pollard HB, Srivastava M. Role of multi-hnRNP nuclear complex in regulation of tumor suppressor ANXA7 in prostate cancer cells. Oncogene. 2010;29:2457-2466. [PubMed] [DOI] |
| 16. | Zech VF, Dlaska M, Tzankov A, Hilbe W. Prognostic and diagnostic relevance of hnRNP A2/B1, hnRNP B1 and S100 A2 in non-small cell lung cancer. Cancer Detect Prev. 2006;30:395-402. [PubMed] |