修回日期: 2014-12-23
接受日期: 2014-12-24
在线出版日期: 2015-01-08
肝脏受损伤后, 由炎症因子和细胞因子所启动的多种信号转导通路, 使处于静止状态的肝星状细胞(hepatic stellate cell, HSC)活化, 转分化, 是肝纤维化形成的关键环节之一. 广泛存在于多种生物体内的微小RNA(microRNA, miRNA)能在转录后或翻译水平负调控靶基因的表达. 研究显示, 与HSC功能相关的信号转导通路对miRNA的转录、加工成熟及功能进行特异性调控; 同时, 不同的miRNA也参与了对HSC活化、增殖和凋亡相关信号转导通路的调控. 因此, 仅仅针对HSC功能相关分子与多种miRNA相互调控的研究, 能为肝纤维化病理进程的研究和分子靶向治疗提供一些思路.
核心提示: 本文较为详实地描述了肝星状细胞(hepatic stellate cell, HSC)相关信号通路对微小RNA(microRNA, miRNA)的转录、加工和功能的调控, 也描述了miRNA通过调控信号通路的下游分子参与HSC的活化、增殖和凋亡, 阐述了HSC相关信号通路与miRNA相互调控的关系.
引文著录: 曾宪一, 王洁, 张艳琼, 吴江锋. 肝星状细胞相关信号通路与miRNA相互调控的研究进展. 世界华人消化杂志 2015; 23(1): 1-7
Revised: December 23, 2014
Accepted: December 24, 2014
Published online: January 8, 2015
Activation and transdifferentiation of hepatic stellate cells (HSCs) caused by a variety of signal transduction pathways triggered by inflammatory factors and cytokines are a key initiating event in the process of hepatic fibrosis. MicroRNAs (miRNAs) existing in a wide variety of organisms play a role by negative regulation of their target genes at the transcriptional or translational level. Research shows that several signal transduction pathways associated with HSCs can regulate miRNA transcription, processing, maturation and function. At the same time, different miRNAs also regulate HSC activation, proliferation and apoptosis-related signal transduction. This interaction can provide some ideas for the molecular target therapy of hepatic fibrosis and the exploration of its pathogenesis.
- Citation: Zeng XY, Wang J, Zhang YQ, Wu JF. Relationship between microRNAs and signaling pathways associated with hepatic stellate cells. Shijie Huaren Xiaohua Zazhi 2015; 23(1): 1-7
- URL: https://www.wjgnet.com/1009-3079/full/v23/i1/1.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i1.1
肝纤维化(hepatic fibrosis, HF)是各种慢性进行性肝病进展至肝硬化所共有的病理过程, 其特征是以胶原蛋白为主的细胞外基质(extracellular matrix, ECM)的合成与降解失调, 活化的肝星状细胞(hepatic stellate cell, HSC)是促进ECM过度沉积的主要细胞, 炎症过程中所分泌的多种细胞因子, 如血小板衍生生长因子(platelet derived growth factor, PDGF)、转化生长因子β(transforming growth factor-β, TGF-β)、血管内皮生长因子(vascular endothelial growth factor, VEGF)等, 可通过多种信号转导通路介导HSC的活化、增殖和凋亡[1-3], 也参与了HSC微小RNA(microRNA, miRNA)的生物合成过程. 同时, miRNA能通过多种信号转导通路影响HSC的活化、增殖和凋亡. 虽然已有大量地文献较为详细地讨论了多种信号转导通路与miRNA的相关关系, 但是, 仅仅针对与肝纤维化具有密切关系的HSC, 做一些系统性的总结是必要的. 本文就miRNA和HSC相关信号通路之间的相互调控作一评述, 希望给肝纤维化病理机制研究和分子靶向治疗的学者提供一些思路.
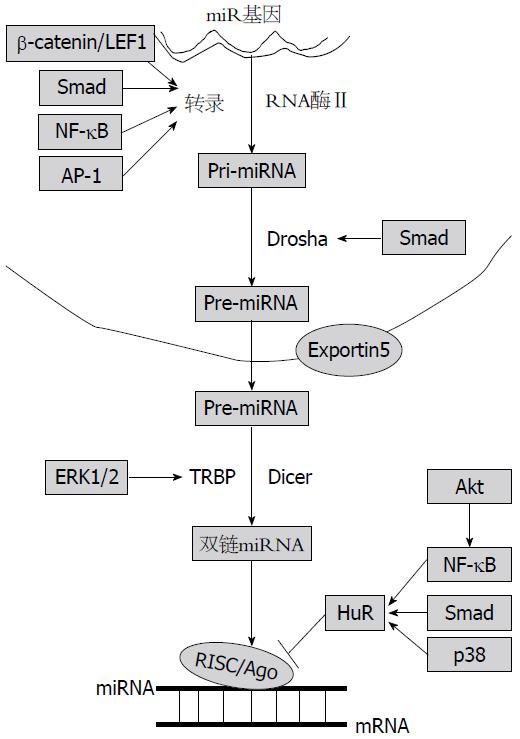
miRNA广泛存在于真核生物中. 在细胞核, miRNA基因通常是由RNA聚合酶Ⅱ(Pol Ⅱ)转录的, 最初产物为primary miRNA(pri-miRNA), 在RNase Ⅲ Drosha及其辅助因子Pasha的作用下, 这些pri-miRNA被加工成约70个核苷酸的前体产物pre-miRNA(precursor miRNA). 输出蛋白exportin 5将这种前体分子输送到细胞质中. 随后, 另一个RNase Ⅲ Dicer将其剪切为22个核苷酸左右的miRNA: miRNA双链. 这种双链很快与RNA诱导沉默复合体(argonaute-containing RNA interference-induced silencing complex, RISC)中的Argonaute(Ago)家族蛋白偶联, 成为特异性决定子, 其成熟的单链miRNA保留在RISC中. 成熟的miRNA结合到与其互补的mRNA的位点上, 通过依赖于序列互补性的机制负调控基因的表达[4]. 在HSC中, 多种信号转导通路可以通过相关因子调控miRNA的生物合成过程(图1).
TGF-β/骨形成蛋白(bone morphogenetic protein, BMP)、Wnt、细胞外信号调节激酶(extracellular signal-regulated kinase, ERK)和过氧化物酶体增殖物激活受体(peroxisome proliferators-activated receptors, PPAR)等多个信号转导通路与HSC的活化有关, 其中, 前三者具有调控HSC中miRNA的生物合成作用, 而后者对miRNA的影响未见报道.
TGF-β/BMP通过下游的Smad分子, 在miRNA的加工、转录和功能发挥三个层次影响miRNA的生物合成. TGF-β属于调节细胞生长和分化的超家族成员, 含有6种亚型, 其中TGF-β1是促进HSC活化和导致肝纤维化最强的细胞因子[5]. 当肝细胞受损时, 分泌到细胞外的TGF-β与HSC表面TGF-βⅡ型受体(TGF-βRⅡ)结合, 激活胞内段丝氨酸/苏氨酸激酶, 使TGF-βⅠ型受体(TGF-βRⅠ)活化的关键部位, GS结构域磷酸化, 活化的TGF-βRⅠ将生物信号传递给下游分子Smad2/3/4, 继而入核, 促进细胞外基质的分泌. Davis等[6,7]发现, pri-miR-21具有受体型Smad绑定元件(receptor Smad-binding element, R-SBE), 当Smad与R-SBE特异性结合时, 招募Drosha复合物对pri-miR-21进行加工; Smad2/3还可以增加miR-200基因的甲基化水平, 间接地调控miRNA的转录. BMP也属于TGF-β超家族的一员. 细胞外的BMP与HSC细胞膜上的BMP受体(BMPR)结合后, 活化的受体使细胞内的Smad1/5/8磷酸化, 与TGF-β信号竞争性的结合Smad4, 形成复合物后进入细胞核调节BMP靶基因的转录. 高表达的BMP-7能抑制TGF-β诱导的上皮-间充质细胞转化, 从而抑制HSC的活化、增殖[8]. 有研究[9]表明, miRNA生物合成过程中的RNA结合蛋白HuR, 其基因的启动子上存在BMP应答元件(BMP responsive element, BRE), 受Smad1/5/8的直接调控.
Wnt蛋白是一类富含半胱氨酸的高度保守的分泌型糖蛋白, 他可以通过HSC自分泌的方式释放到细胞外, 与HSCs细胞膜上的Frizzled/低密度脂蛋白受体相关蛋白(Fz/LRP)结合, 进而调节HSC的活化[10]. Zhou等[11]研究发现, 经典的Wnt信号通路通过转录因子β-catenin/LEF结合到miR-371-373启动子上, 从而促进其转录.
ERK属于细胞丝裂原活化蛋白激酶(mitogen-activated protein kinases, MAPK)蛋白家族. MAPK途径可被多种细胞因子激活, 如PDGF、白介素-1(interleukin-1, IL-1)、肿瘤坏死因子-α(tumor necrosis factor α, TNF-α)等, 其中, PDGF诱导的ERK细胞内信号转导途径是HSC活化和增殖的主要方式. 肝损伤可明显上调HSC中PDGF-β受体的mRNA表达, 从而增强PDGF-BB的促分裂作用, 而PDGF-BB可通过ERK通路诱导活化的HSC分泌VEGF, 间接促进内皮细胞的生长和增殖, 从而促进肝纤维化形成[12]. ERK通路的ERK1/2磷酸化能促使Dicer结合蛋白TRBP(transactivating response RNA binding protein)磷酸化, 磷酸化的TRBP能与miRNA生物合成过程中的Dicer酶结合, 进行pre-miRNA的加工, 维持miRNA生物合成的稳定性[13].
PDGF是已知的促进HSC增殖最强的细胞因子, 是活化ERK信号转导通路的必要条件[14]. PDGF与HSC胞膜上的受体结合后, 使黏附斑激酶(focal adhesion kinase, FAK)活化, 活化的FAK激活磷脂酰肌醇-3激酶(phosphotidylinositol 3-kinase, PI3K), 从而激活p70S6激酶, 活化的p70S6激酶使细胞周期蛋白D1和D3磷酸化进而促进HSC的增殖和活化[15]. PI3K能够促使Akt活化, 活化的Akt激活核因子-κB(nuclear factor-κB, NF-κB)并通过转录调控促进RNA结合蛋白HuR的表达[16], 而HuR能拮抗miRNA的翻译抑制作用[17,18].
MAPK蛋白家族包括ERK、c-jun氨基末端激酶(c-jun N-terminal kinase, JNK)和p38. p38 MAPK信号转导通路是HSC产生胶原的重要途径; JNK通路也是促进HSC增殖的一种方式, 乙醛通过JNK通路增加肝脏Ⅰ型α2胶原(collagen Ⅰα2)的沉积. Schnabl等[19]发现p38和JNK对细胞增殖有不同的作用. p38可抑制HSC的增殖, 因而, 阻断p38能促进HSCs增殖; 而阻断JNK则抑制HSCs增殖. TGF-β非经典通路不依赖TGF-β/Smad, 而是经p38MAPK通路直接激活Smad3, 使其磷酸化并最终导致ECM的沉积, 而阻断p38MAPK信号转导通路能部分阻断TGF-β的促纤维化作用[20]. 另外, 转录细胞因子PDGF可以诱导Ras活化, 从而激活ERK信号转导通路促进细胞增殖. p38MAPK通路还能影响RNA结合蛋白HuR的表达及其亚细胞定位, 进而对miRNA的生物合成过程产生调控作用; MAPK介导的信号通路对于Dicer的加工过程同样具有调控作用, 如TRBP在受到MAPK/ERK通路的ERK1/2磷酸化后才能与Dicer相互作用进行pre-miRNA的加工, 并介导Ago2的结合[13].
目前文献报道的与HSC凋亡相关信号转导通路中, NF-κB通路能够影响miRNA的生物合成过程. NF-κB家族由REL(cREL)、p65(REL-A)、REL-B、p50和p52组成. 正常情况下NF-κB与胞质中抑制因子家族IκBs(inhibit κB)结合, 在胞质内处于无活性状态; 当受到信号刺激后IκBs降解, 解离出的NF-κB开始活化并产生活性, 具有活性的NF-κB进入细胞核与DNA上特异序列结合参与调控基因转录. Gao等[21]研究发现, HSC持续存活与结缔组织生长因子有关, 他通过NF-κB转导途径阻止HSC的凋亡. NF-κB同时也调控miRNA的功能, 与miRNA生物合成过程有关的RNA结合蛋白HuR是NF-κB的下游靶基因, 他能抑制miRNA对靶基因的调控作用, 其转录激活需要PI3K/AKT通路的协同作用[22]; MiR-21则同时受到NF-κB和MAPK/JNK通路的共同调控.
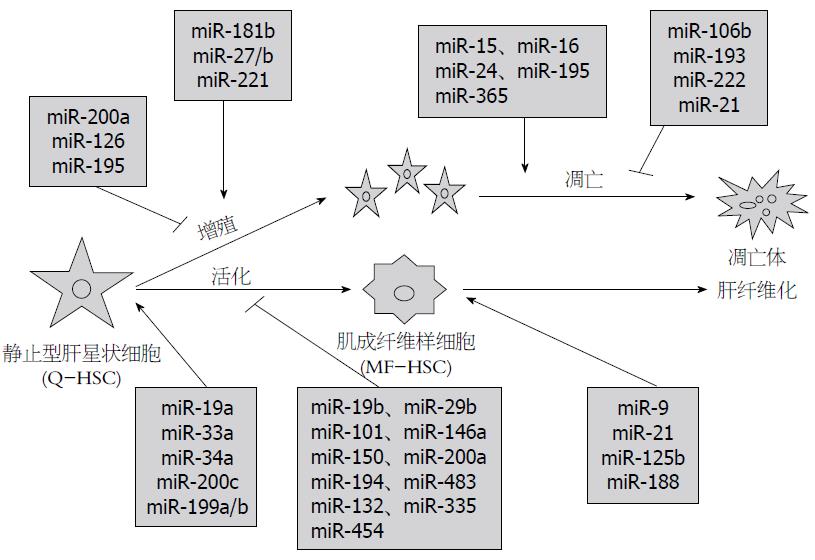
miRNA已被证明在HSC活化、增殖和凋亡及信号转导中发挥着重要作用, miRNA的失调涉及到癌症和纤维化相关的疾病. HSC活化后丢失脂滴, 转分化为肌成纤维细胞(myofibroblastic hepatic stellate cells, MF-HSC), 进而分泌ECM, 同时, 在HSC活化的过程中还伴随着HSC的增殖和凋亡, 许多miRNA参与了该过程[23-48](图2). 目前已发现, miRNA通过多个信号转导途径影响HSC的活化、增殖和凋亡, 例如TGF-β、PI3K-Akt、死亡受体及线粒体调控细胞凋亡等信号转导通路.
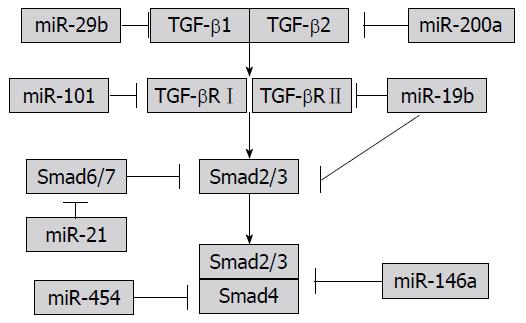
与HSC活化相关的信号转导通路中, 目前主要集中在miRNA对TGF-β/Smad信号转导通路的调控研究. MiR-29b直接靶向TGF-β1从而通过TGF-β1/Smad3信号转导通路, 抑制Ⅰ型胶原蛋白和α-SMA的表达[49]. miR-200a通过抑制TGF-β2蛋白水平和mRNA水平, 进而抑制TGF-β介导的HSC活化, 他能显著抑制α-SMA的表达[42]. 研究还发现, miR-101具有抑制TGF-β信号转导通路的能力, 他通过靶向TGF-βⅠ型受体(TGF-βRⅠ)并抑制其表达, 进而减弱TGF-β信号转导通路的促HSC活化作用[41], miR-19b靶向抑制TGF-βⅡ型受体(TGF-βRⅡ)的表达, 导致Smad3的磷酸化水平降低, 减少Ⅰ型胶原的表达[34]. Smad7可以干扰Smad2和Smad3磷酸化, 进而抑制TGF-β信号, 而miR-21能下调Smad7的表达, 从而减弱Smad7对TGF-β信号通路的负调控, 促进肝纤维化[50]. He等[31]研究显示miR-146a在肝纤维化中表达下调, 而miR-146a能通过靶向Smad4, 抑制TGF-β诱导的HSC的活化、增殖, 并促进HSC凋亡, miR-454也能直接靶向Smad4, 进而抑制HSC的活化[43], 这些miRNA通过对TGF-β/Smad信号通路分子的调控, 影响肝纤维化进程(图3).
miRNA也能调控HSC增殖, Wang等[25]证实, 过表达的miR-181b通过直接靶向CDNK1B(编码p27蛋白)增加S期HSC的数量, 促进增殖. miR-27a和miR-27b能靶向维甲酸X受体α(retinoic X receptor α, RXRα)促进HSC增殖[27], 在LX-2细胞(人HSC)中, 干扰素β(interferon-β, IFN-β)能介导miR-195过表达, 进而降低细胞周期蛋白E1的表达, 增强p21基因的表达, 通过延缓G1期向S期进展来抑制细胞增殖[28]. miR-200a通过靶向肿瘤抑制因子keap1(kelch-like ECH-associated protein 1), 从而激活keap/Nrf2信号转导通路, 进而抑制HSC的增殖[29].
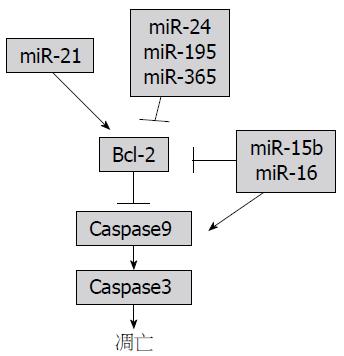
Caspase家族是一组存在于细胞质中含半胱氨酸的天冬氨酸蛋白水解酶, 能够特异性切割靶蛋白天冬氨酸残基后的肽键, 引起细胞凋亡. 在HSC活化的过程中伴随着HSC的凋亡, 随着时间的推移, 凋亡的细胞数也不断地增多. miRNA可以通过Caspase相关凋亡通路影响HSC的凋亡(图4). miR-15b、miR-16、miR-21、miR-24、miR-195和miR-365均参与了线粒体诱导的凋亡通路, miR-24、miR-195和miR-365能靶向调节Bcl-2基因促进HSC的凋亡[45], Guo等[30]研究发现, miR-15b和miR-16也能降低Bcl-2的表达, 同时具有激活半胱天冬酶Caspase9的能力, 进而抑制HSC的增殖并促进活化的HSC凋亡, 此外, 他们进一步证实, miR-16也可以降低细胞周期蛋白D1的表达水平, 抑制细胞增殖, 促进细胞凋亡; 而miR-21能上调Bcl-2的表达, 抑制Caspase9的激活, 进而抑制细胞凋亡[46].
MiRNA和HSC相关信号通路的相互作用在HSC的活化、增殖和凋亡中发挥着重要作用. 一方面, HSC活化、增殖和凋亡相关的多个信号通路的下游分子, 直接或者间接参与了miRNA的转录、加工和功能的调控; 另一方面, 部分miRNA通过调控信号通路的下游分子, 参与了HSC的活化、增殖和凋亡. 针对抑制HSC活化、增殖及促进HSC凋亡的miRNA, 上调其表达有可能成为治疗肝纤维化的新策略.
以胶原蛋白为主的细胞外基质(extracellular matrix, ECM)的合成与降解失调是肝纤维化的重要特征, 活化的肝星状细胞(hepatic stellate cell, HSC)是促进ECM过度沉积的主要细胞. 微小RNA(microRNA, miRNA)能通过多种信号转导通路影响HSC的活化、增殖和凋亡, 这为肝纤维化的分子靶向治疗提供了方向.
袁周, 副主任医师, 上海交通大学附属第六人民医院; 邓庆, 副研究员, 上海人类基因组研究中心功能基因组部
在生物体内多样化调控途径中, miRNA扮演着关键性角色, 包括控制发育进程、细胞分化、细胞凋亡以及器官发育等, miRNA的失调涉及到包括癌症在内的许多疾病, 阐明miRNA与HSC活化之间的关系, 可能为肝纤维化的靶向治疗提供思路.
本文就miRNA和HSC密切的信号通路相关分子之间的相互调控关系做一些系统性的总结, 目前从共性方面, 已经有文献涉及到多种信号转导通路与miRNA的相关关系.
文章总结了HSC相关信号通路对miRNA转录、加工成熟及功能的调控, 同时, miRNA又通过这些信号通路及相关分子调控HSC的活化、增殖和凋亡.
miRNA和HSC相关信号通路的相互作用在HSC的活化、增殖和凋亡中发挥着重要作用, 针对抑制HSC活化、增殖及促进HSC凋亡的miRNA, 上调其表达有可能成为治疗肝纤维化的新策略.
HSC: 位于肝Dissel间隙内, 是ECM的主要来源, 正常情况下, HSC处于静止状态, 各种炎性刺激能促使其激活并转化为肌成纤维样细胞, 目前认为是导致肝纤维化形成的重要细胞.
作者较为详实地描述了miRNA和HSC相关信号转导通路的相互作用及miRNA在HSC的活化、增殖和凋亡的重要作用, 文章描述合理, 观点新颖且正确, 为肝星状细胞激活的内在机制、肝纤维化病理进程过程中的分子机制研究以及分子靶向治疗提供文献参考.
编辑: 郭鹏 电编:都珍珍
| 1. | Liu Y, Wang Z, Kwong SQ, Lui EL, Friedman SL, Li FR, Lam RW, Zhang GC, Zhang H, Ye T. Inhibition of PDGF, TGF-β, and Abl signaling and reduction of liver fibrosis by the small molecule Bcr-Abl tyrosine kinase antagonist Nilotinib. J Hepatol. 2011;55:612-625. [PubMed] [DOI] |
| 2. | Nagaraja T, Chen L, Balasubramanian A, Groopman JE, Ghoshal K, Jacob ST, Leask A, Brigstock DR, Anand AR, Ganju RK. Activation of the connective tissue growth factor (CTGF)-transforming growth factor β 1 (TGF-β 1) axis in hepatitis C virus-expressing hepatocytes. PLoS One. 2012;7:e46526. [PubMed] [DOI] |
| 3. | Qu H, Yang X. Metformin inhibits angiogenesis induced by interaction of hepatocellular carcinoma with hepatic stellate cells. Cell Biochem Biophys. 2014; Oct 18. [Epub ahead of print]. [PubMed] |
| 4. | Kavitha N, Vijayarathna S, Jothy SL, Oon CE, Chen Y, Kanwar JR, Sasidharan S. MicroRNAs: biogenesis, roles for carcinogenesis and as potential biomarkers for cancer diagnosis and prognosis. Asian Pac J Cancer Prev. 2014;15:7489-7497. [PubMed] |
| 6. | Davis BN, Hilyard AC, Lagna G, Hata A. SMAD proteins control DROSHA-mediated microRNA maturation. Nature. 2008;454:56-61. [PubMed] [DOI] |
| 7. | Davis BN, Hilyard AC, Nguyen PH, Lagna G, Hata A. Smad proteins bind a conserved RNA sequence to promote microRNA maturation by Drosha. Mol Cell. 2010;39:373-384. [PubMed] [DOI] |
| 8. | Zhong L, Wang X, Wang S, Yang L, Gao H, Yang C. The anti-fibrotic effect of bone morphogenic protein-7(BMP-7) on liver fibrosis. Int J Med Sci. 2013;10:441-450. [PubMed] [DOI] |
| 9. | Jeyaraj SC, Singh M, Ayupova DA, Govindaraju S, Lee BS. Transcriptional control of human antigen R by bone morphogenetic protein. J Biol Chem. 2010;285:4432-4440. [PubMed] [DOI] |
| 11. | Zhou AD, Diao LT, Xu H, Xiao ZD, Li JH, Zhou H, Qu LH. β-Catenin/LEF1 transactivates the microRNA-371-373 cluster that modulates the Wnt/β-catenin-signaling pathway. Oncogene. 2012;31:2968-2978. [PubMed] [DOI] |
| 12. | Zhang F, Zhang Z, Kong D, Zhang X, Chen L, Zhu X, Lu Y, Zheng S. Tetramethylpyrazine reduces glucose and insulin-induced activation of hepatic stellate cells by inhibiting insulin receptor-mediated PI3K/AKT and ERK pathways. Mol Cell Endocrinol. 2014;382:197-204. [PubMed] [DOI] |
| 13. | Paroo Z, Ye X, Chen S, Liu Q. Phosphorylation of the human microRNA-generating complex mediates MAPK/Erk signaling. Cell. 2009;139:112-122. [PubMed] [DOI] |
| 14. | Li J, Hu W, Baldassare JJ, Bora PS, Chen S, Poulos JE, O'Neill R, Britton RS, Bacon BR. The ethanol metabolite, linolenic acid ethyl ester, stimulates mitogen-activated protein kinase and cyclin signaling in hepatic stellate cells. Life Sci. 2003;73:1083-1096. [PubMed] |
| 15. | Pinzani M. PDGF and signal transduction in hepatic stellate cells. Front Biosci. 2002;7:d1720-d1726. [PubMed] |
| 16. | Singh M, Martinez AR, Govindaraju S, Lee BS. HuR inhibits apoptosis by amplifying Akt signaling through a positive feedback loop. J Cell Physiol. 2013;228:182-189. [PubMed] [DOI] |
| 17. | Dassi E, Zuccotti P, Leo S, Provenzani A, Assfalg M, D'Onofrio M, Riva P, Quattrone A. Hyper conserved elements in vertebrate mRNA 3'-UTRs reveal a translational network of RNA-binding proteins controlled by HuR. Nucleic Acids Res. 2013;41:3201-3216. [PubMed] [DOI] |
| 18. | Srikantan S, Tominaga K, Gorospe M. Functional interplay between RNA-binding protein HuR and microRNAs. Curr Protein Pept Sci. 2012;13:372-379. [PubMed] |
| 19. | Schnabl B, Bradham CA, Bennett BL, Manning AM, Stefanovic B, Brenner DA. TAK1/JNK and p38 have opposite effects on rat hepatic stellate cells. Hepatology. 2001;34:953-963. [PubMed] |
| 20. | Kim SI, Kwak JH, Zachariah M, He Y, Wang L, Choi ME. TGF-beta-activated kinase 1 and TAK1-binding protein 1 cooperate to mediate TGF-beta1-induced MKK3-p38 MAPK activation and stimulation of type I collagen. Am J Physiol Renal Physiol. 2007;292:F1471-F1478. [PubMed] |
| 21. | Gao R, Brigstock DR. Activation of nuclear factor kappa B (NF-kappaB) by connective tissue growth factor (CCN2) is involved in sustaining the survival of primary rat hepatic stellate cells. Cell Commun Signal. 2005;3:14. [PubMed] |
| 22. | Kang MJ, Ryu BK, Lee MG, Han J, Lee JH, Ha TK, Byun DS, Chae KS, Lee BH, Chun HS. NF-kappaB activates transcription of the RNA-binding factor HuR, via PI3K-AKT signaling, to promote gastric tumorigenesis. Gastroenterology. 2008;135:2030-242, 2030-242. [PubMed] [DOI] |
| 23. | Chen C, Wu CQ, Zhang ZQ, Yao DK, Zhu L. Loss of expression of miR-335 is implicated in hepatic stellate cell migration and activation. Exp Cell Res. 2011;317:1714-1725. [PubMed] [DOI] |
| 24. | Zheng J, Lin Z, Dong P, Lu Z, Gao S, Chen X, Wu C, Yu F. Activation of hepatic stellate cells is suppressed by microRNA-150. Int J Mol Med. 2013;32:17-24. [PubMed] [DOI] |
| 25. | Wang B, Li W, Guo K, Xiao Y, Wang Y, Fan J. miR-181b promotes hepatic stellate cells proliferation by targeting p27 and is elevated in the serum of cirrhosis patients. Biochem Biophys Res Commun. 2012;421:4-8. [PubMed] [DOI] |
| 26. | Szabo G, Bala S. MicroRNAs in liver disease. Nat Rev Gastroenterol Hepatol. 2013;10:542-552. [PubMed] [DOI] |
| 27. | Ji J, Zhang J, Huang G, Qian J, Wang X, Mei S. Over-expressed microRNA-27a and 27b influence fat accumulation and cell proliferation during rat hepatic stellate cell activation. FEBS Lett. 2009;583:759-766. [PubMed] [DOI] |
| 28. | Sekiya Y, Ogawa T, Iizuka M, Yoshizato K, Ikeda K, Kawada N. Down-regulation of cyclin E1 expression by microRNA-195 accounts for interferon-β-induced inhibition of hepatic stellate cell proliferation. J Cell Physiol. 2011;226:2535-2542. [PubMed] [DOI] |
| 29. | Yang JJ, Tao H, Hu W, Liu LP, Shi KH, Deng ZY, Li J. MicroRNA-200a controls Nrf2 activation by target Keap1 in hepatic stellate cell proliferation and fibrosis. Cell Signal. 2014;26:2381-2389. [PubMed] [DOI] |
| 30. | Guo CJ, Pan Q, Li DG, Sun H, Liu BW. miR-15b and miR-16 are implicated in activation of the rat hepatic stellate cell: An essential role for apoptosis. J Hepatol. 2009;50:766-778. [PubMed] [DOI] |
| 31. | He Y, Huang C, Sun X, Long XR, Lv XW, Li J. MicroRNA-146a modulates TGF-beta1-induced hepatic stellate cell proliferation by targeting SMAD4. Cell Signal. 2012;24:1923-1930. [PubMed] [DOI] |
| 32. | Sekiya Y, Ogawa T, Yoshizato K, Ikeda K, Kawada N. Suppression of hepatic stellate cell activation by microRNA-29b. Biochem Biophys Res Commun. 2011;412:74-79. [PubMed] [DOI] |
| 33. | Gong XH, Chen C, Hou P, Zhu SC, Wu CQ, Song CL, Ni W, Hu JF, Yao DK, Kang JH. Overexpression of miR-126 inhibits the activation and migration of HSCs through targeting CRK. Cell Physiol Biochem. 2014;33:97-106. [PubMed] [DOI] |
| 34. | Lakner AM, Steuerwald NM, Walling TL, Ghosh S, Li T, McKillop IH, Russo MW, Bonkovsky HL, Schrum LW. Inhibitory effects of microRNA 19b in hepatic stellate cell-mediated fibrogenesis. Hepatology. 2012;56:300-310. [PubMed] [DOI] |
| 35. | Li ZJ, Ou-Yang PH, Han XP. Profibrotic effect of miR-33a with Akt activation in hepatic stellate cells. Cell Signal. 2014;26:141-148. [PubMed] [DOI] |
| 36. | Li WQ, Chen C, Xu MD, Guo J, Li YM, Xia QM, Liu HM, He J, Yu HY, Zhu L. The rno-miR-34 family is upregulated and targets ACSL1 in dimethylnitrosamine-induced hepatic fibrosis in rats. FEBS J. 2011;278:1522-1532. [PubMed] [DOI] |
| 37. | Ogawa T, Enomoto M, Fujii H, Sekiya Y, Yoshizato K, Ikeda K, Kawada N. MicroRNA-221/222 upregulation indicates the activation of stellate cells and the progression of liver fibrosis. Gut. 2012;61:1600-1609. [PubMed] |
| 38. | Shen WJ, Dong R, Chen G, Zheng S. microRNA-222 modulates liver fibrosis in a murine model of biliary atresia. Biochem Biophys Res Commun. 2014;446:155-159. [PubMed] [DOI] |
| 39. | Tan W, Li Y, Lim SG, Tan TM. miR-106b-25/miR-17-92 clusters: polycistrons with oncogenic roles in hepatocellular carcinoma. World J Gastroenterol. 2014;20:5962-5972. [PubMed] [DOI] |
| 40. | Zheng J, Wu C, Xu Z, Xia P, Dong P, Chen B, Yu F. Hepatic stellate cell is activated by microRNA-181b via PTEN/Akt pathway. Mol Cell Biochem. 2015;398:1-9. [PubMed] [DOI] |
| 41. | Tu X, Zhang H, Zhang J, Zhao S, Zheng X, Zhang Z, Zhu J, Chen J, Dong L, Zang Y. MicroRNA-101 suppresses liver fibrosis by targeting the TGFβ signalling pathway. J Pathol. 2014;234:46-59. [PubMed] [DOI] |
| 42. | Sun X, He Y, Ma TT, Huang C, Zhang L, Li J. Participation of miR-200a in TGF-β1-mediated hepatic stellate cell activation. Mol Cell Biochem. 2014;388:11-23. [PubMed] [DOI] |
| 43. | Zhu D, He X, Duan Y, Chen J, Wang J, Sun X, Qian H, Feng J, Sun W, Xu F. Expression of microRNA-454 in TGF-β1-stimulated hepatic stellate cells and in mouse livers infected with Schistosoma japonicum. Parasit Vectors. 2014;7:148. [PubMed] [DOI] |
| 44. | Venugopal SK, Jiang J, Kim TH, Li Y, Wang SS, Torok NJ, Wu J, Zern MA. Liver fibrosis causes downregulation of miRNA-150 and miRNA-194 in hepatic stellate cells, and their overexpression causes decreased stellate cell activation. Am J Physiol Gastrointest Liver Physiol. 2010;298:G101-G106. [PubMed] [DOI] |
| 45. | Singh R, Saini N. Downregulation of BCL2 by miRNAs augments drug-induced apoptosis--a combined computational and experimental approach. J Cell Sci. 2012;125:1568-1578. [PubMed] [DOI] |
| 46. | Zhou X, Zhang J, Jia Q, Ren Y, Wang Y, Shi L, Liu N, Wang G, Pu P, You Y. Reduction of miR-21 induces glioma cell apoptosis via activating caspase 9 and 3. Oncol Rep. 2010;24:195-201. [PubMed] |
| 47. | Mann J, Chu DC, Maxwell A, Oakley F, Zhu NL, Tsukamoto H, Mann DA. MeCP2 controls an epigenetic pathway that promotes myofibroblast transdifferentiation and fibrosis. Gastroenterology. 2010;138:705-714, 714.e1-4. [PubMed] [DOI] |
| 48. | Ramachandran S, Ilias Basha H, Sarma NJ, Lin Y, Crippin JS, Chapman WC, Mohanakumar T. Hepatitis C virus induced miR200c down modulates FAP-1, a negative regulator of Src signaling and promotes hepatic fibrosis. PLoS One. 2013;8:e70744. [PubMed] [DOI] |
| 49. | Zhang Y, Huang XR, Wei LH, Chung AC, Yu CM, Lan HY. miR-29b as a therapeutic agent for angiotensin II-induced cardiac fibrosis by targeting TGF-β/Smad3 signaling. Mol Ther. 2014;22:974-985. [PubMed] [DOI] |
| 50. | Noetel A, Kwiecinski M, Elfimova N, Huang J, Odenthal M. microRNA are Central Players in Anti- and Profibrotic Gene Regulation during Liver Fibrosis. Front Physiol. 2012;3:49. [PubMed] [DOI] |