修回日期: 2014-01-23
接受日期: 2014-01-24
在线出版日期: 2014-03-28
目的: 检测钙周期素结合蛋白[calcyclin (S100-A6)-binding-protein, CacyBP/Siah-1 interacting protein, SIP]在大肠各种组织中的表达, 探讨其在大肠癌发生发展中的作用.
方法: 采用免疫组织化学技术检测10例正常大肠组织、17例大肠增生性息肉、26例大肠腺瘤和50例大肠癌组织中CacyBP/SIP的表达. 采用Western blot检测3例大肠癌及相应癌旁正常组织中CacyBP/SIP的表达. 并分析CacyBP/SIP与大肠癌临床病理资料之间的关系.
结果: CacyBP/SIP在正常大肠、大肠增生性息肉、大肠腺瘤及大肠癌组织中的表达率分别为0(0/10)、17.7%(3/17)、26.9%(7/26)、52.0%(26/50), CacyBP/SIP在大肠增生性息肉中的表达与正常大肠组织中的表达比较无统计学差异(P>0.05), 而在大肠腺瘤组织、大肠癌组织中的表达与正常大肠组织比较差异均有统计学意义(P<0.05). Western blot显示CacyBP/SIP在大肠癌组织中的表达明显高于其相应癌旁正常组织, 差异有统计学意义(P<0.05). CacyBP/SIP在大肠癌组织中的表达与大肠癌患者的性别、年龄、组织分化程度、TNM分期之间比较均无统计学差异(P>0.05).
结论: CacyBP/SIP在大肠腺瘤组织、大肠癌组织中高表达, 可能参与了大肠癌的发生发展.
核心提示: 钙周期素结合蛋白CacyBP/SIP[calcycl-in(S100A6)-binding-protein, CacyBP, Siah-1 interacting protein, SIP]是泛素化降解通路中的一员, 在G1/S期转换中具有重要作用. 本文研究发现: 与正常大肠、大肠增生性息肉中的表达相比, CacyBP/SIP在大肠腺瘤、大肠癌中的表达明显升高, 提示其可能参与大肠癌的发生发展.
引文著录: 翟惠虹, 冯珊珊, 仇长青, 武婧, 王安萍. CacyBP/SIP在不同大肠组织中的表达及临床意义. 世界华人消化杂志 2014; 22(9): 1328-1333
Revised: January 23, 2014
Accepted: January 24, 2014
Published online: March 28, 2014
AIM: To detect the expression of CacyBP/SIP [Calcyclin (S100A6)-binding protein/Siah-1 interacting protein] in normal colorectal tissue, colorectal hyperplastic polyps, colorectal adenoma and colorectal cancer.
METHODS: Immunohistochemistry was used to analyze the expression of CacyBP/SIP in 10 normal colorectal tissue samples, 17 samples of colorectal hyperplastic polyps, 26 samples of colorectal adenomas and 50 samples of colorectal cancer. Four frozen tissue samples of colorectal cancer and adjacent noncancerous tissues were used in Western blot to detect CacyBP/SIP expression. Immunohistochemical results were compared against patient data and pathological analysis of tissue slices. Slices were assessed for associations with gender, age, degree of tumor differentiation and TNM stage.
RESULTS: CacyBP/SIP was detected in 0 (0/10) of normal tissue samples, 17.7% (7/26) of colorectal hyperplastic polyps, 26.9% (7/26) of colorectal adenomas, and 52% (26/50) of colorectal cancer tissues by immunohistochemistry. The expression of CacyBP/SIP in colorectal adenomas and colorectal cancer tissues was higher than that in the normal colon tissue and colorectal hyperplasic polyps (0 vs 26.9%, 0 vs 52%, 17.7% vs 26.9%, 17.7% vs 52%, P < 0.05 for all). The expression of CacyBP/SIP was also higher in cancerous tissue than in adjacent noncancerous colorectal tissue, as revealed by Western blot (P < 0.05). There was no association between CacyBP/SIP expression and patient age, gender, degree of tumor differentiation or TNM stage (P > 0.05 for all).
CONCLUSION: These results suggest that CacyBP/SIP may be involved in the progression of colorectal cancer.
- Citation: Zhai HH, Feng SS, Qiu CQ, Wu J, Wang AP. Clinical significance of expression of CacyBP/SIP in colorectal tissues. Shijie Huaren Xiaohua Zazhi 2014; 22(9): 1328-1333
- URL: https://www.wjgnet.com/1009-3079/full/v22/i9/1328.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i9.1328
钙周期素结合蛋白CacyBP[calcyclin (S100A6)-binding-protein, CacyBP]是1998年在小鼠艾氏腹水瘤中发现的、以Ca2+浓度依赖的方式结合S100A6蛋白[1]. 2001年, 从人cDNA文库中钓到一个可以和人Siah-1相互作用的蛋白(Siah-1 interacting protein, SIP), 经序列比对发现, 人SIP和鼠CacyBP基因93%相同, 认为SIP即为CacyBP, 从此命名为CacyBP/SIP[2].
研究发现, CacyBP/SIP可以与S100蛋白家族结合, 如S100 A6蛋白[3]; 可以与细胞骨架蛋白结合, 如tubulin、actin、tropomyosin(ERK1/2激酶)、ERK1/2[4-6]. 目前关于CacyBP/SIP的功能发现: CacyBP/SIP可以参与细胞的泛素化调控[7]、神经细胞和心肌细胞的分化[4,8]、调控凋亡[9]等. 另外还发现, CacyBP/SIP参与了胃癌[10]、肾癌[11]、胰腺癌[12]、乳腺癌[13-15]等肿瘤的发生发展. 但是CacyBP/SIP在大肠癌中的病理作用仍不清楚.
本研究小组前期通过自制的CacyBP/SIP单克隆抗体(mAb)[16]对其在正常组织及肿瘤组织中的表达进行了研究, 发现: CacyBP/SIP在正常大肠黏膜组织中不表达, 而在结肠癌中高表达[17]. 进一步的研究发现, CacyBP/SIP在结肠癌细胞中具有依赖Ca2+浓度的核转位现象[18]. 因此认为CacyBP/SIP可能参与了大肠癌的发生发展过程, 但需进一步验证.
为此, 本研究对CacyBP/SIP在大肠组织、大肠息肉、大肠腺瘤以及大肠癌中的表达进行检测, 并分析其表达与大肠癌临床病理资料之间的关系, 探讨其在大肠癌发生发展中的作用, 为大肠癌的分子诊断和治疗提供实验依据.
收集2006-06/2008-02在宁夏医科大学总医院手术切除的50例大肠癌石蜡标本, 结肠镜及病理诊断的26例腺瘤组织、17例增生性息肉石蜡标本、10例大肠正常组织石蜡标本. 大肠癌患者50例, 男29例, 女21例. 用于Western blot检测的3例手术切除标本, 均经病理诊断为大肠癌. 抗CacyBP/SIP单克隆抗体为实验室冻存[3]; SP超敏免疫组织化学剂盒、DAB显色试剂盒(北京中山公司); HRP及酶标二抗(DAKO公司).
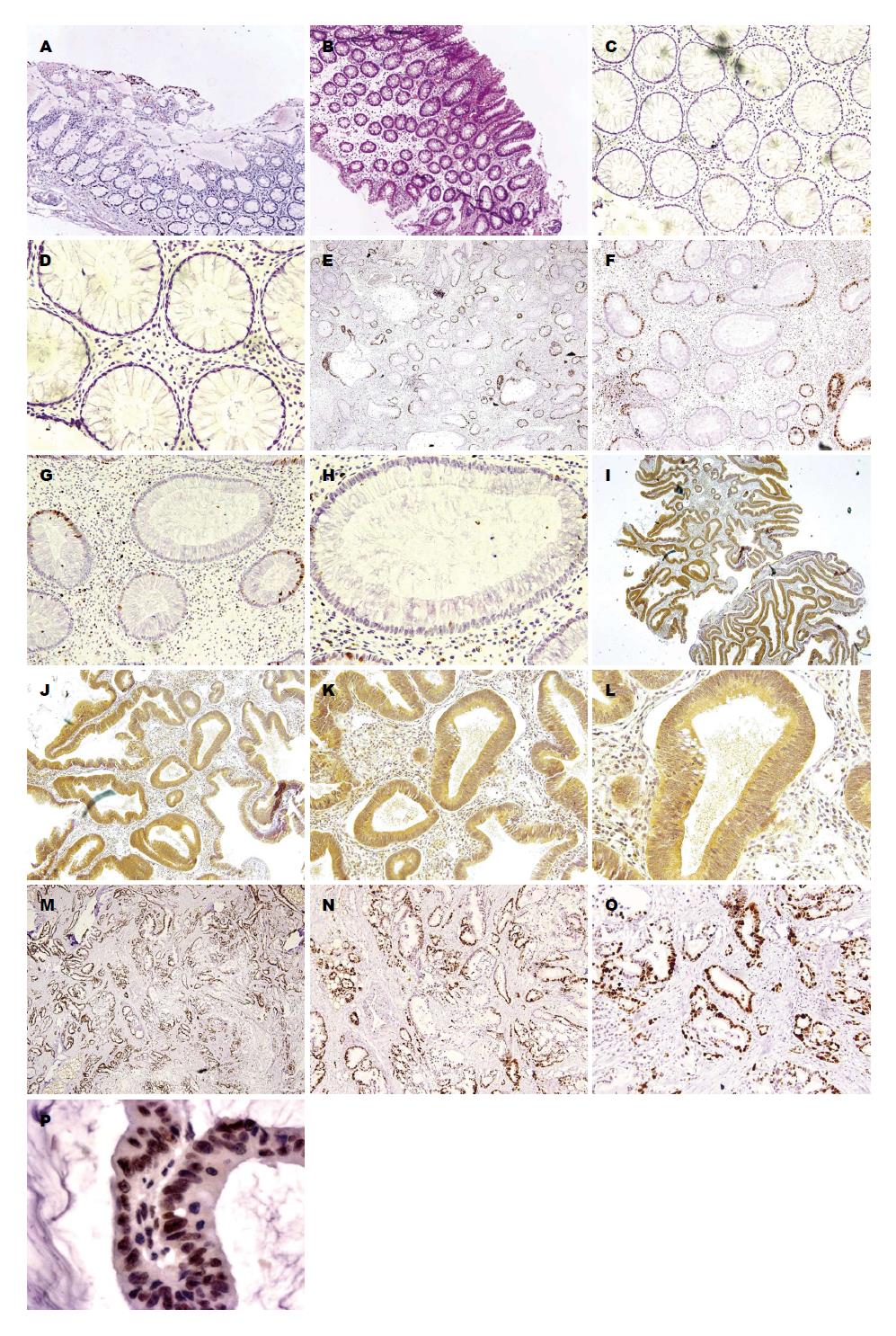
1.2.1 免疫组织化学染色: 取大肠癌组织、腺瘤组织、增生性息肉组织及正常组织石蜡标本, 连续3 μm切片, 采用免疫组织化学SP法检测CacyBP/SIP的表达情况, 具体操作参照SP试剂盒说明进行, PBS代替一抗作阴性对照, 以已知CacyBP/SIP阳性组织切片做阳性对照.
1.2.2 免疫组织化学结果判定: 由两位病理医师采用双盲法独立评估. 随机于高倍镜下取10个不同视野, 各计数100个细胞, 同时对染色强度及阳性细胞所占百分比进行评分. 无色为0分, 淡黄色为1分, 棕黄色为2分, 棕褐色为3分; 小于总数的5%为0分, 5%-25%为1分, 26%-50%为2分, >50%为3分; 染色强度得分与阳性细胞数得分相乘, 0分为阴性(-), 1-3分为弱阳性(+), 4-5分为中度阳性(++), ≥6分为强阳性(+++). 胞浆、胞核染色均计为阳性细胞.
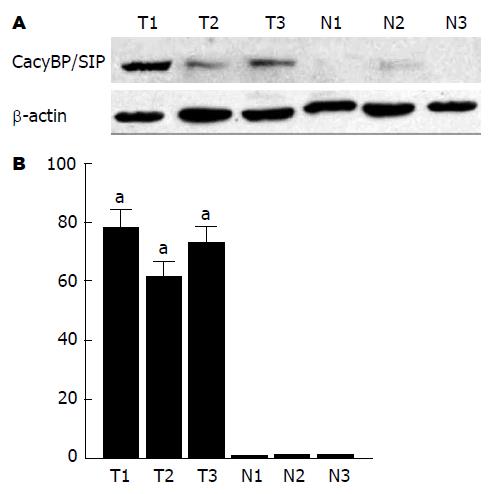
1.2.3 Western blot检测: 参照Santa Cruz公司提供的方法, 用RIPA组织裂解液裂解大肠癌及癌旁组织, 提取总蛋白, 按照蛋白定量试剂盒说明测定蛋白浓度, 取相同的蛋白上样量行SDS-PAGE, 电转移至NC膜, 封闭后, 加入一抗(抗hCacyBP/SIP单抗, 1:100)及用HRP标记的山羊抗小鼠IgG(1:2000), 按常规方法进行ECL底物化学发光, 曝光, 显影, 以β-actin为内参. 化学发光试剂检测蛋白条带, 测定各条带积分吸光度(A)值, 采用Image ProPlus图像分析系统对蛋白条带的相对深度进行分析.
统计学处理 采用SPSS18.0统计分析软件包进行统计分析, 采用χ2检验, P<0.05为差异有统计学意义.
免疫组织化学结果: CacyBP/SIP在大肠癌组织、大肠腺瘤组织、大肠增生性息肉组织中的肠上皮细胞中均存在一定程度的表达, 在大肠正常组织中不表达, 主要分布于肠上皮细胞的细胞浆和细胞核, 呈棕黄色颗粒或线网状分布(图1). CacyBP/SIP在大肠正常组织中无表达(0/10); 大肠增生性息肉组织中表达率为17.7%(3/17); 大肠腺瘤组织的表达率为26.9%(7/26); 在大肠癌组织中的表达最高为52.0%(26/50). CacyBP/SIP在大肠增生性息肉中的表达与正常大肠组织相比, 差异无统计学意义(P>0.05); 而CacyBP/SIP在大肠腺瘤组织、大肠癌组织中的表达率与正常大肠组织相比, 差异均有统计学意义(均P<0.05)(表1). 与正常大肠组织、大肠增生性息肉及大肠腺瘤组织相比, CacyBP/SIP在大肠癌组织中的表达显著升高(P<0.05)(表1, 图1), 且CacyBP/SIP在肠上皮细胞的细胞核中表达(图1P), 提示CacyBP/SIP参与了大肠从正常结肠黏膜-息肉-腺瘤-癌的发生发展过程.
| 大肠不同组织 | n | 染色结果阳性数 | 阳性率(%) | P值 |
| 正常大肠黏膜 | 10 | 0 | 0 | |
| 增生性息肉 | 17 | 3 | 17.7 | >0.05 |
| 大肠腺瘤 | 26 | 7 | 26.9 | <0.05 |
| 大肠癌 | 50 | 26 | 52.0 | <0.05 |
3例大肠癌组织及相应癌旁组织中CacyBP/SIP的蛋白表达情况, 发现: CacyBP/SIP在大肠癌组织中均表达, 而在相应癌旁组织中均表达下调(图2A), 且差异均有统计学意义(P<0.05)(图2B). 进一步从蛋白水平上提示CacyBP/SIP参与了大肠癌的发生.
50例大肠癌的临床病理数据分析表明, CacyBP/SIP在大肠癌中的阳性表达与患者的性别、年龄、组织分化程度和TNM分期均无关, 差异均无统计学意义(P>0.05), (表2).
| 临床及病理学特征 | n | 阳性数 | 阳性率(%) | P值 |
| 性别 | >0.05 | |||
| 男 | 29 | 17 | 58.6 | |
| 女 | 21 | 9 | 42.9 | |
| 年龄(岁) | >0.05 | |||
| <50 | 18 | 11 | 61.1 | |
| ≥50 | 32 | 15 | 46.9 | |
| 分化程度 | >0.05 | |||
| 高分化 | 19 | 11 | 57.9 | |
| 中分化 | 17 | 12 | 70.6 | |
| 低分化 | 14 | 9 | 64.3 | |
| TNM分期 | >0.05 | |||
| Ⅰ+Ⅱ | 23 | 15 | 65.2 | |
| Ⅲ+Ⅳ | 27 | 11 | 40.7 |
本研究小组前期发现: CacyBP/SIP在多种正常组织和肿瘤组织中表达[17]. 现有研究提示, CacyBP/SIP在胃癌细胞中低表达, 通过下调β-catenin的表达来抑制胃癌细胞的增殖和侵袭[10]; 在肾癌细胞中亦是低表达, 增强其表达则抑制肾癌细胞生长[11]; 在胰腺癌组织中高表达, 且与胰腺癌的肿瘤分期、转移呈正相关[12]; 在乳腺癌的研究中目前结果不一, 有研究表明CacyBP/SIP在乳腺癌中的表达低于癌组织, 且与肿瘤的分化程度呈负相关, 在乳腺癌细胞中降低其表达, 则可增强乳腺癌细胞的增殖及侵袭[13]; 但另有研究表明, CacyBP/SIP在乳腺癌组织中高表达, 且与预后呈正相关[14]; 最新的研究表明: 在应用二甲基苯并(α)蒽DMBA[dimethylbenz(α)anthracene]制备的乳腺癌鼠模型中发现, 随着乳腺癌的进展, CacyBP/SIP表达逐渐升高[15]. 本研究发现: CacyBP/SIP在正常大肠黏膜中不表达, 增生性息肉和腺瘤组织中表达逐渐增高, 大肠癌组织中的蛋白高表达, 在其相应的癌旁组织中不表达. 结果提示, CacyBP/SIP参与了大肠癌的发生发展过程. CacyBP/SIP在不同的肿瘤中发挥的作用不同, 亦说明其作用的多样性. 但是, 其在大肠癌组织的高表达, 为后续结肠癌细胞中的研究奠定了基础.
本研究结果亦发现: CacyBP/SIP在大肠癌组织中的高表达与肿瘤的分化程度、TNM分期无关. 但CacyBP/SIP在胰腺癌组织中高表达, 且与肿瘤低分化, 高TNM分级有关[14]. CacyBP/SIP在乳腺癌组织中低表达, 与肿瘤低分化、TNM分级增高, 淋巴转移及生存率降低有关[13]. 因此, CacyBP/SIP在不同肿瘤组织中所发挥的作用不同, 可能与其肿瘤类别有关; 在大肠癌中, CacyBP/SIP可能只是参与了大肠癌的发生发展, 并不是关键分子.
免疫组织化学结果提示, CacyBP/SIP在大肠癌组织的细胞核中表达. 分析CacyBP/SIP的基因序列发现, CacyBP/SIP包含非经典的核定位序列信号(nuclear localization signal, NLS, amino acids: 144-160)[19,20]. 本课题组前期研究证明CacyBP/SIP在结肠癌细胞中表达, 胃泌素可诱导CacyBP/SIP发生核转位, 具有依赖Ca2+浓度的核转位现象[18]. 另外, 在胃癌[12]和神经细胞瘤NB-2a细胞系[20]中也发现CacyBP/SIP可根据不同的Ca2+浓度出现由胞浆到胞核的转位现象. 细胞核是细胞增殖、分化、代谢的调控中枢, 蛋白转位至细胞核且发生磷酸化对于传递细胞外信号, 调控下游基因表达具有重要意义. 在大肠癌的组织学和细胞学水平均证实CacyBP/SIP主要存在于细胞浆, 某些时候可以转位至细胞核. 由此提示, CacyBP/SIP可能作为信号分子, 可能通过入核来参与大肠癌的发生发展.
CacyBP/SIP广泛存在于哺乳动物的组织和细胞中, 他可以和S100A6蛋白结合. 根据目前研究结果[21]表明: CacyBP/SIP可以与S100A6及S100蛋白家族的其他成员, Siah-1、Skp 1、tubulin、actin、tropmyosin、ERK1/2结合. CacyBP/SIP与Siah-1、Skp 1结合在β-catenin泛素化降解过程中发挥作用, 进而引起细胞增殖、肿瘤形成. CacyBP/SIP与tubulin、actin、tropmyosin、ERK1/2结合在细胞骨架重建、细胞分化、转录活性调控过程中发挥作用. 因此, 从CacyBP/SIP的结构和功能上分析, CacyBP/SIP是通过结合不同的蛋白而在许多正常组织和病理组织中发挥不同的细胞学功能. 那么, CacyBP/SIP引起大肠癌发生发展的机制为何, 他在信号通路中的作用如何, 这是我们下一步的研究方向.
钙周期素结合蛋白[calcyclin (S100A6)-binding-protein, CacyBP]首先发现是S100蛋白的靶蛋白, 随后在泛素化降解通路中发现其可以与Siah-1(Siah-1 interacting protein)相互作用, 因此命名为CacyBP/SIP. 目前发现其与胃癌、肾癌、胰腺癌及乳腺癌相关. 我们前期研究发现, 其在多种正常组织中低表达, 肿瘤组织中高表达. 因此, 本研究拟进一步研究CacyBP/SIP在不同大肠组织中的表达, 探讨其在大肠癌发生发展中的作用.
刘占举, 教授, 同济大学附属上海市第十人民医院
CacyBP/SIP在正常大肠组织、大肠增生性息肉中低表达, 在大肠腺瘤及大肠癌中高表达, 表明其参与了大肠癌的发生过程, 可能是大肠癌早期发生的分子之一, 可以作为早期诊断早期治疗的靶标之一.
CacyBP/SIP在胃癌细胞、肾癌细胞中低表达, 增强其表达则抑制肾癌细胞生长; 在胰腺癌组织中高表达, 且与胰腺癌的肿瘤分期、转移呈正相关; 在乳腺癌的研究中目前结果不一, 有研究表明CacyBP/SIP在乳腺癌中的表达低于正常组织, 且与肿瘤的分化程度呈负相关; 但另有研究表明, CacyBP/SIP在乳腺癌组织中高表达, 且与预后呈正相关; 最新的研究表明: 在应用DMBA制备的乳腺癌鼠模型中发现, 随着乳腺癌的进展, CacyBP/SIP表达逐渐升高.
本文应用不同的大肠组织, 对CacyBP/SIP在正常大肠黏膜、增生性息肉、大肠腺瘤及大肠癌中的表达进行深入研究, 为明确CacyBP/SIP在大肠癌中的作用提供了依据.
本研究发现CacyBP/SIP在正常结肠黏膜-息肉-腺瘤-癌的演变过程中, 表达逐渐升高, 且发现其在大肠癌组织细胞核染色, 表明其参与大肠癌的发生过程, 且具有核转位现象, 可以作为早期诊断的分子.
CacyBP/SIP, 可以与Siah-1, Skp 1结合在β-catenin泛素化降解过程中发挥作用, 进而引起细胞增殖、肿瘤形成. 与tubulin、actin、tropmyosin、ERK1/2结合在细胞骨架重建、细胞分化、转录活性调控过程中发挥作用. 发现CacyBP/SIP在细胞核染色, 提示其具有核转位现象, 同时在大肠腺瘤及大肠癌中高表达, 提示其参与了大肠癌的发生.
编辑: 郭鹏 电编: 鲁亚静
| 1. | Filipek A, Kuźnicki J. Molecular cloning and expression of a mouse brain cDNA encoding a novel protein target of calcyclin. J Neurochem. 1998;70:1793-1798. [PubMed] [DOI] |
| 2. | Matsuzawa SI, Reed JC. Siah-1, SIP, and Ebi collaborate in a novel pathway for beta-catenin degradation linked to p53 responses. Mol Cell. 2001;7:915-926. [PubMed] [DOI] |
| 3. | Filipek A, Jastrzebska B, Nowotny M, Kuznicki J. CacyBP/SIP, a calcyclin and Siah-1-interacting protein, binds EF-hand proteins of the S100 family. J Biol Chem. 2002;277:28848-28852. [PubMed] [DOI] |
| 4. | Schneider G, Nieznanski K, Kilanczyk E, Bieganowski P, Kuznicki J, Filipek A. CacyBP/SIP interacts with tubulin in neuroblastoma NB2a cells and induces formation of globular tubulin assemblies. Biochim Biophys Acta. 2007;1773:1628-1636. [PubMed] [DOI] |
| 5. | Jurewicz E, Ostrowska Z, Jozwiak J, Redowicz MJ, Lesniak W, Moraczewska J, Filipek A. CacyBP/SIP as a novel modulator of the thin filament. Biochim Biophys Acta. 2013;1833:761-766. [PubMed] [DOI] |
| 6. | Kilanczyk E, Filipek S, Jastrzebska B, Filipek A. CacyBP/SIP binds ERK1/2 and affects transcriptional activity of Elk-1. Biochem Biophys Res Commun. 2009;380:54-59. [PubMed] [DOI] |
| 7. | Wasik U, Filipek A. The CacyBP/SIP protein is sumoylated in neuroblastoma NB2a cells. Neurochem Res. 2013;38:2427-2432. [PubMed] [DOI] |
| 8. | Au KW, Kou CY, Woo AY, Chim SS, Fung KP, Cheng CH, Waye MM, Tsui SK. Calcyclin binding protein promotes DNA synthesis and differentiation in rat neonatal cardiomyocytes. J Cell Biochem. 2006;98:555-566. [PubMed] [DOI] |
| 9. | Lou JR, Zhang XX, Zheng J, Ding WQ. Transient metals enhance cytotoxicity of curcumin: potential involvement of the NF-kappaB and mTOR signaling pathways. Anticancer Res. 2010;30:3249-3255. [PubMed] |
| 10. | Ning X, Sun S, Hong L, Liang J, Liu L, Han S, Liu Z, Shi Y, Li Y, Gong W. Calcyclin-binding protein inhibits proliferation, tumorigenicity, and invasion of gastric cancer. Mol Cancer Res. 2007;5:1254-1262. [PubMed] [DOI] |
| 11. | Sun S, Ning X, Liu J, Liu L, Chen Y, Han S, Zhang Y, Liang J, Wu K, Fan D. Overexpressed CacyBP/SIP leads to the suppression of growth in renal cell carcinoma. Biochem Biophys Res Commun. 2007;356:864-871. [PubMed] [DOI] |
| 12. | Chen X, Han G, Zhai H, Zhang F, Wang J, Li X, Huang S, Wang X, Fan D. Expression and clinical significance of CacyBP/SIP in pancreatic cancer. Pancreatology. 2008;8:470-477. [PubMed] [DOI] |
| 13. | Nie F, Yu XL, Wang XG, Tang YF, Wang LL, Ma L. Down-regulation of CacyBP is associated with poor prognosis and the effects on COX-2 expression in breast cancer. Int J Oncol. 2010;37:1261-1269. [PubMed] |
| 14. | Wang N, Ma Q, Wang Y, Ma G, Zhai H. CacyBP/SIP expression is involved in the clinical progression of breast cancer. World J Surg. 2010;34:2545-2552. [PubMed] [DOI] |
| 15. | Kilańczyk E, Gwoździński K, Wilczek E, Filipek A. Up-regulation of CacyBP/SIP during rat breast cancer development. Breast Cancer. 2012; Aug 28. [Epub ahead of print]. [PubMed] |
| 16. | Zhai H, Shi Y, Yu J, Hong L, Tang H, Wang J, Hu S, Bai F, Fan D. Establishment and characterization of calcyclin binding protein (CacyBP) monoclonal antibody. Hybridoma (Larchmt). 2006;25:91-94. [PubMed] |
| 17. | Zhai H, Shi Y, Jin H, Li Y, Lu Y, Chen X, Wang J, Ding L, Wang X, Fan D. Expression of calcyclin-binding protein/Siah-1 interacting protein in normal and malignant human tissues: an immunohistochemical survey. J Histochem Cytochem. 2008;56:765-772. [PubMed] [DOI] |
| 19. | Filipek A, Jastrzebska B, Nowotny M, Kwiatkowska K, Hetman M, Surmacz L, Wyroba E, Kuznicki J. Ca2+-dependent translocation of the calcyclin-binding protein in neurons and neuroblastoma NB-2a cells. J Biol Chem. 2002;277:21103-21109. [PubMed] [DOI] |
| 20. | Wu J, Tan X, Peng X, Yuan J, Qiang B. Translocation and phosphorylation of calcyclin binding protein during retinoic acid-induced neuronal differentiation of neuroblastoma SH-SY5Y cells. J Biochem Mol Biol. 2003;36:354-358. [PubMed] |
| 21. | Schneider G, Filipek A. S100A6 binding protein and Siah-1 interacting protein (CacyBP/SIP): spotlight on properties and cellular function. Amino Acids. 2011;41:773-780. [PubMed] [DOI] |