修回日期: 2014-01-13
接受日期: 2014-01-24
在线出版日期: 2014-03-28
目的: 研究同源结构域相互作用蛋白激酶2(homeodomain-interacting protein kinases 2, HIPK2)基因重组质粒对HCT-116细胞环氧合酶2(cyclooxygenase 2, COX-2)及β-catenin表达的影响, 探讨HIPK2基因对人结直肠癌细胞血管新生因子表达的调节作用.
方法: 采用脂质体将pEGFP-N3和pEGFP-N3-HIPK2质粒转染人结直肠癌细胞, 分为正常组、载体质粒组和HIPK2质粒组, ELISA法检测细胞培养液中血管内皮生长因子(vascular endothelial growth factor, VEGF)的表达, Western blot检测β-catenin蛋白表达情况. 在上述3组细胞中同时转染含COX-2基因启动子质粒pGL3-basic-COX-2后, 双荧光素酶活性检测COX-2启动子的表达, Real-time PCR检测COX-2 mRNA的表达水平.
结果: HCT-116细胞中pEGFP-N3-HIPK2质粒组的荧光表达量与载体质粒pEGFP-N3组的表达量基本一致, 两组相比无明显差异. 转染pEGFP-N3-HIPK2质粒后, HCT-116细胞内VEGF的表达量由对照组的857.54 pg/mL±65.04 pg/mL降低至368.32 pg/mL±98.82 pg/mL, 两组相比具有统计学意义(P<0.05); COX-2启动子活性由空载体组的266.407×10-5±40.902×10-5下降至75.467×10-5±18.666×10-5, 两组相比具有统计学意义(P<0.05); COX-2 mRNA的相对表达量由空载体组的3.48×10-4±0.64×10-4下调至1.07×10-4±0.32×10-4, 两组相比具有统计学意义(P<0.05). 同时, Western blot结果显示, HIPK2可明显降低细胞β-catenin的蛋白表达, 上调细胞内p-β-catenin蛋白的表达量.
结论: pEGFP-N3-HIPK2可明显上调HCT-116细胞HIPK2的表达, 显著下调人结直肠癌细胞COX-2的转录表达及VEGF的表达水平, 其作用机制可能与其抑制细胞COX-2及β-catenin表达, 调节β-catenin-COX-2信号转导有关.
核心提示: 目前研究认为, 同源结构域相互作用的蛋白激酶2(homeodomain-interacting protein kinases 2)基因是一种在大肠癌细胞中低表达的抑癌基因, 我们研究发现其抑制结直肠癌细胞血管内皮生长因子表达可能与其下调细胞内环氧合酶2(cyclooxygenase 2)及β-catenin表达有关, 其详细的作用机制尚有待于进一步的研究及探讨.
引文著录: 胡强, 周利红, 刘宣, 隋华, 付晓伶, 颜琳琳, 任建琳, 李琦. HIPK2调控COX-2及β-catenin表达对人结直肠癌细胞VEGF表达的影响. 世界华人消化杂志 2014; 22(9): 1266-1274
Revised: January 13, 2014
Accepted: January 24, 2014
Published online: March 28, 2014
AIM: To study the effects of overexpression of homeodomain-interacting protein kinase 2 (HIPK2) on the expression of cyclooxygenase 2 (COX-2) and β-catenin in HCT-116 cells, and to explore the regulatory effect of the HIPK2 gene on angiogenic factor expression in human colorectal cancer cells.
METHODS: The pEGFP-N3 vector or pEGFP-N3-HIPK2 plasmid was transfected into human colorectal cancer HCT-116 cells using Lipofectamine 2000, and untransfected cells were used as normal controls. The expression of VEGF (vascular endothelial growth factor) in cell culture medium was detected by ELISA assay, and the protein expression of β-catenin was tested by Western blot. The COX-2 promoter containing plasmid pGL3-basic-COX-2 was co-transfected with pRL-SV40 in the three groups above. COX-2 promoter activity was detected by dual luciferase activity assay, and COX-2 mRNA level was determined by real-time PCR.
RESULTS: The pEGFP-N3-HIPK2 group and pEGFP-N3 group had the same fluorescent level, and there was no statistically significant difference in HCT-116 cells. The VEGF expression was significantly inhibited (857.54 pg/mL ± 65.04 pg/mL vs 368.32 pg/mL ± 98.82 pg/mL, P < 0.05) after pEGFP-N3-HIPK2 plasmid transfection. COX-2 promoter activity and mRNA expression were significantly lower in the pEGFP-N3-HIPK2 group than in the pEGFP-N3 group (75.467×10-5 ± 18.666×10-5vs 266.407×10-5 ± 40.902×10-5, 1.07×10-4 ± 0.32×10-4vs 3.48×10-4 ± 0.64×10-4P < 0.05 for both). HIPK2 could inhibit the protein expression of β-catenin but up-regulate p-β-catenin expression.
CONCLUSION: pEGFP-N3-HIPK2 transfection significantly increased the expression of HIPK2, and reduced the transcription of the COX2 gene and VEGF level in human colorectal cancer HCT-116 cells. The mechanisms may be related to the inhibition of COX-2 and β-catenin expression in cells, and regulation of β-catenin-COX-2 signal transduction.
- Citation: Hu Q, Zhou LH, Liu X, Sui H, Fu XL, Yan LL, Ren JL, Li Q. HIPK2 reduces VEGF expression by regulating expression of COX-2 and β-catenin in human colorectal cancer cells. Shijie Huaren Xiaohua Zazhi 2014; 22(9): 1266-1274
- URL: https://www.wjgnet.com/1009-3079/full/v22/i9/1266.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i9.1266
血管新生是结直肠癌发生的重要促进因素, 结直肠癌的生长、浸润、复发和转移均有赖于肿瘤血管的生成. β-catenin信号途径在肿瘤的发生、发展中占据着重要的地位, 该通路的过度激活与多种人类肿瘤的发生有密切的联系, 尤其在结直肠癌的发生、发展上, 约90%与该通路过度激活有关. 同源结构域相互作用的蛋白激酶2(homeodomain-interacting protein kinases 2, HIPK2)与肿瘤的发生发展关系密切, HIPK2能调节转录、凋亡、细胞生长和进展, 既作为转录共阻遏物又作为激酶, 而对一些功能蛋白产生影响影响. 环氧合酶2(cyclooxygenase 2, COX-2)是花生四烯酶转化为前列腺素的限速酶, 是β-catenin信号途径的下游靶基因, 在恶性肿瘤中特别是大肠癌细胞中过表达, 促进大肠癌的发生. 肿瘤细胞中HIPK2过表达可能通过调节细胞内β-catenin及COX-2的活性而下调血管内皮生长因子(vascular endothelial growth factor, VEGF)的表达, 从而对结直肠癌血管新生产生抑制作用. 本研究利用成功构建的人HIPK2基因重组质粒pEGFP-N3-HIPK2, 将重组质粒转染人结直肠癌HCT-116细胞, 观察HIPK2基因在HCT-116细胞中的表达情况及其对HCT-116细胞β-catenin-COX-2信号通路的调控作用, 以期探讨HIPK2基因对人结直肠癌细胞血管新生因子表达的调节作用, 为临床上抗结直肠癌的作用靶点研究提供思路及途径.
人结直肠癌HCT-116细胞(购自中国科学院上海细胞库), 细胞培养于含10%胎牛血清的R/MINI 1640培养基, 置于5%CO2、37 ℃及饱和湿度的培养箱中培养. pGL3-Basic-COX-2重组质粒、pRL-SV40内参质粒、pEGFP-N3载体质粒及人HIPK2基因重组质粒pEGFP-N3-HIPK2均由上海中医药大学附属曙光医院肿瘤实验室提供. HilyMax转染脂质体(购自日本同仁化学研究所); 人VEGF ELISA试剂盒(美国Bio Sources公司); Dual-Luciferase Assay System试剂盒(美国Promega公司); Rnaiso试剂、RNA的反转录试剂盒、Real-time PCR试剂盒(日本TaKaRa公司); BCA Protein Assay Kit(HyClone-Pierce, 货号: 23225); Prestained protein marker(中晶公司, 货号: SM0441); ECL-PLUS/Kit(Amersham公司货号: RPN2132); 医用X射线光片(Kodak公司); X线胶片显影粉(上海冠龙照相材料厂); X线胶片定影粉(上海冠龙照相材料厂). 双人垂直流超净工作台(新加坡ESCO公司, SVE-6A1), 台式个人型高速离心机(德国Eppendorf公司, Minispan), 台式高速冷冻离心机(德国Eppendorf公司, 5804R), 银质梯度PCR仪(德国Eppendorf公司, Mastercycler Ep), 荧光定量PCR仪(美国ABI公司, Prism® 7300型), 生物分光光度计(德国Eppendorf公司, RS-232-C), 高精确电子天平(德国Sartorious Stedim Biotech公司, CP225D), 酶标仪(美国BioRad公司, 680), 化学发光仪(美国Promega公司, GloMix 20/20), 荧光倒置显微镜(日本OLMYPUS公司, CKX41/U-RFLT50), CO2培养箱(英国RSBiotech公司, GALAXYS).
1.2.1 细胞培养: 人结直肠癌HCT-116细胞, 用含10%小牛血清的Mycoy's 5A培养基于置于体积分数5%CO2、饱和湿度、37 ℃孵箱中常规培养, 每1-2天传代一次. 传代时, 吸除瓶中培养液, 加细胞消化液1 mL, 消化贴壁细胞, 吸取培养液轻轻吹打瓶壁, 使其脱离瓶壁形成单个细胞悬液, 取对数生长期的细胞用于实验.
1.2.2 pEGFP-N3-HIPK2质粒转染细胞: 将上述常规培养的人结直肠癌HCT-116细胞随机分为空白组、载体质粒组、重组质粒组, 分别按如下剂量加入不同的质粒进行瞬时转染: (1)空白组: 正常HCT-116细胞(n = 3); (2)载体质粒组: pEGFP-N3(n = 3); (3)重组质粒组: pEGFP-N3-HIPK2 (n = 3). 在1.5 mL的离心管中配制待转染质粒(1.0 μg/孔)、转染脂质体Hily-Max(4.5 μL/孔)复合物, 将待转染质粒稀释至不含血清和抗菌素的Mycoy's 5A培养基中, 混合均匀, 然后将转染脂质体悬液, 室温温育5 min. 最后将两者混合在一起, 充分混匀静置20 min, 使质粒与脂质体充分结合. 然后直接加入到细胞培养中, 在37 ℃ 5%CO2培养箱中培养24-72 h, 荧光倒置显微镜下观察绿色荧光蛋白的表达情况.
1.2.3 pGL3-Basic-COX-2启动子质粒共转染HCT-116细胞: 将培养于含有10%新生牛血清、100 U/mL青霉素、100 μg/mL链霉素Mycoy's 5A完全培养基(37 ℃ 5%CO2、饱和湿度)的人结直肠癌HCT-116细胞株, 按1×106个细胞/孔的量在24孔板中接种指数生长期的细胞, 在37 ℃ 5%CO2培养箱中过夜培养, 直到细胞密度达到60%-80%. 将上述常规培养的人结直肠癌HCT-116细胞随机分为对照组、载体质粒处理组、重组质粒处理组, 分别按如下剂量加入不同的质粒进行瞬时转染: (1)对照组: 转染pGL3-Basic-COX-2质粒和PRL-SV40内参质粒(n = 3); (2)载体质粒处理组: 转染pGL3-Basic-COX-2质粒、PRL-SV40内参质粒和pEGFP-N3质粒(n = 3); (3)重组质粒处理组: 转染pGL3-Basic-COX-2质粒、PRL-SV40内参质粒和pEGFP-N3-HIPK2重组质粒(n = 3). 按上述分组将每一组细胞均转染含人COX-2基因启动子重组质粒和pRL-SV40内参质粒, 不同处理组分别加转染pEGFP-N3载体质粒和pEGFP-N3-HIPK2重组质粒, 转染48 h后使用化学发光法检测各组细胞的双荧光素酶活性.
1.2.4 化学发光法检测双荧光素酶活性: 将上述24孔板中转染pGL3-Basic-COX-2重组质粒和pRL-SV40内参质粒的HCT-116细胞于转染3-5 h后吸除质粒/脂质体/Mycoy's 5A复合物, 以完全培养基为空白对照, 分别在各组细胞中加入含TanIIA 4、8、12、16、20 μmol/L的Mycoy's 5A培养基, 每组设4复孔, 继续于5%CO2、37 ℃的培养箱中培养24-48 h, 一般于培养48 h后进行双荧光素酶活性. 细胞内双荧光素酶活性检测采用美国Promega公司提供的Dual-Luciferase Assay System试剂盒检测, 分别用萤火虫荧光素酶的值除以海肾荧光素酶的值, 所得到的比值(RLU1/RLU2)即可反映COX-2基因启动子的转录活性.
1.2.5 ELISA法检测细胞培养液中VEGF的表达: 取常规培养对数生长期的人结直肠癌HCT-116细胞, 0.25%的胰蛋白酶将培养瓶中的细胞消化, 用含10%小牛血清的Mycoy's 5A培养液稀释细胞, 配制成单个细胞细胞悬液, 充分混匀后调整细胞浓度至1×105/mL, 以每孔500 μL的量接种于3个24孔细胞培养板中, 置于5%CO2、饱和湿度、37 ℃培养箱中培养. 将24孔板中的人结直肠癌HCT-116细胞共分为3组, 每组4个复孔: (1)空白对照组: 加入空白培养液; (2)pEGFP-N3组: 转染pEGFP-N3质粒; (3)pEGFP-N3-HIPK2组: 转染pEGFP-N3-HIPK2质粒. 按上述分组及要求对细胞进行pEGFP-N3、pEGFP-N3-HIPK2质粒转染处理24、48 h. 作用不同时间点后, 将每孔中的细胞培养液分别收集到1.5 mL的离心管中, 5000 r/min离心5 min, 每孔各取100 μL培养液上清, 按试剂盒提供的操作步骤进行ELISA法检测细胞培养液中VEGF的表达情况.
1.2.6 Western blot检测蛋白表达: 细胞总蛋白抽提: 从培养箱中取出细胞, 弃去细胞培养液, PBS 洗涤2次, 弃去PBS, 加入适量预冷的2×Lysis Buffer, 细胞刮刮下细胞, 将样品转移入Ep管中, 冰上裂解细胞10-15 min, 超声破碎仪破碎细胞(200 W共4次, 每次5 s, 间隔2 s), 4 ℃, 12000 g, 离心15 min, 取上清, 测蛋白浓度后, 每个样品蛋白终浓度均调整为2 μg/μL, -80 ℃保存备用. 上样样品准备: 每个样品取相同总蛋白量, 加入相同体积的2×loading buffer上样缓冲液, 混匀后, 沸水浴煮5-10 min, 4 ℃存放备用. SDS-PAGE: 制胶: 根据目的蛋白分子量大小配制不同浓度的胶; 上样: 等胶凝固好后, 拔去梳子, 电泳缓冲液清洗上样孔, 将准备好的样品上样; 电泳: 30 mA电泳2 h. 免疫印迹(湿转): 电泳结束后, 使用转移电泳装置, 在4 ℃、400 mA恒流条件下电转120 min, 将蛋白转移到PVDF膜上. 免疫显色: (1)封闭: 用封闭液(含5%脱脂牛奶的TBST溶液)室温封闭PVDF膜1 h或4 ℃过夜; (2)一抗孵育: 封闭液稀释抗体, 然后与封闭好的PVDF膜室温孵育2 h或4 ℃过夜; (3)洗膜: TBST洗膜3次, 每次10 min; (4)二抗孵育: 用封闭液稀释相应的二抗, 室温下孵育PVDF膜2 h; (5)洗膜: TBST洗膜3次, 每次10 min; (6)采用Amersham公司ECL+plus™ Western blotting system试剂盒进行显色; (7)X光显影: 在暗房中进行, 获得显示条带的胶片.
1.2.7 Real-time PCR检测mRNA表达: 用RNAiso试剂提取细胞总RNA, 溶解于40-60 μL的DEPC水中, 于55 ℃-60 ℃放置10 min助溶; 紫外分光光度计测定A260/280值, 推算RNA纯度(1.8-2.0即可); 将各试剂按以下剂量加入到200 μL EP管中, 混合均匀: 5×PrimeScript Buffer 4 μL, PrimeScript RT Enzyme Mix Ⅰ 1 μL, Oligo dT Primer (50 μmol/L) 1 μL, Random 6 mers (100 μmol/L) 1 μL, Total RNA 4 μL, Rnase free water up to 20 μL, 反应条件: 37 ℃ 15 min, 85 ℃ 5 s, 反应结束所得cDNA保存于-20 ℃. 荧光定量PCR: 采用已合成的GAPDH和COX-2基因上下游引物和探针, 将上述cDNA分别按以下剂量加入到8联管中, 每个基因做12个复孔: Forward Primer 0.4 μL, Reverse Primer 0.4 μL, Probe 0.8 μL, cDNA 2 μL, Rox Reference Dye 0.4 μL, Premix EX Taq 10 μL, ddH2O up to 20 μL, 反应条件: 预变性: 95 ℃, 10 s; 变性: 95 ℃, 5 s; 退火、延伸: 60 ℃, 31 s, 40个循环, 所得到的数据采用ABI 7300 SDS软件分析. 相对mRNA表达水平的计算: 每个样本的相对mRNA表达, 能直接用样品各自的内源控制物GAPDH表达来标准化加入的初始RNA的量. 即每个样品的靶基因的相对mRNA表达水平可以用以下公式计算: 相对mRNA表达 = 2-ΔCt, (ΔCt = 靶基因Ct值-GAPDH Ct值). 以GAPDH作为内参, 同时以正常HCT-116细胞作用为基准, 各组mRNA的表达量表示成正常HCT-116细胞的N倍(N = 2-样品ΔCt/2-基准ΔCt).
统计学处理 采用SPSS18.0专用统计软件包对数据进行统计分析, 所得到的数据以mean±SD表示, 多样本均数比较用单因素方差分析; 各组两两比较采用Student-Newman-Keuls检验, 组间比较用t检验. P<0.05为差异有统计学意义.
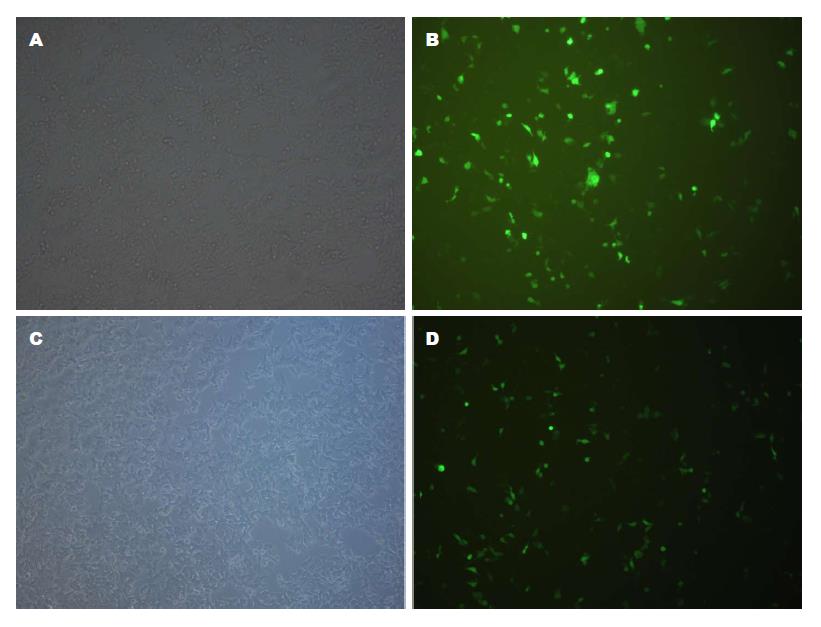
按照阳离子脂质体质粒转染技术, 将pEGFP-N3载体质粒与pEGFP-N3-HIPK2重组质粒转染人结直肠癌HCT-116细胞24 h后, 用荧光倒置显微镜观察细胞绿色荧光表达情况. 结果显示如图1所示, HIPK2基因重组质粒转染细胞12 h就可以观察到细胞表达绿色荧光, 与转染pEGFP-N3载体质粒组相比, 其表达效果无明显统计学意义(P>0.05).
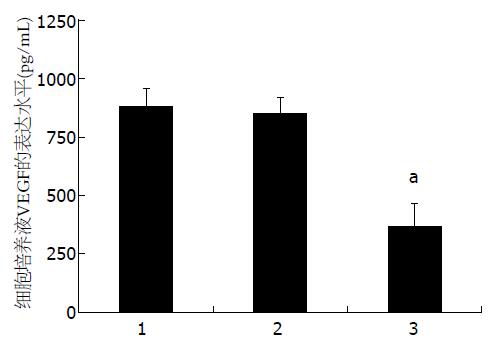
正常培养对数生长期的人结直肠癌HCT-116细胞, 分为正常组、pEGFP-N3载体质粒转染组、pEGFP-N3-HIPK2重组质粒转染组, 采用阳离子脂质体法分别进行培养液处理、转染pEGFP-N3载体质粒和转染pEGFP-N3-HIPK2重组质粒. 转染后正常培养24 h, 收集细胞上清, 采用ELISA试剂盒法检测细胞培养液中VEGF的浓度. 结果如图2所示, 空白培养液处理组和载体质粒处理组的细胞培养液中, VEGF的浓度较高, 分别为886.63 pg/mL±34.86 pg/mL和857.54 pg/mL±24.04 pg/mL, 而HIPK2重组质粒转染后, VEGF的浓度显著下调为368.32 pg/mL±27.82 pg/mL, 具有统计学意义.
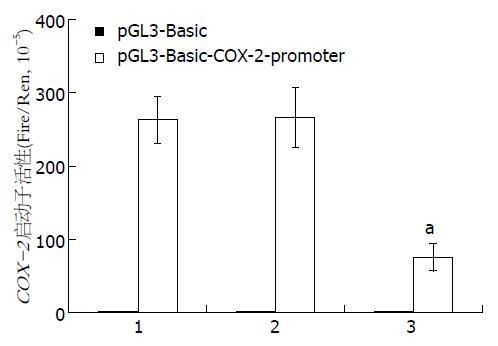
正常HCT-116细胞、转染pEGFP-N3载体质粒的HCT-116细胞和转染pEGFP-N3-HIPK2重组质粒的HCT-116细胞, 分别共转染含COX-2启动子重组质粒的pGL3-Basic-COX-2启动子, 转染48 h后使用化学发光法检测各组细胞的双荧光素酶活性、Real-time PCR法检测细胞内COX-2 mRNA的表达. 结果如图3所示, HIPK2基因能明显抑制人结直肠癌细胞萤火虫荧光素酶活性, 说明HIPK2基因抑制了细胞内COX-2启动子的转录活性, 两者相比具有明显的统计学意义. 同时, HIPK2基因对COX-2 mRNA和蛋白表达均具有抑制作用, 结果如表1所示.
| 分组 | 环氧合酶2 mRNA(×10-4) |
| 空白组 | 3.72±0.46 |
| pEGFP-N3组 | 3.48±0.64 |
| pEGFP-N3-HIPK2组 | 1.07±0.32a |
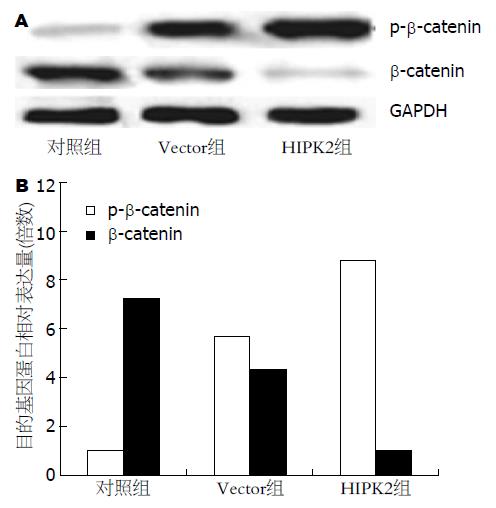
将指数生长期的HCT-116细胞接种于10 cm培养皿中, 接种密度为60%-80%, 接种6 h后, 分别进行培养液处理、转染pEGFP-N3载体质粒和转染pEGFP-N3-HIPK2重组质粒, 处理12、24、36 h后, 分别提取细胞总蛋白, 采用Western blot法检测细胞内β-catenin蛋白的表达情况, 结果如图4所示, HIPK2可以明显抑制β-catenin蛋白的表达, 上调细胞内磷酸化β-catenin蛋白p-β-catenin的表达.
肿瘤血管新生(tumor angiogenesis)或血管生成(vascularization)是实体瘤生长非常关键的因素, 恶性肿瘤的生长、浸润和转移有赖于肿瘤血管的生成. 如果没有血管新生, 原发瘤生长不会超过1-2 mm, 其继续生长必须依赖新血管的形成, 以提供足够的营养和氧, 带走代谢产物[1], 同时, 新生血管管壁不完整, 呈高通透状态, 有利于肿瘤细胞的转移. 肿瘤血管生成受两者有机调控, 一旦血管生成因子上调或血管生成抑制因子功能障碍, 二者平衡被打破即发生肿瘤血管新生[2,3]. 肿瘤细胞分泌的血管生成因子能将增强新血管生成和增殖的特殊基因激活和蛋白表达的信号传递到正常组织周围, 从而使血管内皮细胞加速分化, 产生微血管包绕到肿瘤组织周围, 从而促进肿瘤侵袭和转移. 因此, 有效调控血管生成和抑制因子间的动态平衡, 是抗肿瘤血管生成的治疗关键和作用靶点[4].
影响血管新生的因素较多, 机制极其复杂, 目前认为, 以VEGF家族和血管生成素(angiogenin, Ang)家族为代表的血管生成因子在肿瘤血管新生中扮演了重要的角色. VEGF是一种糖基化分泌性多肽因子, 分子量约4.3 kDa, 是作用最强的促血管生长因子, 能特异性刺激血管内皮细胞增殖与血管生成[5]. 可直接作用于血管内皮细胞, 刺激其有丝分裂的发生, 从而促进新血管的生成, 也可通过增加血管通透性, 使包括许多基质形成重要因子的血浆蛋白外渗, 为血管内皮细胞的迁移及肿瘤细胞的转移提供基质[6]. 已发现多种恶性肿瘤中VEGF表达增高, 并认为其与肿瘤的生长, 血管的新生有关[7]. VEGF与大肠癌的发生、发展、浸润程度及淋巴结转移关系密切, 干预VEGF的生成及其产生的作用途径或破坏其受体可抑制大肠癌肿瘤血管生成, 从而抑制大肠癌的生长、转移, 为临床治疗本病提供了新思路. Ang是与血管新生密切相关的一类血管生长调节因子, Ang-2是该家族目前已发现的4个成员(Ang-1、2、3、4)之一. Ang-2是Ang家族成员参与血管形成的早期启动、激活阶段, 通过拮抗Ang-1离断内皮细胞与血管周细胞的作用, 在VEGFÐ同下促进血管出芽、生长, 与肿瘤血管生成密切相关[8,9]. 临床病例分析表明, Ang-2在人大肠癌组织呈现过度表达, 与癌旁正常组织相比具有显著差异性(P<0.01), 证实Ang-2可能在大肠癌的发生发展中起着重要作用[10].
研究证实, VEGF和Ang-2的产生受到其上游诸多信号通路的调控和基因的介导, 特别是许多致癌基因蛋白的激活(如β-catenin、COX-2、HIF-1α等), 促进了肿瘤形成过程中VEGF和Ang-2的过表达和释放. 我们前期研究发现, 作为多数肿瘤细胞中重要的肿瘤标志基因, COX-2的过度表达能明显上调人结直肠癌HCT-116细胞VEGF的表达水平, 在促进肿瘤血管新生和侵袭转移过程中发挥着重要的作用. Kawasaki等[11]研究显示, 结直肠癌细胞中COX-2过表达与细胞质β-catenin蛋白的大量积累有关, β-catenin对于稳定细胞内COX-2 mRNA表达具有重要的作用, 并且Wnt/β-catenin通路的激活伴随着COX-2表达的大量增加. 结合本课题组的前期研究基础, 我们有理由推断Wnt/β-catenin-COX-2通路的激活是结直肠癌血管新生的重要环节, 如何对其进行调控是防治结直肠癌血管新生新的治疗靶点.
大量研究显示, Wnt/β-catenin信号途径在肿瘤的发生、发展中占据着重要的地位[12], 该通路的过度激活与多种人类肿瘤的发生有密切的联系, 尤其在大肠癌的发生、发展上, 约90%的大肠癌发生与该通路过度激活有关[13,14]. Wnt/β-catenin信号通路主要由胞膜上的Wnt受体在外界信号的刺激下, 活化胞质内散乱蛋白Dsh, Dsh被磷酸化后抑制β-catenin降解复合体, 包括结肠腺瘤性息肉病基因(adenomatous polyposis coli, APC)、Axin、糖原合成酶激酶3β(glycogen synthase kinase 3β, GSK3β)和CK1α. 降解β-catenin, β-catenin降解复合体异常(如APC或axin突变等)和β-catenin基因本身突变均可致β-catenin降解障碍, 在胞质内积累继而进入细胞核, 激活转录因子Tcf-4/LEF[15], 启动靶基因(如cyclinD1、TGF-1、MMP-7, VEGF、EGFR[16]等)的转录.
作为Wnt/β-catenin信号通路一个最基本的组成部分, 癌基因β-catenin在细胞质的积累牵涉到多种人类肿瘤及其血管新生的进程. β-catenin可被多种生化机制调节, 但具体机制尚不明确. 大多数研究认为, β-catenin信号通路可被肿瘤抑制基因APC的突变所激活, 也有部分研究认为, β-catenin本身在GSK3β磷酸化位点的突变可导致β-catenin在细胞质内的积聚, 并作为转录激活因子诱导包含于细胞生长中一些靶基因的表达. 作为β-catenin激活转录重要的靶基因, VEGF对体内外肿瘤血管新生均能产生有效的诱导作用, 肿瘤发展通常由细胞VEGF表达上调后增加对周围微血管供应所控制, 而VEGF表达的抑制作用则可以减少裸鼠体内肿瘤体积和抑制肿瘤血管新生. 因此, 探讨减少胞质β-catenin积累, 靶向调节VEGF的作用机制, 对于抑制结直肠癌血管新生具有重要意义.
1998年, Kim研究小组[17]发现了的一种新的核蛋白激酶家族, 是一个与同源结构域转录因子相互作用的保守丝氨酸/苏氨酸核激酶, 因能够增强同源蛋白转录活性, 故命名为HIPKs. 目前已知该激酶有3个亚型, 分别为HIPK1、HIPK2、HIPK3, 其中HIPK2与肿瘤的发生发展关系密切, HIPK2能调节转录、凋亡、细胞生长和进展, 既作为转录共阻遏物又作为激酶, 而对一些功能蛋白产生影响[18]. D'Orazi课题组经过近十年的研究发现, HIPK2在细胞内作为一个肿瘤抑制基因, 通过多种方式影响肿瘤的生长, 如: 促进p53的凋亡功能、抑制MDM2或CtBP抗凋亡活性、抑制HIF-1α的转录表达等[19-21].
大量研究证实[22-24], β-catenin信号转导通路中的Axin与HIPK2、p53形成一个三联复合物, 激活p53依赖的转录和凋亡. 在Wnt信号通路中, Axin和通路中的许多组份相互影响, 包括肿瘤抑制因子APC、CKIα、GSK3β和β-catenin. 因为β-catenin在Ser-37、Ser-33位点可被GSK3β磷酸化, 所以该复合物通过多重、多层次的磷酸化事件(如β-Trcp和靶向蛋白酶体降解等)促进β-catenin的降解. HIPK2能够下调cPLA2诱导的前列腺素E2产物, 而沉默HIPK2表达可以增加体内肿瘤生长和肿瘤血管生成. 同时, 最新研究显示[25-27], 肿瘤细胞中HIPK2过表达通过调控β-catenin的活性而调节VEGF、EGFR、转化生长因子-β等因子的活性, 影响肿瘤的进展.
本项目组前期对β-catenin蛋白调节VEGF对大肠癌血管新生及侵袭转移进行了大量的研究[28-30], 发现其调节受到诸多因素的影响, 但是机制尚不清楚. 研究通过前期构建的pEGFP-N3-HIPK2重组质粒转染人结直肠癌细胞, 上调HCT-116细胞内HIPK2基因的表达水平, 检测HIPK2对人结直肠癌细胞β-catenin及COX-2表达的调控作用. 研究结果显示, HIPK2基因重组质粒能在人结直肠癌细胞中稳定表达, 其表达效果与对照组相比无明显统计学意义. HIPK2可明显抑制HCT-116细胞VEGF的表达水平, 及COX-2启动子和mRNA的活性, 并下调细胞内β-catenin的蛋白表达, 促进p-β-catenin蛋白的表达水平. 根据结果, 我们可以推断, HIPK2抑制结直肠癌细胞血管内皮生长因子表达可能与其下调细胞内COX-2及β-catenin表达有关, 其详细的作用机制尚有待于进一步的研究及探讨.
血管新生是结直肠癌发生的重要促进因素, 结直肠癌的生长、浸润、复发和转移均有赖于肿瘤血管的生成. β-catenin信号途径在肿瘤的发生、发展中占据着重要的地位, 该通路的过度激活与多种人类肿瘤的发生有密切的联系, 尤其在结直肠癌的发生发展上, 约90%与该通路过度激活有关.
刘海峰, 主任医师, 北京市武警总医院消化科
Wnt/β-catenin信号通路是细胞内常见的信号通路, 在肿瘤的发生、发展中占据着重要的地位, 该通路的过度激活与多种人类肿瘤的发生有密切的联系, 尤其在大肠癌的发生、发展上, 约90%大肠癌发生与该通路过度激活有关. 癌基因β-catenin在细胞质的积累牵涉到多种人类肿瘤及其血管新生的进程, β-catenin可被多种生化机制调节, 但具体的机制尚不明确.
Kim研究小组最先发现与同源结构域转录因子相互作用的保守丝氨酸/苏氨酸核激酶-同源结构域相互作用的蛋白激酶(homeodomain-interacting protein kinases, HIPKs). 目前已知该激酶有3个亚型, 分别为HIPK1、HIPK2、HIPK3, 其中HIPK2与肿瘤的发生发展关系密切, HIPK2既作为转录共阻遏物又作为激酶, 能调节肿瘤细胞转录、凋亡、生长和进展.
本研究通过构建HIPK2基因CDS序列质粒转染人结直肠癌细胞, 发现HIPK2基因重组质粒能在人结直肠癌细胞中稳定表达, 可抑制HCT-116细胞VEGF的表达水平, 及环氧合酶2(cyclooxygenase 2, COX-2)启动子和mRNA的活性, 并下调细胞内β-catenin的蛋白表达, 促进p-β-catenin蛋白的表达水平.
将利用人HIPK2基因重组质粒pEGFP-N3-HIPK2转染人结直肠癌细胞, 观察其对肠癌细胞β-catenin-COX-2信号通路的调控作用, 探讨HIPK2基因对人结直肠癌细胞血管新生因子表达的调节作用, 为临床上抗结直肠癌的作用靶点研究提供思路及途径.
血管内皮生长因子(vascular endothelial growth factor, VEGF), 是一种糖基化分泌性多肽因子, 分子量约4.3 kDa, 是作用最强的促血管生长因子, 能特异性刺激血管内皮细胞增殖与血管生成. 可直接作用于血管内皮细胞, 刺激其有丝分裂的发生, 从而促进新血管的生成, 也可通过增加血管通透性, 使包括许多基质形成重要因子的血浆蛋白外渗, 为血管内皮细胞的迁移及肿瘤细胞的转移提供基质.
作者研究了HIPK2基因对人结直肠癌细胞血管新生因子表达的调节作用, 发现HIPK2基因抑制结直肠癌细胞血管内皮生长因子表达可能与其下调细胞COX-2及β-catenin表达有关, 为临床上抗结直肠癌的作用靶点研究提供思路及途径究. 研究设计合理、科学性较强, 有一定的创新性, 文笔流畅, 可读性好, 是一篇不错的基础研究论文.
编辑: 郭鹏 电编: 鲁亚静
| 1. | Ferrara N. VEGF and the quest for tumour angiogenesis factors. Nat Rev Cancer. 2002;2:795-803. [PubMed] [DOI] |
| 2. | Folkman J. Seminars in Medicine of the Beth Israel Hospital, Boston. Clinical applications of research on angiogenesis. N Engl J Med. 1995;333:1757-1763. [PubMed] [DOI] |
| 3. | Thompson WD, Li WW, Maragoudakis M. The clinical manipulation of angiogenesis: pathology, side-effects, surprises, and opportunities with novel human therapies. J Pathol. 2000;190:330-337. [PubMed] |
| 4. | Cherrington JM, Strawn LM, Shawver LK. New paradigms for the treatment of cancer: the role of anti-angiogenesis agents. Adv Cancer Res. 2000;79:1-38. [PubMed] [DOI] |
| 5. | Senger DR, Galli SJ, Dvorak AM, Perruzzi CA, Harvey VS, Dvorak HF. Tumor cells secrete a vascular permeability factor that promotes accumulation of ascites fluid. Science. 1983;219:983-985. [PubMed] [DOI] |
| 6. | Guo WJ, Li J, Chen Z, Zhuang JY, Gu WH, Zhang L, Pang J, Lu CH, Zhang WZ, Cheng YF. Transient increased expression of VEGF and MMP-1 in a rat liver tumor model after hepatic arterial occlusion. Hepatogastroenterology. 2004;51:381-386. [PubMed] |
| 7. | Bates DO, Harper SJ. Regulation of vascular permeability by vascular endothelial growth factors. Vascul Pharmacol. 2002;39:225-237. [PubMed] [DOI] |
| 8. | Holash J, Wiegand SJ, Yancopoulos GD. New model of tumor angiogenesis: dynamic balance between vessel regression and growth mediated by angiopoietins and VEGF. Oncogene. 1999;18:5356-5362. [PubMed] [DOI] |
| 9. | Goede V, Schmidt T, Kimmina S, Kozian D, Augustin HG. Analysis of blood vessel maturation processes during cyclic ovarian angiogenesis. Lab Invest. 1998;78:1385-1394. [PubMed] |
| 11. | Kawasaki T, Nosho K, Ohnishi M, Suemoto Y, Kirkner GJ, Dehari R, Meyerhardt JA, Fuchs CS, Ogino S. Correlation of beta-catenin localization with cyclooxygenase-2 expression and CpG island methylator phenotype (CIMP) in colorectal cancer. Neoplasia. 2007;9:569-577. [PubMed] [DOI] |
| 12. | Reya T, Clevers H. Wnt signalling in stem cells and cancer. Nature. 2005;434:843-850. [PubMed] [DOI] |
| 13. | Thorstensen L, Lind GE, Løvig T, Diep CB, Meling GI, Rognum TO, Lothe RA. Genetic and epigenetic changes of components affecting the WNT pathway in colorectal carcinomas stratified by microsatellite instability. Neoplasia. 2005;7:99-108. [PubMed] [DOI] |
| 14. | Tetsu O, McCormick F. Beta-catenin regulates expression of cyclin D1 in colon carcinoma cells. Nature. 1999;398:422-426. [PubMed] [DOI] |
| 15. | Shimokawa T, Furukawa Y, Sakai M, Li M, Miwa N, Lin YM, Nakamura Y. Involvement of the FGF18 gene in colorectal carcinogenesis, as a novel downstream target of the beta-catenin/T-cell factor complex. Cancer Res. 2003;63:6116-6120. [PubMed] |
| 16. | Tan X, Apte U, Micsenyi A, Kotsagrelos E, Luo JH, Ranganathan S, Monga DK, Bell A, Michalopoulos GK, Monga SP. Epidermal growth factor receptor: a novel target of the Wnt/beta-catenin pathway in liver. Gastroenterology. 2005;129:285-302. [PubMed] [DOI] |
| 17. | Kim YH, Choi CY, Lee SJ, Conti MA, Kim Y. Homeodomain-interacting protein kinases, a novel family of co-repressors for homeodomain transcription factors. J Biol Chem. 1998;273:25875-25879. [PubMed] [DOI] |
| 18. | Pierantoni GM, Bulfone A, Pentimalli F, Fedele M, Iuliano R, Santoro M, Chiariotti L, Ballabio A, Fusco A. The homeodomain-interacting protein kinase 2 gene is expressed late in embryogenesis and preferentially in retina, muscle, and neural tissues. Biochem Biophys Res Commun. 2002;290:942-947. [PubMed] [DOI] |
| 19. | D'Orazi G, Cecchinelli B, Bruno T, Manni I, Higashimoto Y, Saito S, Gostissa M, Coen S, Marchetti A, Del Sal G. Homeodomain-interacting protein kinase-2 phosphorylates p53 at Ser 46 and mediates apoptosis. Nat Cell Biol. 2002;4:11-19. [PubMed] [DOI] |
| 20. | Di Stefano V, Blandino G, Sacchi A, Soddu S, D'Orazi G. HIPK2 neutralizes MDM2 inhibition rescuing p53 transcriptional activity and apoptotic function. Oncogene. 2004;23:5185-5192. [PubMed] [DOI] |
| 21. | Nardinocchi L, Puca R, Guidolin D, Belloni AS, Bossi G, Michiels C, Sacchi A, Onisto M, D'Orazi G. Transcriptional regulation of hypoxia-inducible factor 1alpha by HIPK2 suggests a novel mechanism to restrain tumor growth. Biochim Biophys Acta. 2009;1793:368-377. [PubMed] [DOI] |
| 22. | Rubinfeld B, Albert I, Porfiri E, Fiol C, Munemitsu S, Polakis P. Binding of GSK3beta to the APC-beta-catenin complex and regulation of complex assembly. Science. 1996;272:1023-1026. [PubMed] [DOI] |
| 23. | Ikeda S, Kishida S, Yamamoto H, Murai H, Koyama S, Kikuchi A. Axin, a negative regulator of the Wnt signaling pathway, forms a complex with GSK-3beta and beta-catenin and promotes GSK-3beta-dependent phosphorylation of beta-catenin. EMBO J. 1998;17:1371-1384. [PubMed] [DOI] |
| 24. | Liu C, Li Y, Semenov M, Han C, Baeg GH, Tan Y, Zhang Z, Lin X, He X. Control of beta-catenin phosphorylation/degradation by a dual-kinase mechanism. Cell. 2002;108:837-847. [PubMed] [DOI] |
| 25. | Puca R, Nardinocchi L, D'Orazi G. Regulation of vascular endothelial growth factor expression by homeodomain-interacting protein kinase-2. J Exp Clin Cancer Res. 2008;27:22. [PubMed] [DOI] |
| 26. | Shang Y, Doan CN, Arnold TD, Lee S, Tang AA, Reichardt LF, Huang EJ. Transcriptional corepressors HIPK1 and HIPK2 control angiogenesis via TGF-β-TAK1-dependent mechanism. PLoS Biol. 2013;11:e1001527. [PubMed] [DOI] |
| 27. | Hofmann TG, Stollberg N, Schmitz ML, Will H. HIPK2 regulates transforming growth factor-beta-induced c-Jun NH(2)-terminal kinase activation and apoptosis in human hepatoma cells. Cancer Res. 2003;63:8271-8277. [PubMed] |
| 28. | 刘 宣, 王 炎, 李 丹光, 周 利红, 殷 佩浩, 隋 华, 范 忠泽, 李 琦. 丹参酮IIA对COX-2激活Wnt β-catenin信号通路介导的人肠癌细胞VEGF表达的调控作用. 中华中医药杂志. 2013;28:108-112. |