修回日期: 2014-01-13
接受日期: 2014-01-18
在线出版日期: 2014-03-28
目的: 研究双氢青蒿素联合吉西他滨抗胰腺癌作用及其机制.
方法: 构建裸鼠胰腺癌移植瘤模型, 按治疗用药随机分为对照组(C组)、双氢青蒿素组(D组)、吉西他滨组(G组)、联合用药组(D+G组). 各组均采取腹腔注射药物, 4 d 1次, 前后共5次. 观察各组用药过程中肿瘤体积的变化. 末次用药后4 d处死裸鼠取肿瘤组织. 采用Tunel法检测各组肿瘤组织凋亡情况. 采用Western blot法检测肿瘤组织凋亡相关蛋白Bcl-2和C-myc的表达变化.
结果: 联合用药组肿瘤体积明显小于其他各组(P<0.05); Tunel法显示联合用药组肿瘤细胞凋亡比其余各组显著增多(P<0.05); Western blot法显示联合用药组凋亡相关蛋白Bcl-2和C-myc的表达比其余各组明显降低(P<0.05).
结论: 双氢青蒿素联合吉西他滨能明显抑制裸鼠SW1990细胞皮下移植瘤的生长,其机制可能是抑制细胞中凋亡相关蛋白Bcl-2和C-myc的表达.
核心提示: 双氢青蒿素联合吉西他滨能显著抑制裸鼠胰腺癌移植瘤的生长并具有化疗增敏作用, 其机制可能是下调胰腺癌移植瘤组织中Bcl-2和C-myc蛋白的表达, 从而促进胰腺癌的凋亡有关.
引文著录: 吴伟林, 郑继行, 陈玲玲, 蔡振寨, 薛战雄. 双氢青蒿素联合吉西他滨治疗胰腺癌及其机制. 世界华人消化杂志 2014; 22(9): 1256-1261
Revised: January 13, 2014
Accepted: January 18, 2014
Published online: March 28, 2014
AIM: To investigate the anticancer effect of dihydroartemisinin combined with gemcitabine against pancreatic cancer in mice and the possible mechanisms involved.
METHODS: A xenograft model of SW1990 pancreatic cancer was developed in nude mice. Model mice were randomized into four groups according to the drug(s) injected: C (normal saline), D (dihydroartemisinin), G (gemcitabine), and D + G (dihydroartemisinin + gemcitabine). All groups underwent intraperitoneal injection of the corresponding drug(s) once every 4 days for a total of 5 times. Tumor volume was measured during the drug therapy. The mice were sacrificed 4 d after the last drug injection. TUNEL assay was used to detect the apoptosis of tumor cells. Western blot was used to detect the protein expression of Bcl-2 and C-myc.
RESULTS: The average tumor volume in group D + G was significantly decreased compared with the other groups. TUNEL assay showed that group D + G presented with apparently more apoptosis than the other groups. Western blot analysis showed the expression of Bcl-2 and C-myc in group D + G was significantly down-regulated compared with the other groups.
CONCLUSION: Dihydroartemisinin combined with gemcitabine can significantly decrease pancreatic cancer xenograft growth in nude mice possibly via mechanisms related to the down-regulation of Bcl-2 and C-myc expression.
- Citation: Wu WL, Zheng JX, Chen LL, Cai ZZ, Xue ZX. Effect of dihydroartemisinin combined with gemcitabine for treatment of pancreatic cancer in mice. Shijie Huaren Xiaohua Zazhi 2014; 22(9): 1256-1261
- URL: https://www.wjgnet.com/1009-3079/full/v22/i9/1256.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i9.1256
近年来, 胰腺癌发病率有上升趋势, 在西方国家中, 胰腺癌是恶性肿瘤的第4位死因, 由于早期诊断困难, 胰腺癌发现时大多已失去手术机会, 因此大多数胰腺癌患者需要选择包括化疗在内的辅助治疗[1]. 美国国立综合癌症网络(National Comprehensive Cancer Network, NCCN)和欧洲肿瘤学协会临床指南均把吉西他滨作为胰腺癌的第一线化疗药物. 但在长期的临床应用中发现, 单用吉西他滨效果仍不理想, 总有效率<20%[2], 原因主要在于胰腺癌细胞获得性或内在的耐药性. 寻求高效低毒的新型抗肿瘤药物或化疗增敏剂成了肿瘤研究亟待解决的问题.
青蒿素是我国传统的中草药, 他在抗疟方面的卓越成效, 挽救了数以亿万计的生命, 青蒿素在抗肿瘤方面的疗效也同样令人瞩目. 近年来研究发现, 青蒿素具有显著的抗癌作用, 并且具有化疗增敏作用[3-6]. 有报道双氢青蒿素在体外或者体内均能通过抑制细胞核因子(nuclear factor κB, NF-κB)信号通路促进吉西他滨对胰腺癌的化疗效果[7], 但目前研究大多基于细胞株的体外研究, 青蒿素抗胰腺癌的体内研究较少.
本研究构建裸鼠胰腺癌移植瘤模型, 探讨双氢青蒿素联合吉西他滨治疗胰腺癌的效果并初步探讨两药协同作用的机制.
人胰腺癌细胞株SW1990购自中国科学院细胞库(中国科学院上海生命科学研究院细胞资源中心). SW1990细胞培养于37 ℃含5%CO2、37 ℃培养箱中, 使用含10%胎牛血清、100 U/mL青霉素和100 U/mL链霉素的DMEM细胞单层贴壁生长至70%-80%融合时胰蛋白酶消化传代. ♀4-6周龄健康Balb/c小鼠, 体质量18-20 g购自中科院上海实验动物中心, 饲养于SPF环境中层流架内; 饲养和处理经温州医学院动物伦理委员会审批并通过. 双氢青蒿素购自中国药品生物制品检定所, 使用DMSO溶解, DMSO终浓度≤1‰; 盐酸吉西他滨注射液(健择)购自法国Lilly公司, 使用生理盐水溶解. DMEM、胎牛血清、含0.25%EDTA的胰蛋白酶、不含0.25%EDTA的胰蛋白酶、青链霉素为Gibco公司产品; TRIzol试剂为美国Invitrogen公司产品; 原位细胞凋亡检测(Tunel检测)试剂盒为瑞士Roche公司产品; 兔抗人Bcl-2多克隆抗体、鼠抗人C-myc单克隆抗体、鼠抗人β-actin单克隆抗体、羊抗兔二抗、羊抗鼠二抗为美国abcam公司. 3111型CO2细胞培养箱(美国, ThermoForma公司); 细胞培养瓶(美国, Corning公司); 石蜡包埋机、病理切片机(Leika公司); 电子天平(瑞士, Mettler Toledo公司); CH20-BIM光学显微镜(日本, 奥林巴斯); 放射自显影暗盒(乐¿胶片集团有限公司); 超净工作台、电热恒温水浴箱、电烤箱、立式高压蒸汽灭菌器(上海医疗设备厂); 3K15型台式冷冻离心机美国(Sigma公司); 微量移液器(德国, Eppendorf公司); 垂直蛋白电泳装置和垂直型蛋白电泳槽转膜装置(美国, Bio-Rad公司).
1.2.1 人胰腺癌细胞株SW1990的培养: 人胰腺癌细胞SW1990细胞培养于37 ℃含5%CO2饱和湿度的培养箱中, 使用含10%胎牛血清、100 U/mL青霉素和100 U/mL链霉素的DMEM, 细胞单层贴壁生长至70%-80%融合时胰蛋白酶消化传代.
1.2.2 胰腺癌裸鼠模型的建立: 胰蛋白酶消化对数生长期SW1990细胞, 用含10%胎牛血清的完全培养基终止消化, 离心后(1000 r/min, 5 min)将细胞用不含血清的DMEM培养基洗涤1次, 再次离心将细胞混匀于不含血清的DMEM培养基中. 将SW1990细胞悬液注射于裸小鼠背部靠近后肢部位的皮下, 每只鼠约注射4×106个细胞.
1.2.3 实验分组及用药: 当裸鼠移植瘤长径4-6 mm时, 将裸鼠随机分成4组, 分别为对照组(C、生理盐水组)、双氢青蒿素组(D)、吉西他滨组(G)和联合组(D+G), 每组15只. 对照组腹腔注射同量生理盐水, 双氢青蒿素组腹腔注射双氢青蒿素(40 mg/kg), 吉西他滨组腹腔注射吉西他滨(125 mg/kg), 联合组为腹腔注射双氢青蒿素(40 mg/kg)和吉西他滨(80 mg/kg). 分组当天即开始用药, 随后4 d 1次, 前后共5次, 末次用药4 d后处死裸鼠. 并且从分组当天开始每4 d测一次裸鼠体质量, 每次均在注射药物前测体质量, 以此体质量为标准进行用药, 并用游标卡尺测量1次皮下瘤的大小, 包括长径a(mm)和短径b(mm), 并计算皮下瘤的体积, 体积(V) = 4/3×π×r3, r = (a+b)/4. 处死之前最后测一次瘤体体积和裸鼠体质量, 前后共测量6次裸鼠体质量和瘤体大小. 末次用药4 d后用水合氯醛麻醉裸鼠, 取出瘤体组织称质量, 分取部分瘤体组织置于40 g/L甲醛固定液, 石蜡包埋, 行Tunel法检测, 并留取剩余部分新鲜肿瘤组织存于液氮中供Western blot法使用.
1.2.4 Tunel法检测肿瘤细胞凋亡: 取固定好的肿瘤组织, 经脱水、透明、浸蜡、4 μm包埋切片、贴片、烘片. 按Tunel试剂盒所示操作步骤进行操作, 最后加Tunel反应液37 ℃孵育1 h后中性树胶封片, 用光学显微镜400倍下进行观察拍照; 取10个高倍视野, 数每个高倍视野下凋亡细胞数, 再取平均值; 将对照组凋亡细胞数调整为1, 计算双氢青蒿素组、吉西他滨组、双氢青蒿素+吉西他滨组相对凋亡值. 阳性对照样本处理: 样本经蛋白酶K处理、PBS浸洗后, 再加入100 μL DNase Ⅰ反应液, 37 ℃处理30 min, 其余步骤同待检样本. 阴性对照样本处理: 在标记反应制备TdT酶反应液时, 不添加TdT酶, 其余步骤均相同.
1.2.5 Western blot法检测C-myc、Bcl-2蛋白表达: 用RIPA裂解液试剂盒说明书提取新鲜瘤体组织中的总蛋白, 按照BCA蛋白浓度测定试剂盒(碧云天)测定总蛋白浓度. 将定量后的蛋白质样品以每孔30 μg点样于SDS-PAGE凝胶上样孔中, 200 V电泳至溴酚蓝迁移到距分离胶底部0.5 cm处, 300 mA转膜45 min, 将转好的硝酸纤维素膜至于5%的脱脂奶粉中, 室温振荡封闭2 h, 加入一抗, 4 ℃孵育过夜, TBS缓冲液漂洗3次, 每次10 min, 再加入二抗, 37 ℃于摇床孵育1 h, TBS缓冲液漂洗3次, 每次10 min, 化学发光显影, 胶片曝光, AlphaEaseFC扫描分析软件系统检测条带灰度值, 以目的蛋白与内参蛋白比值作为蛋白相对表达量. 阴性对照组不加一抗, 其余步骤相同, 阳性对照为Miapaca-2胰腺癌细胞, 本研究组先前已经验证该细胞系表达C-myc、Bcl-2蛋白, 将β-actin作为内参对照.
统计学处理 实验数据结果用mean±SD表示, 采用SPSS17.0软件ANOVA方差分析进行统计分析. P<0.05为差异有统计学意义.
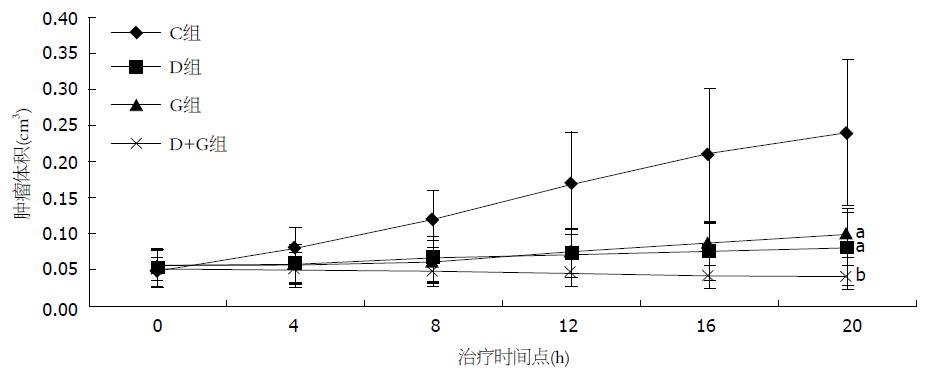
随机分组当天C组、D组、G组及D+G组瘤体平均体积分别为0.048 cm3±0.018 cm3、0.052 cm3±0.02 cm3、0.056 cm3±0.026 cm3及0.051 cm3±0.024 cm3, 各组裸鼠移植瘤体积比较无显著差异(P>0.05). 用药20 d后处死裸鼠取肿瘤, C组、D组、G组及D+G组瘤体平均体积分别为0.24 cm3±0.01 cm3、0.08 cm3±0.034 cm3、0.1 cm3±0.05 cm3及0.04 cm3±0.017 cm3. 与C组相比, D组与G组的瘤体平均体积明显减小(P<0.05), 但D+G组抑制肿瘤的作用更为明显(P<0.01)(图1).
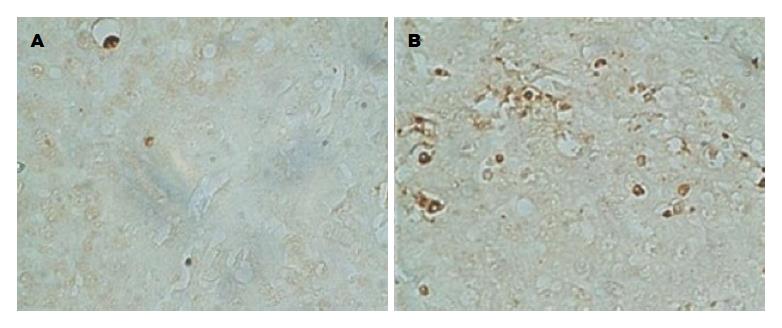
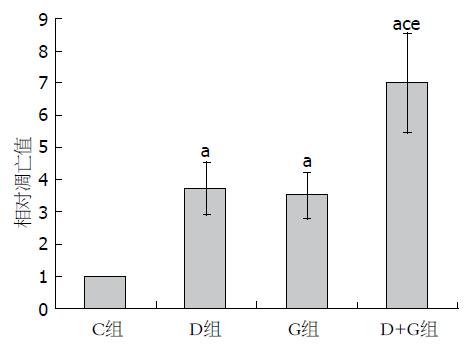
在光学显微镜下, Tunel染色法阳性对照组凋亡细胞表现为棕黄色(或者棕褐色)为细胞核染色, 细胞核突出在细胞边缘; 对照组细胞不显色. C组凋亡细胞稀少(图2A), D组、G组、D+G组(图2B)凋亡细胞明显增加. 随机选取10个高倍视野(×400), 数每个高倍视野下凋亡细胞数, 再取平均值; 将C组凋亡细胞数调整为1, D组和G组相对凋亡值分别为3.7±0.8和3.5±0.7, 均显著高于C组(P<0.05); D+G组相对凋亡值为7.0±1.5, 显著高于其他3组(P<0.05)(图3).
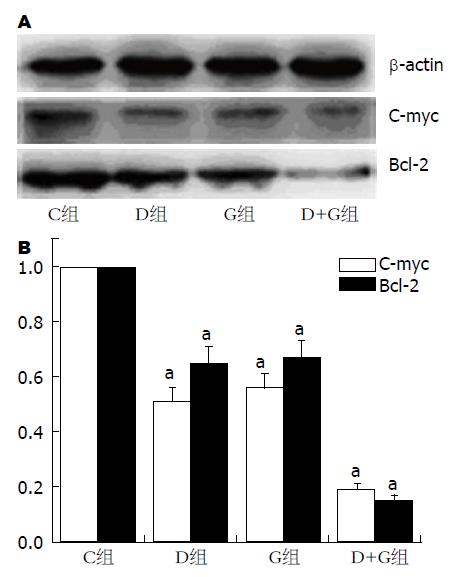
阴性对照组未表达目的蛋白, 阳性对照组表达目的蛋白. 与对照组(C)相比较, 双氢青蒿素组(D)和吉西他滨组(G)均能抑制C-myc和Bcl-2的表达(P<0.05), 与其他三组相比, 双氢青蒿素联合吉西他滨组(D+G)明显地下调C-myc和Bcl-2蛋白的表达(P<0.05)(图4).
手术治疗是胰腺癌治疗的首选方法, 但多数患者在确诊时已达局部晚期或有远处转移而失去手术机会. 大多数胰腺癌主要治疗手段是化疗. 吉西他滨是一种脱氧胞苷的水溶性类似物, 是细胞周期特异性的抗代谢类药物, 主要作用于DNA合成期的肿瘤细胞, 即S期细胞, 在一定条件下, 可阻止肿瘤细胞从Gl期向S期的进展. 吉西他滨治疗胰腺癌患者在减轻疼痛和改善生活质量方面具有一定的作用, 已被广泛接受作为晚期胰腺癌化疗的标准用药[8], 但吉西他滨在临床应用中也存在许多不足: (1)只能起到有限的姑息治疗作用, 对胰腺癌的缓解率低, 只有10%左右[9,10], 即便作为根治术后辅助化疗药, 其中位生存时间也只有22.1 mo[11]; (2)多数胰腺癌会逐渐对吉西他滨产生耐药性; (3)作为一种化疗药物, 存在一些较强的不良反应, 长期用药对人体会造成一定的伤害; (4)价格昂贵, 长期使用困难. 由于上述原因, 吉西他滨对胰腺癌化疗的临床应用受到了极大的限制. 青蒿素是我国药学工作者于20世纪70年代初从植物黄花蒿中分离得到的有效抗疟疾药物, 主要分布在植物的叶中. 双氢青蒿素是青蒿素类药物在体内的主要活性代谢产物, 也是青蒿素的一个重要衍生物. 双氢青蒿素在抗肿瘤方面的作用逐渐成为研究的热点. 先前研究表明双氢青蒿素能够明显抑制胰腺癌细胞的增殖[12]. 但青蒿素抗胰腺癌作用的体内研究较少. 本研究在裸鼠移植瘤动物模型基础上发现双氢青蒿素和吉西他滨联合用药组的瘤体体积明显小于对照组及单用双氢青蒿素组和吉西他滨组, 而且联合用药组吉西他滨使用剂量减少, 表明双氢青蒿素联合吉西他滨具有显著抗胰腺癌作用, 并且两者具有协同作用.
青蒿素的抗肿瘤作用主要包括促进肿瘤细胞凋亡、抑制肿瘤细胞增殖、抑制肿瘤血管形成及逆转肿瘤多药耐药等机制[13]. 诱导肿瘤细胞凋亡是青蒿素抗肿瘤效应的重要机制之一. 我们采用Tunel方法检测双氢青蒿素和吉西他滨单用或联合使用对胰腺癌裸鼠移植瘤组织SW1990细胞凋亡的影响, 结果显示, 双氢青蒿素组、吉西他滨组与对照组相比, 凋亡细胞明显增多, 而双氢青蒿素联合吉西他滨组的凋亡细胞比其他三组均明显增多, 提示双氢青蒿素和吉西他滨均可通过诱导肿瘤细胞凋亡抑制胰腺癌裸鼠移植瘤的生长, 两者联合使用不仅效应增强, 而且吉西他滨使用剂量明显减少, 说明二氢青蒿素除了具有诱导肿瘤细胞凋亡作用, 还具有吉西他滨化疗增敏作用.
细胞凋亡是一种多基因和细胞因子调控的过程, 具有代表性的是Bcl-2基因家族和c-myc基因家族, 已经证明原癌基因, 如Bcl-2基因家族和c-myc基因家族等, 均参与细胞凋亡的精确调控. 现已发现, Bcl-2蛋白是典型的抑制细胞细胞凋亡的蛋白, 而且Bcl-2基因家族调节多种化疗药物的促凋亡作用, Bcl-2的过表达跟多种肿瘤对化疗药物的耐药性有关. 高表达Bcl-2蛋白的患者预示着胰腺癌预后不良[14]. c-myc基因是凋亡调控的重要基因, 高表达c-myc基因的肿瘤细胞凋亡受阻[15], 在某些情况下如与致癌基因同时存在时C-myc则可协同Bcl-2导致肿瘤的发生. NF-κB信号通路活化后能能使其下游基因c-myc、cyclin D1、bcl-2、bcl-xL表达增加, 细胞凋亡受到抑制, 从而产生耐药, 二氢青蒿素能逆转吉西他滨诱导NF-κB信号通路的活化, 从而改善吉西他滨化疗效应[7]. 本实验结果显示, 双氢青蒿素和吉西他滨联合治疗可使胰腺癌移植瘤组织Bcl-2和C-myc蛋白表达明显下调, 说明二氢青蒿素与吉西他滨具有协同治疗作用, 与文献报道相符.
总之, 双氢青蒿素联合吉西他滨能显著抑制裸鼠胰腺癌移植瘤的生长, 其机制可能是下调胰腺癌移植瘤组织中Bcl-2和C-myc蛋白的表达, 从而促进胰腺癌的凋亡有关.
胰腺癌预后差, 发现时大多属晚期, 化疗是目前改善胰腺癌预后的重要措施, 但由于肿瘤耐药, 目前胰腺癌的化疗效果仍不理想. 青蒿素具有显著的抗肿瘤效应, 且具有逆转肿瘤耐药的作用.
肖恩华, 教授, 中南大学湘雅二医院放射教研室
青蒿素抗肿瘤效应及其机制是目前中医药抗肿瘤研究的热点之一, 但青蒿素联合吉西他滨治疗胰腺癌的研究及其机制目前报道较少.
Wang等报道双氢青蒿素在体外或者体内研究中均能通过抑制核因子-κB信号通路促进吉西他滨对胰腺癌的化疗效果.
本文探讨双氢青蒿素联合吉西他滨治疗胰腺癌的移植瘤体内研究及其机制, 丰富和完善了青蒿素类中药抗肿瘤作用机制.
本研究为青蒿素类中药用于胰腺癌的治疗提供实验基础, 青蒿素逆转肿瘤耐药的机制需要进一步研究, 将来青蒿素可能作为逆转肿瘤耐药的辅助用药进入临床使用.
本文显示双氢青蒿素联合吉西他滨能明显抑制裸鼠胰腺癌移植瘤的生长, 有可能为临床治疗带来新的希望.
编辑: 田滢 电编: 鲁亚静
| 2. | Tada M, Arizumi T, Nakai Y, Sasaki T, Kogure H, Togawa O, Matsubara S, Tsujino T, Hirano K, Sasahira N. Efficacy of gemcitabine for locally advanced pancreatic cancer: comparison with 5-fluorouracil-based chemoradiotherapy. Chemotherapy. 2008;54:302-308. [PubMed] [DOI] |
| 3. | Zhao C, Gao W, Chen T. Synergistic induction of apoptosis in A549 cells by dihydroartemisinin and gemcitabine. Apoptosis. 2013; Dec 13. [Epub ahead of print]. [PubMed] |
| 4. | Hu CJ, Zhou L, Cai Y. Dihydroartemisinin induces apoptosis of cervical cancer cells via upregulation of RKIP and downregulation of bcl-2. Cancer Biol Ther. 2013; Dec 11. [Epub ahead of print]. [PubMed] |
| 5. | Wang SJ, Sun B, Pan SH, Chen H, Kong R, Li J, Xue DB, Bai XW, Jiang HC. [Experimental study of the function and mechanism combining dihydroartemisinin and gemcitabine in treating pancreatic cancer]. Zhonghua Waike Zazhi. 2010;48:530-534. [PubMed] |
| 6. | Kong R, Jia G, Cheng ZX, Wang YW, Mu M, Wang SJ, Pan SH, Gao Y, Jiang HC, Dong DL. Dihydroartemisinin enhances Apo2L/TRAIL-mediated apoptosis in pancreatic cancer cells via ROS-mediated up-regulation of death receptor 5. PLoS One. 2012;7:e37222. [PubMed] [DOI] |
| 7. | Wang SJ, Gao Y, Chen H, Kong R, Jiang HC, Pan SH, Xue DB, Bai XW, Sun B. Dihydroartemisinin inactivates NF-kappaB and potentiates the anti-tumor effect of gemcitabine on pancreatic cancer both in vitro and in vivo. Cancer Lett. 2010;293:99-108. [PubMed] [DOI] |
| 8. | Tempero MA, Behrman S, Ben-Josef E, Benson AB, Cameron JL, Casper ES, Hoffman JP, Karl RC, Kim P, Koh WJ. Pancreatic adenocarcinoma: Clinical Practice Guidelines in Oncology. J Natl Compr Canc Netw. 2005;3:598-626. [PubMed] |
| 9. | Burris HA, Moore MJ, Andersen J, Green MR, Rothenberg ML, Modiano MR, Cripps MC, Portenoy RK, Storniolo AM, Tarassoff P. Improvements in survival and clinical benefit with gemcitabine as first-line therapy for patients with advanced pancreas cancer: a randomized trial. J Clin Oncol. 1997;15:2403-2413. [PubMed] |
| 10. | Burris H, Storniolo AM. Assessing clinical benefit in the treatment of pancreas cancer: gemcitabine compared to 5-fluorouracil. Eur J Cancer. 1997;33 Suppl 1:S18-S22. [PubMed] |
| 11. | Oettle H, Post S, Neuhaus P, Gellert K, Langrehr J, Ridwelski K, Schramm H, Fahlke J, Zuelke C, Burkart C. Adjuvant chemotherapy with gemcitabine vs observation in patients undergoing curative-intent resection of pancreatic cancer: a randomized controlled trial. JAMA. 2007;297:267-277. [PubMed] |
| 13. | 陆 金健, 黄 鸣清, 陈 修平, 王 一涛. 二氢青蒿素抗肿瘤作用及其机制研究进展. 中国药理学与毒理学杂志. 2012;26:397-401. |
| 14. | Sinicrope FA, Evans DB, Leach SD, Cleary KR, Fenoglio CJ, Lee JJ, Abbruzzese JL. bcl-2 and p53 expression in resectable pancreatic adenocarcinomas: association with clinical outcome. Clin Cancer Res. 1996;2:2015-2022. [PubMed] |
| 15. | Lu JJ, Meng LH, Shankavaram UT, Zhu CH, Tong LJ, Chen G, Lin LP, Weinstein JN, Ding J. Dihydroartemisinin accelerates c-MYC oncoprotein degradation and induces apoptosis in c-MYC-overexpressing tumor cells. Biochem Pharmacol. 2010;80:22-30. [PubMed] [DOI] |