修回日期: 2014-01-14
接受日期: 2014-01-24
在线出版日期: 2014-03-18
目的: 检测人前梯度蛋白2(anterior gradient-2, AGR2)在结肠癌组织中的表达及其与结肠癌临床病理参数之间关系.
方法: 采用半定量反转录-聚合酶链反应(semi-quantitative RT-PCR)检测结肠癌及癌旁正常组织中AGR2 mRNA表达情况, 应用蛋白质印迹(Western blot)、免疫组织化学S-P法检测结肠癌及癌旁正常组织中AGR2蛋白的表达情况, 并结合临床病理参数进行分析.
结果: 半定量PCR及Western blot结果显示, AGR2 mRNA及蛋白在结肠癌的表达水平均明显高于癌旁正常组织(mRNA: 0.95±0.03 vs 0.21±0.06, P<0.05; 蛋白: 0.93±0.03 vs 0.31±0.02, P<0.05); 免疫组织化学结果显示, AGR2在结肠癌组织中阳性表达率明显高于癌旁正常组织(75% vs 29.4%, P<0.05), AGR2在结肠癌组织中的表达与年龄、性别无相关性(P>0.05), 与Dukes分期、组织学分级、淋巴结转移均显著相关(P<0.05).
结论: AGR2在结肠癌组织中的表达上调可能与结肠癌的发生、发展、转移相关, 有望成为结肠癌的早期诊断指标.
核心提示: 本研究发现人前梯度蛋白2(anterior gradient-2, AGR2)mRNA及蛋白在结肠癌组织中的表达明显高于癌旁正常组织, 且与淋巴结转移相关, 提示AGR2在结肠癌组织中的表达上调可能与结肠癌的发生、发展、转移相关, 有望成为结肠癌的早期诊断指标.
引文著录: 李涵, 王进, 杨丽敏, 宁寒冰. 人前梯度蛋白2在结肠癌组织中的表达及其意义. 世界华人消化杂志 2014; 22(8): 1064-1069
Revised: January 14, 2014
Accepted: January 24, 2014
Published online: March 18, 2014
AIM: To investigate the expression of anterior gradient-2 (AGR2) in colon adenocarcinoma and the relationship between AGR2 expression and clinicopathological features of colon adenocarcinoma.
METHODS: AGR2 mRNA and protein expression in colon adenocarcinoma and tumor-adjacent non-cancerous tissues was detected by semi-quantitative RT-PCR, Western blot and immunohistochemistry.
RESULTS: The expression of AGR2 mRNA and protein in colon adenocarcinoma was significantly higher than that in tumor-adjacent non-cancerous tissues (0.95 ± 0.03 vs 0.21 ± 0.06, 0.93 ± 0.03 vs 0.31 ± 0.02, P < 0.05 for both). The positive rate of AGR2 expression in colon adenocarcinoma was significantly higher than that in tumor-adjacent non-cancerous tissues (75% vs 29.4%, P < 0.05). The expression of AGR2 was correlated with Dukes stage, histopathological grade and lymph node metastasis (P < 0.05 for all), but not with other clinicopathologic factors.
CONCLUSION: Our findings indicate that the expression of AGR2 is closely related to the tumorigenesis, progression and metastasis of colon adenocarcinoma. AGR2 may be used as a diagnostic marker for colon adenocarcinoma.
- Citation: Li H, Wang J, Yang LM, Ning HB. Clinical significance of expression of anterior gradient-2 in colon adenocarcinoma. Shijie Huaren Xiaohua Zazhi 2014; 22(8): 1064-1069
- URL: https://www.wjgnet.com/1009-3079/full/v22/i8/1064.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i8.1064
结肠癌是临床常见的恶性肿瘤之一, 在我国常见恶性肿瘤中, 发病率位于第5位[1], 且具有逐年升高趋势, 因此结肠癌早期诊断日益重要. 众多研究发现人前梯度蛋白2(anterior gradient-2, AGR2)在多种人类肿瘤中过表达[2-7], 与肿瘤形成和转移密切相关[8-10]. 最近研究发现前列腺癌组织中AGR2异常表达, 而且AGR2在前列腺癌患者尿液中过表达[11]. 基于AGR2在一些肿瘤组织中过表达及易于检测等性质, AGR2可作为潜在的肿瘤检测指标进一步研究. 国外最新研究发现在结肠癌患者外周血中AGR2 mRNA明显升高[12], 且在多数结肠癌细胞系中AGR2高表达[13]. 目前AGR2在结肠癌组织中表达情况尚未见相关文献报道, 本实验采用半定量PCR、免疫印迹、免疫组织化学方法, 检测AGR2在结肠癌组织中的表达情况, 探讨其在结肠癌发生、发展过程中的作用及临床意义.
收集郑州大学第一附属医院2012-10/2013-05结肠癌手术切除标本68例, 所有标本收集均经患者同意并签署知情同意书, 并通过伦理委员会批准. 每例标本取材于癌组织及其癌旁组织(距癌灶边缘5.0 cm及以上), 液氮10 min后置于-80 ℃保存, 所有患者诊断均经病理证实, 术前均未接受过放疗、化疗和生物治疗. 其中男33例, 女35例, 年龄32-84岁, 中位年龄55.4岁. Duke分期分为A期15例、B期16例、C期29例、D期8例. 按分化程度分为高分化17例、中分化28例、低分化23例. 淋巴结转移32例, 无淋巴结转移36例. 取其中32例淋巴结转移组癌组织及其对应癌旁组织行半定量-PCR及免疫印迹. Trizol购自美国Invitrogen公司, RT-PCR试剂盒购自上海生工公司, PCR引物序列由上海生工公司合成, AGR2引物序列: 上游5'-CTGGCCAGAGATACCACAGTC-3', 下游5'-AGTTGGTCACCCCAACCTC-3', 产物片段101 bp; 以β-actin为内参基因. 兔抗人AGR2多克隆抗体购自美国Abgent公司(Cat.AJ1020a); 兔抗人β-actin多克隆抗体购自北京博奥森公司(bs-0061R); HRP标记山羊抗兔二抗、ECL发光液、BCA蛋白浓度测定试剂盒均购自碧云天; 即用型S-P试剂盒及DAB显色剂均购自北京博奥森生物技术有限公司.
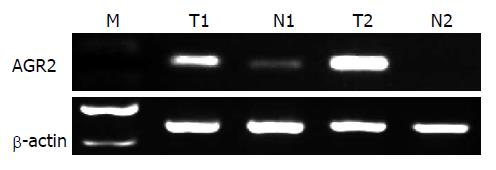
1.2.1 Semi-quantitative RT-PCR检测: 组织总RNA提取按照TRIzol试剂盒提供的说明书操作, 提取总RNA经琼脂糖凝胶电泳, 采用紫外分光光度法测定总RNA含量和纯度. 按逆转录试剂盒说明书进行逆转录, AGR2反应条件为95 ℃ 5 min, 95 ℃ 30 s、55 ℃ 30 s、72 ℃ 45 s, 共30个循环, 终末延伸72 ℃ 5 min. 取PCR产物经琼脂糖凝胶电泳, 凝胶成像分析系统进行电泳条带分析, 用目的条带灰度值与β-actin条带灰度值的比值表示标本相对mRNA水平.
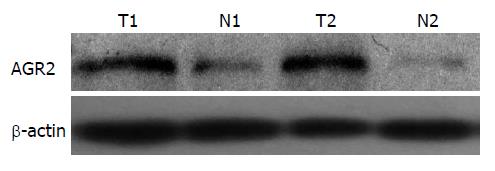
1.2.2 Western blot检测: 采用RIPA裂解液分别提取32例结肠癌组织及癌旁正常组织总蛋白, 按照蛋白定量试剂盒说明书BCA法进行总蛋白定量, 取50 μg蛋白质样品进行10%SDS-PAGE凝胶电泳后将蛋白转移至PVDF膜. 5%脱脂牛奶封闭后, 加入1:1000稀释的兔抗人AGR2多克隆抗体、1:200稀释的兔抗人β-actin多克隆抗体4℃孵育过夜, TBST洗涤后加入HRP标记山羊抗兔二抗室温孵育1 h, TBST洗涤后ECL化学发光试剂自显影, 照相. 以目的蛋白与β-actin的灰度比进行半定量分析.
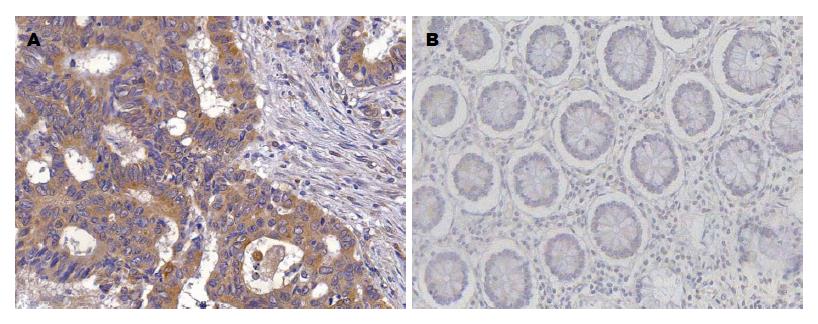
1.2.3 免疫组织化学检测: 全部68例标本均经10%甲醛固定, 常规石蜡包埋, 4 μm厚连续切片, 常规脱蜡, 高温高压修复, 具体操作步骤严格按照试剂盒说明书进行. AGR2一抗浓度均为1:100, 用PBS代替一抗作为空白对照, 用已知阳性切片作为阳性对照. AGR2蛋白阳性信号定位于细胞质, 呈黄色或棕黄色颗粒, 首先按染色强度进行评分: 未染色为0分, 淡黄色为1分, 棕黄色为2分, 深棕黄色为3分; 然后以阳性细胞比例进行评分: 阴性细胞为0分, 阳性细胞<10%为1分, 11%-50%为2分, 51%-75%为3分, >75%为4分. 免疫组织化学染色结果以染色强度评分与阳性细胞比例评分乘积表示, ≤3为阴性表达, >3为阳性表达.
统计学处理 采用SPSS17.0软件行统计学分析, 结肠癌、癌旁正常组织中mRNA和蛋白表达量数据采用mean±SD表示, 进行配对资料t检验, 免疫组织化学计数资料进行χ2检验, 以α = 0.05为检验水准. P<0.05为差异有统计学意义.
AGR2 mRNA在结肠癌组织、癌旁组织中相对表达量分别为0.95±0.03、0.21±0.06, 结肠癌中表达量明显高于癌旁正常组织(P<0.05, 表1, 图1).
AGR2在结肠癌组织、癌旁组织中相对表达量分别为0.93±0.03、0.31±0.02, 结肠癌组织中表达量明显高于癌旁正常组织(P<0.05, 表1, 图2).
AGR2在结肠癌组织、癌旁组织中阳性表达率分别为75%(51/68)、29.4%(20/68), 结肠癌组织阳性表达率明显高于癌旁正常组织(χ2 = 28.32, P<0.05), (表2, 图3).
| 组织类型 | AGR2 | ||
| 阳性 | χ2值 | P值 | |
| 癌旁组织 | 20(29.4) | 28.32 | 0.000 |
| 癌组织 | 51(75) | ||
AGR2在结肠癌中的表达与年龄、性别无相关性(P>0.05), 与Dukes分期、组织学分级均有关(P<0.05)(表3).
| 临床病理因素 | n | AGR2 | ||
| + | χ2值 | P值 | ||
| 年龄(岁) | 0.982 | 0.322 | ||
| ≤55 | 29 | 20(69) | ||
| >55 | 39 | 31(79.5) | ||
| 性别 | 0.962 | 0.327 | ||
| 男 | 33 | 23(69.7) | ||
| 女 | 35 | 28(80.0) | ||
| Dukes分期 | 8.715 | 0.003 | ||
| A+B | 31 | 18(58.1) | ||
| C+D | 37 | 33(89.2) | ||
| 分化程度 | 7.906 | 0.005 | ||
| 高、中分化 | 45 | 29(64.4) | ||
| 低分化 | 23 | 21(95.7) | ||
| 淋巴结转移 | 7.870 | 0.005 | ||
| 无 | 36 | 22(61.6) | ||
| 有 | 32 | 29(90.6) | ||
随着人们生活水平提高、饮食习惯改变, 我国结肠癌的发病率迅速上升[14], 且结肠癌的发病呈年轻化[15]. 早期结肠癌常无症状, 随着癌肿的增大与并发症的发生才出现症状, 多数患者确诊时已处中晚期, 8%-25%已发生肝转移. 目前结肠癌的治疗是以手术为主, 术后辅助化疗为了减少复发与转移, 5年生存率徘徊在25%-50%之间[16]. 因此结肠癌早期诊断在临床中越来越重要.
AGR2基因位于染色体7p21.3, 编码一种分泌性蛋白质, 是非洲爪蛙黏液腺基因xAG2(xenopus laevis anterior gradient-2)的人型同源物[17]. AGR2最早由Kuang等[18]在雌激素受体阳性表达的乳腺癌细胞株差异表达中发现. 目前国内外对AGR2的研究主要集中在两个方向. 一方面是与肿瘤发生的相关性研究, 相关研究结果表明其在一系列肿瘤组织中都存在异常表达, 例如胃癌[2]、卵巢癌[3]、乳腺癌[19-20]、前列腺癌[21,22]、胰腺癌[23]等肿瘤中高表达, 提示其与肿瘤的发生、发展相关[24]. Ramachandran等[25]发现AGR2在转移性胰腺癌细胞中高表达, 而抑制AGR2表达后肿瘤细胞生长受到明显抑制, 侵袭行为明显减少, 且细胞对于抗肿瘤药物的敏感性增加. Zhang等[26]发现过量AGR2表达可以促进前列腺癌细胞的侵袭行为和迁移能力, 沉默AGR2后其侵袭行为和迁移能力受到抑制. Hrstka等[27]在研究AGR2在乳腺癌抗激素药物耐药所起的作用时, 发现使用他莫昔芬治疗后, AGR2的表达量有所上升, 提示AGR2可能与乳腺癌耐药性有关. 上述研究表明AGR2可能与肿瘤转移及耐药有关, 这为AGR2作为肿瘤诊断指标和治疗靶点进一步研究提供支持. 另一方面是机制研究, 主要包括在分子水平促进肿瘤发生、发展的机制. 目前陆续发现了一些与AGR2结合的蛋白, 例如人肠黏蛋白(mucin2, MUC2)[28,29]、ATP结合蛋白reptin[30]等. Dong等[31]发现AGR2通过激活Yes相关蛋白(Yes-associated protein, YAP)去磷酸化, 来诱导双调蛋白(amphiregulin, AREG)的表达, 从而促进肿瘤的形成. 其中YAP为新发现的信号转导通路Hippo通路下游主要的转录因子[32], 表明AGR2与Hippo信号通路、EGF信号通路在促肿瘤形成过程中相关. 现阶段对AGR2促进肿瘤形成、转移的具体分子机制尚不清楚, 可作为潜在肿瘤标志物进一步研究.
国外相关研究发现, AGR2在结肠癌患者外周血及结肠癌细胞系中异常表达. Valladares-Ayerbes等[12]通过检测结肠癌患者外周血中AGR2 mRNA, 提出AGR2可作为检测结肠癌的潜在标志物. Lee等[13]应用Western blot方法发现大多数结肠癌细胞系中AGR2表达上调, 例如DK01、DLD1、HCT-8等, 提出AGR2可作为结肠癌生物免疫治疗的潜在分子靶标进行深入研究. 目前在结肠癌组织中AGR2的表达情况尚未见相关报道.
本实验应用半定量RT-PCR、Western blot及免疫组织化学方法检测结肠癌组织中AGR2 mRNA及蛋白表达情况. 本实验结果显示AGR2 mRNA及蛋白在结肠癌组织中的表达明显高于癌旁正常组织, 差异具有统计学意义, 且在结肠癌组织中的表达随着临床分期进展、分化程度降低, 其表达水平不断升高, 与国外文献报道结肠癌患者外周血及结肠癌细胞系中表达情况基本一致, 提示AGR2高表达与结肠癌的发生、发展有关.
本研究结果还发现淋巴结转移的结肠癌组织中AGR2阳性表达率明显高于无淋巴结转移的结肠癌组织, 提示AGR2高表达与结肠癌的淋巴结转移有关. 结合国外研究结果, 可推测AGR2异常表达可能促进结肠癌的发生、发展及转移, 因此AGR2可作为结肠癌潜在肿瘤标志物进行深入研究.
结肠癌是临床常见的恶性肿瘤之一, 随着生活方式及饮食结构改变, 我国结肠癌的发病率迅速上升, 且早期结肠癌常无症状, 多数患者确诊时已处中晚期. 因此结肠癌早期诊断在临床中越来越重要.
卢晓梅, 教授, 研究员, 新疆医科大学第一附属医院临床医学研究院
目前国内外对人前梯度蛋白2(anterior gradient-2, AGR2)的研究主要集中在两个方向. 一方面是与肿瘤发生的相关性研究, 研究结果表明其在一系列肿瘤组织中都存在异常表达, 提示其与肿瘤的发生、发展相关. 另一方面是机制研究, 主要包括在分子水平促进肿瘤发生、发展的机制, 具体机制目前尚未清楚.
2012年Manuel等通过检测结肠癌患者外周血中AGR2 mRNA, 提出AGR2可作为检测结肠癌的潜在标志物. Lee等应用Western blot方法发现大多数结肠癌细胞系中AGR2异常表达, 并提出AGR2可作为结肠癌生物免疫治疗的潜在分子靶标进行深入研究.
目前在结肠癌组织中AGR2的表达情况尚未见相关报道. 本实验应用半定量RT-PCR、Western blot及免疫组织化学方法检测结肠癌组织中AGR2 mRNA及蛋白表达情况.
AGR2有可能作为结肠癌早期诊断的肿瘤标志物, 并有可能成为结肠癌生物免疫治疗的潜在分子靶标.
本文作者分析并探讨人AGR2的表达与临床病理学的关系, 为AGR2作为潜在的肿瘤检测指标进一步提供了理论依据. 该研究具有较好的创新性, 实验对照设置完整, 行文较为流畅.
编辑: 郭鹏 电编: 鲁亚静
| 1. | Zhao P, Dai M, Chen W, Li N. Cancer trends in China. Jpn J Clin Oncol. 2010;40:281-285. [PubMed] [DOI] |
| 2. | Bai Z, Ye Y, Liang B, Xu F, Zhang H, Zhang Y, Peng J, Shen D, Cui Z, Zhang Z. Proteomics-based identification of a group of apoptosis-related proteins and biomarkers in gastric cancer. Int J Oncol. 2011;38:375-383. [PubMed] [DOI] |
| 3. | Park K, Chung YJ, So H, Kim K, Park J, Oh M, Jo M, Choi K, Lee EJ, Choi YL. AGR2, a mucinous ovarian cancer marker, promotes cell proliferation and migration. Exp Mol Med. 2011;43:91-100. [PubMed] |
| 4. | Rice GE, Edgell TA, Autelitano DJ. Evaluation of midkine and anterior gradient 2 in a multimarker panel for the detection of ovarian cancer. J Exp Clin Cancer Res. 2010;29:62. [PubMed] [DOI] |
| 5. | Dumartin L, Whiteman HJ, Weeks ME, Hariharan D, Dmitrovic B, Iacobuzio-Donahue CA, Brentnall TA, Bronner MP, Feakins RM, Timms JF. AGR2 is a novel surface antigen that promotes the dissemination of pancreatic cancer cells through regulation of cathepsins B and D. Cancer Res. 2011;71:7091-7102. [PubMed] [DOI] |
| 6. | Durán MC, Vega F, Moreno-Bueno G, Artiga MJ, Sanchez L, Palacios J, Ridley A, Timms JF. Characterisation of tumoral markers correlated with ErbB2 (HER2/Neu) overexpression and metastasis in breast cancer. Proteomics Clin Appl. 2008;2:1313-1326. [PubMed] [DOI] |
| 7. | Kovalev LI, Shishkin SS, Khasigov PZ, Dzeranov NK, Kazachenko AV, Toropygin IIu, Mamykina SV. [Identification of AGR2 protein, a novel potential cancer marker, using proteomics technologies]. Prikl Biokhim Mikrobiol. 2006;42:480-484. [PubMed] |
| 8. | Wu ZS, Wu Q, Ding XD, Wang HQ, Shen YX, Fang SY. [Expression of a novel metastasis-inducing protein human anterior gradient-2 (AGR2) in breast cancer and its clinical and prognostic significance]. Zhonghua Binglixue Zazhi. 2008;37:109-113. [PubMed] |
| 9. | Ambolet-Camoit A, Bui LC, Pierre S, Chevallier A, Marchand A, Coumoul X, Garlatti M, Andreau K, Barouki R, Aggerbeck M. 2,3,7,8-tetrachlorodibenzo-p-dioxin counteracts the p53 response to a genotoxicant by upregulating expression of the metastasis marker agr2 in the hepatocarcinoma cell line HepG2. Toxicol Sci. 2010;115:501-512. [PubMed] [DOI] |
| 10. | Sweeny L, Liu Z, Bush BD, Hartman Y, Zhou T, Rosenthal EL. CD147 and AGR2 expression promote cellular proliferation and metastasis of head and neck squamous cell carcinoma. Exp Cell Res. 2012;318:1788-1798. [PubMed] [DOI] |
| 11. | Bu H, Bormann S, Schäfer G, Horninger W, Massoner P, Neeb A, Lakshmanan VK, Maddalo D, Nestl A, Sültmann H. The anterior gradient 2 (AGR2) gene is overexpressed in prostate cancer and may be useful as a urine sediment marker for prostate cancer detection. Prostate. 2011;71:575-587. [PubMed] [DOI] |
| 12. | Valladares-Ayerbes M, Blanco-Calvo M, Reboredo M, Lorenzo-Patiño MJ, Iglesias-Díaz P, Haz M, Díaz-Prado S, Medina V, Santamarina I, Pértega S. Evaluation of the adenocarcinoma-associated gene AGR2 and the intestinal stem cell marker LGR5 as biomarkers in colorectal cancer. Int J Mol Sci. 2012;13:4367-4387. [PubMed] [DOI] |
| 13. | Lee HJ, Hong CY, Jin CJ, Kim MH, Lee YK, Nguyen-Pham TN, Lee H, Park BC, Chung IJ, Kim HJ. Identification of novel HLA-A*0201-restricted epitopes from anterior gradient-2 as a tumor-associated antigen against colorectal cancer. Cell Mol Immunol. 2012;9:175-183. [PubMed] [DOI] |
| 14. | Freeman HJ. Early stage colon cancer. World J Gastroenterol. 2013;19:8468-8473. [PubMed] |
| 17. | Liu D, Rudland PS, Sibson DR, Platt-Higgins A, Barraclough R. Human homologue of cement gland protein, a novel metastasis inducer associated with breast carcinomas. Cancer Res. 2005;65:3796-3805. [PubMed] |
| 18. | Kuang WW, Thompson DA, Hoch RV, Weigel RJ. Differential screening and suppression subtractive hybridization identified genes differentially expressed in an estrogen receptor-positive breast carcinoma cell line. Nucleic Acids Res. 1998;26:1116-1123. [PubMed] |
| 20. | Salmans ML, Zhao F, Andersen B. The estrogen-regulated anterior gradient 2 (AGR2) protein in breast cancer: a potential drug target and biomarker. Breast Cancer Res. 2013;15:204. [PubMed] |
| 21. | Kani K, Malihi PD, Jiang Y, Wang H, Wang Y, Ruderman DL, Agus DB, Mallick P, Gross ME. Anterior gradient 2 (AGR2): blood-based biomarker elevated in metastatic prostate cancer associated with the neuroendocrine phenotype. Prostate. 2013;73:306-315. [PubMed] [DOI] |
| 22. | Bu H, Schweiger MR, Manke T, Wunderlich A, Timmermann B, Kerick M, Pasqualini L, Shehu E, Fuchsberger C, Cato AC. Anterior gradient 2 and 3--two prototype androgen-responsive genes transcriptionally upregulated by androgens and by oestrogens in prostate cancer cells. FEBS J. 2013;280:1249-1266. [PubMed] [DOI] |
| 23. | Sun C, Rosendahl AH, Ansari D, Andersson R. Proteome-based biomarkers in pancreatic cancer. World J Gastroenterol. 2011;17:4845-4852. [PubMed] [DOI] |
| 24. | Chevet E, Fessart D, Delom F, Mulot A, Vojtesek B, Hrstka R, Murray E, Gray T, Hupp T. Emerging roles for the pro-oncogenic anterior gradient-2 in cancer development. Oncogene. 2013;32:2499-2509. [PubMed] [DOI] |
| 25. | Ramachandran V, Arumugam T, Wang H, Logsdon CD. Anterior gradient 2 is expressed and secreted during the development of pancreatic cancer and promotes cancer cell survival. Cancer Res. 2008;68:7811-7818. [PubMed] [DOI] |
| 26. | Zhang Y, Ali TZ, Zhou H, D'Souza DR, Lu Y, Jaffe J, Liu Z, Passaniti A, Hamburger AW. ErbB3 binding protein 1 represses metastasis-promoting gene anterior gradient protein 2 in prostate cancer. Cancer Res. 2010;70:240-248. [PubMed] [DOI] |
| 27. | Hrstka R, Nenutil R, Fourtouna A, Maslon MM, Naughton C, Langdon S, Murray E, Larionov A, Petrakova K, Muller P. The pro-metastatic protein anterior gradient-2 predicts poor prognosis in tamoxifen-treated breast cancers. Oncogene. 2010;29:4838-4847. [PubMed] [DOI] |
| 28. | Higa A, Mulot A, Delom F, Bouchecareilh M, Nguyên DT, Boismenu D, Wise MJ, Chevet E. Role of pro-oncogenic protein disulfide isomerase (PDI) family member anterior gradient 2 (AGR2) in the control of endoplasmic reticulum homeostasis. J Biol Chem. 2011;286:44855-44868. [PubMed] [DOI] |
| 29. | Imai Y, Yamagishi H, Fukuda K, Ono Y, Inoue T, Ueda Y. Differential mucin phenotypes and their significance in a variation of colorectal carcinoma. World J Gastroenterol. 2013;19:3957-3968. [PubMed] [DOI] |
| 30. | Maslon MM, Hrstka R, Vojtesek B, Hupp TR. A divergent substrate-binding loop within the pro-oncogenic protein anterior gradient-2 forms a docking site for Reptin. J Mol Biol. 2010;404:418-438. [PubMed] [DOI] |
| 31. | Dong A, Gupta A, Pai RK, Tun M, Lowe AW. The human adenocarcinoma-associated gene, AGR2, induces expression of amphiregulin through Hippo pathway co-activator YAP1 activation. J Biol Chem. 2011;286:18301-18310. [PubMed] [DOI] |