修回日期: 2013-12-26
接受日期: 2014-01-08
在线出版日期: 2014-02-28
目的: 分析胃肠胰神经内分泌肿瘤(gastroenteropancreafic neuroendocrine neoplasm, GEP-NEN)的临床病理特点及其与预后的关系.
方法: 收集哈尔滨医科大学附属肿瘤医院2007-04/2013-04通过病理诊断为GEP-NEN的患者资料, Kaplan-Meier法进行生存分析, Log-rank法比较临床病理特点与预后的关系, 多因素Cox回归分析影响患者预后的独立危险因素.
结果: 43例患者的平均年龄为57.5岁, 男女性别比为2.91:1. 原发部位中以胃部最多(19例, 44.19%). 2例为功能性的GEP-NEN(1例为胰高血糖素瘤, 1例出现类癌综合征). 有14例术后经过药物治疗. 43例患者中死亡22例(52.38%), 失访1例(2.38%). 患者1、3年生存率分别为70.2%、36.9%, 中位总生存期为16.0 mo. 单因素分析显示: 肿瘤大小(≥5 cm)、T分期、淋巴结转移、远处转移以及病理类型为神经内分泌癌 (neuroendocrine carcinoma, NEC)、混合性腺神经内分泌癌(mixed adenoneuroen docrine carcinoma, MANEC)影响患者的预后(P<0.05). 患者年龄、性别、吸烟史、饮酒史、肿瘤家族史、手术方式及术后药物治疗与预后无相关性. 多因素分析显示: 淋巴结转移、远处转移及病理类型是预后的独立危险因素.
结论: 胃是GEP-NEN最常见的原发部位, 临床表现无特异性. 淋巴结转移、远处转移及病理类型是预后的独立危险因素.
核心提示: 胃是胃肠胰神经内分泌肿瘤(gastroenteropancreafic neuroendocrine neoplasm)最常见的原发部位, 临床表现无特异性. 单因素分析显示: 肿瘤大小、T分期、淋巴结转移、远处转移以及病理类型为神经内分泌癌(neuroendocrine carcinoma)、混合性腺神经内分泌癌(mixed adenoneuroen docrine carcinoma)影响患者的预后. 淋巴结转移、远处转移及病理类型是预后的独立危险因素.
引文著录: 李伟, 隋红, 周建华. 胃肠胰神经内分泌肿瘤的临床病理特点及其与预后的关系. 世界华人消化杂志 2014; 22(6): 846-852
Revised: December 26, 2013
Accepted: January 8, 2014
Published online: February 28, 2014
AIM: To analyze the clinicopathologic characteristics of gastroenteropancreatic neuroendocrine neoplasms (GEP-NEN) and their correlation with prognosis.
METHODS: Clinical data for 43 patients diagnosed pathologically with GEP-NEN in Harbin Medical University Cancer Hospital from April 2007 to April 2013 were retrospectively analyzed. Survival analysis was performed by Kaplan-Meier method. The relationship between clinicopathologic characteristics and prognosis was analyzed using the Log-rank test. Independent risk factors for prognosis were analyzed by multivariate Cox regression analysis.
RESULTS: The mean age was 57.5 years, with a male-to-female ratio of 2.91:1. The most common site was stomach (19 cases, 44.19%). There were 2 cases of functional GEP-NEN (one case of glucagonoma and another case of carcinoid syndrome). Of the 43 patients, 14 received postoperative drug therapy. There were 22 deaths in 43 patients (52.38%) and one case (2.38%) was lost to follow-up. The 1- and 3-year survival rates were 70.2% and 36.9%, with a median overall survival (OS) of 16.0 months. Univariate analysis showed that tumor size (≥ 5 cm), depth of invasion, lymph node metastasis, distant metastasis and pathological grades of NEC (neuroendocrine carcinoma) and MANEC (mixed adenoneuroen docrine carcinoma) could affect the patient's prognosis (P < 0.05 for all). Age, gender, smoking, drinking, family history of cancer, surgical approach and postoperative drug therapy were not significantly associated with prognosis. Multivariate analysis showed that lymph node metastasis, distant metastasis and pathological type were independent risk factors.
CONCLUSION: The stomach is the most common primary site of GEP-NEN, and GEP-NEN lacks specific clinical manifestations. Lymph node metastasis, distant metastasis and pathological type are independent risk factors.
- Citation: Li W, Sui H, Zhou JH. Gastroenteropancreatic neuroendocrine neoplasms: Clinicopathologic characteristics and their correlation with prognosis. Shijie Huaren Xiaohua Zazhi 2014; 22(6): 846-852
- URL: https://www.wjgnet.com/1009-3079/full/v22/i6/846.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i6.846
神经内分泌肿瘤(neuroendocrine neoplasms, NEN)是一组起源于肽能神经元和神经内分泌细胞的异质性肿瘤, 可发生于全身各个部位, 以胃肠胰神经内分泌肿瘤(gastroenteropancreafic neuroendocrine neoplasm, GEP-NEN)最常见[1]. GEP-NEN一度被认为是罕见病, 但是随着诊断技术的发展和各种生物标志物的发现, 这类疾病越来越多在临床中被诊断出来. 美国的一项流行病学研究显示, GEP-NEN的发病率由1973年的1.09/10万增长到2004年的5.25/10万[2]. Lawrence等[3]发现GEP-NEN的患病率在消化系恶性肿瘤中占第二位, 其发病率仅次于大肠癌. 在我国, 目前还没有有力的GEP-NEN流行病学资料, 对该病的流行趋势、临床特征及预后防治了解较少, 仅朱预等[4]在2006年就我国胰腺神经内分泌肿瘤的诊治情况做了概述, 高尤亮等[5]对福建地区的NEN的临床特点进行了统计. 本研究回顾性分析哈尔滨医科大学附属肿瘤医院2007-04/2013-04收治的43例GEP-NEN患者的临床资料, 探讨分析GEP-NEN的临床病理特点及其与预后的关系.
收集哈尔滨医科大学附属肿瘤医院2007-04至2013-04通过病理诊断为GEP-NEN的患者资料, 共43例, 其中男性32例, 女性11例, 年龄20-77岁, 平均年龄为57.5岁. 回顾性分析患者的年龄、性别、临床表现、病理等相关资料.
1.2.1 分类及分级标准: 采用2010年世界卫生组织(World Health Organization, WHO)对GEP-NEN分类方法[6]: 神经内分泌瘤(neuroendocrine tumor, NET)、神经内分泌癌(neuroendocrine carcinoma, NEC)、混合性腺神经内分泌癌(mixed adenoneuroen docrine carcinoma, MANEC)及增生性和肿瘤前病变(hyperplastic and pre-neoplastic lesions). 采用欧洲神经内分泌肿瘤协会(European Neuroendocrine Tumor Society, ENETS)根据细胞增生比例(细胞核分裂指数和Ki-67指数)的分级方法[7]: G1: 核分裂<2个/10高倍镜视野和(或)Ki-67指数≤2%; G2: 核分裂2-20个/10高倍镜视野和(或)Ki-67指数为3%-20%; G3: 核分裂>20个/10高倍镜视野和(或)Ki-67指数>20%, 若两者结果不一致, 以高级别为准.
1.2.2 随访: 通过联系电话或地址信息获得随访信息, 随访截止时间为2013-10-31. 起点为患者病理报告诊断时间, 终点为患者因肿瘤而死亡的时间, 生存时间为起点到终点或随访截止所经历的时间. 因各种原因而失去联系的视为失访.
统计学处理 采用SPSS17.0软件处理统计数据, Kaplan-Meier法进行生存分析, Log-rank法比较临床病理特点与预后的关系, 多因素Cox回归分析影响患者预后的独立危险因素. 以P<0.05为差异有统计学意义.
2.1.1 临床表现: 发病部位: 43例患者的发病部位依次为: 胃19例(44.19%)、胰腺14例(32.56%)、直肠3例(6.98%)、食道2例(4.65%)、壶腹部2例(4.65%)、结肠2例(4.65%)、回盲部1例(2.32%), 起源部位中胃为最常见. 临床症状: 43例患者中2例(4.65%)患者为功能性的(1例为胰高血糖素瘤, 1例出现类癌综合征), 其余41例(95.35%)为非功能性的, 后者主要表现为非特异性的消化系症状, 如吞咽困难、腹痛、腹胀、呕血、黄染、腹泻、黑便、消瘦等. 1例临床表现为典型的类癌综合征, 主要症状为胸闷、面部潮红.
2.1.2 临床病理特点: 43例GEP-NEN患者中, 男性32例(74.42%)、女性11例(25.58%); <60岁的25例(58.14%), ≥60岁的18例(41.86%); 有吸烟史者19例(44.19%), 无吸烟史者24例(55.81%); 有饮酒史者19例(44.19%), 无饮酒史者24例(55.81%); 有肿瘤家族史7例(16.28%), 无肿瘤家族史36例(83.72%); 肿瘤大小(直径)在0.6-20 cm, 平均为5.5 cm; T分期中, T1、T2为11例, T3、T4为29例, 3例因病例资料不完整无法评估; 伴有淋巴结转移者22例(51.16%); 6例远处转移中全部伴有肝转移, 其中2例同时伴有肺转移; 绝大多数患者通过手术切除(90.70%); 病理类型中以NEC最多见(67.44%)(表1).
| 临床病理参数 | n(%) |
| 性别 | |
| 男 | 32(74.42) |
| 女 | 11(25.58) |
| 年龄(岁) | |
| <60 | 25(58.14) |
| ≥60 | 18(41.86) |
| 吸烟史 | |
| 无 | 24(55.81) |
| 有 | 19(44.19) |
| 饮酒史 | |
| 无 | 24(55.81) |
| 有 | 19(44.19) |
| 肿瘤家族史 | |
| 无 | 36(83.72) |
| 有 | 7(16.28) |
| 肿瘤大小(cm) | |
| <5 | 19(44.19) |
| ≥5 | 24(55.81) |
| 手术方式 | |
| 活检 | 4(9.30) |
| 手术切除 | 39(90.70) |
| T分期 | |
| T1、T2 | 11(25.58) |
| T3、T4 | 29(67.44) |
| Tx | 3(6.98) |
| 淋巴结转移 | |
| 无 | 21(48.84) |
| 有 | 22(51.16) |
| 远处转移 | |
| 无 | 37(86.05) |
| 有 | 6(13.95) |
| 病理分类 | |
| NET | 13(30.23) |
| NEC | 29(67.44) |
| MANEC | 1(2.33) |
| 病理分级 | |
| G1、G2 | 13(30.23) |
| G3 | 30(69.77) |
2.1.3 治疗情况: 43例GEP-NEN患者中4例(9.30%)经内镜下活检取得病理, 其中NEC、NET各为2例, 其余39例经手术完全切除原发灶(90.70%), 其中11例(28.21%)为NEC, 27例(69.23%)为NET, 1例(2.56%)为MANEC. 43例患者中有14例接受化疗, 其中3例同时接受生长抑素治疗, 化疗药物以细胞毒药物为主(氟尿嘧啶、铂类、依托泊苷等), 生长抑素治疗药物采用奥曲肽. 术后化疗患者中有12例为G3患者.
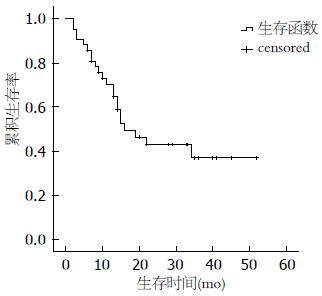
2.2.1 总生存情况: 43例患者的中位随访时间为14 mo(2-52 mo), 死亡22例(52.38%), 皆因肿瘤死亡, 1例患者失访. 患者1、3年生存率分别为70.2%、36.9%, 中位总生存期为16.0 mo(图1).
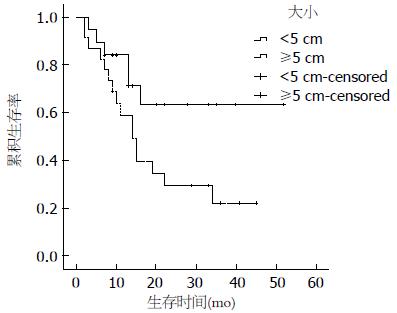
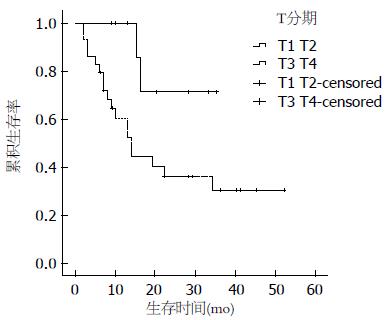
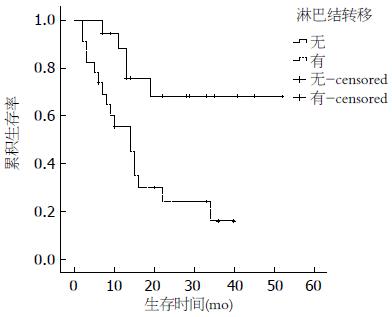
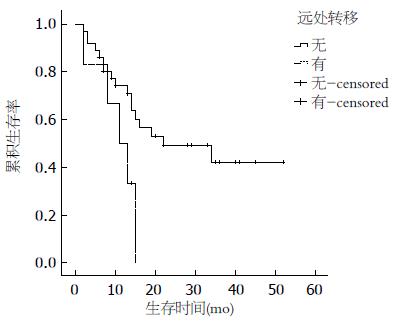
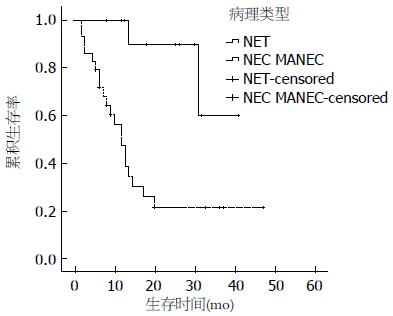
2.2.2 单因素分析: 患者年龄、性别、吸烟史、饮酒史、肿瘤家族史、手术方式及术后药物治疗与预后无相关性, 而肿瘤大小(≥5 cm)、T分期、有淋巴结转移、有远处转移和病理类型为NEC、MANEC影响患者的预后(P<0.05)(图2-6).
2.2.3 多因素Cox回归分析: 将单因素分析中P<0.05的变量纳入多因素Cox回归分析, 结果显示, 淋巴结转移、远处转移及病理类型是影响预后的独立危险因素(P<0.05, 表2).
| 相关因素 | P值 | 危险度 | 95%置信区间 |
| 淋巴结转移 | 0.028 | 3.534 | 1.147-10.889 |
| 远处转移 | 0.029 | 4.445 | 1.165-16.958 |
| 病理类型 | 0.036 | 8.926 | 1.156-68.925 |
近年来, 世界各国的GEP-NEN发病率都在逐渐增加. 美国1973-2004年发病率增加了5倍[2]; 意大利1985-2005年发病率从0.7/10万增至1.6/10万(男), 0.3/10万增至2.1/10万(女)[8]; 澳大利亚的发病率从1980-1989年的1.7/10万增至2000-2006年的3.3/10万[9]. 我国尚没有大型临床资料. 高尤亮等[5]统计福建地区2006-2011年GEP-NEN的发病率为0.20%, 这可能与现代医学的进步、检测技术的提高以及对该病的认识逐渐深入有关. 在本研究中, 哈医大附属肿瘤医院在2007年以前的病例中, GEP-NEN的发病率极低, 在2007年以后该病逐渐被发现和认识.
本组研究中的发病部位主要为: 胃(44.19%)、胰腺(32.56%), 其次为直肠(6.98%)、食道(4.65%)、壶腹部(4.65%)、结肠(4.65%)、回盲部(2.32%). Oberg[10]报道欧美地区GEP-NEN最常见的部位为直肠和小肠. 出现不同的结果可能与种族及地域的不同以及诊断的病例数较少有关. GEP-NEN根据是否产生激素引起相应的临床症状可分为功能性和非功能性两类, 本组研究中仅有2例为功能性的GEP-NEN, 其余均没有特异性的临床症状, 因此病理检查结合免疫组织化学的方法对该病的诊断尤为重要. 典型的类癌综合征并不多见, 其发生率不足神经内分泌肿瘤的10%[11], 本研究中仅有1例(2.33%)出现类癌综合征.
美国的SEER(Surveillance Epidemiology and End Results)数据显示, 神经内分泌肿瘤的1年生存率为76%-94%, 3年生存率为48%-87%[2], 国内文献报道1年和3年生存率分别为69%和34%[12], 本研究的患者1年、3年生存率分别为70.2%、36.9%. 单因素分析显示: 肿瘤大小(≥5 cm)、T分期、淋巴结转移、远处转移以及病理类型为NEC、MANEC影响患者的预后. 本研究中肿瘤大小>2 cm与≤2 cm预后的差异无统计学意义, 而进一步分析得出肿瘤大小≥5 cm与<5 cm预后的差异有统计学意义, 既往文献报道[13]肿瘤大小<1 cm转移发生率为3%, 预后较好, 1-2 cm者转移发生率为10%-15%, >2 cm者转移发生率为60%-80%, 预后差, 这有赖于更多的病例进一步研究. T分期、淋巴结转移、远处转移及病理类型均对预后有影响, 这与既往文献报道一致[14,15]. 患者年龄、性别、吸烟史、饮酒史、肿瘤家族史、手术方式及术后药物治疗与预后无相关性, 其中年龄、性别、手术方式及术后药物治疗对预后的影响既往文献报道不一致[8,16]. 治疗方面手术仍是主要的治疗手段, 即使局部或远处转移, 特别是肝转移患者通过手术切除或局部治疗[17]也可以通过减轻肿瘤负荷来提高患者的生存率和生活质量, 但本组研究中完全手术切除和镜下活检患者的生存时间并没有统计学差异. 6例远处转移中有2例行减瘤术, 由于病例数较少, 无法比较两组的生存差异. 药物治疗包括化疗及生长抑素治疗, 43例患者中有14例术后行化疗, 化疗药物以氟尿嘧啶、铂类及依托泊苷为主, 其中3例合并使用生长抑素(醋酸奥曲肽)治疗, 结果并没有显示出对预后有统计学差异. 由于GEP-NEN发病率较低, 因此缺少大型的III期临床试验对照不同化疗药物的疗效, 总体来说GEP-NEN化疗效果欠佳. 德国的PROMID研究证实长效奥曲肽对分化好的GEP-NEN有较好疗效[18], 本研究中共有3例患者行奥曲肽治疗, 因病例数太少无法比较生存差异. 另外, 靶向药物哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin, mTOR)抑制剂-依维莫司[19]和酪氨酸酶抑制剂-舒尼替尼[20]对GEP-NEN也有较好疗效, 但本研究中并没有患者使用该类药物治疗. 目前我们国家参照2010年欧洲肿瘤内科学会指南[10]制定了神经内分泌肿瘤的流程: 病理分级为1级(G1), Ki-67<2%, 采用生物治疗或生物治疗联合靶向, 包括生长抑素类似物(somatostatin analogues, SMS)、α-干扰素、SMS+α-干扰素、SMS+舒尼替尼、SMS+贝伐单抗、SMS+依维莫司; 病理分级为2级(G2), Ki-67在3%-20%之间采用化疗为主的综合治疗, 包括链脲霉素(streptozotocin, STZ)+氟尿嘧啶/阿霉素、STZ+依维莫司、替莫唑胺+卡培他滨、舒尼替尼+SMS、贝伐单抗+SMS、SMS控制症状; 病理分级为3级(G3), Ki-67>20%, 该类肿瘤对化疗敏感, 方案包括顺铂+足叶乙甙(VP-16)、替莫唑胺+卡培他滨+贝伐单抗、SMS控制症状.本研究中病理分级为G3的患者是否化疗与预后无相关性, 分析原因可能为: (1)病例数偏少, 随访时间不够长; (2)所采用的化疗方案多样以及疗程的影响. 多因素分析显示: 淋巴结转移、远处转移及病理类型是影响预后的独立危险因素, 其死亡风险分别为3.534、4.445、8.926倍, 与既往文献报道一致[2,21].
目前, 多种新的治疗方法和治疗药物, 如肽受体放射性同位素治疗(peptide receptor radionuclide therapy, PRRT)[22]、帕瑞肽(SOM230)[23]、索拉菲尼[24]以及帕唑帕尼[25]等药物都在临床试验当中. 尽管在命名、分类、药物治疗等方面有显著进步, 但因其生物学行为异常复杂和多变及高度的异质性仍给我们带来很多亟待解决的问题, 如有预测价值的生物标志物, 大规模中心Ⅲ期临床试验数据探索更多有效的治疗手段等. 我们有理由相信, 随着对GEP-NEN不断的深入和了解, 对其治疗必将产生里程碑式的飞跃.
神经内分泌肿瘤在临床上一直以来被视作一种罕见的肿瘤, 随着现代医学的进步、检测技术的提高以及对该病的认识逐渐深入, 神经内分泌肿瘤的发病率已明显增高. 通过对胃肠胰神经内分泌肿瘤的临床病理特征及其对预后影响的分析, 提高临床医师的诊治水平.
李正荣, 副主任医师, 副教授, 南昌大学附属第一医院胃肠外科(普六病区); 王文跃, 主任医师, 中日友好医院普通外科
胃肠胰神经内分泌肿瘤近年来发病率提高主要是由于诊断技术的进步, 目前该研究领域的重点和热点问题是对此病有诊断价值的生物标志物和更多、更有效的治疗手段, 我们亟待解决的问题也是具有诊断价值的生物标志物和大规模中心Ⅲ期临床试验数据探索更多有效的治疗手段.
Yao等报道亚洲人种直肠为最常见的原发部位, 疾病分期、肿瘤原发部位、组织学分级、性别、种族、年龄等对疾病预后有影响. Rinke等报道长效奥曲肽对分化好的胃肠胰神经内分泌肿瘤(gastroenteropancreafic neuroendocrine neoplasm)有较好疗效.
对43例胃肠胰神经内分泌肿瘤(gastroenteropancreafic neuroendocrine neoplasm, GEP-NEN)的基本资料, 包括吸烟史、饮酒史、肿瘤家族史等纳入了分析影响患者预后的因素, 病例资料较完整, 文章结论是胃是GEP-NEN最常见的原发部位, 临床表现无特异性. 淋巴结转移、远处转移及病理类型是预后独立危险因素.
病例资料较完整, 统计资料真实, 尽管病例数较少, 但有一定的临床指导意义. 该病并没有特殊的临床表现, 这提示在临床诊治过程中不可忽略该病. 在治疗中, 根据病理分级的不同而进行不同的治疗.
本文分析了临床病理特点与预后的关系, 多因素Cox回归分析影响患者预后的独立危险因素. 虽然国内也有类似的报道, 但本文资料收集较完整, 病例数较多, 有一定的临床指导意义.
编辑: 郭鹏 电编:鲁亚静
| 1. | Oberg K, Castellano D. Current knowledge on diagnosis and staging of neuroendocrine tumors. Cancer Metastasis Rev. 2011;30 Suppl 1:3-7. [PubMed] [DOI] |
| 2. | Yao JC, Hassan M, Phan A, Dagohoy C, Leary C, Mares JE, Abdalla EK, Fleming JB, Vauthey JN, Rashid A. One hundred years after "carcinoid": epidemiology of and prognostic factors for neuroendocrine tumors in 35, 825 cases in the United States. J Clin Oncol. 2008;26:3063-3072. [PubMed] [DOI] |
| 3. | Lawrence B, Gustafsson BI, Chan A, Svejda B, Kidd M, Modlin IM. The epidemiology of gastroenteropancreatic neuroendocrine tumors. Endocrinol Metab Clin North Am. 2011;40:1-18, vii. [PubMed] [DOI] |
| 6. | Bosman FT, Carneiro F, Hruban RH, Theise ND. WHO classification of tumours of the digestive system. Lyon: IARC Press 2010; 26-27. |
| 7. | Rindi G, Klöppel G, Alhman H, Caplin M, Couvelard A, de Herder WW, Erikssson B, Falchetti A, Falconi M, Komminoth P. TNM staging of foregut (neuro)endocrine tumors: a consensus proposal including a grading system. Virchows Arch. 2006;449:395-401. [PubMed] [DOI] |
| 8. | Caldarella A, Crocetti E, Paci E. Distribution, incidence, and prognosis in neuroendocrine tumors: a population based study from a cancer registry. Pathol Oncol Res. 2011;17:759-763. [PubMed] [DOI] |
| 9. | Luke C, Price T, Townsend A, Karapetis C, Kotasek D, Singhal N, Tracey E, Roder D. Epidemiology of neuroendocrine cancers in an Australian population. Cancer Causes Control. 2010;21:931-938. [PubMed] [DOI] |
| 10. | Öberg KE. Gastrointestinal neuroendocrine tumors. Ann Oncol. 2010;21 Suppl 7:vii72-vii80. [PubMed] [DOI] |
| 13. | Plöckinger U, Rindi G, Arnold R, Eriksson B, Krenning EP, de Herder WW, Goede A, Caplin M, Oberg K, Reubi JC. Guidelines for the diagnosis and treatment of neuroendocrine gastrointestinal tumours. A consensus statement on behalf of the European Neuroendocrine Tumour Society (ENETS). Neuroendocrinology. 2004;80:394-424. [PubMed] [DOI] |
| 15. | Medrano-Guzmán R, Alvarado-Cabrero I, González-Rodríguez D, López-García SC, Páez-Agraz F. [Surgical prognostic factors of gastroenteropancreatic neuroendocrine tumors (GEP NET)]. Rev Med Inst Mex Seguro Soc. 2012;50:243-248. [PubMed] |
| 17. | Anthony LB, Strosberg JR, Klimstra DS, Maples WJ, O'Dorisio TM, Warner RR, Wiseman GA, Benson AB, Pommier RF. The NANETS consensus guidelines for the diagnosis and management of gastrointestinal neuroendocrine tumors (nets): well-differentiated nets of the distal colon and rectum. Pancreas. 2010;39:767-774. [PubMed] [DOI] |
| 18. | Rinke A, Müller HH, Schade-Brittinger C, Klose KJ, Barth P, Wied M, Mayer C, Aminossadati B, Pape UF, Bläker M. Placebo-controlled, double-blind, prospective, randomized study on the effect of octreotide LAR in the control of tumor growth in patients with metastatic neuroendocrine midgut tumors: a report from the PROMID Study Group. J Clin Oncol. 2009;27:4656-4663. [PubMed] [DOI] |
| 19. | Yao JC, Shah MH, Ito T, Bohas CL, Wolin EM, Van Cutsem E, Hobday TJ, Okusaka T, Capdevila J, de Vries EG. Everolimus for advanced pancreatic neuroendocrine tumors. N Engl J Med. 2011;364:514-523. [PubMed] [DOI] |
| 20. | Raymond E, Dahan L, Raoul JL, Bang YJ, Borbath I, Lombard-Bohas C, Valle J, Metrakos P, Smith D, Vinik A. Sunitinib malate for the treatment of pancreatic neuroendocrine tumors. N Engl J Med. 2011;364:501-513. [PubMed] [DOI] |
| 22. | Bergsma H, van Vliet EI, Teunissen JJ, Kam BL, de Herder WW, Peeters RP, Krenning EP, Kwekkeboom DJ. Peptide receptor radionuclide therapy (PRRT) for GEP-NETs. Best Pract Res Clin Gastroenterol. 2012;26:867-881. [PubMed] [DOI] |
| 23. | Kvols LK, Oberg KE, O'Dorisio TM, Mohideen P, de Herder WW, Arnold R, Hu K, Zhang Y, Hughes G, Anthony L. Pasireotide (SOM230) shows efficacy and tolerability in the treatment of patients with advanced neuroendocrine tumors refractory or resistant to octreotide LAR: results from a phase II study. Endocr Relat Cancer. 2012;19:657-666. [PubMed] [DOI] |
| 24. | Chan JA, Mayer RJ, Jackson N, Malinowski P, Regan E, Kulke MH. Phase I study of sorafenib in combination with everolimus (RAD001) in patients with advanced neuroendocrine tumors. Cancer Chemother Pharmacol. 2013;71:1241-1246. [PubMed] [DOI] |
| 25. | Ahn HK, Choi JY, Kim KM, Kim H, Choi SH, Park SH, Park JO, Lim HY, Kang WK, Lee J. Phase II study of pazopanib monotherapy in metastatic gastroenteropancreatic neuroendocrine tumours. Br J Cancer. 2013;109:1414-1419. [PubMed] [DOI] |