修回日期: 2014-01-05
接受日期: 2014-01-10
在线出版日期: 2014-02-18
目的: 总结内镜下黏膜剥离术(endoscopic submucosal dissection, ESD)在上消化道病变治疗中的应用体会.
方法: 回顾分析2012-05/2013-05在我院经ESD的52例患者资料, 评价ESD在上消化道病变治疗的安全性、有效性.
结果: 52例患者中食管病变4例、胃部病变48例, 所有病变均经病理检查表明病灶完整切除, 切缘及基底部无病变残留. 其中黏膜病变40例(术后病理示食管乳头状瘤2例, 贲门增生性息肉9例、腺瘤3例, 胃窦原位癌2例、高级别上皮内瘤变3例、低级别上皮内瘤变5例、腺瘤9例、增生性息肉5例、肠上皮化生2例); 黏膜下肿瘤12例(术后病理示食管平滑肌瘤1例、食管间质瘤1例、胃间质瘤2例、胃脂肪瘤1例, 胃异位胰腺7例). 无并发大出血病例; 术中穿孔2例, 均于保守治疗后治愈.
结论: 以ESD方法治疗上消化道病变, 不仅能完整切除病变, 同时可获得完整、准确的病理资料, 值得推广应用.
核心提示: 本研究回顾分析2012-05/2013-05在我院经内镜下剥离术(endoscopic submucosal dissection, ESD)的52例患者资料, 评价ESD在上消化道病变治疗的安全性、有效性, 结果显示: 对于ESD术中穿孔重在预防, 如已发生穿孔应及时使用金属夹闭合创面, 尽量做到"以镜救镜", 以胃镜技术处理胃镜并发症. 本院自开展ESD以来, 所有患者近期效果均良好, 远期疗效还需进一步随访观察.
引文著录: 沈睿炜, 孙聪, 郑惠虹, 孙常波, 李江波, 魏冬梅, 朱红梅, 王贤君. ESD术治疗上消化道疾病50例. 世界华人消化杂志 2014; 22(5): 730-734
Revised: January 5, 2014
Accepted: January 10, 2014
Published online: February 18, 2014
AIM: To discuss the clinical value of endoscopic submucosal dissection (ESD) for treating upper gastrointestinal lesions.
METHODS: A total of 52 patients who underwent ESD between May 2012 and May 2013 were retrospectively analyzed to assess the feasibility, safety and efficacy of ESD for treating upper gastrointestinal lesions.
RESULTS: Among 52 patients, 4 had esophageal lesions, 48 had gastric lesions. Postoperative pathology revealed that 40 were mucosal lesions, including esophageal papilloma (n = 2), cardiac hyperplastic polyps (n = 9), cardiac adenoma (n = 3), early gastric cancer (n = 2), high grade intraepithelial neoplasia (n = 3), low grade intraepithelial neoplasia (n = 5), gastric antral adenomatous polyps (n = 9), hyperplastic polyps (n = 5), and intestinal metaplasia (n = 2); and 12 were submucosal lesions, including esophageal leiomyoma (n = 1), esophageal gastrointestinal stromal tumor (n = 1), gastric heterotopic pancreas (n = 7), gastric body gastrointestinal stromal tumor (n = 2), and lipoma (n = 1). All the lesions were completely resected and were confirmed by pathologic examination. No severe bleeding occurred. Perforation occurred in two cases but was safely managed by conservative treatment.
CONCLUSION: ESD is a safe, effective and recommendable treatment for upper gastrointestinal lesions. It can not only resect the lesions completely, but also provide accurate pathologic information.
- Citation: Shen RW, Sun C, Zhen HH, Sun CB, Li JB, Wei DM, Zhu HM, Wang XJ. Endoscopic submucosal dissection for upper gastrointestinal lesions: Our experience with 50 cases. Shijie Huaren Xiaohua Zazhi 2014; 22(5): 730-734
- URL: https://www.wjgnet.com/1009-3079/full/v22/i5/730.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i5.730
消化系肿瘤是临床常见病、多发病. 据报道, 我国每年胃癌发病率为男性31.2/10万, 女性15.5/10万; 食管癌的发病率为15.15/10万[1]. 大部分肿瘤患者发现时均已达到中晚期, 即使外科根治术后, 5年生存率也较低, 严重影响人们的生活质量. 提高消化系肿瘤治疗有效性的关键在于早期发现、早期治疗. 近年来随着消化内镜技术的发展, 内镜下治疗消化道早期肿瘤的临床应用日益广泛, 消化内镜已从单纯的检查诊断进展到消化系肿瘤的治疗时期. 由剥脱活检术(strip biopsy)发展而来的内镜下黏膜切除术(endoscopic mucosal resection, EMR)、内镜下剥离术(endoscopic submucosal dissection, ESD)、内镜黏膜下肿瘤挖除术(endoscopic submucosal excavation, ESE)已逐步推广, 少数医院还可开展内镜全层切除术(endoscopic full-thickness resection, EFR). 这些由内而外的内镜治疗, 提高了肿瘤的切除率, 减少病灶残存, 可达到对早期消化道肿瘤的根治性切除[2]. 目前ESD治疗技术日益推广. 现将我院经ESD治疗的52例患者资料总结如下, 并讨论ESD的适应症、并发症及操作过程中出现的问题.
选取2012-05/2013-05在我院就诊, 经胃镜发现的上消化道病变共52例, 其中男20例, 女32例; 年龄35-73岁, 平均50.3岁. 病变组织活检提示为低或高级别上皮内瘤变、早期胃癌, 黏膜下占位, 直径>2 cm的宽基底息肉病变. 对黏膜下占位均进行超声内镜检查. 排除服用抗凝药、凝血功能异常者. 术前告知可能的益处及风险, 并签署知情同意书. 采用富士能EG-250WR5、EG-590WR胃镜. 内镜超声系统为富士能SP702-EUS909型, 超声探头频率酌情采用12、15或20 MHz. Olympus NM-4L-1注射针, Olympus FD-1-1热活检钳, Olympus HX-610-135L、HX-610-135止血夹, ERBE ICC 200高频电切装置和APC 300氩离子凝固器, Olympus钩形电刀(Hook knife)、IT刀(insulation-tipped knife). ESD治疗过程中胃镜前端附加透明帽.
1.2.1 术前检查: 术前了解病灶的大小、形态, 确定病灶的深度, 排除淋巴结转移. 黏膜病变采用表面喷洒0.4%靛胭脂染色观察. 对黏膜下肿瘤常规行超声内镜, 了解病变所在的层次、深度, 有无浸润特征; 较大者行上腹部CT增强, 排除腔外病变.
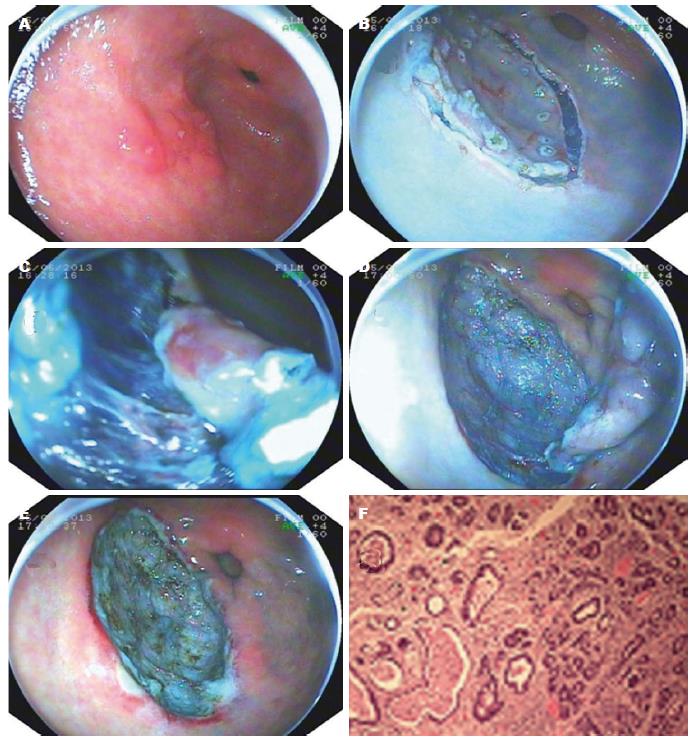
1.2.2 ESD手术: (1)标记: 用APC在病灶周围进行电凝标记. 对黏膜病灶标记点离开病灶边缘至少5 mm, 对黏膜下病变紧靠病灶边缘标记; (2)黏膜下注射: 将5 mL 0.2%靛胭脂(南京微创公司)、2 mL 1%肾上腺素和100 mL生理盐水混合配制的混合溶液, 自远端至近端, 于病灶边缘标记点外进行多点黏膜下注射, 每点至少2 mL至黏膜明显隆起; (3)切开病变外侧缘黏膜: 应用Hook刀沿病灶边缘标记点切开黏膜; (4)黏膜剥离、挖除病变: 借助透明帽, 通过反复的黏膜下注射、分离, 根据情况采用钩形电刀或IT刀将病灶从黏膜下层进行剥离, 大块、完整地切除病灶. 术中保持直视下操作, 并注意随时止血; (5)创面处理: 对创面可见的小血管应用氩离子血浆凝固术凝固治疗, 较大血管用热活检钳电凝, 必要时应用金属夹闭合创面或血管.
1.2.3 术后处理: 切除病灶标本应用大头针固定, 甲醛固定后送病理检查, 确定病变性质及切缘和基底部有无侵犯. 患者术后常规禁食1-3 d, 并予质子泵抑制剂、黏膜保护剂等治疗; 观察腹部体征及胃管引出物颜色, 判断有无消化系出血等并发症, 必要时给予抗感染治疗.
1.2.4 术后随访: 术后1-3 mo内镜随访, 了解人工溃疡愈合情况, 并在瘢痕处活检, 了解有无复发.
本组病例包括食管病变4例、胃部病变48例, 所有病变均经病理检查表明病灶完整切除, 切缘及基底部无病变残留. 4例食管病变中黏膜层病变2例, 术后病理提示为乳头状瘤; 黏膜下层病变2例, 超声内镜提示起源于黏膜肌层1例、黏膜下层1例, 术后病理分别为食管平滑肌瘤、间质瘤(低度恶性). 48例胃部病变中: (1)贲门部病变12例, 内镜下肉眼观察均为隆起性病变, 术后病理为增生性息肉9例、腺瘤3例; (2)胃体病变3例, 均为黏膜下占位, 病变直径2.0-3.0 cm, 超声内镜提示起源于黏膜肌层1例、黏膜下层1例、肌层1例; 术后病理提示间质瘤2例、脂肪瘤1例; (3)胃窦部病变33例, 其中黏膜层病变26例, 病变直径1.5-4.0 cm, 平均3.3 cm, 术后病理提示原位癌2例、高级别上皮内瘤变3例、低级别上皮内瘤变5例、腺瘤9例、增生性息肉5例、肠上皮化生2例; 另有黏膜下病变7例, 术前超声内镜提示起源于黏膜下层4例、肌层3例, 术后病理均为异位胰腺. ESD术中发生穿孔2例, 均经保守治疗后好转. 未有发生大出血转外科手术的病例(图1).
随着内镜设备的改进及技术的提高, 内镜下黏膜剥脱活检术逐步发展为黏膜切除术, 并进一步发展为内镜下黏膜剥离术、内镜黏膜下肿瘤挖除术. 近年来, 随着金属夹闭合技术的发展, 部分经验丰富的内镜医生甚至由治疗过程中的被动穿孔发展为主动穿孔, 可以行内镜全层切除术. 经过金属夹闭合创面及抑酸、抗感染等治疗, 内镜下治疗一般不会产生严重的并发症. 目前应用ESD治疗上消化道早期肿瘤及癌前病变日益增多, ESD属于微创治疗, 患者无需开腹手术, 痛苦小、住院天数少、术后不留体表瘢痕, 尤其是可以一次性完整切除病灶, 不仅利于对所切除标本的病理观察, 而且可以减少局部复发几率. 但ESD手术操作过程复杂, 手术时间较长, 对操作者的技术要求高, 并且需助手的熟练配合.
近年来日本确定了上消化道早期肿瘤内镜切除的治疗规范. Gotoda等[3]认为ESD治疗早期胃癌的适应症为: (1)分化型黏膜内癌、无溃疡发生、大小不限定; (2)溃疡、分化型黏膜内癌, 直径<3 cm; (3)sm1浸润分化癌、无溃疡发生、无淋巴及血行转移, 直径<3 cm; (4)低分化型黏膜内癌、无溃疡发生, 直径<2 cm. 2007年, Fujishiro等[4]提出ESD治疗食管病变的适应症为食管重度异型增生、原位癌、黏膜内癌. 我们体会, 术前必须严格掌握ESD的临床适应症, 这是保证内镜下安全、有效治疗的首要关键.
对于ESD操作, 我们有如下体会. (1)要重视黏膜染色剂靛胭脂的作用, 在部分病例, 只有使用了靛胭脂染色后其病变范围才能充分显现, 才可保证切除范围的充分性; (2)病灶边缘标记要清晰, 做病灶全周切开时要将全部标记点包含在内, 这是保证切除范围充分性的另一个要点; (3)黏膜下注射时要使黏膜层充分隆起, 并于手术过程中反复多次追加注射, 使切割操作易于进行, 并减少电刀对消化道肌层的损害; (4)黏膜下注射后抬举不良的病变, 即黏膜下注射后黏膜层不能充分隆起者, 多由溃疡瘢痕、反复活检后瘢痕黏连甚至肿瘤浸润所导致, 通常不宜进行ESD治疗, 因为此时发生穿孔的可能性较大. 我们体会, 若黏膜层与黏膜下层黏连不严重, 充分利用透明帽的推举作用, 谨慎操作, 胆大心细地循层剥离也可成功进行ESD. 本组有1例EMR术后8 mo局部复发的胃窦黏膜隆起性病变患者, 再次行ESD时抬举不良征阳性, 术中黏连明显, 与患者及家属充分沟通后, 于黏膜下多次、足量注射含肾上腺素、靛胭脂的生理盐水, 使黏膜下层与肌层尽可能分离, 在保证视野、保持直视下操作的前提条件下, 沿肌层上缘谨慎、仔细地进行切割, 最终ESD顺利完成; (5)对于黏膜下占位的剥离, 去除黏膜下占位的顶端黏膜, 充分暴露瘤体, 可沿占位边缘一次性完整大块剥离; 如占位有包膜, 应尽量不破坏包膜的完整性, 这样可减少占位的残存, 防止肿瘤的种植转移, 减少肿瘤的局部复发[5].
出血和穿孔是ESD治疗过程的两种主要并发症. (1)关于出血的预防及处理. Fujishiro[6]报道应用ESD治疗382例胃部肿瘤患者, 术中出血13例(3.4%), 术后再出血8例(2.1%). ESD术中出血一旦发生, 会严重影响内镜视野, 而盲目止血容易发生穿孔, 所以对术中所见血管的预处理极其重要, 对于可能出血的血管要及时电凝, 对于黏膜下层较细小的血管, 可以用Hook刀头端或IT刀直接电凝; 对于较粗的血管, 则使用热活检钳夹闭后电凝血管. 如发生术中出血需及时、准确止血, 不可盲目操作. 术中出血较少时, 可用含去甲肾上腺素的冰盐水进行冲洗, 明确出血位置后选择相应措施止血. 如出血量较大, 术中不能止血, 有时不得不中止手术, 转外科手术治疗. 病灶完整剥离后, 应用APC烧灼创面上所有裸露的小血管, 必要时应用金属夹缝合创面, 可达到预防术后迟发出血的目的. 术中出血较多或术中穿孔者, 术后应常规放置胃管引流, 观察胃管内引流物颜色、数量, 如有数十分钟内引出约100 mL以上血性液体者, 需行急诊胃镜检查, 对动脉出血可金属夹闭合血管, 静脉渗血可用热活检钳电凝止血. 本组术者术中止血充分, 本组未发生因术中出血影响视野而中止ESD转外科手术治疗的病例, 也无术后出血病例; (2)关于穿孔的预防及处理. 临床文献报道ESD穿孔的发生率为0%-8%[7-10]. Fujishiro等[11]认为避免术中发生消化系穿孔最重要的要点是在ESD术中始终保持操作视野清晰. ESD术中穿孔一般较小, 术中基本上都能及时发现. 操作者术中应间断进行腹部触诊检查, 腹胀明显时要及时抽吸出胃腔内气体, 保持胃腔适度充气即可, 若可保持良好视野则应尽量少充气. 发生消化系穿孔时可及时用金属夹缝合, 一般不必终止治疗. 气腹明显时可用20 mL注射器, 在右上腹进行腹腔穿刺排气. 因胃镜治疗前患者处于禁食状态, 术中胃腔内液体较少, 穿孔所致的腹膜炎体征往往较轻, 金属夹闭合后气腹往往能得到控制. 若穿孔较大, 可在内镜下将大网膜吸引入胃腔, 应用金属夹固定大网膜封堵穿孔[12]. 对于穿孔病例, 术中夹闭结合术后禁食、胃肠减压、选择合理体位、静脉使用抗生素等, 保守治疗一般能成功[13-15]. 本组出现2例穿孔, 均为黏膜下占位, 超声内镜提示起源于肌层、黏膜下层各1例, 2例均术中黏膜下注射生理盐水、靛胭脂、肾上腺素混合液后抬举不良, 分离瘤体过程中出血较多影响视野, 同时钩刀分离过程中, 钩刀勾端无意中倾向于腔外, 结果造成术中点状穿孔. 穿孔发生后, 我们在穿孔部位使用金属夹闭合创面, 后继续完整切除病灶, 术后观察无严重腹膜炎. 我们体会: ESD术中要充分黏膜下注射, 同时利用胃镜前端透明帽的推举作用, 使瘤体与其下层分离; 使用钩刀时, 要使勾端倾向于腔内, 在直视下完成切割, 可防止勾端造成的穿孔.
总之, 对于ESD术中穿孔重在预防, 如已发生穿孔应及时使用金属夹闭合创面, 尽量做到"以镜救镜", 以胃镜技术处理胃镜并发症. 本院自开展ESD以来, 所有患者近期效果均良好, 远期疗效还需进一步随访观察.
近年来随着消化内镜技术的发展, 内镜下治疗消化道早期肿瘤的临床应用日益广泛, 消化内镜已从单纯的检查诊断进展到消化系肿瘤的治疗时期. 由剥脱活检术发展而来的内镜下黏膜切除术(endoscopic mucosal resection)、内镜下剥离术(endoscopic submucosal dissection, ESD)、内镜黏膜下肿瘤挖除术(endoscopic submucosal excavation)已逐步推广, 少数医院还可开展内镜全层切除术(endoscopic full-thickness resection). 这些由内而外的内镜治疗, 提高了肿瘤的切除率, 减少病灶残存, 可达到对早期消化道肿瘤的根治性切除.
欧希龙, 副教授, 东南大学中大医院消化科
ESD手术操作过程复杂, 手术时间较长, 对操作者的技术要求高, 并且需助手的熟练配合.
近年来日本确定了上消化道早期肿瘤内镜切除的治疗规范. Gotoda等认为ESD治疗早期胃癌的适应症为: (1)分化型黏膜内癌、无溃疡发生、大小不限定; (2)溃疡、分化型黏膜内癌, 直径<3 cm; (3)sm1浸润分化癌、无溃疡发生、无淋巴及血行转移, 直径<3 cm; (4)低分化型黏膜内癌、无溃疡发生, 直径<2 cm.
本研究设计合理, 结果可靠, 讨论丰富, 有较好的参考价值.
编辑: 田滢 电编:鲁亚静
| 2. | Mochizuki Y, Saito Y, Tanaka T, Nitta N, Yamada H, Tsujikawa T, Murata K, Fujiyama Y, Andoh A. Endoscopic submucosal dissection combined with the placement of biodegradable stents for recurrent esophageal cancer after chemoradiotherapy. J Gastrointest Cancer. 2012;43:324-328. [PubMed] [DOI] |
| 3. | Gotoda T, Iwasaki M, Kusano C, Seewald S, Oda I. Endoscopic resection of early gastric cancer treated by guideline and expanded National Cancer Centre criteria. Br J Surg. 2010;97:868-871. [PubMed] [DOI] |
| 4. | Fujishiro M. Perspective on the practical indications of endoscopic submucosal dissection of gastrointestinal neoplasms. World J Gastroenterol. 2008;14:4289-4295. [PubMed] [DOI] |
| 6. | Fujishiro M. Endoscopic submucosal dissection for stomach neoplasms. World J Gastroenterol. 2006;12:5108-5112. [PubMed] [DOI] |
| 7. | Tanaka S, Oka S, Kaneko I, Hirata M, Mouri R, Kanao H, Yoshida S, Chayama K. Endoscopic submucosal dissection for colorectal neoplasia: possibility of standardization. Gastrointest Endosc. 2007;66:100-107. [PubMed] [DOI] |
| 8. | Miyamoto S, Muto M, Hamamoto Y, Boku N, Ohtsu A, Baba S, Yoshida M, Ohkuwa M, Hosokawa K, Tajiri H. A new technique for endoscopic mucosal resection with an insulated-tip electrosurgical knife improves the completeness of resection of intramucosal gastric neoplasms. Gastrointest Endosc. 2002;55:576-581. [PubMed] [DOI] |
| 9. | Yamamoto H, Kawata H, Sunada K, Satoh K, Kaneko Y, Ido K, Sugano K. Success rate of curative endoscopic mucosal resection with circumferential mucosal incision assisted by submucosal injection of sodium hyaluronate. Gastrointest Endosc. 2002;56:507-512. [PubMed] [DOI] |
| 11. | Fujishiro M, Yahagi N, Kakushima N, Kodashima S, Muraki Y, Ono S, Kobayashi K, Hashimoto T, Yamamichi N, Tateishi A. Successful nonsurgical management of perforation complicating endoscopic submucosal dissection of gastrointestinal epithelial neoplasms. Endoscopy. 2006;38:1001-1006. [PubMed] [DOI] |