修回日期: 2013-12-23
接受日期: 2013-12-27
在线出版日期: 2014-02-18
目的: 探讨内镜黏膜下剥离术(endoscopic submucosal dissection, ESD)治疗直肠类癌的应用价值.
方法: 对内镜发现的直肠黏膜下肿瘤, 通过微超声探头检查, 超声内镜明确诊断17例来源于黏膜下层、没有固有肌层受累和淋巴结或远处转移的直肠类癌, 用Dual Knife和IT-2 Knife进行ESD治疗, 并进行术后随访.
结果: 17例成功完成ESD治疗, 完整切除率达100%. 病变最大直径0.4-1.2 cm(平均0.72 cm), 手术时间7-25 min(平均9.4 min). 无1例出现迟发性出血及穿孔. 所有ESD剥离肿瘤包膜完整, 基底和切缘0.2 cm以内均未见病变累及. 术后随访3-36 mo, 无1例病变残留和复发.
结论: ESD治疗直径≤2.0 cm、未侵犯固有肌层的直肠类癌安全、有效, 可以一次性完整切除病变, 提供完整的病理学诊断资料.
核心提示: 直肠类癌是一种生长缓慢、恶性程度低、病程较长的神经内分泌肿瘤. 目前越来越多的直肠类癌能够在早期通过内镜下一体化诊断及治疗, 而内镜黏膜下剥离术(endoscopic submucosal dissection)的应用也使类癌在内镜下治疗的完整切除率和安全性大大提高, 复发率下降.
引文著录: 王海波, 吴会超, 彭丹若, 刘黔, 庹必光. 内镜黏膜下剥离术治疗直肠类癌17例. 世界华人消化杂志 2014; 22(5): 709-712
Revised: December 23, 2013
Accepted: December 27, 2013
Published online: February 18, 2014
AIM: To assess the clinical efficacy and safety of endoscopic submucosal dissection (ESD) for rectal carcinoid tumors.
METHODS: Seventeen consecutive patients with 17 carcinoid tumors were enrolled. Carcinoid tumors were diagnosed by colonoscopy and endoscopic ultrasonography, and further confirmed by histopathologic examination of resected specimens. There was no endoscopic evidence of muscularis propria invasion or evidence of lymph node or distant metastasis. Tumors were resected by ESD with the Dual Knife and IT-2 Knife. All cases were followed after operation.
RESULTS: Complete resection was achieved in all 17 cases (100%). The size of tumors ranged from 0.4 to 1.2 cm (average 0.72 cm). The operative time was 7-25 min (average 9.4 min). No late hemorrhage or perforation occurred. The capsules of all resected tumors were complete. The bases of tumors and the edges within 0.2 cm from tumors had no lesions. No residual lesion or recurrence occurred during the follow-up period of 3-36 mo.
CONCLUSION: ESD is feasible and effective for patients with a rectal carcinoid tumor smaller than 10, but without muscularis propria invasion.
- Citation: Wang HB, Wu HC, Peng DR, Liu Q, Tuo BG. Endoscopic submucosal dissection for rectal carcinoid tumors: An analysis of 17 cases. Shijie Huaren Xiaohua Zazhi 2014; 22(5): 709-712
- URL: https://www.wjgnet.com/1009-3079/full/v22/i5/709.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i5.709
内镜黏膜下剥离术(endoscopic submucosal dissection, ESD)是由内镜黏膜切除术(endoscopic mucosal resection, EMR)演变出一种新技术. 由于较大较深的消化系病变在EMR治疗时, 容易病变残留或复发, 为了避免EMR的局限性, 一次性能将较大较深的消化系病变完整地切除, 并将整块病变送病理组织学检查, ESD显示出明显的优势, 而且同时具备微创治疗的优越性[1]. 我院消化内镜科自开展ESD新技术治疗方法3年以来, 成功切除17例直肠类癌, 而且术后经病理及免疫组织化学染色检查均证实为类癌, 取得了较好的临床效果. 现报告如下.
选择2010-04/2013-04我院消化内镜科经肠镜检查发现的直肠黏膜下肿瘤经超声内镜(endoscopic ultrasonography, EUS)检查, 有17例符合直肠类癌超声内镜影像学改变[2], 然后患者住院后在全麻下行ESD治疗. 其中男患12例, 女患5例. 年龄31-66岁(平均年龄为45.5岁). 我院消化内镜科采用ERBE公司VIO-200D高频电切装置和APC300氩离子凝固器. Olympus公司CF Q260电子结肠镜; KD-650L型Dual刀和KD-611L型IT-2刀; NM-4L-1注射针, FD-410LR热活检钳, FG-8U-1异物钳, HX-610-90金属止血铗.
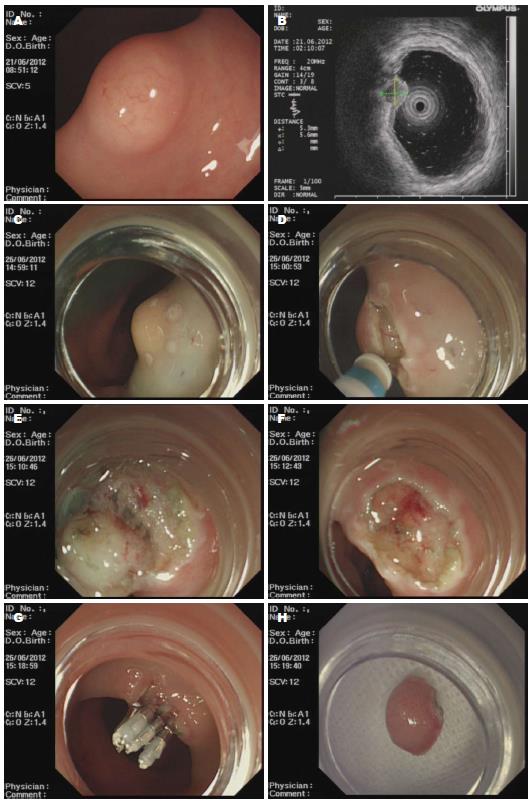
1.2.1 手术: 所有患者在术前均充分告知手术的必要性和风险性, 患者及其委托人签署手术知情同意书, 并经术前常规检查明确无内镜治疗禁忌症, 腹部彩超、X线或CT检查常规排除有无肝、肺等远处转移. 手术步骤: (1)观察病变: 内镜头端附加透明帽后, 充分暴露局部病变, 活检钳触动病变均有黏膜下滑动; (2)标记: 应用Dual刀头端于要切除的病变边缘进行电凝标记; (3)黏膜下注射: 使用0.0005%肾上腺素生理盐水混合溶液, 为了手术中分辩剥离层次, 还混有少量靛胭脂, 用注射针于病变标记点处进行多点黏膜下注射, 观察有无抬举征; (4)预切开: 应用Dual刀沿标记点环形切开黏膜, 这时可观察到一些部分肿瘤表面; (5)剥离: 根据病变大小应用Dual刀或/和IT-2刀进行黏膜下剥离, 剥离过程中可反复进行黏膜下注射, 保持病变与肌层分离, 直至完整剥离肿瘤; (6)创面处理: 切除病变后, 观察创面基底部有无残留, 然后应用APC或热活检钳处理创面预防出血. 对于较大创面可采用金属止血铗夹闭创面.
1.2.2 术后处理: 处理创面后应用异物钳将肿瘤取出, 观察包膜是否完整, 并放入formalin固定液中, 送病理组织学检查.
1.2.3 术后观察: 患者有无腹痛、腹胀症状, 有无肛门滴血表现. 术后常规禁食、卧床休息, 使用止血药和补液治疗, 24 h后如无并发症, 可进流质饮食. 术后第3个月复查内镜, 观察局部愈合情况及病变有无残留; 第6、12、24、36个月分别复查内镜, 了解病变有无复发.
17例中肿瘤位于距肛门约4-12 cm直肠处. 剥离病变时证实均来源于黏膜下层, 固有肌层完整. 本组病例均成功完成ESD治疗, 完整切除率达100%, 切除病变最大直径0.4-1.2 cm, 平均0.72 cm. 病变部位标记至内镜下完整切除病变及处理创面时间7-25 min, 平均9.4 min.
严格按照手术步骤(标记、黏膜下注射、预切开、剥离、处理创面)进行手术. 术中有少量出血, 均采用APC或热活检钳止血成功, 无1例出现迟发性出血及穿孔. 所有ESD切除的肿瘤包膜完整(图1), 病理报告基底和切缘0.2 cm以内均未见病变累及, 且所有病变均得到病理及免疫组织化学染色检查证实为直肠类癌, 超声内镜诊断率达100%.
患者术后第2天均予进食流质, 住院4-6 d, 平均4.4 d. 17例患者目前术后随访了3 mo的1例, 随访了6 mo的2例, 随访了1年的5例, 随访了2年的8例, 随访了3年的1例, 所有患者的创面均愈合良好, 无1例病变残留或复发.
直肠类癌是一种生长缓慢、恶性程度低、病程较长的神经内分泌肿瘤, 其发病率已位居胃肠道类癌的首位[3], 好发于40-60岁的中老年人群, 且男患多于女患, 本组17例病例平均年龄45.5岁, 男患12例, 女患5例, 均符合文献报道[4].
直肠类癌是具有潜在恶性的肿瘤, 判断其良恶性的主要依据在于肿瘤大小及其是否侵入肌层, 目前普遍认为, 直径≤1 cm的直肠类癌肿瘤鲜有肌层侵犯、淋巴结受累及远处转移[5,6], 对于此类肿瘤, 内镜下一体化诊断及治疗已逐渐受到内镜医师的重视.
如今超声内镜技术的应用可对消化系管壁黏膜下生长的肿瘤性质进行更精确的鉴别诊断, 特别是对于较小黏膜下肿瘤的诊断精确度高, 这对于直肠类癌的诊断、良恶性判断及治疗方案的选择有着重大意义. 本组17例病例的术后组织经病理及免疫组织化学染色检查证实均为直肠类癌, 超声内镜诊断率达100%, 这与多篇文献[7, 8]报道结果一致, 由此可见超声内镜诊断直肠类癌已是术前常规检查项目.
直肠类癌肿瘤直径≤1 cm、未侵犯肌层及肿瘤表面无溃疡或凹陷是目前被大多数学者认为符合内镜下治疗的3条标准[9,10]. 内镜治疗方法既往以标准的EMR为主[11], 但近年来随着ESD新技术的开展, 使病变切除更完整、更彻底. EMR对于消化道较大的平坦病变、早期癌和黏膜下肿瘤, 只能进行分块切除, 不能获得完整的病理学诊断资料, 或者在无法确定解剖层次的情况下切除病变, 大大增加病变残留及复发的风险, 而ESD可以大块、完整地切除病变, 术后可将完整的病变组织进行全面的病理组织学检查, 提供完整的病理诊断依据, 并判断患者是否治愈及是否需要进一步治疗, 可见ESD较EMR更能体现微创手术的优越性和有效性.
而针对此类病变, Lee等[12]在两组肿瘤大小无统计学差异的患者中, EMR和ESD的完整切除率分别为89.3%、100%, 且两组的并发症发生率无统计学差异, 无1例复发. Baek等[13]报道12例直肠类癌患者经由EMR或ESD的完整切除率均达100%, 无1例出现并发症. 阮荣蔚等[14]对直径<1.5 cm的19例直肠类癌肿瘤行ESD治疗, 均完整切除病灶, 1例术中直肠小穿孔, 1例术后2 d出现创面边缘小动脉搏动性出血, 均随即采用金属止血铗夹闭妥善处理, 所有病例随访1-4年, 无1例复发及远处转移. 另有文献[15]报道16例超声内镜诊断的直肠类癌予ESD治疗, 病灶均一次性完整切除, 手术时间25-55 min, 6例术中出血, 予电凝及金属止血铗止血成功, 随访6-24 mo, 均无复发. 本组研究中, 笔者选取3年来我院消化内镜科收治的17例直肠类癌病例, 术前常规行超声内镜检查, 在排除恶性倾向的可能性后均行ESD, 手术完整切除率达100%, 无1例出现迟发性出血及穿孔, 随访3-36 mo, 无1例病变残留及复发. 以上数据提示, ESD在直肠类癌的内镜治疗上取得了较好的疗效, 并随着内镜技术的发展及内镜医师操作水平的提高, ESD将成为治疗良性直肠类癌高效、安全的内镜主要手术方式, 但由于ESD的开展时间较短, 病例数相对较少, 随访时间相对较短, ESD治疗直肠类癌的远期疗效有待进一步观察.
直肠类癌是一种恶性程度低的神经内分泌肿瘤, 但发展缓慢, 其恶性程度的判断主要取决于肿瘤的大小、是否侵入肌层及组织学分化程度. 随着内镜治疗技术的不断提高, 直肠类癌的内镜治疗已成为研究热点.
许剑民, 教授, 上海市复旦大学附属中山医院普外科; 卢宁, 副主任医师, 中国人民解放军兰州军区乌鲁木齐总医院肿瘤科
内镜黏膜下剥离术(endoscopic submucosal dissection, ESD)可以完整地切除病变, 较内镜黏膜切除术(endoscopic mucosal resection, EMR)更能体现微创手术的优越性和有效性, 但是需要较高的内镜治疗技术, 如何掌握ESD操作技巧、减少并发症的发生, 体现该技术的应用价值是研究热点.
Yamaguchi等指出ESD切除直径≤1 cm的直肠类癌是安全有效的. Park等报道在两组肿瘤大小无统计学差异的患者中, EMR和ESD的完整切除率分别为71.0%、90.3%, 而且并发症较EMR少.
随着内镜下一体化诊断及治疗技术的不断提高, 对于直径≤2.0 cm、未侵犯固有肌层的直肠类癌, 本文从治疗效果、有无并发症及随访情况, 认为ESD仍是首选治疗方法, 值得推广.
本文目标明确, 设计合理, 实验数据可靠, 具有一定的创新性, 研究结果有一定科学意义.
编辑: 田滢 电编:鲁亚静
| 3. | Kinoshita T, Kanehira E, Omura K, Tomori T, Yamada H. Transanal endoscopic microsurgery in the treatment of rectal carcinoid tumor. Surg Endosc. 2007;21:970-974. [PubMed] |
| 4. | 程 天明, 秦 和平. 消化道类癌的诊治现状. 现代消化及介入诊疗. 2010;15:184-187. |
| 5. | Bates HR. Carcinoid tumors of the rectum: a statistical review. Dis Colon Rectum. 1966;9:90. [PubMed] |
| 6. | Naunheim KS, Zeitels J, Kaplan EL, Sugimoto J, Shen KL, Lee CH, Straus FH. Rectal carcinoid tumors--treatment and prognosis. Surgery. 1983;94:670-676. [PubMed] |
| 7. | Ishii N, Horiki N, Itoh T, Maruyama M, Matsuda M, Setoyama T, Suzuki S, Uchida S, Uemura M, Iizuka Y. Endoscopic submucosal dissection and preoperative assessment with endoscopic ultrasonography for the treatment of rectal carcinoid tumors. Surg Endosc. 2010;24:1413-1419. [PubMed] [DOI] |
| 8. | 周 平红, 姚 礼庆, 钟 芸诗, 徐 美东, 高 卫东, 何 国杰, 张 扶群, 陈 魏峰, 秦 新裕. 直肠类癌的内镜超声诊断和内镜黏膜下切除. 中华消化内镜杂志. 2006;23:175-178. |
| 10. | Konishi T, Watanabe T, Kishimoto J, Kotake K, Muto T, Nagawa H. Prognosis and risk factors of metastasis in colorectal carcinoids: results of a nationwide registry over 15 years. Gut. 2007;56:863-868. [PubMed] |
| 11. | Kim YJ, Lee SK, Cheon JH, Kim TI, Lee YC, Kim WH, Chung JB, Yi SW, Park S. [Efficacy of endoscopic resection for small rectal carcinoid: a retrospective study]. Korean J Gastroenterol. 2008;51:174-180. [PubMed] |
| 12. | Lee DS, Jeon SW, Park SY, Jung MK, Cho CM, Tak WY, Kweon YO, Kim SK. The feasibility of endoscopic submucosal dissection for rectal carcinoid tumors: comparison with endoscopic mucosal resection. Endoscopy. 2010;42:647-651. [PubMed] [DOI] |
| 13. | Baek IH. Endoscopic submucosal dissection or conventional endoscopic mucosal resection is an effective and safe treatment for rectal carcinoid tumors: a retrospective study. J Laparoendosc Adv Surg Tech A. 2010;20:329-331. [PubMed] |