修回日期: 2013-12-14
接受日期: 2013-12-27
在线出版日期: 2014-02-18
目的: 通过检测肝细胞癌(hepatocellular carcinoma, HCC)患者肝癌、癌旁组织及正常肝组织中Ⅱ型多磷酸肌醇4-磷酸酶(inositol polyphosphate 4-phosphatase type Ⅱ, INPP4B)和磷酸酯酶(phosphatase and tensin homolog deleted on chromosome ten, PTEN)的表达情况, 结合HCC的临床病理特征, 探讨其在HCC发生发展中的作用及意义.
方法: 应用免疫组织化学方法分别检测74例肝癌组织、对应癌旁组织及30例正常肝脏组织中INPP4B和PTEN的表达情况.
结果: (1)肝癌组织中INPP4B和PTEN的表达水平显著低于癌旁组织和正常肝脏组织(均P<0.05); (2)INPP4B和PTEN的表达与HCC患者的性别、年龄、肝硬化病史无关, 与分化程度、包膜完整程度相关. INPP4B的表达与肿瘤直径相关, PTEN的表达与肿瘤直径无关; (3)肝癌组织中INPP4B和PTEN的表达呈正相关(r = 0.561, P = 0.000).
结论: INPP4B和PTEN在肝癌组织中的低表达及两者表达呈正相关提示两者可能共同参与了HCC的发生发展.
核心提示: Ⅱ型多磷酸肌醇4-磷酸酶(inositol polyphosphate 4-phosphatase type Ⅱ, INPP4B)和磷酸酯酶(phosphatase and tensin homolog deleted on chromosome ten, PTEN)在肝癌组织中的表达明显减低, 且两者表达呈正相关; INPP4B和PTEN的表达与肿瘤分化程度、包膜完整程度相关; 提示两者可能共同参与肝细胞癌(hepatocellular carcinoma)的发生发展及侵袭转移.
引文著录: 张洋洋, 李建生, 贺德志, 蒋冬. INPP4B和PTEN蛋白在肝细胞癌中的表达及其意义. 世界华人消化杂志 2014; 22(5): 695-699
Revised: December 14, 2013
Accepted: December 27, 2013
Published online: February 18, 2014
AIM: To investigate the expression of INPP4B and PTEN in hepatocellular carcinoma (HCC) and to analyze their correlation with clinicopathological parameters of HCC patients.
METHODS: By immunohistochemistry, the expression of INPP4B and PTEN was detected in 74 HCC tissue, 74 matched tumor-adjacent atypical hyperplasia tissues and 30 normal tissues. Correlations between INPP4B and PTEN expression and clinicopathological parameters were analyzed by statistical analysis.
RESULTS: The levels of INPP4B and PTEN expression in HCC were significantly lower than those in histologically normal hepatic tissues (both P < 0.05). INPP4B and PTEN protein expression in HCC was not statistically correlated with age, sex, or cirrhosis background, but was significantly correlated with degree of differentiation and presence of tumor capsule. INPP4B protein expression, not PTEN protein expression, was correlated with tumor size. There was a positive correlation between INPP4B protein expression and PTEN protein expression in HCC (r = 0.561, P = 0.000).
CONCLUSION: The low expression of INPP4B and PTEN proteins in HCC and their positive correlation suggest that they are possibly involved in the occurrence and development of HCC.
- Citation: Zhang YY, Li JS, He DZ, Jiang D. Significance of expression of INPP4B and PTEN in hepatocellular carcinoma. Shijie Huaren Xiaohua Zazhi 2014; 22(5): 695-699
- URL: https://www.wjgnet.com/1009-3079/full/v22/i5/695.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i5.695
肝细胞癌(hepatocellular carcinoma, HCC), 简称肝癌, 是目前常见的恶性肿瘤之一, 在我国HCC年发病率位居第4位, 而肿瘤死亡率居第2位[1]. 其恶性程度高, 预后普遍较差. 虽然目前有多种治疗方法可供选择, 但疗效甚微, 即使根治性手术切除术后复发率仍然很高. 因此, 寻找新型的、有效的治疗方法十分必要. 然而, HCC的病理生理机制不完全清楚, 环境因素和遗传因素都参与其中, 各种细胞信号传导通路的失调、DNA修复调节基因的缺失、原癌基因的激活、抑癌基因的失活及细胞周期调控基因的失控等因素促进了HCC的发生发展[2]. Ⅱ型多磷酸肌醇4-磷酸酶(inositol polyphosphate 4-phosphatase type II, INPP4B)是一种新发现的脂质磷酸酶, 作为一个潜在的肿瘤抑制因子, 在前列腺癌、乳腺癌、卵巢癌、黑色素瘤、白血病等多种恶性肿瘤中表达缺失[3]. 第10号染色体上缺失的与张力蛋白同源的磷酸酯酶(phosphatase and tensin homolog deleted on chromosome ten, PTEN), 是一种位于10号染色体(10q23)的抑癌基因, 兼具有脂质磷酸酶活性和蛋白磷酸酶活性, 参与细胞周期以及多种信号传导途径的负调控, 抑制细胞恶性转化[4]. INPP4B和PTEN的缺失与肿瘤的发生发展密切相关. 本研究通过免疫组织化学方法检测肝癌组织、癌旁组织、正常肝脏组织中INPP4B和PTEN的表达, 进一步阐明HCC的发病机制, 探讨INPP4B和PTEN在HCC发生发展过程中的作用和意义, 为日后研发相应的分子靶向治疗药物提供理论支持.
选择2010-07/2013-03郑州大学第一附属医院肝胆外科及肝移植科手术切除后经病理组织学切片HE染色证实为HCC和对应癌旁组织(距离肿瘤2 cm)74例, 其中女18例, 男56例; 年龄20-75岁. 患者术前均未接受任何抗肿瘤治疗, 具有完整的临床病理资料. 并收集因肝破裂、外伤后手术切除的肝脏标本30例作为对照组, 经病理组织学切片HE染色证实为正常肝脏组织. 所有标本手术切除后经10%甲醛固定石蜡包埋存档备用. 鼠抗人PTEN/MMACl(CT)单克隆抗体(上海瑞齐实业科技有限公司); 鼠抗人INPP4B单克隆抗体(Abcam公司); DAB试剂盒(北京中杉金桥生物技术有限公司); SP-9000免疫组织化学试剂盒、即用型一步法(非生物素)检测试剂盒(迈新公司).
标本经10%多聚甲醛固定, 制作石蜡切片, 抗原修复选择热修复, 一抗按1:200稀释, 孵育选择4 ℃过夜(14-16 h), 具体步骤应用SP-9000免疫组织化学试剂盒按照说明书进行, 显微镜下观察. 结果判断: 免疫组织化学: 染色的切片由两位有经验的病理医师采用双盲法读片, 结果判断兼顾阳性细胞率和染色强度, 综合两者计分称为阳性强度, 作为判断标准. 随机观察10个高倍镜视野, 细胞中出现明显的棕黄色颗粒为阳性细胞. 依据染色强度计分: 着色强者计3分, 着色中度计2分, 着色弱者计1分. 依据每个高倍镜视野下的阳性细胞率计分: 阳性细胞率>75%计4分, 50%-75%计3分, 25%-50%计2分, 5%-25%计1分, <5%计0分. 两种记分相加即为阳性强度. 阳性强度0-2分为阴性(-), 3-7为阳性(+). 染色结果均经3次重复观察.
统计学处理 运用SPSS17.0统计软件进行数据分析, INPP4B和PTEN在HCC中的相关性采Spearman等级相关分析. INPP4B和PTEN在肝癌组织、癌旁组织、正常组织中的表达差异以及与各临床病理类型的关系采用χ2检验进行分析. P<0.05为差异有统计学意义.
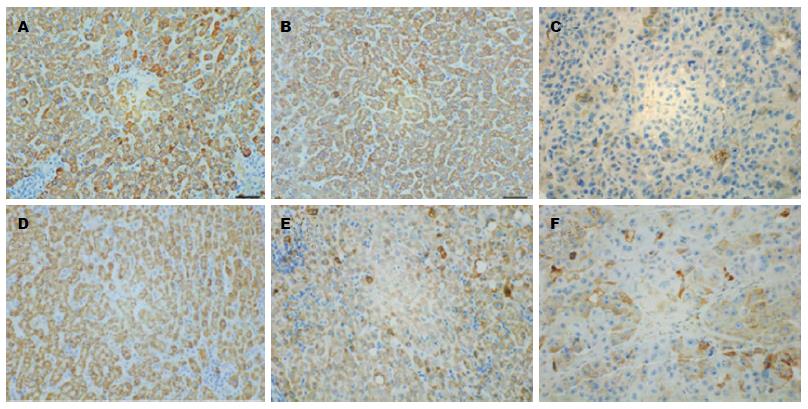
INPP4B与PTEN在肝癌组织及癌旁组织中的表达均明显低于正常组织, 差异有统计学意义(P<0.05)(图1, 表1). INPP4B和PTEN的表达与HCC患者的性别、年龄、肝硬化病史无关, 与分化程度、包膜完整程度相关. INPP4B的表达与肿瘤直径相关, PTEN的表达与肿瘤直径无关(表2). INPP4B与PTEN 在肝癌组织中的表达具有相关性, 两者的表达呈正相关(χ2 = 34.07, r = 0.561, P = 0.000)(表3).
| 分组 | n | INPP4B阳性 | PTEN阳性 |
| 癌组织 | 74 | 26 | 40 |
| 癌旁组织 | 74 | 57 | 67 |
| 正常组织 | 20 | 18 | 20 |
| χ2 | 35.537 | 34.028 | |
| P值 | 0.000 | 0.000 |
| 临床特征分类 | n | INPP4B | PTEN | ||||||
| + | - | χ2 | P值 | + | - | χ2 | P值 | ||
| 年龄(岁) | 0.350 | 0.554 | 3.731 | 0.053 | |||||
| >35 | 63 | 23 | 40 | 37 | 26 | ||||
| ≤35 | 11 | 3 | 8 | 3 | 8 | ||||
| 性别 | 0.565 | 0.452 | 0.014 | 0.906 | |||||
| 男 | 56 | 21 | 35 | 32 | 24 | ||||
| 女 | 18 | 5 | 13 | 8 | 10 | ||||
| 肿瘤直径(cm) | 5.071 | 0.024 | 0.718 | 0.397 | |||||
| >5 | 30 | 6 | 24 | 18 | 12 | ||||
| ≤5 | 44 | 20 | 24 | 22 | 22 | ||||
| 肝硬化病史 | 0.554 | 0.457 | 0.728 | 0.394 | |||||
| 有 | 53 | 20 | 33 | 27 | 26 | ||||
| 无 | 21 | 6 | 15 | 13 | 8 | ||||
| 分化程度 | 10.687 | 0.001 | 14.255 | 0.000 | |||||
| 高、中 | 35 | 19 | 16 | 27 | 8 | ||||
| 低 | 39 | 7 | 32 | 13 | 26 | ||||
| 肿块包膜 | 10.377 | 0.001 | 11.622 | 0.001 | |||||
| 有 | 18 | 12 | 6 | 16 | 2 | ||||
| 无 | 56 | 14 | 42 | 24 | 32 | ||||
| INPP4B | P值 | r值 | |||
| + | - | ||||
| PTEN | + | 26 | 14 | 0.000 | 0.561 |
| - | 0 | 34 | |||
PI3K/AKT/mROT信号通路参与细胞生长、增殖和分化, 其调节异常在肿瘤的恶性增殖、血管生成和侵袭转移中起着重要作用[5]. PI3K/AKT/mROT信号通路的激活与HCC发生发展呈负相关, 使得其成为重要的分子治疗靶点之一[2]. 在人类恶性肿瘤中, PI3K激活催化形成两个主要的磷脂池: 磷脂酰肌醇-3, 4, 5三磷酸[PI(3, 4, 5)P3]和磷脂酰肌醇-3, 4二磷酸[PI(3, 4, )P2). [PI(3, 4, 5)P3]和[PI(3, 4)P2]都可与AKT和PDK1的PH结构域结合, 促使PDK1催化AKT磷酸化激活, 促进肿瘤细胞增殖、侵袭和转移[6]. INPP4B包含N-末端C2脂质结合结构域, 内部NHR 2和C-末端磷酸酶结构域. INPP4B C2域优先结合磷脂酸和PI(3, 4, 5)P3, 可水解PI(3, 4, )P2的D4位磷酸基团, 使其去磷酸化为3-磷酸磷脂酰肌醇[PI(3)P][3]. PTEN是一种多功能蛋白质, 定位于常染色体10q23.3, 共含8个内含子和9个外显子, 全长约200 kb, 是第1个具有双特异性磷酸酶活性的抑癌基因. PTEN水解PI(3, 4, 5)P3的D3位磷酸基团, 使其去磷酸化形成PI(4, 5)P2[7]. PTEN和INPP4B的缺失可能导致各自的底物PI(3, 4, 5)P3和PI(3, 4)P2的堆积, 两底物共同促进Akt活性最大化, 增强细胞活性, 导致肿瘤细胞锚定独立生长[6].
INPP4B作为上皮肿瘤的抑癌基因, 参与PI3K信号通路的调节, 在人类乳腺癌中可检测到INPP4B杂合性缺失(loss of heterozygosity, LOH), 并与肿瘤分级、肿瘤大小、激素受体缺失有关, 在三阴性或基底细胞样乳腺癌亚型中, INPP4B表达下降及LOH较为显著, 随访发现, 这类患者通常预后差, 肿瘤复发率高[8,9]. 在随机抽取的乳腺癌和卵巢癌患者中, INPP4B低水平表达者往往出现较早的淋巴结转移, 且肿瘤患者的生存时间明显缩短[6]. 有研究表明, 在卵泡颗粒细胞中INPP4B表达下降可使PI3K/Akt信号传导通路超活化, 导致卵泡形成时卵巢内环境缺陷, 促使卵巢畸胎瘤形成[10]. Hodgson等[11]通过对正常前列腺上皮和前列腺癌组织的免疫组织化学染色发现, INPP4B在前列腺癌组织中表达明显下降, INPP4B表达阴性肿瘤更容易复发. 以上研究表明, INPP4B的表达水平与多种恶性肿瘤的发生呈负相关, 由此本课题就INPP4B表达与HCC的关系进行研究, 进一步阐明HCC的发病机制.
PTEN具有双特异性磷酸酯酶活性, 不仅可以通过抑制PI3K/Akt信号传导通路, 使细胞周期停滞在G1期或促进细胞凋亡, 还能通过抑制PTEN/ERK/MARK途径, 使细胞生长分化减慢或停滞, 并促进肿瘤细胞衰老或凋亡, 从而阻碍肿瘤的发生发展[12]. Horie等[13]通过对比正常小鼠和敲除PTEN相关基因的小鼠中肝脏恶性肿瘤的发生率, 发现敲除PTEN相关基因的小鼠肝脏恶性肿瘤的发生率显著增高, 提示了PTEN的缺失可能导致肝脏恶性肿瘤的发生. Zhu等[14]研究发现, PTEN的阳性表达率随着肝癌组织组织学分级的降低及侵袭性的增高而显著下降, 提示了在HCC的发生发展中, PTEN可能与肝癌细胞的转移和浸润密切相关. 以上研究表明, PTEN不仅参与了HCC的发生发展, 也可能作为一个潜在的HCC诊断和预后指标. PTEN的表达水平与HCC的发生发展呈负相关, 其作为HCC治疗的一个重要靶基因, 越来越多地被关注.
在本课题研究中, 我们通过免疫组织化学检测方法, 检测INPP4B和PTEN在肝癌组织、癌旁组织及正常肝组织的表达情况. 通过显微镜下观察可见INPP4B和PTEN在肝癌组织中的表达较癌旁组织和正常肝组织明显减低. 通过统计学分析发现, 肝癌组织中INPP4B和PTEN的表达呈正相关, 提示INPP4B和PTEN可能共同参与HCC的发生发展, 且已有研究表明在乳腺癌中存在INPP4B和PTEN共同缺失[8]. 能否通过敲除INPP4B和PTEN相关基因预防和治疗HCC还有待研究, 本课题就此进行了前期探索, 为HCC的防治提供新的突破点. 我们推测, INPP4B和PTEN表达缺失的肿瘤将为PI3K传导通路抑制因子治疗提供理想的选择. 目前, 众多Ⅰ期、Ⅱ期临床试验正在进行, 探讨PI3K信号通路抑制因子在治疗人类肿瘤中的作用[8]. mROT抑制剂治疗HCC也已进入临床试验阶段[15], 以INPP4B和PTEN基因为靶点预防和治疗HCC仍需进行大量基础及临床实验研究.
随着生活水平的提升及生活习惯的改变, HCC的发病率逐年升高, 这严重影响了人们的生活质量. 因此, 对于HCC的研究需要综合各种因素, 本文从免疫组织化学检测层面就INPP4B和PTEN在HCC的表达进行了初步研究, 为HCC的治疗和预防提供了新的方向, 但其在HCC中的作用、意义及两者的相关性仍需要大量的实验进一步证实.
Ⅱ型多磷酸肌醇4-磷酸酶(inositol polyphosphate 4-phosphatase type Ⅱ, INPP4B)是一种新发现的脂质磷酸酶, 作为一个潜在的肿瘤抑制因子, 在前列腺癌、乳腺癌、卵巢癌、黑色素瘤、白血病等多种恶性肿瘤中表达缺失. 磷酸酯酶(phosphatase and tensin homolog deleted on chromosome ten, PTEN)是一种位于10号染色体(10q23)的抑癌基因, 兼具有脂质磷酸酶活性和蛋白磷酸酶活性参与细胞周期以及多种信号传导途径的负调控, 抑制细胞恶性转化. INPP4B和PTEN的缺失与肿瘤的发生发展密切相关.目前国内外文献甚少有两者在肝癌中的表达及相关性研究报道.
李孟森, 教授, 海南医学院/海南省肿瘤发生和干预重点实验室
通过免疫组织化学法检测 INPP4B和PTEN在肝癌组织、对应癌旁组织及正常肝脏组织中的表达, 并结合患者临床病理资料进行分析, 探讨两者的表达特点及意义.
Gewinner等发现在随机抽取的乳腺癌和卵巢癌患者中, INPP4B低水平表达者往往出现较早的淋巴结转移, 且肿瘤患者的生存时间明显缩短. Hodgson等发现 INPP4B在前列腺癌组织中表达明显下降, INPP4B表达阴性肿瘤更容易复发. Horie等发现敲除PTEN相关基因的小鼠肝脏恶性肿瘤的发生率显著增高, PTEN的缺失可能导致肝脏恶性肿瘤的发生. Zhu等研究发现, PTEN的阳性表达率随着肝癌组织组织学分级的降低及侵袭性的增高而显著下降.
本文通过免疫组织化学方法检测肝癌组织、癌旁组织、正常肝脏组织中INPP4B和PTEN的表达, 进一步阐明肝细胞癌(hepatocellular carcinoma, HCC)的发病机制, 为HCC的治疗和预防提供新的方向.
本文对认识这两种蛋白分子共同参与肝癌发生、发展有一定的指导价值.
编辑: 田滢 电编:鲁亚静
| 1. | 赫 捷, 陈 万青. 2012年中国肿瘤登记年报. 北京: 军事科学医学出版社 2012; 22-23. |
| 2. | Aravalli RN, Steer CJ, Cressman EN. Molecular mechanisms of hepatocellular carcinoma. Hepatology. 2008;48:2047-2063. [PubMed] [DOI] |
| 3. | Agoulnik IU, Hodgson MC, Bowden WA, Ittmann MM. INPP4B: the new kid on the PI3K block. Oncotarget. 2011;2:321-328. [PubMed] |
| 4. | Song MS, Carracedo A, Salmena L, Song SJ, Egia A, Malumbres M, Pandolfi PP. Nuclear PTEN regulates the APC-CDH1 tumor-suppressive complex in a phosphatase-independent manner. Cell. 2011;144:187-199. [PubMed] [DOI] |
| 6. | Gewinner C, Wang ZC, Richardson A, Teruya-Feldstein J, Etemadmoghadam D, Bowtell D, Barretina J, Lin WM, Rameh L, Salmena L. Evidence that inositol polyphosphate 4-phosphatase type II is a tumor suppressor that inhibits PI3K signaling. Cancer Cell. 2009;16:115-125. [PubMed] [DOI] |
| 7. | Dong-Dong L, Xi-Ran Z, Xiang-Rong C. Expression and significance of new tumor suppressor gene PTEN in primary liver cancer. J Cell Mol Med. 2003;7:67-71. [PubMed] |
| 8. | Fedele CG, Ooms LM, Ho M, Vieusseux J, O'Toole SA, Millar EK, Lopez-Knowles E, Sriratana A, Gurung R, Baglietto L. Inositol polyphosphate 4-phosphatase II regulates PI3K/Akt signaling and is lost in human basal-like breast cancers. Proc Natl Acad Sci U S A. 2010;107:22231-22236. [PubMed] [DOI] |
| 9. | Sørlie T, Perou CM, Tibshirani R, Aas T, Geisler S, Johnsen H, Hastie T, Eisen MB, van de Rijn M, Jeffrey SS. Gene expression patterns of breast carcinomas distinguish tumor subclasses with clinical implications. Proc Natl Acad Sci U S A. 2001;98:10869-10874. [PubMed] |
| 10. | Balakrishnan A, Chaillet JR. Role of the inositol polyphosphate-4-phosphatase type II Inpp4b in the generation of ovarian teratomas. Dev Biol. 2013;373:118-129. [PubMed] [DOI] |
| 11. | Hodgson MC, Shao LJ, Frolov A, Li R, Peterson LE, Ayala G, Ittmann MM, Weigel NL, Agoulnik IU. Decreased expression and androgen regulation of the tumor suppressor gene INPP4B in prostate cancer. Cancer Res. 2011;71:572-582. [PubMed] [DOI] |
| 12. | Kotelevets L, van Hengel J, Bruyneel E, Mareel M, van Roy F, Chastre E. Implication of the MAGI-1b/PTEN signalosome in stabilization of adherens junctions and suppression of invasiveness. FASEB J. 2005;19:115-117. [PubMed] |
| 13. | Horie Y, Suzuki A, Kataoka E, Sasaki T, Hamada K, Sasaki J, Mizuno K, Hasegawa G, Kishimoto H, Iizuka M. Hepatocyte-specific Pten deficiency results in steatohepatitis and hepatocellular carcinomas. J Clin Invest. 2004;113:1774-1783. [PubMed] |
| 14. | Zhu X, Qin X, Fei M, Hou W, Greshock J, Bachman KE, Wooster R, Kang J, Qin CY. Combined Phosphatase and Tensin Homolog (PTEN) Loss and Fatty Acid Synthase (FAS) Overexpression Worsens the Prognosis of Chinese Patients with Hepatocellular Carcinoma. Int J Mol Sci. 2012;13:9980-9991. [PubMed] [DOI] |