修回日期: 2013-12-24
接受日期: 2013-12-27
在线出版日期: 2014-02-18
目的: 本研究旨在探讨多形性腺瘤基因1(pleomorphic adenoma gene 1, PLAG1)在肝细胞癌患者血浆中的异常表达及其临床意义.
方法: 收集42例肝癌患者、34例肝硬化患者及30例健康人血浆, 应用SYBR Green Ⅰ实时荧光定量PCR技术检测PLAG1 mRNA在健康人、肝硬化患者及肝癌患者血浆中的表达情况, 并分析其与肝癌患者临床病理特征之间的关系.
结果: SYBR GreenⅠ实时荧光定量PCR结果显示, PLAG1 mRNA在肝癌组、肝硬化组及健康体检组的血浆中阳性表达率分别为: 71.4%、23.5 %和6.7%. PLAG1 mRNA在肝癌组血浆中的阳性表达率明显高于健康体检组及肝硬化组(P<0.05). 而健康体检组和肝硬化组血浆中PLAG1 mRNA阳性表达率差异无统计学意义(P>0.05).同时对肝癌组、肝硬化组及健康体检组中PLAG1 mRNA的扩增产物进行相对定量的分析比对, 发现三组间比较差异有统计学意义(P<0.05). 肝癌患者血浆中PLAG1 mRNA表达水平与肝癌的病理分化程度及远处转移有显著的关系(P<0.05).
结论: PLAG1 mRNA在肝癌患者血浆中的表达, 提示其可能在肝癌的发生发展过程中发挥重要的作用, 有望成为新的辅助诊断肝癌, 判断转移风险的临床检测指标.
核心提示: 本研究发现多形性腺瘤基因1(pleomorphic adenoma gene 1, PLAG1) mRNA在肝癌患者血浆中明显高表达, 并与肝癌病理分化程度及远处转移的发生相关. 提示PLAG1与肝癌的发生、发展及侵袭转移有着密切的关系, 有望成为辅助诊断肝癌, 并判断远处转移风险的临床检测指标.
引文著录: 付琳, 杨玉秀, 白阳秋, 张立达. 肝癌患者血浆中PLAG1的异常表达. 世界华人消化杂志 2014; 22(5): 630-636
Revised: December 24, 2013
Accepted: December 27, 2013
Published online: February 18, 2014
AIM: To investigate the abnormal expression of pleomorphic adenoma gene 1 (PLAG1) in plasma of patients with hepatocellular carcinoma (HCC) and to analyze its clinical significance.
METHODS: Plasma samples were collected from 42 HCC patients, 34 liver cirrhosis patients and 30 healthy donors. The mRNA expression levels of PLAG1 were quantified by SYBR Green I real-time fluorescent quantitative PCR. The correlation between clinicopathologic characteristics of HCC and expression of PLAG1 was evaluated.
RESULTS: The positive rate of PLAG1 mRNA in the HCC group, liver cirrhosis group, and healthy control group were 71.4%, 23.5% and 6.7%, respectively. PLAG1 mRNA expression level in the HCC group was significantly higher than those in other two groups (P < 0.05 for both). However, no significant difference was found between the liver cirrhosis group and healthy control group (P > 0.05). Significant difference in quantitative data from SYBR Green I real-time fluorescent quantitative PCR was also found among the three groups (P < 0.05). PLAG1 mRNA expression level in HCC patients was significantly correlated with pathological grade and tumor metastasis (P < 0.05 for both).
CONCLUSION: The expression level of PLAG1 mRNA in plasma of HCC patients may play a significant role in the pathogenesis and development of HCC, and it may serve as a novel tumor marker for diagnosis and metastasis of HCC.
- Citation: Fu L, Yang YX, Bai YQ, Zhang LD. Abnormal expression of PLAG1 in plasma of patients with hepatocellular carcinoma. Shijie Huaren Xiaohua Zazhi 2014; 22(5): 630-636
- URL: https://www.wjgnet.com/1009-3079/full/v22/i5/630.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i5.630
肝细胞癌(hepatocellular carcinoma, HCC), 简称肝癌, 是世界范围内临床上最常见的恶性肿瘤之一, 位居恶性肿瘤发病率第5位, 其中约55%的病例发生于中国. 肝癌起病隐匿, 进展快, 死亡率高, 严重威胁人类的生命健康, 其发生和发展是一个多因素、多阶段及多基因相互作用的过程. 在前期相关实验中发现, 多形性腺瘤基因1(pleomorphic adenoma gene 1, PLAG1)在肝癌发展过程中呈上调表达, 并与肝癌病理分级、分化程度有着密切的关系[1]. 目前有关研究的结果仅提示PLAG1在肝癌组织中高表达, 而在肝癌患者血浆中的表达情况鲜有报道. 本研究采用SYBR Green Ⅰ实时荧光定量PCR技术检测PLAG1在健康人群、肝硬化患者及肝癌患者血浆中的表达水平, 探讨其在肝癌的发生发展过程所发挥的作用及对临床的相关指导意义.
实验组选择2012-06/2012-12河南省人民医院肝胆外科住院的肝癌患者42例, 其中男性34例, 女性8例, 年龄34-78岁, 平均年龄54.2岁±11.1岁. 所有肝癌患者诊断均经过病理证实, 收集标本时均未进行手术治疗、放疗及化疗. 对照组34例为河南省人民医院消化内科住院的肝硬化患者, 并经影像学检查排除肝癌; 另30例为本院同期同年龄段健康体检者. 所有受试者均获得知情同意.
1.2.1 标本采集: 抽取清晨空腹静脉血3 mL, 置于EDTA抗凝的无菌试管中, 室温3500 r/min离心15 min, 收集血浆, 置于-80 ℃保存待测定.
1.2.2 SYBR Green Ⅰ实时荧光定量PCR检测PLAG1 mRNA: (1)引物设计和合成: 目的引物碱基序列由上海生工生物工程股份有限公司合成,内参基因GAPDH由大连宝生物工程有限公司购得(表1); (2)总RNA提取: 取血浆300 μL按 TRIzol试剂(Invitrogen公司)说明书提取血浆总RNA, 加20 μL无核酶去离子水溶解, 所得RNA经1%琼脂糖凝胶电泳(150 V, 15 min)检测RNA 28S和18S比例, 估计总RNA的完整性, 并应用紫外分光光度计检测A260/280, 测定总RNA吸光度; (3)逆转录合成cDNA: 逆转录试剂盒(TaKaRa)购自大连宝生物工程有限公司, 并按照逆转录试剂盒(Takara code No. DRR047A)说明书步骤进行逆转录聚合酶链反应. 基因组DNA的除去反应体系总体积为10 μL, 包含样本RNA 4 μL, 5×gDNA Eraser Buffer 2 μL, gDNA Eraser 1 μL, RNase Free dH2O 3 μL, 反应条件42 ℃, 2 min. 逆转录反应在上述反应液中依次加入RNase Free dH2O 4 μL, 5×PrimeScript Buffer 4 μL, RT Prime Mix 1 μL, PrimeScript RT Enzyme Mix I 1 μL, 逆转录反应体系总体积为20 μL, 反转录条件依次为37 ℃ , 15 min, 85 ℃, 5 s; (4)SYBR Green Ⅰ实时荧光定量PCR反应: 按照RT-PCR试剂盒(TaKaRa)进行操作, PCR反应体系为20 μL, 反应体系中含SYBR Premix Ex Taq Ⅱ 10 μL、正、反PCR引物各0.8 μL, ROX Reference Dye Ⅱ 0.4 μL、cDNA模板2.0 μL、dH2O 6.0 μL. PCR扩增条件为95 ℃ 30 s, 95 ℃ 5 s, 60 ℃ 31 s; 进行40个PCR循环. 所用扩增仪型号为ABI7300.
| 目的基因 | 序列 | 产物长度(bp) |
| PLAG1 | 上游引物: 5'-ATCCCTCTCACCACCTTTCTTT-3' | 125 |
| 下游引物: 5'-GCCACCTTGTAACTCCATCAG-3' | ||
| GAPDH(内参基因) | 由大连宝生物工程有限公司提供 | 138 |
1.2.3 结果判断: (1)∆Ct = 样品Ct-内参Ct, ∆∆Ct = ∆Ct-(随机阴性对照样品Ct均值-该样品的内参Ct均值), 以2-∆∆Ct表示样品中目的基因初始cDNA相对表达量[2], 所有步骤均重复3遍取平均值; (2)取扩增产物10 μL, 应用4%琼脂糖凝胶电泳(150 V, 45 min), BIO-RAD Gel Doc XR凝胶成像系统(美国BIO-RAD公司)进行扫描和分析检测扩增产物的正确性.
统计学处理 采用SPSS17.0统计软件进行统计分析. PLAG1 mRNA各组阳性表达率差异运用χ2检验, 当样本量<40时, 运用Fisher确切概率法统计. 多组定量资料运用Kruskal-Wallis秩和检验. P<0.05为差异有统计学意义.
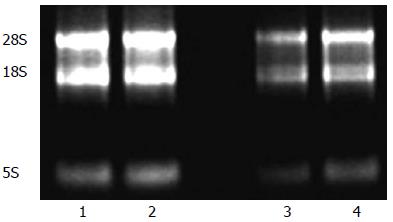
提取结果良好, 1%琼脂糖电泳结果, 可见28S、18S二条清晰条带和稍欠清晰的5S条带(图1), 证实提取的是高纯度的RNA, 完整性较好, 总RNA吸光度A260/280为1.5-1.9, 符合纯度要求(图1).
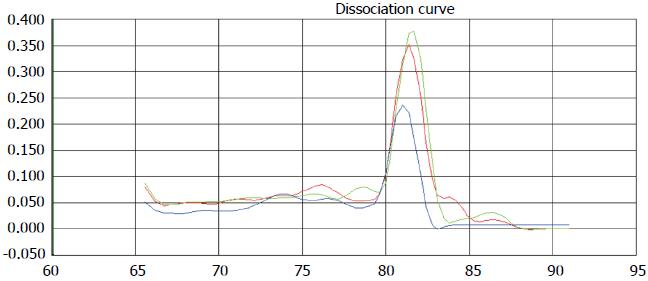
肝癌组与肝硬化组、健康体检组血浆中PLAG1 mRNA表达水平比较: 肝癌组、肝硬化组、健康体检组Ct≤35时PLAG1 mRNA荧光定量扩增曲线呈典型的S型, 熔解曲线分析可见只有单峰值(图2), 熔解温度均一, 排除引物二聚体及非特异性产物的产生. Ct>35时, 则未见或略见起翘, 为一不规则波浪线. 以样品基因CT值≤35表示目的基因阳性表达[3]. 本研究中, 肝癌实验组30例患者PLAG1 mRNA Ct≤35, PLAG1 mRNA阳性表达率为71.4%(30/42), 肝硬化组、健康体检组的阳性表达率分别为23.5%(8/34)、6.7%(2/30). 三组间比较差异有统计学意义(χ2 = 33.654, P<0.05). 两两比较, 肝癌组与肝硬化组、肝癌组与健康体检组差异均有统计学意义(P<0.05). 肝硬化组与健康体检组差异无统计学意义(P = 0.064)(表2). 运用Kruskal-Wallis秩和检验对三组PLAG1 mRNA扩增产物(Ct≤35)的相对定量进行分析比对, 三组间比较差异有统计学意义(χ2 = 23.47, P<0.05).
| 分组 | n | PLAG1 mRNA | 阳性率(%) | χ2值 | P值 | |
| 阳性 | 阴性 | |||||
| 肝癌组 | 42 | 30 | 12 | 71.4 | χ21 = 17.244 | <0.05 |
| 肝硬化组 | 34 | 8 | 26 | 23.5 | χ22 = 3.438 | >0.05 |
| 健康体检组 | 30 | 2 | 28 | 6.7 | χ23 = 29.726 | <0.05 |
42例原发性肝癌患者中, 高分化、中分化与低分化三组的阳性表达率分别为22.2%(2/9)、66.7%(8/12)、95.2%(20/21). 三组差异有统计学意义(χ2 = 16.248, P<0.05)(表3). 运用Fisher确切概率法两两比较, 低分化与高、中分化组差异均有统计学意义(P<0.05). 分化程度越低, PLAG1 mRNA表达率越高. 运用Kruskal-Wallis秩和检验对不同分化程度的三组中PLAG1 mRNA扩增产物(Ct≤35)的相对定量进行比对, 三种不同分化程度肝癌患者血浆中PLAG1 mRNA相对定量差异无统计学意义(χ2 = 4.590, P = 0.101).
| 分组 | n | PLAG1 mRNA | 阳性率(%) | χ2值 | P值 | |
| 阳性 | 阴性 | |||||
| 高分化组 | 9 | 2 | 7 | 22.2 | χ24 = 4.073 | 0.044 |
| 中分化组 | 12 | 8 | 4 | 66.7 | χ25 = 4.849 | 0.028 |
| 低分化组 | 21 | 20 | 1 | 95.2 | χ26 = 17.175 | <0.05 |
运用Fisher确切概率法分析肝癌患者组血浆中PLAG1 mRNA表达与年龄、性别及AFP无关, 与远处转移相关, 发生远处转移肝癌患者PLAG1 mRNA表达率高于未转移者(表4).
| 阳性 | 阴性 | 总例数 | χ2值 | P值 | |
| 年龄(岁) | 0.840 | 0.359 | |||
| ≥55 | 24 | 8 | 32 | ||
| <55 | 6 | 4 | 10 | ||
| 性别 | 0.386 | 0.543 | |||
| 男 | 25 | 9 | 34 | ||
| 女 | 5 | 3 | 8 | ||
| AFP | 0.187 | 0.666 | |||
| 阳性 | 22 | 8 | 30 | ||
| 阴性 | 8 | 4 | 12 | ||
| 有无远处转移 | 4.783 | 0.029 | |||
| 有 | 21 | 4 | 25 | ||
| 无 | 9 | 8 | 17 |
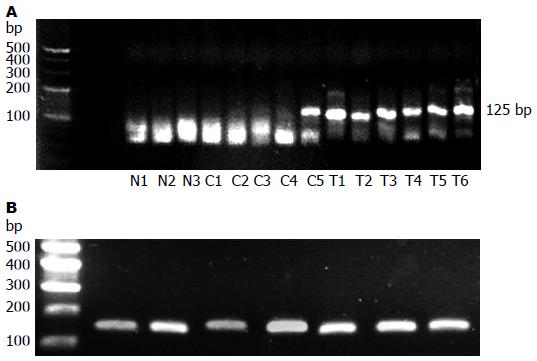
最终扩增产物经4%琼脂糖凝胶电泳, BIO-RAD Gel Doc XR凝胶成像系统进行扫描和分析, 可见PLAG1和GAPDH对应的125、138 bp的电泳条带(图3).
Kas等[4]在1997年从t(3; 8)(p21; q12)染色体易位的多形性腺瘤组织中克隆到了一个高表达基因, 故命名为PLAG1. PLAG1是位于人染色体8q12的原癌基因, 包含5个外显子, cDNA全长7313 bp, 基因库编号为U65002, 其中只有第4外显子的最后端和第5外显子的起始端进行编码, 编码框共1503 bp. 正常情况下, PLAG1仅在胎儿的肺、肝、肾等脏器中表达, 但其在多种肿瘤中存在异常表达的现象也被多次报道. 曾有相关文献报道其在肝母细胞瘤[5]、淋巴细胞型白血病[6]、儿童胃肠道间质瘤[7]、腺样囊性癌[8]中被激活表达.
既往研究中, PLAG1曾被认为是一个"良性癌基因", 并一度被证实为肿瘤抑制基因[9], 但Queimado等[10]的研究并不支持这个理论. 在前期实验中, 我们也曾应用含有19378个已知基因的核苷酸芯片筛选出肝炎、肝硬化及原发性肝癌差异基因表达谱, 显示PLAG1在原发性肝癌中是一个明显高表达基因[11]. PLAG1的致癌能力考虑与其多种靶基因如胰岛素样生长因子Ⅱ(insulin-like growth factor Ⅱ, IGF-Ⅱ)、血管内皮生长因子(vascular endothelial growth factor, VEGF)、胎盘生长因子(placental growth factor, PGF)的异常表达相关. 其中IGF-Ⅱ的表达受其4个启动子(P1-P4)控制[12]. PLAG1作为调控转录因子及原癌基因曾在相关文献中被报道过, 在体外实验中, 也有证据显示PLAG1与IGF-Ⅱ启动子P3的共同结合位点相结合后激活其转录[13]. IGF-Ⅱ是一种促生长因子, 由肝脏分泌和合成, 能够促细胞有丝分裂、刺激细胞增殖以及DNA复制和转录、刺激组织器官的生长和分化、抑制细胞凋亡. 相关研究提示, IGF-Ⅱ在肝细胞癌的早期即开始有过量表达, 并参与发生肝癌早期事件. 而肝细胞癌的快速分裂, 会导致肝供血不足, 局部出现缺氧状态, 也会促使IGF-Ⅱ增加, 作为血管活性因子间接促进VEGF的合成, 从而刺激肝癌新生肿瘤血管的形成[14]. IGF-Ⅱ的过度表达在人类多种类型的肿瘤中均可发现, 他通过自分泌或旁分泌机制强效刺激细胞增殖[15]. 从这些结论及微阵列技术分析也可以得知, PLAG1的致癌能力至少一部分是通过IGF-Ⅱ有丝分裂信号转导通路介导的[16].
引起PLAG1异常表达主要原因与染色体易位相关. 而发生染色体易位的原因主要为PLAG1与其广泛表达的"融合伴侣"基因如位于3p21的CTNNB1、CHCHD7、LIFR(leukemia inhibitory factor receptor)及TCEA1(transcription elongation factor A1)发生了启动子交换所导致[17]. 这一论点曾在关于多形性腺瘤中PLAG1表达的相关实验得到证实[18,19]. 其中CTNNB1负责编码β-catenin[20], 是肝细胞癌中最常发生的突变基因. 其作用机制可能为CTNNB1发生基因突变后, 使β-catenin在细胞胞浆内聚集进而入胞核导致Wnt/β-catenin信号通路活化[21], 促进细胞的增殖, 导致肝癌发生; 同时Wnt/β-catenin信号通路还可以通过调节环氧酶2(cyclo-oxygen-ase 2, COX-2)表达, 促进肿瘤血管新生, 并加速肿瘤侵袭转移.
SYBR Green Ⅰ实时荧光定量PCR技术具有高特异性、高灵敏度、污染小等优点, 在研究基因表达方面, 不仅可以进行定性检测, 还可进行定量研究, 从而更加准确表达基因相关的差异性[22]. 目前国内外陆续有报道显示应用该法检测肿瘤患者血浆中相关mRNA、miRNA表达情况[23]. 本研究运用SYBR GreenⅠ实时荧光定量PCR技术, 对肝癌、肝硬化患者及健康体检者血浆中PLAG1 mRNA进行分析, 并在实验过程中采用下列措施避免假阳性: (1)认真操作, 避免污染; (2)所有步骤均重复检测3次在无明显差异情况下取平均值; (3)扩增产物应用4%琼脂糖凝胶电泳, 进行分析验证扩增产物的正确性, 并结合熔解曲线排除假阳性. 结果表明肝癌患者血浆中PLAG1 mRNA表达水平显著高于肝硬化组及健康体检组, 并跟病理分化程度相关, 分化程度越低, PLAG1 mRNA表达率越高. 前期研究中曾发现PLAG1在肝癌组织中异常表达, 通过本组实验发现在肝癌患者血浆中PLAG1同样高表达, 尤其已发生远处转移组中PLAG1表达明显高于未发生转移组, 考虑其有可能来源于转移入血的肝癌细胞, 也不排除来源于血浆中存在的游离循环核酸内的突变基因. 推测PLAG1可能既通过与"融合伴侣"发生染色体易位引起肝癌的发生, 又与其靶基因发生共同位点结合激活靶基因转录进一步加剧肝癌的发展, 与肝癌的发生、发展及侵袭转移有着密切的关系, 有望成为新的辅助诊断肝癌的肿瘤标志物, 并有可能成为帮助判断肝癌患者是否存在转移风险的有效指标.
循环核酸是指存在于血液(血浆或血清)中的细胞外游离RNA和DNA. 近年来循环核酸在肿瘤的发生发展过程中所起到的作用逐渐引起人们的重视. 特别是在Sorenson等[24]和Vasioukhin等[25]成功检测到循环核酸内的突变原癌基因导致的肿瘤发生后. 目前观点认为导致肿瘤患者体内循环RNA浓度升高的原因, 主要为原发灶肿瘤代谢过程中坏死细胞不断释放核酸入血; 或者在肿瘤转移过程中, 脱落的肿瘤细胞在血液循环中凋亡, 或被机体免疫系统识别后消灭, 释放核酸入血[26]. 虽然血液中存在大量核糖核酸酶(RNase), 但相关研究显示, 外周血中循环RNA可能与包括脂蛋白、核蛋白、P53蛋白、糖蛋白等多种物质形成复合体或包含于合胞体滋养层微粒[27]、凋亡小体[28]从而免受RNase的降解. 而最近的研究也表明, 循环mRNA很可能是来源于机体多种组织及多种类型细胞, 通过包装于外染色体(exosome)或是经转录修饰后释放入血, 从而免受RNase的降解[29]. 在当前的临床实践中, 许多血清标志蛋白如针对肝癌的AFP等作为肿瘤标志物得到广泛的应用[30]. 但是这些蛋白的敏感性和特异性往往令人无法满意, 而且他们无法完整的诠释肿瘤复杂的分子进展过程, 故以血浆中的游离循环核酸作为"分子标志物"逐渐成为临床医学肿瘤诊断的研究重点[31]. 本实验在以血浆为标本的研究基础上, 旨在了解肝癌患者血浆中PLAG1的表达情况, 并通过实验探究PLAG1可能有望作为"分子标志物", 成为新的诊断肝癌的分子生物学辅助指标.
肝细胞癌是世界范围内临床上最常见的恶性肿瘤之一. 在当前临床实践中, 甲胎蛋白(alpha-fetoprotein, AFP)等血清标志蛋白被广泛应用于肝癌诊断, 但由于其敏感性和特异性往往令人无法满意, 而且他们无法完整的诠释肿瘤疾病复杂的分子进展过程, 所以急需新的分子标志物用于辅助诊断肝癌, 并监测预后. 通过前期实验研究发现多形性腺瘤基因1(pleomorphic adenoma gene 1, PLAG1)是原发性肝癌中的一个明显高表达基因, 但研究仅提示在肝癌组织中高表达, 外周血浆中表达情况未见报道.
吴道澄, 教授, 西安交通大学生命学院
目前关于循环核酸在肿瘤发生发展过程中所起到的作用已逐渐成为国内外研究热点.同时血浆中PLAG1作为"分子标志物"应用于肝癌的辅助诊断也已成为令人期待的研究重点.
PLAG1在肝母细胞瘤、淋巴细胞型白血病、儿童胃肠道间质瘤、腺样囊性癌中高表达. 并有文献报道显示PLAG1在肝癌组织中明显高表达, 与肝癌的发生、发展关系密切.
本文应用SYBR GreenⅠ荧光定量PCR技术检测PLAG1肝癌患者血浆中的表达, 并分析其表达水平与肝癌临床病理的关系, 为肝癌诊断及判断远处转移风险提供了进一步研究方向.
对于患者血浆中PLAG1表达水平的检测有望成为新的分子标志物应用于辅助诊断肝癌、判断远处转移风险.
本文提出了一种新的有效指标来表示肝癌患者是否发生转移, 有一定的实际意义和学术价值.
编辑: 田滢 电编:鲁亚静
| 2. | Livak KJ, Schmittgen TD. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) Method. Methods. 2001;25:402-408. [PubMed] |
| 3. | Tani N, Ichikawa D, Ikoma D, Tomita H, Sai S, Ikoma H, Okamoto K, Ochiai T, Ueda Y, Otsuji E. Circulating cell-free mRNA in plasma as a tumor marker for patients with primary and recurrent gastric cancer. Anticancer Res. 2007;27:1207-1212. [PubMed] |
| 4. | Kas K, Voz ML, Röijer E, Aström AK, Meyen E, Stenman G, Van de Ven WJ. Promoter swapping between the genes for a novel zinc finger protein and beta-catenin in pleiomorphic adenomas with t(3; 8)(p21; q12) translocations. Nat Genet. 1997;15:170-174. [PubMed] |
| 5. | Zatkova A, Rouillard JM, Hartmann W, Lamb BJ, Kuick R, Eckart M, von Schweinitz D, Koch A, Fonatsch C, Pietsch T. Amplification and overexpression of the IGF2 regulator PLAG1 in hepatoblastoma. Genes Chromosomes Cancer. 2004;39:126-137. [PubMed] |
| 6. | Pallasch CP, Patz M, Park YJ, Hagist S, Eggle D, Claus R, Debey-Pascher S, Schulz A, Frenzel LP, Claasen J. miRNA deregulation by epigenetic silencing disrupts suppression of the oncogene PLAG1 in chronic lymphocytic leukemia. Blood. 2009;114:3255-3264. [PubMed] [DOI] |
| 7. | Agaram NP, Laquaglia MP, Ustun B, Guo T, Wong GC, Socci ND, Maki RG, DeMatteo RP, Besmer P, Antonescu CR. Molecular characterization of pediatric gastrointestinal stromal tumors. Clin Cancer Res. 2008;14:3204-3215. [PubMed] [DOI] |
| 8. | Aström AK, Voz ML, Kas K, Röijer E, Wedell B, Mandahl N, Van de Ven W, Mark J, Stenman G. Conserved mechanism of PLAG1 activation in salivary gland tumors with and without chromosome 8q12 abnormalities: identification of SII as a new fusion partner gene. Cancer Res. 1999;59:918-923. [PubMed] |
| 9. | Bilanges B, Varrault A, Basyuk E, Rodriguez C, Mazumdar A, Pantaloni C, Bockaert J, Theillet C, Spengler D, Journot L. Loss of expression of the candidate tumor suppressor gene ZAC in breast cancer cell lines and primary tumors. Oncogene. 1999;18:3979-3988. [PubMed] |
| 10. | Queimado L, Obeso D, Hatfield MD, Yang Y, Thompson DM, Reis AM. Dysregulation of Wnt pathway components in human salivary gland tumors. Arch Otolaryngol Head Neck Surg. 2008;134:94-101. [PubMed] [DOI] |
| 12. | Hartmann W, Waha A, Koch A, Albrecht S, Gray SG, Ekström TJ, von Schweinitz D, Pietsch T. Promoter-specific transcription of the IGF2 gene: a novel rapid, non-radioactive and highly sensitive protocol for mRNA analysis. Virchows Arch. 2001;439:803-807. [PubMed] |
| 13. | Akhtar M, Holmgren C, Göndör A, Vesterlund M, Kanduri C, Larsson C, Ekström TJ. Cell type and context-specific function of PLAG1 for IGF2 P3 promoter activity. Int J Oncol. 2012;41:1959-1966. [PubMed] [DOI] |
| 14. | Lee YM, Bae MH, Lee OH, Moon EJ, Moon CK, Kim WH, Kim KW. Synergistic induction of in vivo angiogenesis by the combination of insulin-like growth factor-II and epidermal growth factor. Oncol Rep. 2004;12:843-848. [PubMed] |
| 15. | Khandwala HM, McCutcheon IE, Flyvbjerg A, Friend KE. The effects of insulin-like growth factors on tumorigenesis and neoplastic growth. Endocr Rev. 2000;21:215-244. [PubMed] |
| 16. | Van Dyck F, Declercq J, Braem CV, Van de Ven WJ. PLAG1, the prototype of the PLAG gene family: versatility in tumour development (review). Int J Oncol. 2007;30:765-774. [PubMed] |
| 17. | Matsuyama A, Hisaoka M, Hashimoto H. PLAG1 expression in mesenchymal tumors: an immunohistochemical study with special emphasis on the pathogenetical distinction between soft tissue myoepithelioma and pleomorphic adenoma of the salivary gland. Pathol Int. 2012;62:1-7. [PubMed] [DOI] |
| 18. | Asp J, Persson F, Kost-Alimova M, Stenman G. CHCHD7-PLAG1 and TCEA1-PLAG1 gene fusions resulting from cryptic, intrachromosomal 8q rearrangements in pleomorphic salivary gland adenomas. Genes Chromosomes Cancer. 2006;45:820-828. [PubMed] |
| 19. | Martins C, Fonseca I, Roque L, Pereira T, Ribeiro C, Bullerdiek J, Soares J. PLAG1 gene alterations in salivary gland pleomorphic adenoma and carcinoma ex-pleomorphic adenoma: a combined study using chromosome banding, in situ hybridization and immunocytochemistry. Mod Pathol. 2005;18:1048-1055. [PubMed] |
| 20. | Chan TA, Wang Z, Dang LH, Vogelstein B, Kinzler KW. Targeted inactivation of CTNNB1 reveals unexpected effects of beta-catenin mutation. Proc Natl Acad Sci U S A. 2002;99:8265-8270. [PubMed] |
| 21. | Klaus A, Birchmeier W. Wnt signalling and its impact on development and cancer. Nat Rev Cancer. 2008;8:387-398. [PubMed] [DOI] |
| 23. | Ayaz L, Görür A, Yaroğlu HY, Ozcan C, Tamer L. Differential expression of microRNAs in plasma of patients with laryngeal squamous cell carcinoma: potential early-detection markers for laryngeal squamous cell carcinoma. J Cancer Res Clin Oncol. 2013;139:1499-1506. [PubMed] [DOI] |
| 24. | Sorenson GD, Pribish DM, Valone FH, Memoli VA, Bzik DJ, Yao SL. Soluble normal and mutated DNA sequences from single-copy genes in human blood. Cancer Epidemiol Biomarkers Prev. 1994;3:67-71. [PubMed] |
| 25. | Vasioukhin V, Anker P, Maurice P, Lyautey J, Lederrey C, Stroun M. Point mutations of the N-ras gene in the blood plasma DNA of patients with myelodysplastic syndrome or acute myelogenous leukaemia. Br J Haematol. 1994;86:774-779. [PubMed] |
| 27. | Gupta AK, Holzgreve W, Huppertz B, Malek A, Schneider H, Hahn S. Detection of fetal DNA and RNA in placenta-derived syncytiotrophoblast microparticles generated in vitro. Clin Chem. 2004;50:2187-2190. [PubMed] |
| 28. | Hasselmann DO, Rappl G, Tilgen W, Reinhold U. Extracellular tyrosinase mRNA within apoptotic bodies is protected from degradation in human serum. Clin Chem. 2001;47:1488-1489. [PubMed] |
| 29. | Taylor DD, Gercel-Taylor C. MicroRNA signatures of tumor-derived exosomes as diagnostic biomarkers of ovarian cancer. Gynecol Oncol. 2008;110:13-21. [PubMed] [DOI] |
| 30. | Ren FY, Piao XX, Jin AL. Efficacy of ultrasonography and alpha-fetoprotein on early detection of hepatocellular carcinoma. World J Gastroenterol. 2006;12:4656-4659. [PubMed] |