修回日期: 2013-12-15
接受日期: 2013-12-27
在线出版日期: 2014-02-08
目的: 研究三氧化二砷(As2O3)对人体外肠癌细胞HCT116的生长抑制作用和增殖周期的影响.
方法: 肠癌细胞HCT116进行体外培养后, 分成对照组, 0.5 μmol/L As2O3组、1.5 μmol/L As2O3组、2.5 μmol/L As2O3组, 在不同时间段内, MTT法观察不同浓度As2O3对肠癌细胞的生长抑制情况, 绘制细胞生长曲线; 流式细胞技术分析细胞增殖的周期变化.
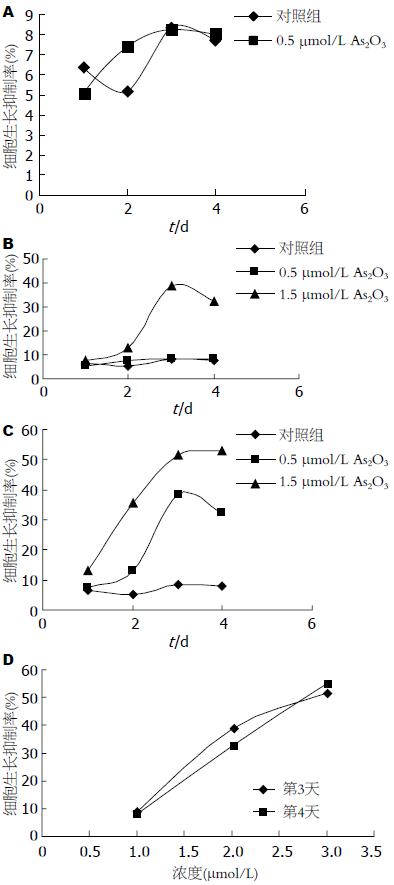
结果: MTT结果显示0.5 μmol/L的低剂量As2O3抑制率与对照组无明显差别(P>0.05), 1.5 μmol/L As2O3组抑制率和2.5 μmol/L As2O3组抑制率与对照组相比较, 组间均有差异(P<0.05), 且As2O3对肿瘤细胞的抑制作用均随时间延长而增强, 并在第3天时抑制作用最明显(1.5 μmol/L As2O3组抑制率为38.64%±0.16%, 2.5 μmol/L As2O3组抑制率为51.42%±0.53%, 对照组是8.35%±0.76%), 然后第4天有下降的趋势, 但2.5 μmol/L As2O3的抑制作用第4天未见明显下降趋势(抑制率为52.93%±1.53%); 流式细胞术分析表明, As2O3为0.5 μmol/L时, S期细胞分布35.58%±0.63%(对照组25.69%±1.46%), G2/M期细胞分布33.41%±0.73%(对照组30.44%±1.51%)两者比较没有统计学差异(P>0.05), 当As2O3浓度为1.5 μmol/L时, S期细胞占42.69%±2.64%, G2/M期细胞占22.46%±0.59%, 与对照组比较, 差异有统计学意义(P<0.05); 药物提高到2.5 μmol/L时, S期细胞占45.71%±1.53%, G2/M期细胞占14.66%±0.92%, 与对照组比较差异有统计学意义(P<0.05).
结论: As2O3对人肠癌细胞HCT116具有明显的抑制作用, 主要抑制肿瘤细胞DNA合成的增殖期, 且至少1.5 μmol/L以上的As2O3浓度才能达到抑制肿瘤增长繁殖的效果, 所以临床应用As2O3进行肠癌化疗时应掌握好有效的剂量浓度和化疗时间窗, 从而提高化疗效果的同时最大减轻不良反应, 延缓耐药性的发生.
核心提示: 本文研究了As2O3对人肠癌细胞HCT116的生长抑制作用和增殖周期的影响. 发现As2O3对肠癌细胞HCT116具有明显的抑制作用, 主要抑制在DNA合成的增殖期, 且至少1.5 μmol/L以上的As2O3才有效, 故As2O3进行肠癌化疗时应掌握好剂量浓度和化疗时间窗.
引文著录: 蔡朋朋, 冯越, 王东红, 周艳, 孙丽慧, 李晶. As2O3对体外肠癌细胞HCT116生长和增殖周期的影响. 世界华人消化杂志 2014; 22(4): 563-567
Revised: December 15, 2013
Accepted: December 27, 2013
Published online: February 8, 2014
AIM: To study the effect of arsenic trioxide (As2O3) on cell growth and cell cycle progression in human colon carcinoma cell line HCT116.
METHODS: HCT116 cells cultured in vitro were divided into a control group, a 0.5 μmol/L As2O3 group, a 1.5 μmol/L As2O3 group, and a 2.5 μmol/L As2O3 group. After treatment with As2O3 for different durations, the effect of different concentrations of arsenic trioxide on the growth of colon cancer cells was detected by MTT assay. Cell growth curve was plotted to observe the change in cell proliferation. Flow cytometry (FCM) was used to determine cell cycle progression.
RESULTS: Low dose of As2O3 (0.5 μmol/L) had no significant inhibitory effect on HCT116 cells compared with the control group (P > 0.05), but 1.5 and 2.5 μmol/L of As2O3 showed a significant inhibitory effect on cell growth in a time-dependent manner (38.64% ± 0.16%, 51.42% ± 0.53% vs 8.35% ± 0.76%, P < 0.05 for both). In the 1.5 μmol/L As2O3 group, the inhibitory effect was most obvious on day 3, then gradually declined; however, such a downward trend was not observed in the 2.5 μmol/L As2O3 group (52.93% ± 1.53%). FCM analysis showed that As2O3 at a concentration of 0.5 μmol/L had no significant effect on the percentages of cells in S phase and G2/M phase (35.58% ± 0.63% vs 25.69% ± 1.46%; 33.41% ± 0.73% vs 30.44% ± 1.51%, P > 0.05 for both). However, As2O3 at concentrations of 1.5 μmol/L and 2.5 μmol/L significantly increased the percentages of cells in S phase but decreased the percentages of cells in G2/M phase (1.5 μmol/L: 42.69% ± 2.64% and 22.46% ± 0.59%; 2.5 μmol/L: 45.71% ± 1.53% and 14.66% ± 0.92%; P < 0.05 for all).
CONCLUSION: Arsenic trioxide has an obvious inhibitory effect on the proliferation of HCT116 cells, mainly by inhibiting the synthesis of DNA in the proliferation stage. The effective dose and treatment time are important in clinical application of As2O3 for cancer chemotherapy in order to improve the effect of chemotherapy, reduce toxicity reactions and delay the occurrence of drug resistance.
- Citation: Cai PP, Feng Y, Wang DH, Zhou Y, Sun LH, Li J. Effect of arsenic trioxide on growth and cell cycle progression in colon cancer cell line HCT116. Shijie Huaren Xiaohua Zazhi 2014; 22(4): 563-567
- URL: https://www.wjgnet.com/1009-3079/full/v22/i4/563.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i4.563
大肠癌为我国常见的消化系恶性肿瘤之一, 而且发病率近年有逐年上升的趋势, 流行病学表明, 全球大肠癌每年新发病例数达94万例, 每年近50万例死于大肠癌, 大肠癌死亡居癌症死因第3位, 在我国大肠癌也是最常见的恶性肿瘤之一, 目前居恶性肿瘤发病率第4位, 5年生存率为60%左右[1,2]. 大肠癌的发病与生活方式改变及膳食结构不合理密切相关, 患者就诊时往往已到了晚期并发生转移, 失去了手术的机会, 化疗成为重要的治疗手段, 但一定要密切注意化疗药物的不良反应, 祖国传统医学治疗肿瘤有着悠久的历史, 三氧化二砷(As2O3)是中药砒霜石的主要成分, 他能通过多种调节因子抑制细胞DNA和RNA合成、干扰细胞代谢、可引起肿瘤细胞多种基因的表达改变[3-5], 其抗肿瘤作用得到广泛关注, 但其应用于临床最大担心就是其不良反应, 而不良反应产生的重要原因之一是剂量过大和化疗时间窗没控制好, 目前As2O3对肠癌细胞的化疗效果和不良反应, 尚缺乏足够的实验资料, 本研究应用MTT比色法和流式细胞术观察As2O3对肠腺癌细胞株HCT116的生长和增值的影响, 探讨As2O3对肠癌细胞化疗的适宜剂量和化疗时间窗, 以便临床更合理应用减轻其不良反应.
As2O3注射液购自哈尔滨伊达药业有限公司, RPMI 1640和胎牛血清由Gibco/BRL美国公司提供, MTT由上海华舜生物有限公司生产, 肠癌细胞HCT-116由哈尔滨医科大学附属第一医院提供, 超纯水仪Purelabplus公司生产, 恒温培养箱, 由苏州安泰技术有限公司生产, CO2培养箱购自日本SANYO公司, OLYMPUS(IX50-S8F2)倒置显微镜和酶标仪(SAFIRE2)由奥地利生产, PI试剂盒购北京宝赛公司, 流式细胞仪(FACS Calibur)美国BD公司生产.
1.2.1 细胞培养: 复苏后的HCT116细胞接种于50 mL培养瓶中, 加入RPMI 1640培养液(含热灭活胎牛血清, 2 g/L NaHCO3, 青霉素和链霉素各100 mg/L)中, 置于37 ℃、5%CO2浓度及饱和湿度的恒温细胞培养箱中培养, 细胞为贴壁上皮样生长, 用0.15%胰蛋白酶消化传代, 以培养液吹打制成单细胞悬液, 取对数生长期细胞用于实验.
1.2.2 分组及药物处理: 将5×104个/mL单细胞悬液接种于96孔培养板中, 分组为: 阴性对照组加入10%的完全培养液, 实验低剂量组加入0.5 μmol/L的As2O3, 中剂量组加1.5 μmol/L As2O3, 高剂量组加2.5 μmol/L的As2O3培养液, 每隔3 d更换一次培养液, 在不同时间取出培养细胞用于实验.
1.2.3 MTT比色法测定细胞生长抑制率: 96孔培养板内加入5×104个/mL单细胞悬液, 3 ℃, 5%CO2孵箱中培养24 h, 24 h后弃去培养液, 分别加入不同浓度的As2O3(浓度同前)培养液200 μL/孔, 同一浓度设3复孔, 同时设3孔阴性对照, 加入等体积的PBS, 放入37 ℃、5%CO2培养箱中培养, 分别培养1、2、3和4 d后, 各取出一个培养板, 吸去上清液, 每孔加入无血清的培养液180 μL及20 μL MTT液(用PBS配成50 mg/mL), 37 ℃孵育4 h, 弃去上清液, 每孔加入150 μL DMSO, 在微量振荡器上低速振荡10 min, 酶标仪测量各孔的吸光度(A)值, 按公式抑制率 = (1-A用药组/A细胞对照组)×100%计算, 以横轴为时间, 纵轴为抑制率绘制细胞生长曲线.
1.2.4 流式细胞仪检测细胞周期: 收集分别经不同浓度的As2O3(浓度同前)混合培养液处理的细胞, 培养72 h(上述MTT研究显示, 药物第3天作用最强)后取出, 0.15%胰酶消化, 空白对照管加等量培养液, 1000 r/min离心10 min, 弃上清液, 冷PBS漂洗后震荡, 使细胞悬浮以去除细胞碎片, 调整细胞数为5×105-10×105个/mL, 4 ℃离心10 min, 弃上清液, 加入预冷的700 mL/L乙醇固定, 碘化丙啶(propidium iodide, PI)单染, 上机检测细胞周期, 软件分析细胞周期分布.
统计学处理 使用SPSS12.0进行软件分析, 数据以mean±SD表示, 组间比较用t检验, P<0.05为差异有统计学意义.
所设3个浓度的As2O3, 其中0.5 μmol/L的低剂量As2O3抑制率与对照组无明显差别(P>0.05); 1.5 μmol/L As2O3组抑制率和2.5 μmol/L As2O3组抑制率与对照组相比较, 组间均有差异(P<0.05), 且As2O3对肿瘤细胞的抑制作用均随时间延长而增强, 并在第3天时抑制作用最明显(1.5 μmol/L As2O3组抑制率为38.64%±0.16%, 2.5 μmol/L As2O3组抑制率为51.42%±0.53%, 对照组是8.35%±0.76%), 然后第4天有下降的趋势, 但2.5 mol/L As2O3的抑制作用未见明显下降趋势(抑制率为52.93%±1.53%)(图1).
肠癌HCT116经过不同浓度的As2O3作用后细胞周期出现变化, 与对照组相比, As2O3为0.5 μmol/L时, S期细胞分布35.58%±0.63%(对照组25.69%±1.46%), G2/M期细胞分布33.41%±0.73%(对照组30.44%±1.51%)两者比较没有统计学差异(P>0.05), 说明药物浓度较低时, 对肿瘤细胞抑制反应较弱, 当As2O3浓度为1.5 μmol/L时, G0/G1期细胞分布34.85%±1.53%, S期细胞分布42.69%±2.64%, G2/M期细胞分布22.46%±0.59%, 与对照组比较有差异(P<0.05), 药物提高到2.5 μmol/L时, G0/G1期细胞分布39.63%±0.74%, S期细胞分布45.71%±1.53%, G2/M期细胞分布14.66%±0.92%, 与对照组比较有差异(P<0.05), 以上说明至少1.5 μmol/L以上的药物浓度才能达到抑制肿瘤增长繁殖的效果, 随As2O3浓度的升高G0/G1期和G2/M期的肿瘤细胞数下降, S期细胞数上升, 表明As2O3是把肿瘤细胞阻滞在S期, 来抑制细胞有丝分裂的(表1).
大肠癌是消化系统常见的恶性肿瘤, 由于生活节奏的加快、高脂饮食以及体育锻炼减少等, 导致肠癌发病率越来越多, 对于晚期患者化疗成为重要的治疗手段. 但目前化疗药疗效差且对机体有严重的不良反应, 如肝肾损伤、免疫下降、骨髓抑制、消化系反应等, 许多患者或因化疗药物的昂贵放弃治疗, 或直接死于化疗药物的不良反应引起的并发症等, 而产生不良反应的重要原因之一是剂量过大或最佳化疗的时间窗没控制好, 自我国学者首先发现As2O3具有良好的抗急性早幼粒白血病的作用以来, 目前国内外学者不仅对其抗白血病的机制进行了深入的探讨[6-12], 而且对其抗实体瘤的作用也进行了广泛的研究, 砷剂是否对正常细胞有不良反应取决于其剂量及作用的时间, 国内刘建伟等[13]体外研究已证明As2O3对肝癌细胞有明显的抑制增殖及诱导凋亡的作用. 本研究应用As2O3作用于人体外肠癌HCT116细胞后, MTT显示0.5 μmol/L的低剂量As2O3抑制率与对照组无明显差别, 1.5 μmol/L As2O3组抑制率和2.5 μmol/L As2O3组抑制率与对照组相比较, 组间均有差异(P<0.05), 且浓度愈大抑制作用愈强, 出现剂量依赖性, 但第1天抑制作用不明显, 可能是作用时间短, 处于药物敏感基因表达的时间窗内, 致使细胞对化疗药不敏感, 从第3天起抑制明显增强, 第4天又有所下降, 这与徐丹等[14]的研究的As2O3肠癌细胞CCL-187的抑制结果类似, 但不同的是本研究中2.5 μmol/L As2O3对细胞的抑制率在第4天未见明显下降, 分析可能原因和肠癌细胞种系的不同或培养基不同有关, 有待于进一步分析研究, 以上研究表明至少1.5 μmol/L以上的As2O3浓度才能达到抑制肿瘤增长繁殖的效果, 且随着As2O3浓度的增大, 抑制作用明显越来越强, 不容易出现耐药性, 提示我们临床应用As2O3进行肠癌化疗时, 应掌握好有效的剂量和适宜疗程, 不能只追求高剂量来增强化疗效果, 以控制毒性反应的发生; 流式细胞仪检测细胞周期, 发现随着As2O3浓度的提高, G0/G1期的转变逐渐减少, 说明原始肿瘤细胞G0期在减少, 该期细胞是肿瘤复发和增值的源头和阵地, G0期的减少这在一定程度降低了肿瘤复发的机会, 同时处于S期细胞逐渐增多, G2/M期细胞数的减少, 提示As2O3主要是使肿瘤细胞阻滞在DNA合成期, 从而阻滞有丝分裂的继续, 而达到抗肿瘤的目的, G2/M期值的减少, 可能主要原因是阻止了相关转录因子如E2F等[15]的释放, 从而抑制细胞的转录和蛋白表达, 这提示我们As2O3在临床上使用的化疗时间应该在肿瘤细胞处于DNA合成的增殖期时间窗内, 完全可以达到事半功倍的效果, 而对于处于静止状态的肿瘤细胞作用不大, 高浓度长时间的持续化疗反而会引起严重的不良反应, 即"过度治疗"是有害无益的.
综合以上的研究结果表明As2O3对体外人肠癌HCT116细胞有较强的抑制杀伤作用, 虽然肿瘤细胞表现出具有浓度依赖性, 但一定要掌握好适当的有效剂量浓度和最佳化疗时机, 这样可以杀死肿瘤细胞的同时, 最大地减轻不良反应和延缓耐药性的发生, 增强肠癌的化疗效果, 提高患者的生存质量.
三氧化二砷(As2O3)是中药砒霜石的主要成分, 他能通过多种调节因子抑制细胞DNA和RNA合成、干扰细胞代谢、使细胞染色体畸变, 可引起多种肿瘤细胞多种基因的表达改变, 其抗肿瘤作用得到广泛关注, 同时其不良反应是临床必须注意的事情, 其不良反应产生的重要原因之一是剂量过大和化疗时间窗未控制好, 目前As2O3对肠癌细胞的化疗效果和不良反应, 尚缺乏足够的实验资料, 本研究应用MTT法观察As2O3对人低分化结肠腺癌细胞株HCT-116的抑制情况, 以及流式细胞仪观察细胞周期变化, 探讨As2O3对肠癌细胞化疗的适宜剂量和化疗时间窗, 以便临床更合理应用减轻其不良反应.
白雪, 副主任医师, 中国人民解放军北京军区总医院普通外科
1971年哈尔滨医科大学第一临床医学院率先用三氧化化二砷治疗急性早幼粒细胞白血病取得成功以后, 砷剂成为国际血液、肿瘤界研究的新热点. 近年来的研究证实, As2O3抗肿瘤机制是多途径、多靶点的, 其应用于肿瘤的治疗从体外观察、建立动物模型在体实验到最后临床试验均取得了一定疗效, 研究各种细胞通路和信号传导机制, 探素其治疗作用及抗肿瘤机制, 为开辟三氧化二砷新的治疗作用提供参考, 但其具体抗肿瘤机制, 尤其是其不良反应是临床应该考虑的问题, 有待进一步研究.
本文通过MTT对肿瘤细胞抑制情况和流式细胞术分析了细胞周期变化, 阐述了减轻不良反应的机制, 为临床更科学的应用提供了可能.
本研究着重就As2O3不良反应的预防及机制进行探讨, 本文通过MTT对肿瘤细胞抑制情况和流式细胞术分析了细胞周期变化, 阐述了抑制肠癌细胞的变化规律及细胞周期改变, 临床上As2O3应该掌握适当的剂量和在合适的时间窗内应用, 可以有效减少不良反应的发生, 在达到化疗目的的同时, 为患者减轻不良反应, 提高患者的生存质量, 为患者带来福音.
本文研究方法客观, 结果可靠, 具有重要的临床意义.
编辑: 田滢 电编:闫晋利
| 1. | Yang L, Parkin DM, Ferlay J, Li L, Chen Y. Estimates of cancer incidence in China for 2000 and projections for 2005. Cancer Epidemiol Biomarkers Prev. 2005;14:243-250. [PubMed] |
| 2. | 邓 小英, 惠 二京, 李 招发. 大肠癌疗效及预后预测生物标志物的研究进展. 胃肠病学和肝病学杂志. 2013;5:393-395. |
| 7. | Lin-Cereghino GP, Godfrey L, de la Cruz BJ, Johnson S, Khuongsathiene S, Tolstorukov I, Yan M, Lin-Cereghino J, Veenhuis M, Subramani S. Mxr1p, a key regulator of the methanol utilization pathway and peroxisomal genes in Pichia pastoris. Mol Cell Biol. 2006;26:883-897. [PubMed] |
| 8. | Geisler JP, Tammela JE, Manahan KJ, Geisler HE, Miller GA, Zhou Z, Wiemann MC. HSP27 in patients with ovarian carcinoma: still an independent prognostic indicator at 60 months follow-up. Eur J Gynaecol Oncol. 2004;25:165-168. [PubMed] |
| 9. | Pei R, Cao J, Ma J, Zhang P, Liu X, Du X, Chen D, Sha K, Chen L, Li S. Long term curative effects of sequential therapy with all-trans retinoic acid, arsenious oxide and chemotherapy on patients with acute promyelocytic leukemia. Hematology. 2012;17:311-316. [PubMed] |
| 10. | Tomita A, Kiyoi H, Naoe T. Mechanisms of action and resistance to all-trans retinoic acid (ATRA) and arsenic trioxide (As2O 3) in acute promyelocytic leukemia. Int J Hematol. 2013;97:717-725. [PubMed] |