修回日期: 2014-10-17
接受日期: 2014-11-25
在线出版日期: 2014-12-28
目的: 探讨Twist2在膀胱癌形成中的机制, 希望为解决临床实际问题提供了理论依据, 具有重要的理论价值意义.
方法: 实时定量PCR和Western blot检测在肿瘤上皮-间充质细胞转分化(epithelial-mesenchymal transition, EMT)过程中基因mRNA表达水平的变化, 流式细胞标技术检测对照组和实验组中与肿瘤干细胞亚群的表达变化. 细胞迁移实验结果(刮痕实验)和细胞侵袭实验检测结肠癌细胞株的迁移和侵袭的变化.
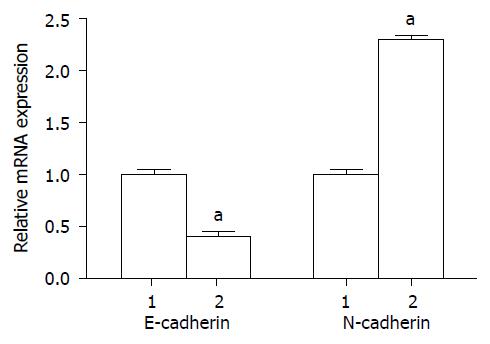
结果: 实时定量PCR和Western blot检测结果表明, 实验组EMT相关标志物E-cadherin和N-cadherin在mRNA水平的表达分别上调和下调(P<0.05). 流式细胞标技术检测对照组和实验组中与肿瘤干细胞亚群的表达变化. 其中实验组肿瘤干细胞CD44+/CD24-的亚群相比于对照组有明显的上调, 具有统计学意义(P<0.05). 说明Twist2蛋白可能通过抑制E-cadherin基因转录活性, 诱发结肠癌细胞发生EMT来提高肿瘤干细胞的比例. 细胞迁移实验结果(刮痕实验)和细胞侵袭实验, 显示Twist过表达细胞与SW480空载细胞相比, 出现了明显的迁移和侵袭运动, 说明Twist可以促进结肠癌细胞株的迁移和侵袭.
结论: Twist2蛋白可能通过抑制E-cadherin基因转录活性, 诱发结肠癌细胞发生EMT来提高肿瘤干细胞的比例和自我更新的能力来促进结肠癌的发生和发展.
核心提示: Twist2蛋白可能通过抑制E-cadherin基因转录活性, 诱发结肠癌细胞发生上皮细胞间质转分化来提高肿瘤干细胞的比例和自我更新的能力来促进结肠癌的发生和发展.
引文著录: 李义. Twist2诱导上皮细胞间质转分化对结肠癌的增殖和迁移的影响. 世界华人消化杂志 2014; 22(36): 5665-5670
Revised: October 17, 2014
Accepted: November 25, 2014
Published online: December 28, 2014
AIM: To investigate the role of Twist2 as a potential target for the treatment of colon cancer in regulating epithelial-mesenchymal transition (EMT).
METHODS: Cell proliferation and migration were determined in colon cancer SW480 cells transfected with pBABE-puro-Twist2, a vector expressing Twist2, and expression levels of E-cadherin, β-catenin and N-cadherin were assessed using qRT-PCR and Western blot. Cancer stem cell subpopulations in non-transfected cells and transfected cells were detected by flow cytometry. Cell migration assay (scratch test) and cell invasion assay were used to determine cell migration and invasion capacity.
RESULTS: Real-time quantitative PCR and Western blot analyses showed that the expression of EMT-related markers E-cadherin and N-cadherin was up-regulated and down-regulated in the transfected cells, respectively. The transfected cells showed stronger ability of migration and invasion. Twsit2 enhanced the capability of forming colonospheres and colonies. CD24 is a HCC stem cell marker, and we discovered that overexpression of Twist2 increased the proportion of CD24+ subpopulation and up-regulated the stem cell proteins. Cell migration assay (scratch test) and cell invasion assay suggested that Twist could promote the migration and invasion of colon cancer cells.
CONCLUSION: Twist2 can promote liver cancer progression by inducing EMT and endowing cancer cells with stem cell-like ability.
- Citation: Li Y. Twist2 promotes colon cancer progression by inducing epithelial-mesenchymal transition. Shijie Huaren Xiaohua Zazhi 2014; 22(36): 5665-5670
- URL: https://www.wjgnet.com/1009-3079/full/v22/i36/5665.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i36.5665
正常的上皮细胞具有典型的顶面-底面极性, 细胞间存在紧密连接和黏附连接, 他的基底面与基底膜相连. 当上皮细胞失去这种典型的上皮样结构, 获得迁移和侵袭的能力, 变成具有间充质细胞形态和特征的细胞, 该变化过程即上皮-间充质细胞转分化(epithelial-mesenchymal transition, EMT)[1,2]. 在EMT转分化的过程中, 细胞的特征性蛋白表达发生一系列的变化, 上皮样细胞特征蛋白E-cadherin等表达量下降, 间充质样细胞特征蛋白Vimentin、α-平滑肌肌动蛋白(α-smooth muscle actin, α-SMA)等表达量上升[3]. 当上皮细胞的基底面降解和细胞迁移离开上皮层时, 此时就意味着EMT过程的完成. Snail、Slug、Twist、ZEB1、ZEB2等转录因子可以直接或间接地作用于E-cadherin的启动子上抑制其表达. 随着对肿瘤的深入研究, 人们发现恶性肿瘤细胞的生长、分化等特征与干细胞密切相关, 进而推测肿瘤的发生起源于干细胞, 并提出肿瘤干细胞(cancer stem cell, CSC)学说. 随后, 研究者先后从急性髓系白血病、乳腺癌、脑肿瘤(如星行胶质瘤)都分离出来肿瘤干细胞[4-6]. 因此本文从Twist2诱导EMT和增强肿瘤干细胞特性从而促进结肠癌的发生发展的视角来探讨结肠癌的发生发展, 为后续治疗结肠癌提供理论参考价值.
细胞株Caco2采购自美国菌种保藏中心(American Tissue Culture Collection, ATCC), 包装细胞系GP2-293和逆转录病毒载体pBABE-puro由美国加州大学伯克利分校罗坤新教授惠赠. Twist2(Abnova, Taipei, Taiwan), Flag(Sigma-Aldrich), E-cadherin、β-catenin、N-cadherin均购自Santa Cruz公司(America). 异硫氰酸荧光素标记的CD44抗体、PE标记的CD24抗体及FACSCalibur流式细胞仪购自BD Biosciences公司.
1.2.1 细胞培养: 细胞培养在DMEM完全培养基中, 添加10%的胎牛血清(fatal bovine serun, FBS), 青霉素(100 U/mL)和链霉素(100 μg/mL). 于37℃、50 mL/L CO2培养箱中通气培养.
1.2.2 目的基因Twist2过表达细胞系的构建: 人源的Twist2-HA cDNA克隆到pBABE-puro表达载体上. 稳定表达的细胞系的构建通过反转录病毒感染获得. 包装细胞系GP2-293长至60%丰度时, 通过脂质体2000(Invitrogen, USA) 转染5 µg的pBABE-puro或者pBABE-puro-Twist 2-HA和5 μg的pCMV-VSVG. 转染48 h后, 收集病毒上清液并在3000 g离心3 min. 上清转移至新的Eppendorf管并经由0.45 μm的滤膜过滤获得干净的实验用病毒颗粒. 将其感染目的细胞, 24 h后, 替换含有2 mg/mL嘌呤霉素的选择性培养基. 含有Twist2-HA或者空载的细胞系通过体外实验RT-PCR和Western blot进行验证.
1.2.3 实时定量PCR验证EMT相关基因的mRNA水平: 总RNA的提取参考TRIzol试剂盒(Invitrogen公司)使用说明书, 整个提取处于无RNase的环境下. EMT标志物相关基因, 包括E-cadherin和Vimentin的mRNAs水平通过SYBR Green法实时定量逆转录PCR进行扩增. 数据同时以3-磷酸甘油醛脱氢酶(GAPDH)作为标准内参并进行归一化处理, 计算出每个基因在不同分组细胞中的表达量, 每个样本进行三个生物学重复. 引物序列如下: E-cadherin, 正向引物: 5'-TGCCCAGAAAATGAAAAAGG-3', 反向引物5'-GTGTATGTGGCAATGCGTTC-3'; Vimentin, 正向引物: 5'-GAGAACTTTGCCGTTGAAGC-3', 反向引物: 5'-GCTTCCTGTAGGTGGCAATC-3'; GAPDH, 正向引物序列为: 5'-CACCCACTCCTCCACCTTTG-3', 反向引物: 5'-CCACCACCCTGTTGCTGTAG-3'.
1.2.4 Western blot检测: 蛋白免疫印迹(Western blot)实验方法介绍如文献[1]所示: 通过破裂细胞, 获取细胞裂解液进行SDS-PAGE凝胶电泳, 并与抗Twist2、Flag、E-cadherin、β-catenin、N-cadherin进行免疫分析, 稀释比例为1:1000, 用于进一步实验分析, 判定各基因在不同细胞样本中的蛋白表达水平.
1.2.5 流式细胞术检测肿瘤细胞干性: CD44+/CD24-细胞亚群的分选通过异硫氰酸荧光素标记的CD44抗体和PE标记的CD24抗体进行检测. 细胞标记后用FACSCalibur流式细胞仪对CD44/CD24标志物进行检测, 分析结肠癌细胞株中CD44+/CD24-细胞亚群的数量并做进一步分析.
1.2.6 细胞划痕实验: 细胞以5×105个的密度接种于6 cm培养皿中, 培养24 h后, 在培养板中间铺满细胞的位置划出一道伤痕, 并轻轻洗去划线周围分离的细胞并加入新鲜的培养基进行培养. 用倒置显微镜记录划痕在不同的时间点下相衬图像的大小, 并对划痕做比较分析.
1.2.7 细胞侵袭实验: 体外侵袭实验: 将生长状态良好的SW480-Twist2 siRNA、SW480-Twist2、SW480及其对照细胞, 常规胰酶消化, 调整细胞浓度为1×105个/mL. 将包被有Matrigel的Transwell小室置于24孔培养板孔中, 在每一Transwell小室的下室加条件培养液0.6 mL, 上室加细胞悬液0.2 mL. 常规培养72 h后, 取出Transwell小室用棉花棒轻轻擦去杯底膜上层的细胞, 用0.1%的结晶紫染色20 min高倍镜下计数穿透滤膜并黏附于其下表面的细胞数. 每小室底膜取6个不同视野, 计算穿膜细胞数的平均值.
统计学处理 采用SPSS17.0统计学软件进行分析, 实验数据以mean±SD表示, 采用Student's t检验方式检测组间的差异, P<0.05为差异具有统计学意义.
通过实时定量PCR检测在肿瘤EMT过程中基因mRNA表达水平的变化, 实验结果EMT相关标志物E-cadherin和N-cadherin在mRNA水平的表达分别上调和下调, 如图1所示.
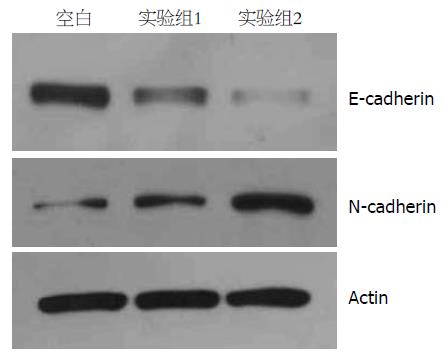
通过Western blot检测在肿瘤EMT过程中蛋白表达水平的变化, 实验结果EMT相关标志物E-cadherin和N-cadherin在蛋白水平的表达分别上调和下调, 如图2所示.
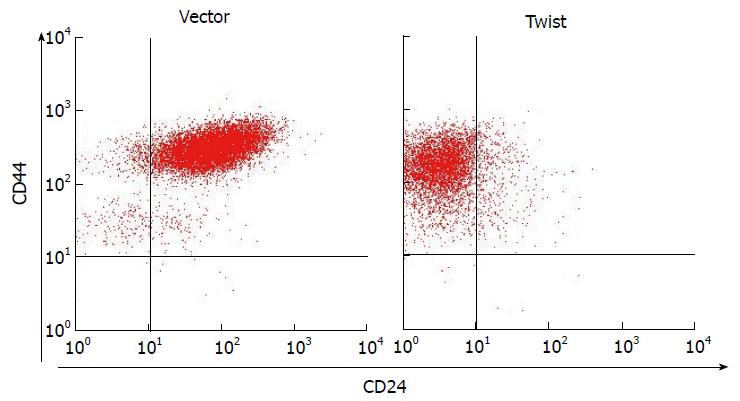
流式细胞标技术检测对照组和实验组中与肿瘤干细胞亚群的表达变化, 检测结果如图3所示, 其中实验组肿瘤干细胞CD44+/CD24-的亚群相比于对照组有明显的上调, 具有统计学意义(P<0.05). 说明Twist2蛋白可能通过抑制E-cadherin基因转录活性, 诱发结肠癌细胞发生EMT来提高肿瘤干细胞的比例.
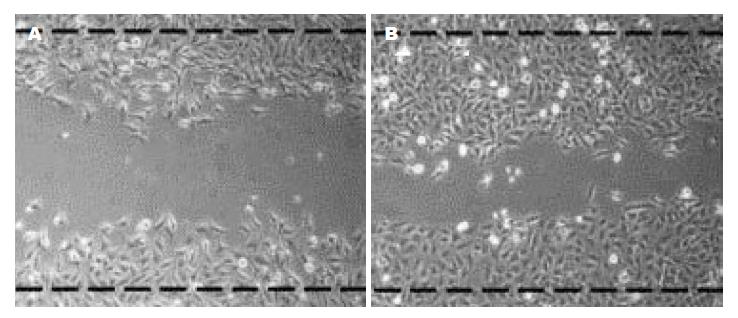
图4显示Twist2过表达细胞与SW482空载细胞相比, 出现了明显的迁移运动, 说明Twist可以促进结肠癌细胞株的迁移.
细胞侵袭能力通过Transwell实验进行验证. 转染Twist的SW480实验组与对照组相比具有明显的侵袭能力, 说明转染Twist后可以明显增强结肠癌细胞株的侵袭能力(图5).
生物体发生EMT可以引起多种不同的效应, 根据其产生的不同效果, EMT可被分成三种亚型[1]. Ⅰ型EMT和胚胎的形成、器官的发育有关, 这种类型的EMT可以产生多种类型的细胞, 并且产生的这些细胞虽然具有间充质细胞的特征, 但是却不会引起组织纤维化, 也不会发生侵染组织的现象. Ⅱ型EMT发生在伤口愈合、组织再生和器官纤维化的过程中. 当机体发生外伤或炎症时, Ⅱ型EMT参与成纤维细胞和其他相关细胞的形成而促进组织修复. Ⅲ型EMT发生在肿瘤细胞中, 参与肿瘤的侵袭和转移. 正常的上皮细胞基因发生突变, 加上其他外界因素的刺激, 上皮细胞可转化为肿瘤细胞, 形成原位癌. 如果肿瘤继续恶化下去, 上皮样细胞丢失掉上皮样细胞的特征, 逐渐获得间充质细胞的特征, 形态上也发生相应的变化, 并且能够突破基底膜的阻碍, 侵染周围组织, 进入血液循环, 在其他组织器官形成转移灶.
肿瘤的形成归根结底是由基因组的不稳定性造成的, 这种基因组的不稳定性使肿瘤获得了标志性的能力: 拥有持续的增殖信号、能够规避生长抑制、能够抗拒细胞死亡、能够永不停息的复制、能够诱导血管生成及侵袭和转移的能力[7]. 肿瘤转移是大多数实体癌治疗不成功几乎必然发生的后果. 肿瘤侵袭转移是肿瘤由原发部位向周围组织的侵袭和性不连续的远隔部位或器官的转移. 肿瘤发生侵袭转移是肿瘤导致患者死亡的最主要原因, 也是肿瘤恶性的重要标志和最本质表现. 肿瘤的侵袭转移基本过程包括转化细胞的生长、实体瘤的细胞解离、周围组织侵袭、穿入脉管进入循环、在循环中存活并聚集、毛细血管床处停留、穿出血管壁、进入周围组织以及在新病灶处生长, 最后形成转移癌. 人类80%-90%的肿瘤来自上皮细胞[8], 上皮细胞发生癌变, 要成功发生侵袭转移, 自身会发生EMT, 逐步丢失掉上皮样细胞特征, 获得间充质细胞特征. 这种变化在肿瘤侵袭前沿(front invision)表现得最明显. 有趣的是, 当肿瘤细胞成功发生转移到达一个新的部位后, 这些细胞就发生间充质样细胞向上皮样细胞转化(mesenchymal-epithelial transition, MET), 丢失间充质细胞特征, 重新获得上皮样细胞特征[9]. 由此可以推测, 间充质样细胞迁移能力强, 有利于细胞的转移, 而肿瘤细胞要在一个新的部位驻扎生长, 就需要恢复上皮样细胞特征, 因为上皮样细胞能与新的环境形成结实的联系, 加强营养物质和信息的交流. 由此可见, 肿瘤的侵袭转移是一个EMT和MET交替发生的动态过程.
生物体内任何一个行为都是在多个分子, 多条信号通路的相互协调, 共同发挥作用完成的, EMT转分化过程也不例外. 研究[10]发现在EMT过程中, 细胞外调节蛋白激酶(extracellular regulated protein kinase, ERK)、磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase, PI3K)、蛋白激酶B(protein kinase B, Akt)、Wnt、转化生长因子β(transforming growth factor β, TGF-β)等信号通路异常活跃. 每条信号通路或者说每个蛋白都能多方面起作用诱发EMT. 目前发现许多分子高表达或活性增高会诱发EMT从而促进肿瘤的发生和发展, 比如Snail、Slug、Twist1、ZEB1(zinc finger E-box binding homeobox 1)、ZEB2、SIP1、TGF-β等[11-15].
上皮-间充质细胞转分化(epithelial-mesenchymal transition, EMT)是存在于生物体特定生理和病理条件下的常见过程. 在这个变化的过程中, 上皮细胞丢失掉上皮样的特征, 转变为没有极性、迁移能力强的间充质样细胞.
刘宝林, 教授, 中国医科大学附属盛京医院
当上皮细胞的基底面降解和细胞迁移离开上皮层时, 此时就意味着EMT过程的完成. 随着对肿瘤的深入研究, 人们发现恶性肿瘤细胞的生长、分化等特征与干细胞密切相关, 进而推测肿瘤的发生起源于干细胞, 并提出肿瘤干细胞(cancer stem cell, CSC)学说.
Twist2是bHLH转录因子家族的一员. 我们发现在人结肠癌细胞系中高表达Twist2能诱导细胞发生EMT转分化, 抑制E-cadherin载体启动子活性, 并增强细胞迁徙和侵袭能力. 同时, 高表达Twist2蛋白可明显地提高结肠癌细胞系中CD24+细胞亚群的比例及体外成球能力, 并促进干细胞特征蛋白的表达.
本文从Twist2诱导EMT和增强肿瘤干细胞特性从而促进结肠癌的发生发展的视角来探讨结肠癌的发生发展, 为后续治疗结肠癌提供理论参考价值.
上皮-间充质细胞转分化(EMT): 正常的上皮细胞具有典型的顶面-底面极性, 细胞间存在紧密连接和黏附连接, 他的基底面与基底膜相连. 当上皮细胞失去这种典型的上皮样结构, 获得迁移和侵袭的能力, 变成具有间充质细胞形态和特征的细胞, 该变化过程即上皮细胞向间充质细胞转分化.
探索诱导上皮细胞间质转分化从而促进结肠癌的增殖和迁移是肿瘤研究的热点, 本文课题设计合理, 方法科学, 数据分析可靠, 结论可信, 是一篇较好的研究论文, 具有较好的发表价值.
编辑: 郭鹏 电编:闫晋利
| 1. | Kalluri R, Weinberg RA. The basics of epithelial-mesenchymal transition. J Clin Invest. 2009;119:1420-1428. [PubMed] [DOI] |
| 2. | Zhao XL, Sun T, Che N, Sun D, Zhao N, Dong XY, Gu Q, Yao Z, Sun BC. Promotion of hepatocellular carcinoma metastasis through matrix metalloproteinase activation by epithelial-mesenchymal transition regulator Twist1. J Cell Mol Med. 2011;15:691-700. [PubMed] [DOI] |
| 3. | Sigurdsson V, Hilmarsdottir B, Sigmundsdottir H, Fridriksdottir AJ, Ringnér M, Villadsen R, Borg A, Agnarsson BA, Petersen OW, Magnusson MK. Endothelial induced EMT in breast epithelial cells with stem cell properties. PLoS One. 2011;6:e23833. [PubMed] [DOI] |
| 4. | Fang X, Cai Y, Liu J, Wang Z, Wu Q, Zhang Z, Yang CJ, Yuan L, Ouyang G. Twist2 contributes to breast cancer progression by promoting an epithelial-mesenchymal transition and cancer stem-like cell self-renewal. Oncogene. 2011;30:4707-4720. [PubMed] [DOI] |
| 5. | Lee TK, Castilho A, Cheung VC, Tang KH, Ma S, Ng IO. CD24(+) liver tumor-initiating cells drive self-renewal and tumor initiation through STAT3-mediated NANOG regulation. Cell Stem Cell. 2011;9:50-63. [PubMed] [DOI] |
| 6. | Isenmann S, Arthur A, Zannettino AC, Turner JL, Shi S, Glackin CA, Gronthos S. TWIST family of basic helix-loop-helix transcription factors mediate human mesenchymal stem cell growth and commitment. Stem Cells. 2009;27:2457-2468. [PubMed] [DOI] |
| 7. | Hanahan D, Weinberg RA. Hallmarks of cancer: the next generation. Cell. 2011;144:646-674. [PubMed] [DOI] |
| 8. | Christofori G, Semb H. The role of the cell-adhesion molecule E-cadherin as a tumour-suppressor gene. Trends Biochem Sci. 1999;24:73-76. [PubMed] |
| 9. | Zeisberg M, Shah AA, Kalluri R. Bone morphogenic protein-7 induces mesenchymal to epithelial transition in adult renal fibroblasts and facilitates regeneration of injured kidney. J Biol Chem. 2005;280:8094-8100. [PubMed] |
| 10. | Tse JC, Kalluri R. Mechanisms of metastasis: epithelial-to-mesenchymal transition and contribution of tumor microenvironment. J Cell Biochem. 2007;101:816-829. [PubMed] |
| 11. | Thiery JP. Epithelial-mesenchymal transitions in tumour progression. Nat Rev Cancer. 2002;2:442-454. [PubMed] |
| 12. | Jechlinger M, Grünert S, Beug H. Mechanisms in epithelial plasticity and metastasis: insights from 3D cultures and expression profiling. J Mammary Gland Biol Neoplasia. 2002;7:415-432. [PubMed] |
| 13. | Shi Y, Massagué J. Mechanisms of TGF-beta signaling from cell membrane to the nucleus. Cell. 2003;113:685-700. [PubMed] |
| 14. | Niessen K, Fu Y, Chang L, Hoodless PA, McFadden D, Karsan A. Slug is a direct Notch target required for initiation of cardiac cushion cellularization. J Cell Biol. 2008;182:315-325. [PubMed] [DOI] |
| 15. | Medici D, Hay ED, Olsen BR. Snail and Slug promote epithelial-mesenchymal transition through beta-catenin-T-cell factor-4-dependent expression of transforming growth factor-beta3. Mol Biol Cell. 2008;19:4875-4887. [PubMed] [DOI] |