修回日期: 2014-10-28
接受日期: 2014-11-12
在线出版日期: 2014-12-28
目的: 观察生长抑素对裸鼠人胃癌SGC-7901细胞种植瘤血管内皮生长因子(vascular endothelial growth factor, VEGF)和碱性成纤维细胞生长因子(basic fibroblast growth factor, bFGF)表达的影响.
方法: 采用人胃癌SGC-7901细胞株建立裸鼠人胃癌种植瘤模型24只, 随机分为4组, 分别尾静脉给予生理盐水(A组)、奥曲肽(B组)、高剂量生长抑素(C组)及低剂量生长抑素(D组)干预3 wk后, 处死动物并获取肿瘤组织; 采用免疫组织化学法及蛋白印迹法检测各肿瘤组织内VEGF和bFGF的表达情况.
结果: 免疫组织化学结果示, A、B、C、D组肿瘤组织中VEGF的平均光密度值(/pix2)分别为0.644±0.022、0.549±0.002、0.345±0.019、0.435±0.018, 与A组相比, B、C、D组VEGF表达量均下调(P<0.001); 与B组相比, C、D组VEGF表达量下调更为显著(P<0.001). A、B、C、D组肿瘤组织中bFGF的平均光密度值(/pix2)分别为0.723±0.018、0.558±0.004、0.288±0.017、0.595±0.011, 与A组相比, B、C、D组bFGF的表达量均下调(P<0.001); 与B组比较, C组bFGF的表达下调更为显著(P<0.001). 免疫印迹结果示: A、B、C、D组肿瘤组织中VEGF的相对灰度值分别为0.98±0.02、0.76±0.02、0.53±0.01、0.53±0.01; bFGF的相对灰度值分别为0.76±0.02、0.71±0.02、0.32±0.01、0.51±0.01; 与A组相比, B、C、D组VEGF、bFGF表达量下调明显(P<0.001); C、D组较B组二者表达量亦显著下调(P<0.001).
结论: 生长抑素能够下调裸鼠人胃癌种植瘤内VEGF、bFGF的表达, 且较奥曲肽表现出更明显的下调优势.
核心提示: 生长抑素能够下调裸鼠人胃癌种植瘤内血管内皮生长因子(vascular endothelial growth factor)和碱性成纤维细胞生长因子(basic fibroblast growth factor)的表达, 且较类似物奥曲肽表现出更明显的下调优势.
引文著录: 邵国庆, 张南征. 生长抑素对裸鼠人胃癌种植瘤内VEGF和bFGF表达的影响. 世界华人消化杂志 2014; 22(36): 5659-5664
Revised: October 28, 2014
Accepted: November 12, 2014
Published online: December 28, 2014
AIM: To observe the effect of somatostatin on the expression of vascular endothelial growth factor (VEGF) and basic fibroblast growth factor (bFGF) in subcutaneous xenografts derived from human gastric carcinoma SGC-7901 cells in nude mice.
METHODS: An animal model of human gastric cancer xenograft was established by subcutaneously implanting SGC-7901 cells in nude mice. Twenty-four nude mice were randomly divided into four groups and treated with normal saline (group A), octreotide (group B), high-dose somatostatin (group C) and low-dose somatostatin (group D) for three weeks, respectively. After treatment, the animals were killed to take the tumors. The expression of VEGF and bFGF was examined by immunohistochemistry and Western blot.
RESULTS: Immunohistochemical analysis indicated that the integral optical density (IOD)/area (/pix2) of VEGF in groups A-D were 0.644 ± 0.022, 0.549 ± 0.002, 0.345 ± 0.019 and 0.435 ± 0.018, respectively. The expression of VEGF protein in tumor tissue was significantly higher in group A than in the other three groups (P < 0.001). Compared with group B, the expression of VEGF was reduced more significantly in groups C and D (P < 0.001 for both). The IOD/area (/pix2) of bFGF in groups A-D were 0.723 ± 0.018, 0.558 ± 0.004, 0.288 ± 0.017 and 0.595 ± 0.011, respectively. The expression of bFGF protein in tumor tissue was significantly higher in group A than in the other three groups (P < 0.001). Compared with group B, the expression of bFGF was reduced more significantly only in group C (P < 0.001). Western blot analysis indicated that the relative expression of VEGF in groups A-D were 0.98 ± 0.02, 0.76 ± 0.02, 0.53 ± 0.01 and 0.53 ± 0.01, respectively. The relative expression of bFGF in groups A-D were 0.76 ± 0.02, 0.71 ± 0.02, 0.32 ± 0.01 and 0.51 ± 0.01, respectively. The expression of bFGF and VEGF protein was significantly higher in group A than in the other three groups (P < 0.001). Compared with group B, the expression of VEGF and bFGF was reduced more significantly in groups C and D (P < 0.001).
CONCLUSION: Somatostatin can down-regulate the expression of VEGF and bFGF in subcutaneous xenografts derived from human gastric carcinoma SGC-7901 cells in nude mice, and the effect is more obvious than that of octreotide.
- Citation: Shao GQ, Zhang NZ. Effect of somatostatin on expression of VEGF and bFGF in human gastric cancer xenografts in nude mice. Shijie Huaren Xiaohua Zazhi 2014; 22(36): 5659-5664
- URL: https://www.wjgnet.com/1009-3079/full/v22/i36/5659.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i36.5659
胃癌是消化系最常见的恶性肿瘤之一, 最新的统计结果发现[1], 在我国, 不论城市还是农村地区, 其发病率均高居第2位, 死亡率均居于第3位. 对于失去手术机会的中晚期胃癌患者, 传统的化疗、放疗等手段效果欠佳. 生长抑素是一种具有广泛生物学活性的环形多肽类激素, 在体内主要表现为对内、外分泌显著的抑制效应, 其类似物治疗肿瘤的研究已开展多年[2]. 胃癌虽为实体肿瘤, 但研究发现[3,4]生长抑素类似物(somatostatin analogues, SSTA)在体内外同样能够抑制胃癌细胞的增殖、促进细胞凋亡. 已探讨的可能机制包括直接[5]和间接[6]2条途径: 前者是SSTA通过与不同的生长抑素受体(somatostatin receptor, SSTR)亚型结合后, 激活下游信号通路来发挥抗肿瘤作用; 后者则主要是SSTA通过抑制促肿瘤生长的细胞外因子的合成与分泌、抑制肿瘤血管生成等作用来完成. 但由于SSTA只能与部分受体亚型结合, 且结合能力相对有限, 可能限制了其抗肿瘤作用的发挥. 而十四肽生长抑素不仅能够与5种受体亚型完全结合[7], 且结合能力明显由于SSTA. 故本研究采用人工合成十四肽生长抑素治疗胃癌裸鼠种植瘤, 观察其较类似物奥曲肽在调控血管内皮生长因子(vascular endothelial growth factor, VEGF)、碱性成纤维细胞生长因子(basic fibroblast growth factor, bFGF)等肿瘤血管生成相关因子表达上的优劣, 并为生长抑素治疗胃癌提供实验依据.
SGC-7901细胞株为中分化人胃腺癌细胞由徐州医学院肿瘤研究所保存惠赠. ♀ Balb/c裸鼠, SPF级, 4-6周龄, 体质量16-20 g, 购自上海斯莱克实验动物有限公司, 动物合格证号: SCXK(沪)2008-0016, 饲养于徐州医学院动物实验中心SPF屏障系统内. 生长抑素为默克雪兰诺公司生产(购自徐州医学院附属医院). 奥曲肽为瑞士诺华公司生产(购自中国人民解放军第九七医院). 兔抗人VEGF单克隆抗体和兔抗人bFGF多克隆抗体均购自美国Abcam公司. SP三步法检测试剂盒和DAB试剂盒均购自碧云天公司.
1.2.1 细胞培养和裸鼠模型构建: SGC-7901细胞培养于含10%灭活小牛血清的RPMI 1640培养基中, 1-2 d换液1次. 取对数生长期的细胞, 台盼蓝检测细胞活力≥90%, 用PBS制备成(1-2)×107 cells/mL浓度的细胞悬液, 以每只0.2 mL接种于各裸鼠右腋皮下. 裸鼠置于SPF层流系统中饲养, 所应用的饲料、垫料、笼具及接触的器械等均高压消毒后使用.
1.2.2 药物治疗: 待裸鼠接种部位肿瘤长至100-300 mm3时, 将裸鼠称质量并随机分为4组: 对照组(给予同体积无菌生理盐水)、奥曲肽组(0.1 mg/kg)、高剂量生长抑素组(1.0 mg/kg)、低剂量生长抑素组(0.1 mg/kg), 每组各6只裸鼠. 采用每天1次尾静脉给药, 连续用药3 wk, 末次用药24 h后处死动物并获取肿瘤组织.
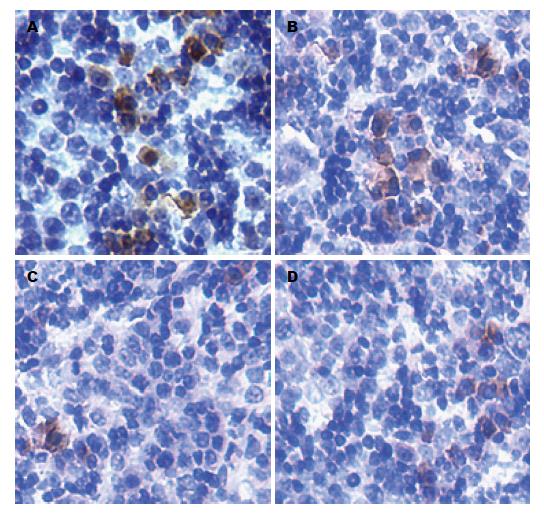
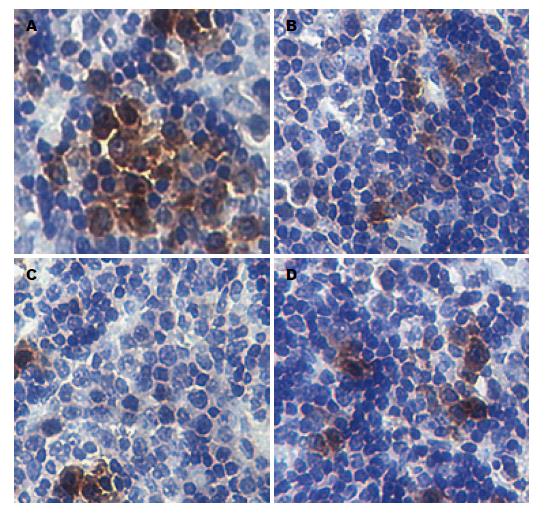
1.2.3 免疫组织化学法检测VEGF和bFGF表达: 肿瘤组织用40 g/L甲醛溶液固定, 经脱水、包埋、4 μm厚连续切片. VEGF和bFGF抗体稀释度分别为1:100和1:200, 操作步骤严格按照SP试剂盒说明书进行. 用PBS代替一抗作阴性对照, 用已知阳性片作阳性对照. VEGF和bFGF阳性表达均为肿瘤细胞胞质染成棕黄色. 显微镜下观察并拍摄图片, 采用Image pro-plus 6.0图像分析软件测量各图片免疫阳性区的总光密度值(integral optical density, IOD)和面积(area), 以平均光密度值[optical density (mean) = IOD/area]代表各蛋白的含量.
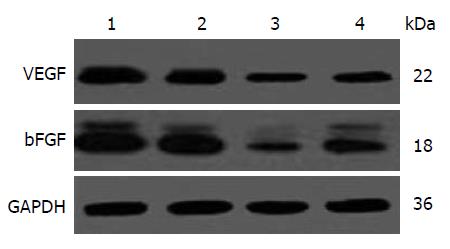
1.2.4 免疫印迹法检测VEGF和bFGF表达: 提取肿瘤组织中的总蛋白, BCA法检测蛋白浓度, SDS聚丙烯酰胺凝胶电泳, 转膜, 5%脱脂奶粉封闭, TBST洗膜后一抗孵育, 4 ℃过夜, TBST洗膜后二抗室温孵育2 h, DAB显色试剂盒显色并拍照. 采用Image J图像分析系统对结果进行分析, 计算目的蛋白与内参的OD比值.
统计学处理 采用SPSS16.0统计软件包进行统计分析, 所有数据均以mean±SD表示, 单处理因素多样本均数的比较采用单因素方差分析, 并用LSD-t检验进行样本均数间两两比较. 检验水准α = 0.05. P<0.05为差异有统计学意义.
VEGF在A、B、C、D组表达量的平均光密度值(/pix2)分别为0.644±0.022、0.549±0.002、0.345±0.019和0.435±0.018, 各组间比较, 差异有统计学意义(F = 120.662, P<0.001); 与在B组表达量的平均光密度值比较, C组VEGF的表达量显著下调, 差异有统计学意义(t = 13.6, P<0.001); 与在B组表达量的平均光密度值比较, D组VEGF的表达量下调显著, 差异有统计学意义(t = 7.6, P<0.001); 与在D组表达量的平均光密度值比较, C组VEGF表达下调更为明显, 差异有统计学意义(t = 6.0, P<0.001)(图1). bFGF在A、B、C、D组的表达量的平均光密度值(/pix2)分别为0.723±0.018、0.558±0.004、0.288±0.017和0.595±0.011, 各组件比较, 差异有统计学意义(F = 591.857, P<0.001); 与在B组表达量的平均光密度值比较, D组bFGF的表达量下调更为显著, 差异有统计学意义(t = 27.0, P<0.001); 与在D组表达量的平均光密度值比较, C组bFGF表达下调更为明显, 差异有统计学意义(t = 31.0, P<0.001)(图2).
VEGF在A、B、C、D组表达量的相对灰度值分别为0.98±0.02、0.76±0.02、0.53±0.02和0.53±0.01, 各组间比较, 差异有统计学意义(F = 737.201, P<0.001); 与在B组表达量的相对灰度值比较, C组VEGF的表达量显著下调, 差异有统计学意义(t = 23.0, P<0.001); 与在B组表达量的相对灰度值比较, D组VEGF的表达量下调显著, 差异有统计学意义(t = 23.0, P<0.001); C、D两组间VEGF表达量的相对灰度值无统计学差异(P = 0.598)(图3). bFGF在A、B、C、D组的表达量的相对灰度值分别为0.76±0.02、0.71±0.02、0.32±0.01和0.51±0.01, 各组间比较, 差异有统计学意义(F = 501.312, P<0.001); 与在B组表达量的相对灰度值比较, C组bFGF的表达量下调显著, 差异有统计学意义(t = 39.0, P<0.001); 与在B组表达量的相对灰度值比较, D组bFGF的表达量下调显著, 差异有统计学意义(t = 20.0, P<0.001); 与在D组表达量的相对灰度值比较, C组bFGF表达下调更为明显, 差异有统计学意义(t = 18.0, P<0.001)(图3).
生长抑素是一种具有广泛生物学活性的环形多肽类激素, 在人体内包括十四肽(SST14)和二十八肽(SST28)两种天然存在形式. 其生理功能主要表现为显著地抑制效应. 目前认为, 生长抑素及其类似物主要通过与体内细胞膜上的SSTR相结合而发挥其抗肿瘤作用. SSTR属G蛋白偶联型受体家族, 包括SSTR1-SSTR5 5个受体亚型[8]. 不同的受体亚型介导发挥不同的作用[9]: SSTR1能够介导抗肿瘤细胞增殖效应; SSTR2则介导抑制生长激素的释放及抗肿瘤增殖; SSTR3能诱导细胞产生凋亡; SSTR4被发现在肺内高表达, 但其具体作用尚不明确; 而SSTR5除了介导抑制胰岛素与胰高血糖素的分泌外, 同时也参与抗肿瘤细胞的增殖.
多数学者选择人工合成的SSTA(如奥曲肽、伐普肽等)而不是生长抑素进行抗肿瘤相关研究, 其主要原因是, 天然生长抑素作用范围广泛、血浆半衰期短(1-3 min)、选择性不强[10], 而未能充分考虑SST14和SST28是目前仅有的能够与5种受体亚型均具有高亲和力的药物[7]. 奥曲肽不仅能够抑制肿瘤的生长, 其对化疗药物的增敏作用也获得证实[11]. 因此, 如果天然生长抑素能够较类似物在抑制肿瘤增殖、减少肿瘤血管生成等方面有更好的表现, 肿瘤的内分泌治疗有可能成为化疗、放疗及生物治疗等现有治疗手段的补充治疗方式. 基于对生长抑素及其类似物发挥抗肿瘤作用的机制的考虑, 我们推测生长抑素在抑制胃癌生长方面较类似物可能更具优势. 由于在各类似物中奥曲肽的研究在目前最为广泛和深入, 故在本实验中我们利用奥曲肽作为阳性对照药物, 比较二者对裸鼠人胃癌种植瘤内促血管生成相关因子VEGF、bFGF表达的影响.
VEGF、bFGF均已被证实为最强有力的促血管生成因子, 在肿瘤的局部生长和远处转移方面发挥着重要作用. 有体外研究表明[12,13]奥曲肽能够抑制人胃癌细胞SGC-7901中VEGF和鼠科内皮细胞HECa10中bFGF的分泌, 动物实验亦证实[14,15], 奥曲肽能够下调胃癌种植瘤内VEGF、bFGF的表达, 而李洪华等[16]研究也发现, 奥曲肽皮下注射不仅能够降低SSTR2表达阳性的胃癌患者血清中VEGF、bFGF的浓度, 还能够下调其肿瘤组织中二者的表达, 提示奥曲肽在体内外均可能参与抑制肿瘤新生血管的形成. 本实验采用动物皮下移植瘤模型, 于体内水平研究生长抑素及其类似物对胃癌组织VEGF、bFGF表达的影响, 结果发现, 生长抑素及奥曲肽作用于裸鼠后, 肿瘤组织中VEGF、bFGF蛋白的表达均较对照组有所下调, 且同等质量浓度下, 生长抑素组的下调量明显高于奥曲肽组. 免疫组织化学法和免疫印迹法的检测结果基本一致, 提示生长抑素及其类似物均可能参与抑制VEGF和bFGF的合成与分泌. 而生长抑素较奥曲肽之所以表现出一定的抑制优势, 分析可能的原因包括: (1)生长抑素较奥曲肽能够更高效地结合瘤体及瘤周分布的各生长抑素受体亚型, 使受体后抑制肿瘤效应达到最大化; (2)生长抑素在体内对瘤体分泌的各种促肿瘤生长的激素和因子较奥曲肽有更强的抑制作用; (3)奥曲肽是生长抑素长效类似物, 长期应用可能会导致瘤体和瘤周生长抑素受体的封闭, 反而抑制了其作用的发挥. 另外, 从手术中所获取的人胃癌组织标本的检测情况来看, 生长抑素受体亚型的表达在不同分化类型的胃癌组织中存在差异[17], 而不同的受体亚型又介导发挥不同的抗肿瘤效应, 这必然在一定程度上影响生长抑素及其类似物作用的发挥. 具体到本实验, SGC-7901细胞系是我国自行建系的细胞系[18], 属于中分化腺癌, 因此对SGC-7901种植瘤内生长抑素受体亚型表达情况的检测、对分别应用生长抑素及其类似物后种植瘤内生长抑素受体亚型的检测均将成为下一步实验的重点. 需要注意的是, 免疫组织化学法和免疫印迹法仅仅是对VEGF、bFGF在蛋白水平的表达情况进行了定性和半定量的分析, 生长抑素及其类似物对二者在mRNA水平和血清内含量的影响是否同样存在差异还需进一步检测获知.
本研究结果表明, 生长抑素对胃癌移植瘤内VEGF、bFGF的表达下调优于奥曲肽, 提示若将生长抑素与常规的手术、化疗和放疗联合应用, 可能会进一步改善胃癌患者预后.
生长抑素类似物(somatostatin analogues, SSTA)能够在体内外抑制胃癌细胞的增殖、促进其凋亡, 主要机制是与部分生长抑素受体结合发挥作用, 而十四肽生长抑素不仅能够与5种受体亚型完全结合, 且结合能力明显优于SSTA, 但目前国内外尚缺乏十四肽生长抑素对胃癌作用的动物实验研究.
姜春萌, 教授, 主任, 大连医科大学附属第二医院消化科
随着对实验动物模型的观察, 发现生长抑素不仅能够显著抑制胃癌细胞的增殖, 还能够下调肿瘤血管生成相关因子的表达, 为胃癌的内分泌治疗提供了新的思路.
国内有研究报道了生长抑素在体外对胃癌细胞株生长有明显的抑制作用, 尚缺乏动物实验研究.
大多数研究关注生长抑素衍生物奥曲肽, 本研究在此基础上对生长抑素本身的作用进行了研究, 并将其作用结果与奥曲肽进行了对比.
生长抑素对胃癌移植瘤内血管内皮生长因子(vascular endothelial growth factor, VEGF)和碱性成纤维细胞生长因子(basic fibroblast growth factor, bFGF)的表达下调优于奥曲肽, 因此若将生长抑素与常规的手术、化疗和放疗联合应用, 可能会进一步改善胃癌患者预后.
生长抑素类似物(SSTA): 指人工合成的多肽, 其相较于生长抑素具有作用相对单一、在某些方面更强大、血浆半衰期较长等特点, 种类有数百种, 根据残基个数, 分为六肽、七肽、八肽、十四肽等, 其中具有代表性的有奥曲肽、伐普肽、兰瑞肽及司格列肽等.
文章研究了生长抑素对胃癌细胞VEGF、bFGF的影响, 研究设计合理、方法得当, 得出结果可靠, 结论正确, 与大多数研究关注生长抑素衍生物奥曲肽相比具有一定的创新性.
编辑: 韦元涛 电编:闫晋利
| 2. | Rinke A, Müller HH, Schade-Brittinger C, Klose KJ, Barth P, Wied M, Mayer C, Aminossadati B, Pape UF, Bläker M. Placebo-controlled, double-blind, prospective, randomized study on the effect of octreotide LAR in the control of tumor growth in patients with metastatic neuroendocrine midgut tumors: a report from the PROMID Study Group. J Clin Oncol. 2009;27:4656-4663. [PubMed] [DOI] |
| 4. | Szepeshazi K, Schally AV, Nagy A, Wagner BW, Bajo AM, Halmos G. Preclinical evaluation of therapeutic effects of targeted cytotoxic analogs of somatostatin and bombesin on human gastric carcinomas. Cancer. 2003;98:1401-1410. [PubMed] [DOI] |
| 5. | Weckbecker G, Lewis I, Albert R, Schmid HA, Hoyer D, Bruns C. Opportunities in somatostatin research: biological, chemical and therapeutic aspects. Nat Rev Drug Discov. 2003;2:999-1017. [PubMed] [DOI] |
| 6. | Barnett P. Somatostatin and somatostatin receptor physiology. Endocrine. 2003;20:255-264. [PubMed] [DOI] |
| 7. | Hoyer D, Lübbert H, Bruns C. Molecular pharmacology of somatostatin receptors. Naunyn Schmiedebergs Arch Pharmacol. 1994;350:441-453. [PubMed] [DOI] |
| 8. | Froidevaux S, Eberle AN. Somatostatin analogs and radiopeptides in cancer therapy. Biopolymers. 2002;66:161-183. [PubMed] [DOI] |
| 9. | Lewis I, Bauer W, Albert R, Chandramouli N, Pless J, Weckbecker G, Bruns C. A novel somatostatin mimic with broad somatotropin release inhibitory factor receptor binding and superior therapeutic potential. J Med Chem. 2003;46:2334-2344. [PubMed] [DOI] |
| 10. | Schally AV, Szepeshazi K, Nagy A, Comaru-Schally AM, Halmos G. New approaches to therapy of cancers of the stomach, colon and pancreas based on peptide analogs. Cell Mol Life Sci. 2004;61:1042-1068. [PubMed] [DOI] |
| 12. | 郭 雯珲, 王 川, 洪 天姿, 傅 芳萌, 张 捷, 郑 美春. 生长抑素受体亚型2、5在胃癌细胞株中的表达及奥曲肽对胃癌细胞分泌VEGF的抑制作用. 临床和实验医学杂志. 2010;9:321-323. |
| 13. | Lawnicka H, Stepień H, Wyczółkowska J, Kolago B, Kunert-Radek J, Komorowski J. Effect of somatostatin and octreotide on proliferation and vascular endothelial growth factor secretion from murine endothelial cell line (HECa10) culture. Biochem Biophys Res Commun. 2000;268:567-571. [PubMed] [DOI] |