修回日期: 2014-10-20
接受日期: 2014-11-05
在线出版日期: 2014-12-18
目的: 本研究采用Meta分析旨在更好地探讨人8-羟基鸟嘌呤糖苷酶(human 8-oxoguanine glycosylase, hOGG1) Ser326Cys多态性与食管癌易感性之间的关系.
方法: 使用中国生物医学文献数据库(CBM)、中国期刊全文数据库(CNKI)、万方数据库(WanFang DATA)、中文科技期刊全文数据库维普(VIP)、Medline、PubMed、Academic Search Premier(ASP)等数据库检索关于hOGG1 Ser326Cys多态性与食管癌相关性的文献, 使用OR值及95%可信区间评估相关度, 使用Stata/SE 11.0软件进行统计分析.
结果: 14项病例-对照研究, 包括2693例食管癌患者和4027名正常对照个体被纳入当前的Meta分析. 我们发现hOGG1 Ser326Cys多态性与食管癌存在相关性. 隐性模型C/C vs C/S+S/S: OR = 1.26, 95%CI: 1.08-1.48; 共显性模型C/C vs S/S: OR = 1.25, 95%CI: 1.05-1.49. 在亚组分析中显示: 在隐性模型(C/C vs C/S+S/S)和共显性模型(C/C vs S/S)中, 亚洲人群、鳞癌患者、以随机人群为来源的研究及以血液为DNA来源的研究中, hOGG1 Ser326Cys多态性可增加食管癌的易感性.
结论: 本研究显示hOGG1 Ser326Cys多态性与食管癌易感性之间存在相关性, Cys326基因型能增加食管癌发病风险. 但以上结论仍需要大样本研究进行验证.
核心提示: 本文纳入14项病例-对照研究, 包括2693例食管癌患者和4027名对照. 结果显示, hOGG1 Ser326Cys多态性可增加食管癌的易感性. 但是以上结论仍需更多设计严谨、样本量大的高质量研究加以证实.
引文著录: 李小林, 余倩, 欧文静, 范巧未, 张学彦. hOGG1 Ser326Cys基因多态性与食管癌相关性的Meta分析. 世界华人消化杂志 2014; 22(35): 5501-5509
Revised: October 20, 2014
Accepted: November 5, 2014
Published online: December 18, 2014
AIM: To explore the association between the human 8-oxoguanine glycosylase (hOGG1) Ser326Cys polymorphism and esophageal carcinoma.
METHODS: Databases, including CBM, CNKI, WanFang, VIP, Medline, Pubmed, and ASP were searched to identify studies assessing the association between the hOGG1 Ser326Cys polymorphism and esophageal carcinoma. Odds ratios (ORs) with 95% confidence intervals (CIs) were used to assess the strength of the association. Stata/SE 11.0 software was used for statistical analysis.
RESULTS: Fourteen studies involving 2693 cases and 4027 controls were included. The hOGG1 Ser326Cys polymorphism was associated with esophageal carcinoma (recessive model C/C vs C/S+S/S: OR = 1.26, 95%CI: 1.08-1.48; co-dominant model C/C vs S/S: OR = 1.25, 95%CI: 1.05-1.49). In subgroup analyses, it was found that hOGG1 Ser326Cys polymorphism might increase the susceptibility to esophageal carcinoma in Asian populations, squamous cell carcinoma, and population- and tissue-based studies.
CONCLUSION: This study suggested that the hOGG1 Ser326Cys polymorphism has relevance to esophageal carcinoma. Cys326 may increase the susceptibility to esophageal carcinoma. However, the above conclusion still needs validation by large sample studies.
- Citation: Li XL, Yu Q, Ou WJ, Fan QW, Zhang XY. A Meta-analysis of association between hOGG1 Ser326cys polymorphism and esophageal carcinoma. Shijie Huaren Xiaohua Zazhi 2014; 22(35): 5501-5509
- URL: https://www.wjgnet.com/1009-3079/full/v22/i35/5501.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i35.5501
食管癌(esophageal carcinoma)是全球最常见的十大恶性肿瘤之一, 发病率和死亡率呈逐年上升的趋势[1], 其病因目前尚不十分明确. 2011年国际癌症研究中心(International Agency for Research on Cancer, IARC)全球癌症统计报告显示[1]: 2008年全球食管癌新发病例46.2万, 占全部肿瘤发病的4.2%; 死亡病例40.7万, 占全部肿瘤死亡的5.7%. 80%-85%的食管癌病例分布在发展中国家, 中国是世界上食管癌发病率和死亡率最高的国家. 目前基因遗传易感性在食管癌发生发展过程中的作用受到了极大的关注[2].
人8-羟基鸟嘌呤糖苷酶(human 8-oxoguanine glycosylase, hOGG1)是一种DNA修复酶, 他能特异切除8-羟基鸟嘌呤(8-hygroxyguanine, 8-OHdG), 对损伤的DNA进行修复[3]. 从遗传的角度来说, 如果DNA修复基因的遗传变异能影响其对DNA的修复能力, 这就意味着癌症发病风险的增加. 目前大量的分子流行病学研究对hOGG1基因多态性与各种癌症易感性进行了分析, 尤以Ser326Cys最为常见. 该位点存在于hOGG1基因第7外显子的第1245位碱基处, 该处碱基C/G替换使第326位密码子编码丝氨酸(Ser, 密码子TCC)或半胱氨酸(Cys, 密码子TGC), 形成hOGG1-Ser326和hOGG1-Cys326两种蛋白. 部分研究表明携带Ser的hOGG1蛋白修复能力是Cys变异体的7倍[4]. 因此, 有学者认为hOGG1基因Ser326Cys多态性可能影响机体对DNA损伤的修复能力, 与肿瘤的易感性有关[5]. 然而关于Ser326Cys多态性与食管癌易感性关系的研究结果并不一致, 本研究通过系统全面的文献检索, 综合分析相关数据, 希望可以得到更有力的结果, 探讨hOGG1多态性与食管癌易感性之间的关系, 提供循证医学证据.
将"食管癌/食管恶性肿瘤/食管肿瘤", "人8-羟基鸟嘌呤糖苷酶/human 8-oxoguanine glycosylase/hOGG1/OGG1/OGG", "多态性"等作为关键词使用CBM、CNKI、WanFang DATA、VIP进行检索. 同时将"esophageal neoplasms/esophageal cancer/esophageal carcinoma", "human 8-oxoguanine glycosylase/hOGG1/OGG1/OGG", "polymorphism/variation/mutation/SNP"等作为关键词使用Medline、PubMed、ASP等数据库进行检索. 收集关于hOGG1 Ser326Cys基因多态性与食管癌相关性的文献, 最后检索日期为2014-05-31.
1.2.1 纳入与排除标准: 纳入标准: (1)研究类型为病例-对照研究; (2)研究对象为人类; (3)涉及hOGG1 Ser326Cys基因多态性与食管癌相关性的研究; (4)病例组为经临床及病理诊断为食管癌的患者; (5)说明对照组来源; (6)文献中数据完整. 排除标准: (1)单纯病例研究、病例报道、综述、评论等文献; (2)如有重复发表的文献仅纳入资料信息最全的研究; (3)关于食管癌患者家系hOGG1 Ser326Cys基因多态性的研究; (4)无法提供完整数据的文献.
1.2.2 数据提取: 有两位研究者独立进行文献筛选和资料提取, 意见不一致时通过讨论解决或由第三位研究者协助解决. 数据提取的内容包括: 第一作者姓名、发表年限、国家、种族、病例组和对照组各基因型的分布情况、患者DNA来源(从血液或肿瘤组织)、对照组来源(随机人群或医院人群为基础)、实验方法, 我们还测试了在对照组基因型分布的Hardy-Weinberg平衡(HWE).
统计学处理 采用Stata/SE11.0软件对纳入本研究的各组数据进行分析. 并采用Q检验和I2统计量分别对隐性模型(C/C vs C/S+S/S)、显性模型(C/C+C/S vs S/S)、共显性遗传模型(C/C vs S/S及C/S vs S/S)进行异质性检验, 若P>0.05或I2<50%提示各研究间无明显异质性, 采用固定效应模型进行分析, 反之则采用随机效应模型. 合并效应选用OR(95%CI)进行统计. 采用Egger's检验和Begg's检验进行定量发表偏倚分析并绘制漏斗图, 将P>0.05定为无明显发表偏倚. 按种族、病理类型、对照组来源、患者DNA来源等, 对研究进行亚组分析. 通过剔除不符合HWE的研究, 依次剔除每项研究, 以评价Meta分析结果的稳定性, 来进行敏感性分析.
通过初步检索, 共获取文献238篇, 删除重复记录88篇. 通过阅读文献标题及摘要, 删除不相关文献112篇. 阅读全文后, 删除不相关或无病例对照文献25篇. 最终共13篇文献符合纳入标准, 由于其中一篇文献包括两项研究, 因此, 共14项研究被纳入到Meta分析. 涉及2693例食管癌患者和4027名对照者的汇总分析(表1, 2). 其中9项研究关于亚洲人群, 5项研究关于高加索人群. 7项研究关于鳞癌, 2项研究关于腺癌, 3项研究不明确何种类型肿瘤, 2项研究同时包括鳞癌与腺癌, 与该5项研究作者联系后, 我们也不能得知各病理的类型及数量. 对照组有10项研究是以随机人群为基础来源的, 3项研究是以医院人群为基础来源的, 1项研究既包括随机人群, 也包括医院人群来源. 患者的DNA从不同的来源提取, 9项研究从血液中提取, 4项研究从组织中提取, 1项研究中72%从血液中提取, 28%从组织中提取. 此外, 在3项研究中对照组的基因型分布不符合HWE.
| 第一作者 | 出版时间 | 国家 | 种族 | 病理 | 对照来源 | 患者DNA来源 | 实验方法 |
| Xing等[6] | 2001 | 中国 | 亚洲人 | 鳞癌 | 随机人群 | 组织 | PCR-SSCP |
| 高长明等[7] | 2000 | 中国 | 亚洲人 | 无法获知 | 随机人群 | 血液 | PCR-SSCP |
| Hao等[8] | 2004 | 中国 | 亚洲人 | 鳞癌 | 随机人群 | 混合3 | PCR-RFLP |
| 刘冉等[9] | 2005 | 中国 | 亚洲人 | 无法获知 | 医院人群 | 血液 | diASA-AMP |
| Hall等[10] | 2007 | 欧洲国家 | 高加索人 | 鳞癌 | 医院人群 | 血液 | TaqMan |
| Ferguson等[11] | 2008 | 爱尔兰 | 高加索人 | 腺癌 | 随机人群 | 血液 | TaqMan |
| Tse等[12] | 2008 | 加拿大 | 高加索人 | 腺癌 | 随机人群 | 血液 | TaqMan |
| Akbari等[13] | 2009 | 伊朗 | 高加索人 | 鳞癌 | 混合2 | 组织 | MassARRAY |
| 朱晓玲等[14] | 2009 | 中国 | 亚洲人 | 鳞癌 | 随机人群 | 组织 | PCR-SSCP |
| Lagadu等[15] | 2010 | 法国 | 高加索人 | 混合1 | 随机人群 | 血液 | PCR-RFLP |
| Upadhyay(1)等[16] | 2010 | 印度 | 亚洲人 | 混合 | 随机人群 | 血液 | PCR-CTPP |
| Upadhyay(2)等[16] | 2010 | 印度 | 亚洲人 | 混合 | 随机人群 | 血液 | PCR-CTPP |
| 胡红军等[17] | 2010 | 中国 | 亚洲人 | 鳞癌 | 随机人群 | 组织 | PCR-RFLP |
| Li等[18] | 2011 | 中国 | 亚洲人 | 鳞癌 | 医院人群 | 血液 | PCR-SSCP |
| 第一作者 | 病例组 | 对照组 | HWE | ||||
| Ser/Ser | Ser/Cys | Cys/Cys | Ser/Ser | Ser/Cys | Cys/Cys | ||
| Xing等[6] | 78 | 76 | 42 | 68 | 106 | 27 | 0.154 |
| 高长明等[7] | 14 | 55 | 24 | 29 | 120 | 49 | 0.0011 |
| Hao等[8] | 153 | 180 | 77 | 184 | 216 | 79 | 0.250 |
| 刘冉等[9] | 16 | 57 | 33 | 21 | 50 | 35 | 0.682 |
| Hall等[10] | 107 | 10 | 56 | 622 | 320 | 27 | 0.061 |
| Ferguson等[11] | 138 | 67 | 4 | 141 | 96 | 11 | 0.288 |
| Tse等[12] | 198 | 95 | 17 | 294 | 133 | 26 | 0.0401 |
| Akbari等[13] | 91 | 76 | 29 | 124 | 102 | 25 | 0.552 |
| 朱晓玲等[14] | 67 | 85 | 36 | 80 | 95 | 28 | 0.981 |
| Lagadu等[15] | 14 | 3 | 0 | 22 | 19 | 2 | 0.402 |
| Upadhyay(1)等[16] | 59 | 66 | 10 | 94 | 89 | 12 | 0.128 |
| Upadhyay(2)等[16] | 84 | 97 | 19 | 96 | 100 | 11 | 0.0201 |
| 胡红军等[17] | 88 | 93 | 54 | 80 | 120 | 28 | 0.096 |
| Li等[18] | 86 | 126 | 13 | 97 | 123 | 26 | 0.154 |
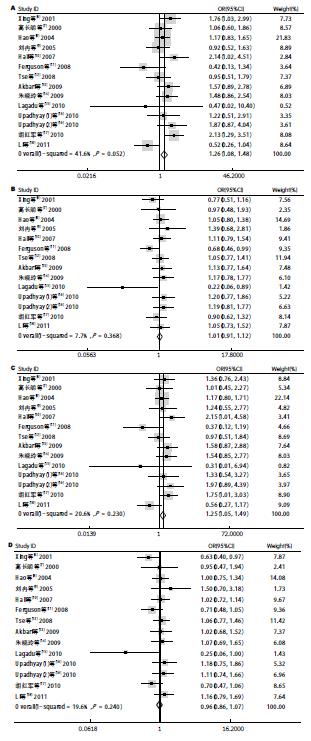
隐性模型(C/C vs C/S+S/S) 中, P = 0.052, I2 = 41.6%; 显性模型(C/C+C/S vs S/S)中, P = 0.368, I2 = 7.7%; 共显性遗传模型中(C/C vs S/S)中, P = 0.231, I2 = 20.5%; 共显性遗传模型(C/S vs S/S)中, P = 0.241, I2 = 19.6%. 结果表明: 4种模型均无明显异质性, 故均采用固定效应模型.
隐性模型(C/C vs C/S+S/S)中OR(95%CI)为1.26(1.08-1.48), 如森林图1A所示. 显性模型(C/C+C/S vs S/S)中OR(95%CI)为1.01(0.91-1.12), 如森林图1B所示. 共显性模型(C/C vs S/S)中OR(95%CI)为1.25(1.05-1.49), 如森林图1C所示. 共显性模型(C/S vs S/S)中OR(95%CI)为0.96(0.86-1.07), 如森林图1D所示. 结果表明: 在隐性模型(C/C vs C/S+S/S)和共显性模型(C/C vs S/S)中, hOGG1 Ser326Cys多态性可增加食管癌的易感性, 而在显性模型(C/C+C/S vs S/S)和共显性模型(C/S vs S/S)中hOGG1 Ser326Cys多态性与食管癌易感性无统计学意义.
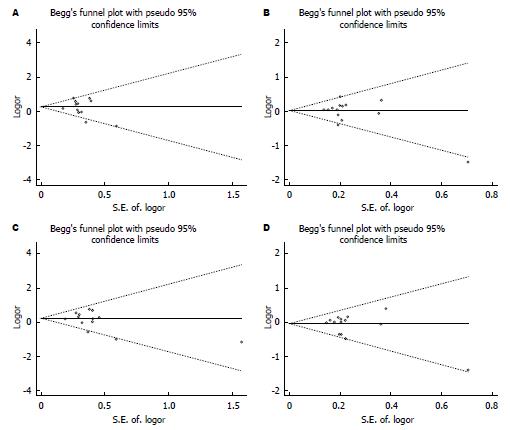
隐性模型(C/C vs C/S+S/S)中, 总体样本Begg's检验Z = 1.09, Pr>|Z| = 0.274, 其漏斗图对称性较好(图2A). Egger's检验t = -0.92, P|t| = 0.375. 显性模型(C/C+C/S vs S/S)中, 总体样本Begg's检验Z = 0.11, Pr>|Z| = 0.913, 其漏斗图对称性较好(图2B). Egger's检验t = -0.99, P|t| = 0.344. 共显性模型(C/C vs S/S)中, 总体样本Begg's检验Z = 1.20, Pr>|Z| = 0.228, 其漏斗图对称性较好(图2C). Egger's检验t = -1.15, P|t| = 0.272. 共显性模型(C/S vs S/S)中, 总体样本Begg's检验Z = 0.33, Pr>|Z| = 0.743, 其漏斗图对称性较好(图2D). Egger's检验t = -0.98, P|t| = 0.349. 结果表明: 4种模型均无明显发表偏倚.
亚洲人群, 在隐性模型(C/C vs C/S+S/S)中OR值(95%CI)为1.28(1.07-1.53), 在显性模型(C/C+C/S vs S/S)中OR值(95%CI)为1.04(0.91-1.19), 在共显性模型(C/C vs S/S)中, OR值(95%CI)为1.27(1.04-1.56), 在共显性模型(C/S vs S/S)中OR值(95%CI)为0.98(0.85-1.13). 结果表明: 在隐性模型(C/C vs C/S+S/S)和共显性模型(C/C vs S/S)中, hOGG1 Ser326Cys多态性可增加食管癌的易感性, 而在显性模型(C/C+C/S vs S/S)和共显性模型(C/S vs S/S)中, hOGG1 Ser326Cys多态性与食管癌易感性无统计学意义.
高加索人群, 在隐性模型(C/C vs C/S+S/S)中OR值(95%CI)为1.21(0.86-1.71), 在显性模型(C/C+C/S vs S/S)中OR值(95%CI)为0.97(0.81-1.14), 在共显性模型(C/C vs S/S)中OR值(95%CI)为1.24(0.87-1.78), 在共显性模型(C/S vs S/S)中OR值(95%CI)为0.93(0.78-1.12). 结果表明: hOGG1 Ser326Cys多态性与食管癌易感性无统计学意义.
鳞癌在隐性模型(C/C vs C/S+S/S)中OR值(95%CI)为1.40(1.15-1.70), 在显性模型(C/C+C/S vs S/S)中OR值(95%CI)为1.03(0.90-1.17), 在共显性模型(C/C vs S/S)中OR值(95%CI)为1.34(1.09-1.66), 在共显性模型(C/S vs S/S)中OR值(95%CI)为0.94(0.82-1.09). 结果表明: 在隐性模型(C/C vs C/S+S/S)和共显性模型(C/C vs S/S)中, hOGG1 Ser326Cys多态性可增加食管癌的易感性, 而在显性模型(C/C+C/S vs S/S)和共显性模型(C/S vs S/S)中, hOGG1 Ser326Cys多态性与食管癌易感性无统计学意义.
腺癌在隐性模型(C/C vs C/S+S/S)中OR值(95%CI)为0.78(0.45-1.34), 在显性模型(C/C+C/S vs S/S)中OR值(95%CI)为0.89(0.70-1.12), 在共显性模型(C/C vs S/S)中OR值(95%CI)为0.78(0.45-1.36), 在共显性模型(C/S vs S/S)中OR值(95%CI)为0.90(0.71-1.16). 结果表明: hOGG1 Ser326Cys多态性与食管癌易感性无统计学意义.
以随机人群为来源的研究, 在隐性模型(C/C vs C/S+S/S)中OR值(95%CI)为1.33(1.11-1.60), 在显性模型(C/C+C/S vs S/S)中OR值(95%CI)为0.98(0.86-1.10), 在共显性模型(C/C vs S/S)中OR值(95%CI)为1.27(1.03-1.56), 在共显性模型(C/S vs S/S)中OR值(95%CI)为0.91(0.80-1.04). 结果表明: 在隐性模型(C/C vs C/S+S/S)和共显性模型(C/C vs S/S)中, hOGG1 Ser326Cys多态性可增加食管癌的易感性, 而在显性模型(C/C+C/S vs S/S)和共显性模型(C/S vs S/S)中, hOGG1 Ser326Cys多态性与食管癌易感性无统计学意义.
以医院人群为来源的研究, 在隐性模型(C/C vs C/S+S/S)中OR值(95%CI)为0.92(0.63-1.35), 在显性模型(C/C+C/S vs S/S)中OR值(95%CI)为1.11(0.88-1.40), 在共显性模型(C/C vs S/S)中OR值(95%CI)为1.12(0.72-1.74), 在共显性模型(C/S vs S/S)中OR值(95%CI)为1.12(0.87-1.42). 结果表明: hOGG1 Ser326Cys多态性与食管癌易感性无统计学意义.
以标本为DNA来源的研究, 在隐性模型(C/C vs C/S+S/S)中OR值(95%CI)为1.74(1.33-2.27), 在显性模型(C/C+C/S vs S/S)中OR值(95%CI)为0.98(0.81-1.20), 在共显性模型(C/C vs S/S)中OR值(95%CI)为1.56(1.16-2.08), 在共显性模型(C/S vs S/S)中OR值(95%CI)为0.83(0.68-1.03). 结果表明: 在隐性模型(C/C vs C/S+S/S)和共显性模型(C/C vs S/S)中, hOGG1 Ser326Cys多态性可增加食管癌的易感性, 而在显性模型(C/C+C/S vs S/S)和共显性模型(C/S vs S/S)中, hOGG1 Ser326Cys多态性与食管癌易感性无统计学意义.
以血液为DNA来源的研究, 在隐性模型(C/C vs C/S+S/S)中OR值(95%CI)为1.00(0.78-1.28), 在显性模型(C/C+C/S vs S/S)中OR值(95%CI)为1.02(0.89-1.17), 在共显性模型(C/C vs S/S)中OR值(95%CI)为1.09(0.82-1.44), 在共显性模型(C/S vs S/S)中OR值(95%CI)为1.02(0.88-1.18). 结果表明: hOGG1 Ser326Cys多态性与食管癌易感性无统计学意义.
各模型剔除不符合HWE的研究后, 各模型合并效应量及异质性均无明显改变, 依次单独剔除其他1篇研究后, 各模型合并效应量仍旧无明显的改变, 因此本研究稳定性较好.
食管癌是世界上最为常见的癌症之一, 遗传易感性对于癌症的发生起到重要的作用. 关于hOGG1基因, 近年来分子流行病和遗传学研究主要集中在其第7外显子的Ser326Cys多态与癌症易感性的关系. 已经有一些研究者报道了hOGG1 Ser326Cys多态性与肺癌[4]、肝癌[19]、结肠癌[20]易感性的相关性, 然而关于Ser326Cys多态性与食管癌易感性是否相关尚存在争议, 为了更好地探讨hOGG1多态性与食管癌易感性之间的关系, 我们进行了Meta分析.
本文纳入14项病例-对照研究包括2693例食管癌患者和4027名对照. 合并结果显示, 在隐性模型(C/C vs C/S+S/S)和共显性模型(C/C vs S/S)中, hOGG1 Ser326Cys多态性可增加食管癌的易感性. 在亚组分析中显示: 在隐性模型(C/C vs C/S+S/S)和共显性模型(C/C vs S/S)中, 亚洲人群、鳞癌患者、以随机人群为来源的研究及以血液为DNA来源的研究, hOGG1 Ser326Cys多态性可增加食管癌的易感性.
总之, hOGG1 Ser326Cys多态性可增加食管癌的易感性. 但是以上结论尚需更多设计严谨、样本量大的高质量研究加以证实.
食管癌病因尚不十分明确. 有学者认为人8-羟基鸟嘌呤糖苷酶(human 8-oxoguanine glycosylase, hOGG1)基因Ser-326Cys多态性可能与肿瘤的易感性有关. 本研究希望可以得到更有力的结果, 探讨hOGG1多态性与食管癌易感性之间的关系, 提供循证医学证据.
刘亮, 副主任医师, 复旦大学胰腺癌研究所, 复旦大学附属肿瘤医院胰腺肝胆外科
目前基因遗传易感性在食管癌发生发展过程中的作用受到了极大的关注. 但是其研究结论仍需更多设计严谨、样本量大的高质量研究加以证实.
有学者认为hOGG1基因Ser-326Cys多态性可能影响机体对DNA损伤的修复能力, 与肿瘤的易感性有关. 已经有一些研究者报道了hOGG1 Ser326Cys多态性与肺癌、肝癌、结肠癌易感性的相关性.
本研究采用Meta分析探讨hOGG1 Ser326Cys多态性与食管癌易感性之间的关系, 通过对2693例食管癌患者和4027名对照的分析、研究, 得出较为可靠的分析结果.
本研究方法合理, 结果分析可靠, 结果具有一定参考意义. 但是其研究结论仍需更多设计严谨、样本量大的高质量研究加以证实.
本研究采用Meta分析探讨hOGG1 Ser326Cys多态性与食管癌易感性之间的关系, 整个文章方法合理, 结果分析可靠, 结果具有一定的参考意义.
编辑: 韦元涛 电编:都珍珍
| 1. | Jemal A, Bray F, Center MM, Ferlay J, Ward E, Forman D. Global cancer statistics. CA Cancer J Clin. 2011;61:69-90. [PubMed] [DOI] |
| 2. | Boonyaphiphat P, Thongsuksai P, Sriplung H, Puttawibul P. Lifestyle habits and genetic susceptibility and the risk of esophageal cancer in the Thai population. Cancer Lett. 2002;186:193-199. [PubMed] [DOI] |
| 3. | Park J, Chen L, Tockman MS, Elahi A, Lazarus P. The human 8-oxoguanine DNA N-glycosylase 1 (hOGG1) DNA repair enzyme and its association with lung cancer risk. Pharmacogenetics. 2004;14:103-109. [PubMed] [DOI] |
| 4. | Sugimura H, Kohno T, Wakai K, Nagura K, Genka K, Igarashi H, Morris BJ, Baba S, Ohno Y, Gao C. hOGG1 Ser326Cys polymorphism and lung cancer susceptibility. Cancer Epidemiol Biomarkers Prev. 1999;8:669-674. [PubMed] |
| 5. | Canbay E, Cakmakoglu B, Zeybek U, Sozen S, Cacina C, Gulluoglu M, Balik E, Bulut T, Yamaner S, Bugra D. Association of APE1 and hOGG1 polymorphisms with colorectal cancer risk in a Turkish population. Curr Med Res Opin. 2011;27:1295-1302. [PubMed] [DOI] |
| 6. | Xing DY, Tan W, Song N, Lin DX. Ser326Cys polymorphism in hOGG1 gene and risk of esophageal cancer in a Chinese population. Int J Cancer. 2001;95:140-143. [PubMed] [DOI] |
| 7. | 高 长明, Sugimura H, Takezaki T, 吴 建中, 李 忠佑, 丁 建华, 刘 燕婷, 李 苏平, 苏 平, 胡 旭. 8-羟基鸟嘌呤糖苷酶基因型、生活习惯与食管癌和胃癌. 中国肿瘤. 2000;10:500-502. |
| 8. | Hao B, Wang H, Zhou K, Li Y, Chen X, Zhou G, Zhu Y, Miao X, Tan W, Wei Q. Identification of genetic variants in base excision repair pathway and their associations with risk of esophageal squamous cell carcinoma. Cancer Res. 2004;64:4378-4384. [PubMed] [DOI] |
| 10. | Hall J, Hashibe M, Boffetta P, Gaborieau V, Moullan N, Chabrier A, Zaridze D, Shangina O, Szeszenia-Dabrowska N, Mates D. The association of sequence variants in DNA repair and cell cycle genes with cancers of the upper aerodigestive tract. Carcinogenesis. 2007;28:665-671. [PubMed] [DOI] |
| 11. | Ferguson HR, Wild CP, Anderson LA, Murphy SJ, Johnston BT, Murray LJ, Watson RG, McGuigan J, Reynolds JV, Hardie LJ. No association between hOGG1, XRCC1, and XPD polymorphisms and risk of reflux esophagitis, Barrett's esophagus, or esophageal adenocarcinoma: results from the factors influencing the Barrett's adenocarcinoma relationship case-control study. Cancer Epidemiol Biomarkers Prev. 2008;17:736-739. [PubMed] [DOI] |
| 12. | Tse D, Zhai R, Zhou W, Heist RS, Asomaning K, Su L, Lynch TJ, Wain JC, Christiani DC, Liu G. Polymorphisms of the NER pathway genes, ERCC1 and XPD are associated with esophageal adenocarcinoma risk. Cancer Causes Control. 2008;19:1077-1083. [PubMed] [DOI] |
| 13. | Akbari MR, Malekzadeh R, Shakeri R, Nasrollahzadeh D, Foumani M, Sun Y, Pourshams A, Sadjadi A, Jafari E, Sotoudeh M. Candidate gene association study of esophageal squamous cell carcinoma in a high-risk region in Iran. Cancer Res. 2009;69:7994-8000. [PubMed] [DOI] |
| 14. | 朱 晓玲, 张 合喜, 杜 海荣, 郝 巧玲, 吴 晓明, 王 友洁. hOGG1 Ser326Cys基因多态性与食管癌及其临床病理特性的关系. 环境与职业医学. 2009;26:25-28. |
| 15. | Lagadu S, Lechevrel M, Sichel F, Breton J, Pottier D, Couderc R, Moussa F, Prevost V. 8-oxo-7,8-dihydro-2'-deoxyguanosine as a biomarker of oxidative damage in oesophageal cancer patients: lack of association with antioxidant vitamins and polymorphism of hOGG1 and GST. J Exp Clin Cancer Res. 2010;29:157. [PubMed] [DOI] |
| 16. | Upadhyay R, Malik MA, Zargar SA, Mittal B. OGG1 Ser326Cys polymorphism and susceptibility to esophageal cancer in low and high at-risk populations of northern India. J Gastrointest Cancer. 2010;41:110-115. [PubMed] [DOI] |
| 18. | Li QD, Li H, Wang MS, Diao TY, Zhou ZY, Fang QX, Yang FY, Li QH. Multi-susceptibility genes associated with the risk of the development stages of esophageal squamous cell cancer in Feicheng County. BMC Gastroenterol. 2011;11:74. [PubMed] [DOI] |
| 20. | Kondo S, Toyokuni S, Tanaka T, Hiai H, Onodera H, Kasai H, Imamura M. Overexpression of the hOGG1 gene and high 8-hydroxy-2'-deoxyguanosine (8-OHdG) lyase activity in human colorectal carcinoma: regulation mechanism of the 8-OHdG level in DNA. Clin Cancer Res. 2000;6:1394-1400. [PubMed] |