修回日期: 2014-09-21
接受日期: 2014-10-29
在线出版日期: 2014-12-18
目的: 探讨缺氧诱导因子1α(hypoxia-inducible factor 1α, HIF-1α)、核因子-κB(nuclear factor kappa B, NF-κB)在非酒精性脂肪肝炎(non-alcoholic fat liver diseases, NAFLD)进展中的作用及其机制.
方法: 选50只♂SD大鼠随机分为正常组、模型组(高脂饮食4、8、12及16 wk组), 每组10只. 通过高脂饲料建立大鼠脂肪肝模型, 取外周血及肝脏组织, 进行血脂、肝功能、空腹血糖及病理组织学检查. Real-time-PCR法检测肝组织中HIF-1α、NF-κB的mRNA水平, 多组计量资料比较采用成组设计的方差分析、Kruskal-Wallis H检验, 两两比较采用LSD法, P<0.05为差异有统计学意义.
结果: 在高脂饮食第12周、16周, 模型组的丙氨酸氨基转移酶(alanine amiotransferase, ALT)、三酰甘油(triglyceride, TG)和胆固醇(cholesterol, CHOL)水平与正常组相比均显著升高(P<0.05), 而高密度脂蛋白胆固醇(high-density lipoprotein cholesterol, HDL-C)的表达则显著下降(P<0.05). HIF-1α和NF-κB表达随着高脂饮食时间的延长, 表达逐渐升高(P<0.05), 与脂肪肝的严重程度呈正比, 且HIF-1α的表达与NF-κB具有相关性(r = 0.67, P<0.05).
结论: HIF-1α/NF-κB信号在大鼠NAFLD的进展中起着一定的促进作用.
核心提示: 本研究发现, 随着脂肪肝的进展, 缺氧诱导因子1α(hypoxia-inducible factor 1α, HIF-1α)和核因子-κB(nuclear factor kappa B, NF-κB)表达逐渐增强, HIF-1α可能通过激活NF-κB可能参与到非酒精性脂肪肝病(nonacoholic fatty liver disease, NAFLD)的发生和发展. 提示HIF-1α/NF-κB通路可能成为NAFLD发生与发展的重要分子生物学机制. 抑制非经典HIF-1α/NF-κB通路可能成为治疗NAFLD的新方向.
引文著录: 陈海姣, 刘鹏飞, 张伟, 郁心圃, 高昳, 沈卫东. HIF-1α、NF-κB在大鼠不同程度非酒精性脂肪肝中的表达. 世界华人消化杂志 2014; 22(35): 5480-5485
Revised: September 21, 2014
Accepted: October 29, 2014
Published online: December 18, 2014
AIM: To investigate the role of hypoxia-inducible factor -1α (HIF-1α) and nuclear transcription factor κB (NF-κB) in the development of non-alcoholic fat liver disease (NAFLD) using a rat model.
METHODS: Fifty SD rats were randomly divided into five groups (a normal group, a 4 wk model group, an 8 wk group, a 12 wk and a 16 wk group). NAFLD was induced in rats by administration of a high fat diet. Serum biochemical parameters were tested, and fiver histological changes were observed. HIF-1α and NF-κB mRNA expression was detected by real-time PCR.
RESULTS: Compared with the normal group, significant elevations of serum alanine amiotransferase (ALT), triglyceride (TG), and cholesterol (CHOL) and reduction of high-density lipoprotein cholesterol (HDL-C) were observed in rats given a high fat diet for 12 wk or 16 wk (P < 0.05). In the model groups, liver steatosis, inflammation grade and degree of fibrosis were significantly aggravated. HIF-1α and NF- κB expression increased gradually with the severity of NAFLD (P < 0.05).
CONCLUSION: HIF-1α/NF-κB signaling may be related to the development of NAFLD.
- Citation: Chen HJ, Liu PF, Zhang W, Yu XP, Gao Y, Shen WD. Expression of HIF-1α and NF-κB in non-alcoholic fat liver disease in rats. Shijie Huaren Xiaohua Zazhi 2014; 22(35): 5480-5485
- URL: https://www.wjgnet.com/1009-3079/full/v22/i35/5480.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i35.5480
非酒精性脂肪肝病(nonacoholic fatty liver disease, NAFLD)是一种无过量饮酒史, 以肝实质细胞脂肪变性和脂肪贮积为特征的临床病理综合征. 随着我国人民生活水平的不断提高和饮食结构的改变, NAFLD的发病率不断上升, 严重危害人们的健康[1,2]. 缺血缺氧在肝细胞的急慢性损伤中的作用日益引起重视, 细胞缺氧也是酒精性肝病的重要特征之一, 但在NAFLD中的研究依然较少, 机制也尚不明确[3-7]. 缺氧诱导因子1α(hypoxia-inducible factor 1α, HIF-1α)是一种受低氧诱导的对氧浓度高度敏感的转录因子, 是组织缺氧的内在标志, 通过诱导糖酵解、红细胞生成和血管生成HIF-1α有助于恢复体内的氧平衡[8-10]. 核因子-κB(nuclear factor kappa B, NF-κB)也是应对缺氧反应的一个关键性转录因子[11,12]. 本研究拟检测HIF-1α、NF-κB在NAFLD进展过程中的表达, 从而进一步探讨非酒精性脂肪肝的进展机制.
野生型大鼠(购自上海斯莱克实验动物有限公司), 高脂饲料配比如下: 基础饲料87.8%、猪油10.0%、胆固醇2.0%、胆盐0.2%, 麻醉剂、酸性甲醛固定液、HE染色液以及TRIzol等RNA提取试剂(购自徐州博立达生物技术有限公司), 逆转录试剂盒和Real-time SYBR Green试剂(购自大连Takara公司), 引物(表1)由上海生工生物工程股份有限公司合成, 采血针和采血管均购自BD公司. 自动生化学分析仪, 7900HT荧光定量PCR仪(ABI公司), 正置荧光显微镜(Leica公司).
| 基因名称 | 引物序列 | 扩增长度(bp) |
| GAPDH | F: 5'-CCTTCATTGACCTCAACTACATG-3' | 215 |
| R: 5'-CTTCTCCATGGTGGTGAAGAC-3' | ||
| NF-κB | F: 5'-GACCTGGAGCAAGCCATTAG-3' | 125 |
| R: 5'-CGCACTGTCACCTGGAAGC-3' | ||
| HIF-1α | F: 5'-CCTACTATGTCGCTTTCTTGGA-3' | 196 |
| R: 5'-TTCTGCTGCCTTGTATGGG-3' |
1.2.1 造模及分组: 野生型大鼠(购自上海斯莱克实验动物有限公司)饲养1 wk后, 进行高脂饮食. 根据我们前期研究, 大约在高脂饮食后4、8、12 wk可分别形成轻度、中度、重度脂肪肝及脂肪性肝炎模型(分别为10只). 正常对照组给予基础饲料, 高脂饮食组饲料配比如下: 基础饲料87.8%、猪油10.0%、胆固醇2.0%、胆盐0.2%, 自然采食. 分别于不同时相以0.1 g/kg体质量氯胺酮麻醉大鼠, 腹主动脉采血, 切取肝脏右叶0.5 cm×0.4 cm×0.5 cm大小组织块浸泡在100 g/L酸性甲醛固定液中, 剩余肝脏储存于液氮中备用. 甲醛固定后进行石蜡切片, HE染色, 检测大鼠肝标本, 判断脂肪肝严重程度, 以及明确脂肪性肝炎及肝纤维化情况.
1.2.2 血清中指标测定: 3000 r/min离心血液10 min, 取上层血清, 通过采用自动生化学分析仪测定丙氨酸氨基转移酶(alanine amiotransferase, ALT)、三酰甘油(triglyceride, TG)、胆固醇(cholesterol, CHOL)、高密度脂蛋白胆固醇(high-density lipoprotein cholesterol, HDL-C)和低密度脂蛋白胆固醇(low-density lipoprotein cholesterol, LDL-C).
1.2.3 Real-time-PCR检测不同脂肪肝组织中HIF-1α、NF-κB mRNA表达: TRIzol法提取组织总RNA, 并逆转录为cDNA, 并配制反应体系, 将反应液加入384-Well Clear Optical Reaction Plate内, 每列16个孔均加入同一基因、不同样品的反应体系. 每个反应均设重复孔; 将加完样的384-Well Clear Optical Reaction Plate置入7900HT荧光定量PCR仪中(引物序列如表1), 按如下的反应条件进行PCR扩增和荧光定量(扩增条件: 95 ℃ 1 min, 95 ℃ 15 s, 60 ℃ 60 s, 40个循环; 60 ℃ 15 s, 最后95 ℃15 s). 荧光定量数据分析采用参照基因的△Ct法计算每个样本目的基因的表达值, 其中△Ct值表示基因反应产物的荧光值达到设定的域值时的反应循环数.
统计学处理 应用SPSS16.0进行统计分析. 计量资料用mean±SD表示, 计数资料用整数表示. 组计量资料比较采用成组设计的方差分析、Kruskal-Wallis H检验, 两两比较采用LSD法, P<0.05为差异有统计学意义.
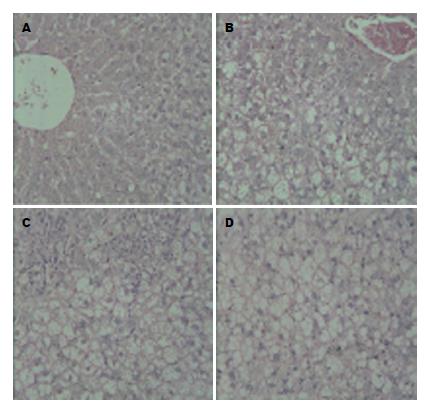
HE染色光镜下显示正常组大鼠肝组织结构完整, 肝细胞形态规则; 经高脂饮食4、8、12 wk可分别形成轻度、中度、重度脂肪肝形成, 16 wk可见明显脂肪性肝炎形成(表2). 肝组织脂肪变程度(F)按低倍镜下视野内脂肪变肝细胞占全部肝细胞的范围分级(F0-3): F0, 无脂肪变; F1(轻度), 33%以下肝细胞脂肪变; F2(中度), 33%-66%肝细胞脂肪变; F3(重度), 66%以上肝细胞脂肪变(图1). 非酒精性脂肪性肝炎(non-alcoholic steatohepatitis, NASH) 的炎症分级和纤维化分期标准参照改良的Brunt标准. NASH炎症程度(G0-3)分级: G0, 无炎症; Gl, 腺泡3带呈现少数气球样肝细胞, 腺泡内散在个别点灶状坏死; G2, 腺泡3带明显气球样肝细胞, 腺泡内点灶状坏死增多, 门管区轻、中度炎症; G3, 腺泡3带广泛气球样肝细胞, 腺泡内点, 灶状坏死明显, 门管区轻、中度炎症伴(或不伴)门管区周围炎症[13].
各组空腹血糖水平与正常对照组差异无统计学意义, 在高脂饮食第12、16周, ALT、TG、CHOL水平较正常组显著升高(P<0.05), 而HDL-C则显著下降(P<0.05)(表3).
| 分组 | 时间 | ALT(U/L) | GLU(mmol/L) | TG(mmol/L) | HDL-C(mmol/L) | CHOL(mmol/L) |
| 对照组 | 73.5±11.25 | 8.50±1.24 | 0.75±0.59 | 2.15±0.29 | 0.39±0.18 | |
| 模型组 | 4 wk | 93.5±10.65 | 8.90±1.35 | 0.94±0.51 | 2.40±1.02 | 0.44±0.19 |
| 8 wk | 92.0±19.06 | 8.59±2.01 | 0.67±0.38 | 2.00±0.68 | 0.48±0.27 | |
| 12 wk | 103.17±18.76a | 9.20±3.35 | 1.11±0.18a | 0.61±0.18a | 2.61±0.87a | |
| 16 wk | 142.13±20.18a | 9.52±1.54 | 1.66±0.32a | 0.56±0.25a | 2.89±0.69a |
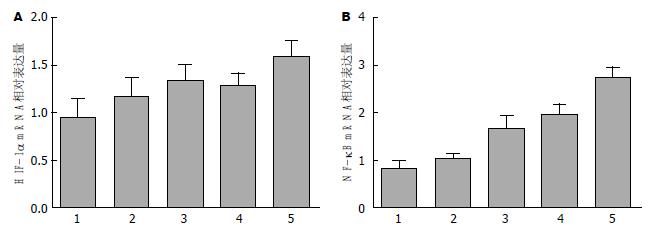
在高脂饮食后, 随着脂肪肝的进展, HIF-1α mRNA表达逐渐增强(图2A). 同时NF-κB的表达随着高脂饮食的时间延长, 脂肪肝的严重程度的加剧, mRNA表达逐渐升高(P<0.05)(图2B).
各组HIF-1α mRNA与NF-κB表达进行Pearson两变量的相关性分析, 结果显示: HIF-1α mRNA表达与NF-κB mRNA具有相关性(r = 0.67, P<0.05).
缺血缺氧在肝细胞的急慢性损伤中的作用日益引起重视, 细胞缺氧也是酒精性肝病的重要特征之一, 但在NAFLD中的研究依然较少, 机制也尚不明确[5,6]. 事实上, 在NAFLD进展过程中, 肝脏对缺血更加敏感. 脂质负荷过重的肝细胞是肿胀的, 尤其在脂肪性肝炎中更为明显. 肿胀性改变会进一步导致肝窦变形及微循环障碍, 血流变慢. 脂肪肝患者的门静脉及肝静脉宽度、血流速度较正常人下降, 在动物模型中, 这样的改变使肝窦的容积下降了近50%[5,7], 从而导致肝细胞处于缺氧状态, 更加容易在氧化应激状态下发生脂质过氧化, 进一步加剧肝细胞的损伤.
缺氧会诱导肝细胞HIF-1α上调, 并进一步调节下游基因参与病理进展, 这在慢性肺病、肿瘤等其他相关疾病研究中已得到大量证实[14]. 但HIF-1α在NAFLD进展过程中究竟扮演着什么角色, 尚不明确.
本研究发现, 随着脂肪肝的进展, HIF-1α表达逐渐增强, 提示HIF-1α可能参与了非酒精性脂肪肝的进展, 但具体机制不清. NF-κB具有促进炎症反应的作用. 已有许多文献证实NF-κB能够促进NAFLD的发生与发展; 且抑制NF-κB能够降低炎症因子的表达, 从而改善NAFLD的进展[15]. 因此, 本研究进一步探讨了NF-κB信号通路在NAFLD中的表达及与HIF-1α表达的关系. 本研究结果表明, NF-κB表达随着高脂饮食的时间延长, 表达逐渐升高(P<0.05). 进一步进行相关分析, 提示HIF-1α表达与NF-κB的表达存在相关性. 但HIF-1α与NF-κB的相互作用关系机制仍需更多的实验研究验证.
总之, HIF-1α通过激活NF-κB可能参与到NAFLD的发生和发展. 提示HIF-1α/NF-κB通路可能成为NAFLD发生与发展的重要分子生物学机制. 抑制非经典HIF-1α/NF-κB通路可能成为治疗NAFLD的新方向.
非酒精性脂肪肝病(nonacoholic fatty liver disease, NAFLD)是一种无过量饮酒史, 以肝实质细胞脂肪变性和脂肪贮积为特征的临床病理综合征. 细胞缺氧是酒精性肝病的重要特征之一, 但在非酒精性脂肪肝病中的研究比较少, 机制也不明确.
迟宝荣, 教授, 吉林大学第一医院消化内科
缺血缺氧在肝细胞的急慢性损伤中的作用日益引起重视, 细胞缺氧也是酒精性肝病的重要特征之一. 而缺氧诱导因子1α(hypoxia-inducible factor-1α, HIF-1α)和核因子-κB(nuclear factor κB, NF-κB)都是应对细胞组织缺氧反应的关键因子. 但是这两个因子与NAFLD的关系尚不明确, 本文就此进行初步的探讨.
缺氧会诱导肝细胞HIF-1α上调, 并进一步调节下游基因参与病理进展, 这在慢性肺病、肿瘤等其他相关疾病研究中已得到大量证实. 但HIF-1α在NAFLD进展过程中究竟扮演着什么角色, 尚不明确. 已有许多文献证实NF-κB能够促进NAFLD的发生与发展; 且抑制NF-κB能够降低炎症因子的表达, 从而改善NAFLD的进展.
细胞缺氧是酒精性肝病的重要特征之一, 已有许多文献证实NF-κB能够促进NAFLD的发生与发展, 但是另一个重要的与缺氧有关关键因子HIF-1α在NAFLD进展过程中究竟扮演着什么角色, 尚不明确, 并且两个因子在NAFLD进展中存在怎样的相互作用也不清楚.
初步实验研究发现HIF-1α通过激活NF-κB可能参与到NAFLD的发生和发展, 这提示HIF-1α/NF-κB通路可能成为NAFLD发生与发展的重要分子生物学机制. 抑制非经典HIF-1α/NF-κB通路可能成为治疗NAFLD的新方向.
缺血缺氧在NAFLD中的作用是比较值得研究的内容. 作者的研究与此相关, 文章内容具有一定的创新性, 但是本文只是对此进行了初步的探讨, 希望作者能继续进行深入研究, 可以更多的揭示其中的关系, 为治疗NAFLD提供新的思路和方法.
编辑: 郭鹏 电编:都珍珍
| 2. | Yan BC, Hart JA. Recent developments in liver pathology. Arch Pathol Lab Med. 2009;133:1078-1086. [PubMed] [DOI] |
| 3. | Moon JO, Welch TP, Gonzalez FJ, Copple BL. Reduced liver fibrosis in hypoxia-inducible factor-1alpha-deficient mice. Am J Physiol Gastrointest Liver Physiol. 2009;296:G582-G592. [PubMed] [DOI] |
| 4. | Farrell GC, Teoh NC, McCuskey RS. Hepatic microcirculation in fatty liver disease. Anat Rec (Hoboken). 2008;291:684-692. [PubMed] [DOI] |
| 5. | Hasegawa T, Ito Y, Wijeweera J, Liu J, Malle E, Farhood A, McCuskey RS, Jaeschke H. Reduced inflammatory response and increased microcirculatory disturbances during hepatic ischemia-reperfusion injury in steatotic livers of ob/ob mice. Am J Physiol Gastrointest Liver Physiol. 2007;292:G1385-G1395. [PubMed] [DOI] |
| 6. | Siegmund SV, Brenner DA. Molecular pathogenesis of alcohol-induced hepatic fibrosis. Alcohol Clin Exp Res. 2005;29:102S-109S. [PubMed] [DOI] |
| 10. | Carmeliet P, Dor Y, Herbert JM, Fukumura D, Brusselmans K, Dewerchin M, Neeman M, Bono F, Abramovitch R, Maxwell P. Role of HIF-1alpha in hypoxia-mediated apoptosis, cell proliferation and tumour angiogenesis. Nature. 1998;394:485-490. [PubMed] [DOI] |
| 11. | Taylor CT, Cummins EP. The role of NF-kappaB in hypoxia-induced gene expression. Ann N Y Acad Sci. 2009;1177:178-184. [PubMed] [DOI] |
| 12. | Culver C, Sundqvist A, Mudie S, Melvin A, Xirodimas D, Rocha S. Mechanism of hypoxia-induced NF-kappaB. Mol Cell Biol. 2010;30:4901-4921. [PubMed] [DOI] |
| 13. | Brunt EM, Janney CG, Di Bisceglie AM, Neuschwander-Tetri BA, Bacon BR. Nonalcoholic steatohepatitis: a proposal for grading and staging the histological lesions. Am J Gastroenterol. 1999;94:2467-2474. [PubMed] [DOI] |
| 14. | Teoh NC, Ito Y, Field J, Bethea NW, Amr D, McCuskey MK, McCuskey RS, Farrell GC, Allison AC. Diannexin, a novel annexin V homodimer, provides prolonged protection against hepatic ischemia-reperfusion injury in mice. Gastroenterology. 2007;133:632-646. [PubMed] [DOI] |