修回日期: 2014-10-21
接受日期: 2014-11-04
在线出版日期: 2014-12-18
目的: 探讨乙型肝炎病毒X(hepatitis B virus X, HBX)基因对肝癌细胞增殖和迁移的影响.
方法: 选取人肝癌细胞系Huh7细胞, 进行培养, 感染重组腺病毒, 建立可稳定表达HBX的Huh7-HBX细胞系(分布构建实验组和对照组), 进行平板克隆形成实验、MTS和结晶紫染色检测细胞增殖情况, 完成细胞迁移实验. 分析HBX基因对肝癌细胞增殖和迁移的影响.
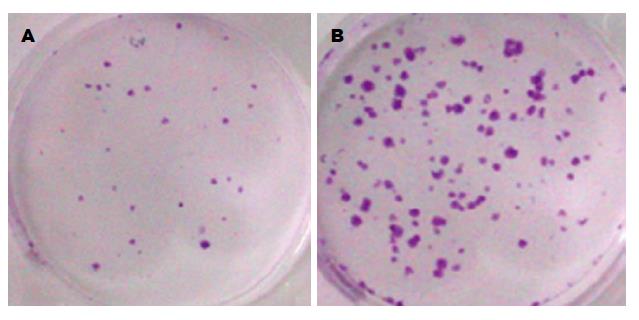
结果: Huh7-HBX的稳定细胞系构建成功. HBX能够促进细胞增殖. 实验组细胞克隆明显高于对照组, 差异具有统计学意义(P<0.05). 回复分泌型卷曲相关蛋白1(secreted frizzled-related protein 1, SFRP1)、SFRP5和干扰掉DNA甲基化转移酶1(DNA methyltransferase1, Dnmt1)后, 能够明显抑制肝癌细胞的增殖. 回复SFRP1、SFRP5和干扰掉Dnmt1后, 能够明显抑制肝癌细胞迁移. Huh7-HBX组、AdSFRP1感染组、AdSFRP5感染组与对照组比较, 差异具有统计学意义(P<0.05).
结论: HBX基因能够抑制肝癌细胞的增殖和迁移, 对于临床治疗有一定的指导意义.
核心提示: 本研究探讨乙型肝炎病毒X(hepatitis B virus X, HBX)基因对肝癌细胞增殖和迁移的影响. 结果显示, HBX基因能够抑制肝癌细胞的增殖和迁移, 对于临床治疗有一定的指导意义.
引文著录: 卫波, 成扬. HBX基因对人肝癌细胞系Huh7细胞增殖和迁移的影响. 世界华人消化杂志 2014; 22(35): 5408-5413
Revised: October 21, 2014
Accepted: November 4, 2014
Published online: December 18, 2014
AIM: To explore the influence of overexpression of hepatitis B virus X (HBX) on the proliferation and migration of hepatoma cells.
METHODS: Human hepatic carcinoma cell line Huh7 was cultured and infected with a recombinant adenovirus vector expressing HBX to establish an Huh7-HBX cell line. Colony forming assay, MTS assay and crystal violet staining were performed to assess cell proliferation. Cell migration assay was also performed.
RESULTS: The Huh7-HBX cell line was established successfully. HBX overexpression could promote cell proliferation. The number of cell colonies formed for Huh7-HBX cells was significantly higher than that for Huh7 cells (P < 0.05). Restoration of secreted frizzled-related protein 1 (SFRP1) and SFRP5 expression or knockdown of DNA methyltransferase 1 (Dnmt1) could significantly inhibit liver cancer cell proliferation and migration (P < 0.05).
CONCLUSION: Overexpression of HBX significantly inhibits the proliferation and migration of hepatoma cells.
- Citation: Wei B, Cheng Y. Influence of overexpression of hepatitis B virus X gene on proliferation and migration of hepatoma cells. Shijie Huaren Xiaohua Zazhi 2014; 22(35): 5408-5413
- URL: https://www.wjgnet.com/1009-3079/full/v22/i35/5408.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i35.5408
肝癌是临床的常见恶性肿瘤之一, 肝癌可分为原发性肝癌和继发性肝癌两大类[1]. 肝脏是人体最大的实质性器官, 承担人体的各类重要代谢功能, 肝脏一旦出现恶性肿瘤将对患者生命造成威胁. 乙型肝炎病毒(hepatitis B virus, HBV)基因具有反式激活作用, 在调控细胞周期、细胞增殖、细胞凋亡以及信号转导等方面, 有一定的作用. 乙型肝炎病毒X(hepatitis B virus X, HBX)是具有多种生物活性的蛋白质. HBX和乙型肝炎病毒感染宿主细胞的过程有关. HBX和肝细胞癌的发生有一定的相关性. 研究HBX基因对肝癌细胞增殖和迁移有着一定的影响. 已有研究[2]表明, HBX蛋白能够下调SFRP1、SFRP5的表达, 病情经染色质免疫共沉淀研究HBX可以诱导DNA甲基化转移酶1(DNA methyltransferase1, Dnmt1)富集于分泌型卷曲相关蛋白1(secreted frizzled-related protein 1, SFRP1)、SFRP5启动子区. 因此, 设计实验, 观察回复SFRP1、SFRP5或者干扰掉Dnmt1后, 是否会抑制肝癌细胞的增殖、迁移能力, 以其更进一步了解HBV X蛋白对SFRP1、SFRP5启动子区调节的机制. 现将上海浦东新区人民医院在该方面的研究报道如下.
人肝癌细胞系Huh7细胞为浦东新区人民医院实验室存放. 培养条件: 37 ℃温度下, 50 mL/L CO2, 10%胎牛血清, 1%青霉素的MEM培养基. 重组腺病毒: AdSFRP1, AdSFRP5, AdsiDnmt1, AdRFP的重组腺病毒(美国芝加哥大学分子肿瘤实验室提供). EK293为浦东新区人民医院保存. 胎牛血清(购自Gibco公司); 脂质体(购自Sigma公司); 抗生素(购自Sigma公司); 磷酸盐缓冲液、胰酶均由本实验室配制而成; 结晶紫染色试剂盒(购自美国GENMED公司); MTS比色检测试剂(购自Promoger公司); Brdu试剂(购自Roche公司). 其他所需仪器包括CO2细胞培养箱、核酸电泳仪、金属恒温仪、凝胶成像仪、倒置荧光显微镜、台式高速离心机、超净台等.
1.2.1 可稳定表达HBX的Huh7-HBX细胞系的建立: 把HEK293细胞铺于T25培养瓶中, 填铺密度为1.5×105/mL. 细胞贴壁完成后, 转染已经构建好的pSEB-3Flag-HBX重组质粒作为试验组, 转染阴性对照pSEB-3Flag空白质粒作为对照组[3]. 把Huh7细胞铺于T25培养瓶中, 填铺密度为1.5×105/mL. 收集转染36、60、84、108 h的HEK293细胞培养上清液, 感染Huh7细胞[4]. 感染60 h后, 加入终浓度为0.1 μg/mL的Blasticidine筛选阳性细胞株.
1.2.2 平板克隆形成实验: 取处于对数期生长的Huh7-HBX细胞、对照组Huh7细胞, 经胰蛋白酶消化, 制备细胞悬浮液, 将其培养于10%胎牛血清的培养基中. 稀释细胞悬液, 接种在37 ℃的预温培养液的6孔板中, 轻轻转动以使细胞分散均匀. 37 ℃、50 mL/L CO2孵育3 wk. 当出现肉眼可见的克隆细胞时, 终止培养[5]. 结晶紫染色、照相.
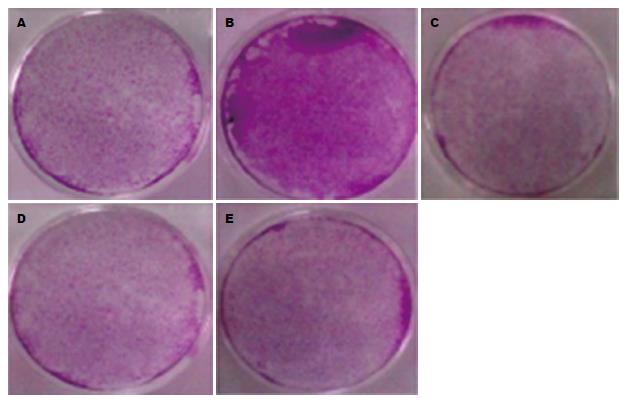
1.2.3 细胞增殖的检测(MTS检测): Huh7-HBX细胞按照3×105/mL的浓度铺于100 mm培养皿中, 感染AdsiDnmt1, AdSFRP1, AdSFRP5腺病毒. 12 h后, 换液, 加入AdRFP腺病毒. 24 h后, 重新铺板, 接种24、48、72、96 h后, 进行MTS检测, 检测波长为490 nm[6], 测定吸光度(A)值.
1.2.4 细胞增殖的检测(结晶紫染色): Huh7-HBX细胞按照3×105/mL的浓度铺于100 mm培养皿中, 感染AdsiDnmt1、AdSFRP1、AdSFRP5腺病毒. 12 h后, 换液, 加入AdRFP腺病毒. 24 h后, 重新铺板, 接种48-72 h, 观察细胞增殖情况. 显微镜观察, 当细胞增殖区别明显时, 弃上清, 加磷酸盐缓冲液2 mL, 清洗细胞, 结晶紫染色20 min, 漂洗, 观察细胞增殖情况[7]. 裂解液裂解30 min, 570 nm检测吸光度(A)值.
1.2.5 Brdu掺入实验: Huh7-HBX细胞、Huh7-Flag细胞按照3×105/mL的浓度分别铺于100 mm培养皿中, 分别感染AdsiDnmt1、AdSFRP1、AdSFRP5腺病毒. 12 h后, 换液, 加入AdRFP腺病毒. 细胞贴壁后, 铺板, 48 h后, 加入10 μL的Brdu, 于37 ℃、50 mL/L CO2条件下培养[8]. 2 h后, 检测370 nm波长吸光度(A)值.
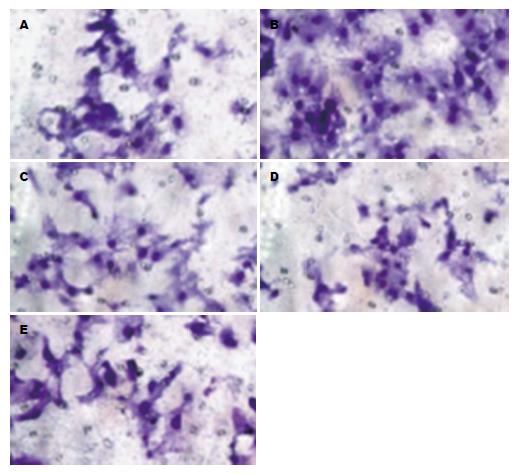
1.2.6 细胞迁移实验: Huh7-HBX细胞按照3×105/mL的浓度铺于100 mm培养皿中, 感染AdsiDnmt1、AdSFRP1、AdSFRP5腺病毒[9]. 12 h后, 换液, 加入AdRFP腺病毒. 37 ℃温热细胞培养基, Tramswell小室放于室温条件下. 消化细胞后, 进行悬浮、计数. CO2孵箱孵育24 h. 染色. 完成染色后1 h, 观察无气泡出现, 继续培养24 h, 去除上下小室培养液. 37 ℃预温PNS, 淋洗小室2次. 加入多聚甲醛, 固定25 min, 弃固定液, PBS淋洗. 倒置小室, 自然风干. 结晶紫浸泡25 min, 去除染液、计数、照相.
统计学处理 采用SPSS19.0统计软件进行统计分析, 计量资料结果用mean±SD表示, 治疗前后及组间比较用t检验, 计数资料以构成比表示, 用χ2检验. P<0.05为差异有统计学意义.
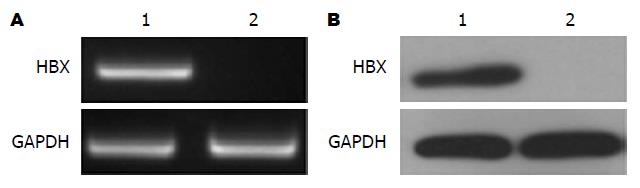
Huh7-HBX的稳定细胞系构建成功. 把HEK293细胞铺于T25培养瓶中, 填铺密度为1.5×105/mL. 细胞贴壁完成后, 转染已经构建好的pSEB-3Flag-HBX重组质粒作为试验组, 转染阴性对照pSEB-3Flag空白质粒作为对照组. 把Huh7细胞铺于T25培养瓶中, 填铺密度为1.5×105/mL. 收集转染36、60、84、108 h的HEK293细胞培养上清液, 感染Huh7细胞. 感染60 h后, 加入终浓度为0.1 μg/mL的Blasticidine筛选阳性细胞株. 结果显示Huh7-HBX的稳定细胞系构建成功(图1).
结果表明, 回复SFRP1、SFRP5和干扰掉Dnmt1后, 能够明显抑制肝癌细胞的增殖(图3).
结果表明, 回复SFRP1、SFRP5和干扰掉Dnmt1后, 能够明显抑制肝癌细胞迁移. 结果如图4所示. 在Huh7细胞里, 对照组平均31.46个/视野±1.88个/视野; Huh7-HBX组平均68.28个/视野±3.78个/视野, AdSiDnmt1感染组平均31.98个/视野±1.57个/视野; AdSFRP1感染组平均28.69个/视野±2.13个/视野; AdSFRP5感染组平均32.48个/视野±2.25个/视野. Huh7-HBX组、AdSFRP1感染组、AdSFRP5感染组与对照组比较, 差异具有统计学意义(P<0.05).
肝脏具有丰富的血流供应, 与人体的重要结构如下腔静脉、门静脉等有密切的联系; 肝癌发病隐匿, 侵袭性生长快速, 治疗难度较高. 早发现、早诊断、早治疗对于提高预后具有重要意义. 原发性肝癌(hepatocellular carcinoma, HCC)是常见肿瘤之一, 其中, HBV感染是引起原发性肝癌的主要危险因素[10-15]. HBX蛋白有反式激活作用, 可以激活病毒和细胞启动子、增强子[16-20]. HBX在进行细胞调节和病毒基因中, 有一定的作用, 如HBV增强子、classⅡ、原癌基因c-jun等[21-25]. 当肿瘤发展到进展期之后, HBX会促进恶性细胞的增殖, 加快肿瘤细胞增长.
HBV可以异常调控原癌基因, 对细胞周期造成影响, 引起肿瘤细胞的周期改变, 产生相关激酶. HBX可以调控细胞凋亡. 在生物体中, 细胞凋亡是一项必须的过程, 在完成细胞凋亡环节中, 需要凋亡起始因子、诱导凋亡蛋白、调节蛋白三种类型的酶[25-28]. 其通过感染肝细胞诱导凋亡后, 可以促进HBV的复制和传播, 进而使得宿主细胞免疫失效. HBX介导凋亡细胞死亡, 其反应机制是他能够和线粒体相互作用, 进而破坏线粒体结构[28-30].
HBX还会影响DNA的修复, 参与DNA修复的多个环节. HBX通过对p53途径的影响, 使得NER受到影响, 进而影响到XPB、XPD的表达[15]. HBX还会促进正常肝细胞LO2的迁移和增殖[16]. HBX是一个多功能蛋白, 在HBV感染等环节中发挥着重要的作用. HBX可以促进肝癌细胞的凋亡, 也能够抑制肝癌细胞的凋亡, 这一系列的环节均和细胞培养环境有关系. 进一步研究其作用机制, 对于更好的预防和治疗肝癌有着重要价值.
本文研究结果显示, HBX基因能够抑制肝癌细胞的增殖和迁移, 对于临床治疗有一定的指导意义.
乙型肝炎病毒(hepatitis B virus, HBV)基因具有反式激活作用, 在调控细胞周期、细胞增殖、细胞凋亡以及信号转导等方面, 有一定的作用. 乙型肝炎病毒X(hepatitis B virus X, HBX)是具有多种生物活性的蛋白质. HBX和乙型肝炎病毒感染宿主细胞的过程有关. HBX和肝细胞癌的发生有一定的相关性. 研究HBX基因对肝癌细胞增殖和迁移有着一定的影响.
高国全, 教授, 中山大学中山医学院生物化学教研室
肝癌发病隐匿, 侵袭性生长快速, 治疗难度较高. 早发现、早诊断、早治疗对于提高预后具有重要意义.
已有研究表明, HBX蛋白能够下调分泌型卷曲相关蛋白1(secreted frizzled-related protein 1, SFRP1)、SFRP5的表达, 病情经染色质免疫共沉淀研究HBX可以诱导Dnmt1富集于SFRP1、SFRP5启动子区.
本研究设计合理, 结果合理, 研究有一定的参考价值.
编辑: 郭鹏 电编:都珍珍
| 1. | Xie Q, Chen L, Shan X, Shan X, Tang J, Zhou F, Chen Q, Quan H, Nie D, Zhang W. Epigenetic silencing of SFRP1 and SFRP5 by hepatitis B virus X protein enhances hepatoma cell tumorigenicity through Wnt signaling pathway. Int J Cancer. 2014;135:635-646. [PubMed] [DOI] |
| 3. | Wei L, Shen Z, Zhao X, Wu Y, Liu W, Zhang J, Xie Y, Liu J. A broadly reactive monoclonal antibody detects multiple genotypes of hepatitis B virus X protein. Arch Virol. 2014;159:2731-2735. [PubMed] |
| 4. | Sun Q, Wang R, Luo J, Wang P, Xiong S, Liu M, Cheng B. Notch1 promotes hepatitis B virus X protein-induced hepatocarcinogenesis via Wnt/β-catenin pathway. Int J Oncol. 2014;45:1638-1648. [PubMed] [DOI] |
| 5. | Mosca N, Castiello F, Coppola N, Trotta MC, Sagnelli C, Pisaturo M, Sagnelli E, Russo A, Potenza N. Functional interplay between hepatitis B virus X protein and human miR-125a in HBV infection. Biochem Biophys Res Commun. 2014;449:141-145. [PubMed] [DOI] |
| 6. | Lou X, Hou Y, Liang D. Effects of hepatitis B virus X protein on human T cell cytokines. Can J Microbiol. 2013;59:620-626. [PubMed] [DOI] |
| 8. | Liu F, You X, Chi X, Wang T, Ye L, Niu J, Zhang X. Hepatitis B virus X protein mutant HBxΔ127 promotes proliferation of hepatoma cells through up-regulating miR-215 targeting PTPRT. Biochem Biophys Res Commun. 2014;444:128-134. [PubMed] [DOI] |
| 9. | Kusunoki H, Tanaka T, Kohno T, Wakamatsu K, Hamaguchi I. Structural characterization of the BH3-like motif of hepatitis B virus X protein. Biochem Biophys Res Commun. 2014;450:741-745. [PubMed] [DOI] |
| 13. | 徐 付卿, 山 长亮, 叶 丽虹, 张 晓东. COX-2在乙肝病毒X蛋白(HBX)促进肝癌细胞和肝细胞增殖中的作用. 中国生物化学与分子生物学报. 2008;24:968-973. |
| 14. | Zhang W, Lu Z, Kong G, Gao Y, Wang T, Wang Q, Cai N, Wang H, Liu F, Ye L. Hepatitis B virus X protein accelerates hepatocarcinogenesis with partner survivin through modulating miR-520b and HBXIP. Mol Cancer. 2014;13:128. [PubMed] [DOI] |
| 15. | Li CH, Xu F, Chow S, Feng L, Yin D, Ng TB, Chen Y. Hepatitis B virus X protein promotes hepatocellular carcinoma transformation through interleukin-6 activation of microRNA-21 expression. Eur J Cancer. 2014;50:2560-2569. [PubMed] [DOI] |
| 16. | Slagle BL, Andrisani OM, Bouchard MJ, Lee CG, Ou JH, Siddiqui A. Technical standards for hepatitis B virus X protein (HBx) research. Hepatology. 2014; Aug 7. [Epub ahead of print]. [PubMed] [DOI] |
| 21. | 戴 悦, 宁 涛, 李 坤, 綦 素霞, 蒋 明伟, 柴 庆波, 盖 郁慧, 汪 欣. LMP2/LMP7基因多态性与人群中乙型肝炎病毒感染相关性研究. 北京大学学报医学版. 2005;37:508-512. |
| 22. | 李 坤, 戴 悦, 阴 秀丽, 綦 素霞, 宁 涛, 曹 邦伟, 徐 昌青. 中国华北地区人群TAP1基因多态性与乙肝关联性的研究. 胃肠病学和肝病学杂志. 2005;14:66-70. |
| 24. | 庄林, 游晶, 陈红英, 俞岚, 孔蕾, 唐宝璋, 黄俊华, 袁绍明, Hutcha Sriplung, Virasakdi Chongsuvivatwong, Alan Geater, 袁丽芳, 王辉. 云南地区乙型肝炎病毒基因型分布与临床的相关性. 世界华人消化杂志. 2007;15:2120-2127. [DOI] |
| 25. | 肖 扬, 周 岳进, 王 开鉴, 张 文静, 胡 操寒, 谢 庆荣, 朱 冰星, 郑 金莉. 浙江温州地区1020例乙型肝炎患者HBV基因分型研究. 中西医结合肝病杂志. 2005;15:41-42. |