修回日期: 2014-10-27
接受日期: 2014-11-12
在线出版日期: 2014-12-18
目的: 探讨幽门螺杆菌(Helicobacter pylori, H. pylori)感染过程中活性氧(reactive oxygen species, ROS)的变化与DNA损伤之间的关系.
方法: 将H. pylori ACTC43504(CagA+, VacA+)感染正常胃黏膜系GES-1细胞, 分别通过活细胞工作站观察细胞内ROS变化和多功能酶标仪定量检测细胞内ROS含量. 采用凯基彗星实验法(单细胞凝胶电泳)检测DNA损伤.
结果: ROS的水平和H. pylori的作用浓度呈正比, 至MOI 300:1时ROS荧光最强. 不同浓度的N-乙酰半胱氨酸(N-acety-L-cysteine, NAC)均可抑制H. pylori感染所引起的ROS的生成. H. pylori可导致DNA损伤, NAC预处理后, GES-1细胞的尾长、彗星长、尾矩及Olive尾矩数值均较H. pylori组有明显下降趋势.
结论: H. pylori作用GES-1细胞后, 可使ROS生成增多, 损伤DNA. 抑制ROS的生成可减轻H. pylori感染导致的DNA损伤.
核心提示: 活性氧(reactive oxygen species, ROS)既可作为细胞信号转导的第二信使, 也可发挥氧化应激损伤作用, 而这与ROS的浓度密切相关. 研究幽门螺杆菌(Helicobacter pylori)感染过程中ROS的水平与DNA损伤之间的关系, 对于胃癌发病机制的研究可能提供一定的理论依据.
引文著录: 易健, 舒徐, 吕静, 张亮, 黄美芳, 吕农华. ROS在幽门螺杆菌对胃上皮细胞DNA损伤中的作用. 世界华人消化杂志 2014; 22(35): 5393-5399
Revised: October 27, 2014
Accepted: November 12, 2014
Published online: December 18, 2014
AIM: To explore the relationship between the change of reactive oxygen species (ROS) and DNA damage caused by Helicobacter pylori (H. pylori) infection in gastric epithelial cells.
METHODS: H. pylori ACTC43504 (CagA+, VacA+) infected GES-1 cells were used in this study. Live cell imaging system was used to observe the change of intracellular ROS, and a microplate reader was used to detect intracellular ROS level. Single cell gel electrophoresis comet assay was used to detect DNA damage.
RESULTS: ROS level was proportional to H. pylori concentration, and the ROS level was the highest when the MOI of H. pylori was 300:1. Various concentrations of N-acety-L-cysteine (NAC) could significantly inhibit the generation of ROS caused by H. pylori infection. H. pylori could cause DNA damage. After NAC pretreatment, the values of tail length, comet length, tail moment, and Olive tail moment had a clear downward trend compared with the H. pylori group.
CONCLUSION: H. pylori infection in GES-1 cells increases intracellular ROS level and results in DNA damage. Inhibition of the generation of ROS could reduce DNA damage.
- Citation: Yi J, Shu X, Lv J, Zhang L, Huang MF, Lv NH. Role of ROS in DNA damage caused by Helicobacter pylori in gastric epithelial cells. Shijie Huaren Xiaohua Zazhi 2014; 22(35): 5393-5399
- URL: https://www.wjgnet.com/1009-3079/full/v22/i35/5393.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i35.5393
Marshall等[1]在1984年发现了定植在胃黏膜的幽门螺旋杆菌(Helicobacter pylori, H. pylori). H. pylori是一种革兰氏阴性、微需氧菌, 其感染约占全球人口的一半[2,3], 与多种消化系疾病相关[4-6], 是感染相关性肿瘤最常见的病原菌[7], 根除H. pylori将有助于减少发生胃恶性肿瘤的风险[8,9]. 而H. pylori的致病多样性与它对胃上皮细胞凋亡和增殖的影响密切相关. 活性氧(reactive oxygen species, ROS)是生物体内需氧细胞在代谢过程中产生的一系列衍生物, 参与和影响细胞信号转导等一系列生物学作用. 有研究[10,11]表明, H. pylori感染后可导致细胞内ROS升高, 且ROS的变化与H. pylori的感染量和感染时间呈正相关性. 过高的ROS发挥氧化应激损伤作用, 可破坏细胞脂质并引起DNA链断裂, 而生理剂量时则可作为第二信使发挥细胞信号因子作用[12]. 因此保持机体ROS生成与清除的平衡状态, 对于细胞的命运有着重要的影响.
然而体外研究大多选用的是胃癌细胞, 胃癌细胞本身在凋亡、增殖信号传导等方面可能已存在异常. 因此本研究选用的细胞是正常胃黏膜细胞系GES-1, 以期更好的研究H. pylori感染过程中ROS的水平与DNA损伤之间的关系, 以进一步探讨H. pylori的可能致病机制, 为H. pylori感染相关性疾病防治策略的制定提供理论和依据.
人胃黏膜上皮细胞GES-1与H. pylori ACTC43504(CagA+, VacA+)标准菌株均由南昌大学第一附属医院消化研究所提供. 细胞培养基DMEM、胎牛血清(Hyclone公司), 无菌脱脂羊血(泰康生物), 空肠弯曲菌琼脂基础(上海市疾病预防控制中心), 活性氧检测试剂盒(碧云天), 凯基彗星法DNA损伤检测试剂盒(凯基生物).
1.2.1 细胞与H. pylori培养: 将人胃黏膜上皮细胞GES-1加入含10%胎牛血清与1%的青链霉素的HyClone高糖DMEM培养基, 在H. pylori感染GES-1细胞前, 细胞培养基换用无抗生素的含10%胎牛血清的高糖DMEM进行培养, 细胞培养均放置在37 ℃、5%CO2的恒温孵箱中培养; H. pylori接种于空肠弯曲杆菌培养基中, 其中含10%的无菌脱脂养血, 培养在37 ℃、85%N2、10%CO2、5%O2的孵箱中培养3 d.
1.2.2 H. pylori活菌悬液的制备: 取出已经培养3 d的H. pylori, 用一次性塑料刮菌环将H. pylori刮取至预先准备好的含DMEM培养基1.5 mL的无菌EP管中, 4 ℃ 12000 g离心10 min. 离心后弃上清, 高糖DMEM重悬, 重悬后取少量菌液稀释成3个细菌浓度, 分别在分光光度计660 nm处测量细菌A值, 测量3次取其平均A值, 1 A = 108 cfu/mL.
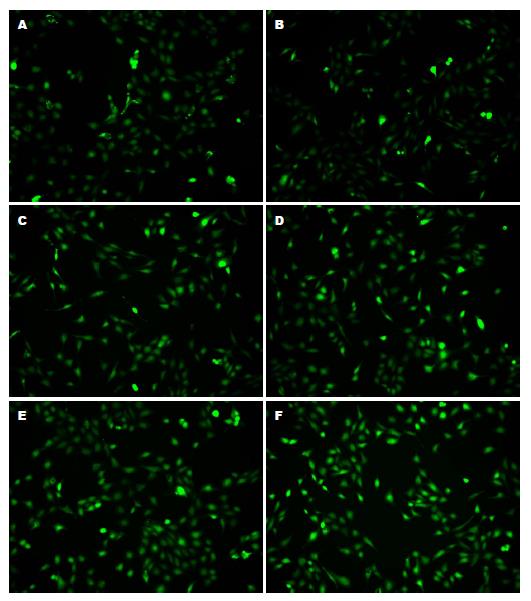
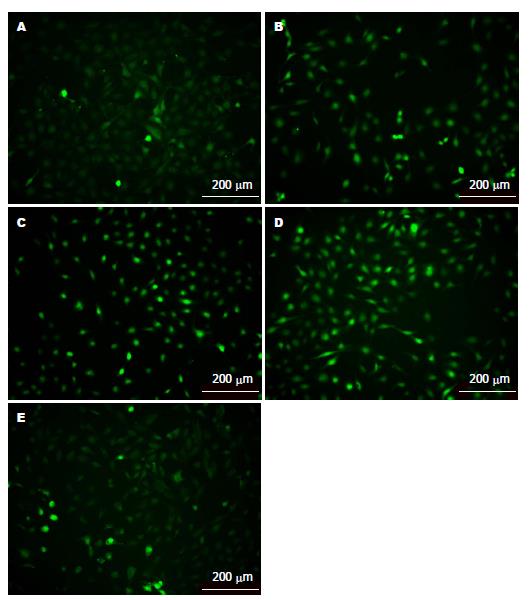
1.2.3 活细胞工作站及多功能酶标仪检测GES-1细胞内ROS变化: 将对数生长期的GES-1细胞分成两组, 一组在培养基中加入不同浓度的H. pylori活菌(MOI 25:1、50:1、100:1、200:1、300:1), 继续培养6 h; 另一组培养基中加入不同浓度的N-乙酰半胱氨酸(N-acety-L-cysteine, NAC)(5、10 mmol/L)预处理GES-1细胞1 h, H. pylori再以不同浓度(MOI 25:1、50:1、100:1、200:1、300:1)感染GES-1细胞, 继续培养6 h; 同时设计空白对照组(GES-1细胞)和阳性对照组(GES-1+Rosup); 按照碧云天活性氧检测试剂盒方法处理细胞并装载荧光探针, 使用多功能酶标仪(488 nm激发波长, 525 nm发射波长)对GES-1细胞内的ROS荧光强度进行定量; 或使用活细胞工作站的FITC绿色荧光通道观察GES-1细胞内ROS的荧光变化并拍照.
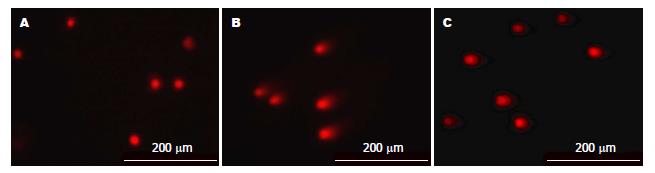
1.2.4 单细胞凝胶电泳检测GES-1的DNA损伤: 将对数生长期的GES-1细胞, 制备成单细胞悬液, 进行6孔板铺板, 设计空白对照组、H. pylori组及NAC组, 每孔细胞数4×105个; 待贴壁后于NAC组加入NAC(10 mmol)预处理1 h, 然后分别在H. pylori组和NAC组按MOI 300:1感染GES-1, H. pylori感染6 h后弃去培养基, 用冰冷的PBS洗1次, 胰酶消化, 离心收集后用PBS重悬GES-1细胞密度为1×106个/mL; 按照凯基彗星实验试剂盒方法依次进行三层凝胶的制备、细胞裂解、DNA解螺旋、单细胞电泳、中和与染色, 最后置于活细胞工作站荧光显微镜中拍照, 通过CASP软件分析DNA损伤程度.
1.2.5 图像处理及分析方法: 采用Casp软件测量GES-1细胞内DNA损伤, 随机选择20个细胞测量GES-1细胞的尾长、彗星长、尾矩、Olive尾矩.
统计学处理 用SPSS17.0统计软件分析. 计量资料以mean±SD的形式表示, 多组间比较采用单因素方差分析, 进行方差齐性检验, P<0.05表示差异有统计学意义.
从图1可以看出在6 h时间点, ROS的荧光强度随H. pylori的作用浓度增加而增强, 至MOI 300:1时ROS荧光最强. 图2结果表明, H. pylori在300:1感染GES-1 6 h, 阳性对照组与单纯H. pylori组均比空白组ROS荧光强; NAC预处理过的GES-1细胞表现出比H. pylori组更低的ROS水平, 并且随着NAC作用浓度的增加, ROS的荧光强度逐渐减弱. 从表1可以看出, H. pylori组6 h内荧光值变化表现为ROS的水平随H. pylori的浓度的增加逐渐增加, 且100:1(P<0.05), 200:1、300:1浓度的ROS水平与空白组相比差异均具有统计学意义(P<0.01), 空白对照组与5、10 mmol/L NAC组差异均有显著统计学意义(P<0.01, 其中5 mmol/L 300:1时P<0.05).
从图3可以看出H. pylori组拖尾长度较空白对照组更长; NAC预处理后, 其彗星拖尾长度较H. pylori有明显缩短, 但仍较空白对照组长; 从表2可以看出H. pylori组的尾长、彗星长、尾矩、Olive尾矩均较对照组增加, 差异具有显著统计学意义(P<0.01); NAC预处理后, 尾长、彗星长、尾矩、Olive尾矩与H. pylori组相比呈减少趋势, 差异有显著统计学意义(P<0.01).
ROS由需氧细胞在代谢过程中产生, 在细胞凋亡和增殖的调控中发挥至关重要作用. H. pylori感染胃上皮细胞后可诱导氧化应激和程序性细胞死亡[13]. 有研究[13-15]表明H. pylori可通过激活巨噬细胞, 进而使精胺氧化酶(spermine oxidase, SMO)上调, SMO可促进H2O2的生成, 导致线粒体膜去极化, 细胞色素C从线粒体释放到细胞质, 致Caspase3活化, 从而引起巨噬细胞凋亡, 导致黏膜免疫的失衡, 增加慢性炎症和癌症风险. H. pylori感染可诱导胃黏膜的急慢性炎症, 伴随着中性粒细胞和巨噬细胞的浸润, 成为包括H2O2在内的ROS的潜在产生来源[16]. 这些炎症细胞可通过利用细胞因子如肿瘤坏死因子α(tumor necrosis factor-α, TNF-α)、γ-干扰素(interferon-γ, IFN-γ)、白介素-1β(interleukin-1β, IL-1β), 刺激上皮细胞ROS的堆积, 引起氧化性损害. 在肿瘤细胞和炎性细胞中发现氧化损伤可导致p53突变, 表明慢性炎症可导致基因组改变[17]. H. pylori的提取液可促进AGS细胞内ROS水平升高, 且与H. pylori感染浓度及时间呈正比[18]. H. pylori提取液可直接诱导ROS的合成, 并可减少细胞内还原型谷胱甘肽(reduced glutathione, GSH)的水平, 导致DNA损伤[19]. 也有研究[20]表明H. pylori菌体本身即可产生ROS. 细胞内含有一系列抗氧化系统以尽量维持体内ROS平衡状态, 宿主依靠细胞和组织适应或者抵抗氧化应激以及修复或清除受损的分子和细胞得以存活, 但ROS的生成往往超过细胞的抗氧化能力, 导致机体处于氧化应激状态. ROS是细胞功能的重要调节器, 高浓度的ROS可损伤细胞脂质、DNA和蛋白质, 破坏正常细胞功能, 进而促进细胞凋亡或坏死, 而低水平ROS对细胞有促增殖作用[21]. NAC本身具有抗氧化活性, 同时可增加谷胱甘肽的抗氧化能力, 其还原型巯基可通过调控氧化应激基因的表达, 从而发挥抑制氧化应激的作用[22]. 本研究将处理过的GES-1细胞装载DCFH-DA荧光探针后, 使用活细胞工作站观察ROS荧光亮度的变化, 得到一个形象直观的结果, 但由于荧光显微镜下曝光时间的不同, 可能出现荧光值的变化, 因此本实验同时在多功能荧光酶标仪下对ROS进行定量检测, 而且本研究采用的是96孔黑色底透微孔板, 可以很好的防止各孔之间荧光的干扰, 更为客观、真实. 通过结合上述两种方法, 发现H. pylori感染GES-1细胞后, ROS的含量与H. pylori的作用浓度呈正比, NAC能够明显的抑制H. pylori作用后的ROS水平. 有文献报道称二氢二氯荧光素(2',7'-dichlorofluorescin, DCFH2)在细胞内可被羟自由基、过氧化氢、过氧亚硝基等氧化成有荧光的氧化型二氯荧光素(dichlorofluorecin, DCF), 但是超氧阴离子并不能使DCFH2转变成有荧光的DCF[23,24]. 超氧阴离子主要在线粒体产生[25], 因而进一步检测超氧阴离子可能更好的反应线粒体水平的ROS变化情况.
慢性H. pylori感染一方面可通过其毒力因子使上皮细胞发生致瘤性转化, 同时慢性H. pylori感染可引起过度的免疫反应, 导致慢性炎症. 由炎症所激发的ROS、细胞因子及趋化因子将导致DNA损伤突变、遗传性状改变及基因组不稳定, 可促进胃上皮细胞的癌变几率[26]. 有研究[27]表明致癌物质二乙基亚硝胺(diethylnitrosamine, DEN)诱导的DNA损伤可促进坏死性细胞死亡, 导致炎症反应, 进而促进肿瘤的发展. 也有研究[28]表明ROS的产生可引起DNA链断裂, DNA损伤可激活p53信号途径, 从而导致线粒体功能障碍, 并引发凋亡因子释放入胞质, 激Caspase并最终引起细胞凋亡. H. pylori感染可促进肿瘤细胞AGS的ROS生成, 造成细胞氧化性DNA损伤与细胞凋亡, 抗氧化剂可通过减少ROS, 进而减轻DNA损伤, 防止细胞凋亡[29]. NAC是经典的抗氧化剂, H. pylori感染可诱导Caspase活化和DNA断裂, 抗氧化剂NAC处理细胞后可抑制H. pylori感染后所诱导的细胞凋亡[13]. Dulger等[30]研究认为根除H. pylori后可显著减少外周血淋巴细胞DNA损伤和氧化应激, 有助于降低发展成胃癌的风险. 因而ROS的含量变化在H. pylori感染所诱导的DNA损伤中起到重要的作用. 本实验采用CASP软件分析彗星的尾长、彗星长、尾矩、Olive尾矩作为DNA损伤的参考指标. 通过H. pylori以MOI 300:1感染正常胃黏膜细胞系GES-1细胞6 h的DNA损伤结果发现, H. pylori组的尾长、彗星长、尾矩、Olive尾矩较未感染H. pylori组有明显的增加, 表明H. pylori可引起胃上皮细胞的DNA损伤. 我们又通过抗氧化剂NAC预处理GES-1细胞, 发现NAC组的各DNA损伤指标数值较H. pylori组的有明显降低, 表明NAC可明显减轻DNA损伤. 根据前期ROS检测结果, 表明NAC通过减少H. pylori升高的ROS, 从而减轻氧化性DNA损伤.
总之, 本研究通过H. pylori感染GES-1表明, H. pylori感染可导致胃上皮细胞内ROS含量升高, 进而导致氧化性DNA损伤, 而抗氧化剂能减轻这种DNA损伤.
幽门螺杆菌(Helicobacter pylori, H. pylori)与慢性胃炎和胃癌的发生密切相关, 而H. pylori导致炎症和肿瘤发生的机制尚不十分清楚.
高英堂, 研究员, 天津市第三中心医院
生理剂量的活性氧(reactive oxygen species, ROS)参与和影响细胞信号转导, 但过高的ROS可破坏细胞脂质并引起DNA链断裂, 本研究旨在探讨H. pylori是否通过诱导ROS的生成增加而致DNA损伤.
H. pylori可引起ROS的变化, 也可导致DNA损伤, 但在H. pylori致病作用中, 有关ROS浓度和DNA损伤的关系报道不多.
本研究通过使用正常胃黏膜细胞系GES-1, 采用活细胞工作站和多功能荧光酶标仪对细胞内ROS进行定量和定性分析, N-乙酰半胱氨酸(N-acety-L-cysteine, NAC)作用后使用活细胞工作站直接观察DNA损伤的彗星图像, 更形象、直接的说明了H. pylori作用后ROS与DNA损伤之间的关系.
本研究证实NAC作用于H. pylori感染的GES-1细胞后, 通过减少ROS的水平, 减轻DNA损伤, 这对临床应用抗氧化剂用于胃癌的防治提供了一定的实验依据.
ROS: 是生物体内需氧细胞在代谢过程中产生的一系列衍生物, 参与和影响细胞信号转导等一系列生物学作用.
本文利用正常胃黏膜系GES-1细胞分析H. pylori感染过程中ROS的增加与DNA损伤之间的关系, 具有一定的研究价值.
编辑: 韦元涛 电编:都珍珍
| 1. | Marshall BJ, Warren JR. Unidentified curved bacilli in the stomach of patients with gastritis and peptic ulceration. Lancet. 1984;1:1311-1315. [PubMed] |
| 2. | Fox JG, Wang TC. Inflammation, atrophy, and gastric cancer. J Clin Invest. 2007;117:60-69. [PubMed] [DOI] |
| 3. | Shi R, Xu S, Zhang H, Ding Y, Sun G, Huang X, Chen X, Li X, Yan Z, Zhang G. Prevalence and risk factors for Helicobacter pylori infection in Chinese populations. Helicobacter. 2008;13:157-165. [PubMed] [DOI] |
| 4. | Makola D, Peura DA, Crowe SE. Helicobacter pylori infection and related gastrointestinal diseases. J Clin Gastroenterol. 2007;41:548-558. [PubMed] [DOI] |
| 5. | Ernst PB, Peura DA, Crowe SE. The translation of Helicobacter pylori basic research to patient care. Gastroenterology. 2006;130:188-206; quiz 212-213. [PubMed] [DOI] |
| 6. | 刘 红丹, 仝 甲钊, 曲 波, 金 世柱, 王 蓓蓓, 祝 芳, 连 丽莹, 白 冰. 幽门螺杆菌与功能性消化不良的相关性. 世界华人消化杂志. 2014;22:1897-1901. [DOI] |
| 7. | Papini E, Satin B, Norais N, de Bernard M, Telford JL, Rappuoli R, Montecucco C. Selective increase of the permeability of polarized epithelial cell monolayers by Helicobacter pylori vacuolating toxin. J Clin Invest. 1998;102:813-820. [PubMed] [DOI] |
| 8. | Zhou L, Lin S, Ding S, Huang X, Jin Z, Cui R, Meng L, Li Y, Zhang L, Guo C. Relationship of Helicobacter pylori eradication with gastric cancer and gastric mucosal histological changes: a 10-year follow-up study. Chin Med J (Engl). 2014;127:1454-1458. [PubMed] |
| 9. | Wong BC, Lam SK, Wong WM, Chen JS, Zheng TT, Feng RE, Lai KC, Hu WH, Yuen ST, Leung SY. Helicobacter pylori eradication to prevent gastric cancer in a high-risk region of China: a randomized controlled trial. JAMA. 2004;291:187-194. [PubMed] [DOI] |
| 10. | Calvino-Fernández M, Benito-Martínez S, Parra-Cid T. Oxidative stress by Helicobacter pylori causes apoptosis through mitochondrial pathway in gastric epithelial cells. Apoptosis. 2008;13:1267-1280. [PubMed] [DOI] |
| 11. | 黄 学文, 罗 瑞华, 赵 琪, 黄 丽丽, 安 仙园, 赵 兰静, 王 玠, 黄 玉政. 幽门螺杆菌提取液诱导AGS细胞内活性氧类物质水平的变化. 中华消化杂志. 2010;30:37-41. |
| 12. | Forman HJ, Maiorino M, Ursini F. Signaling functions of reactive oxygen species. Biochemistry. 2010;49:835-842. [PubMed] [DOI] |
| 13. | Ding SZ, Minohara Y, Fan XJ, Wang J, Reyes VE, Patel J, Dirden-Kramer B, Boldogh I, Ernst PB, Crowe SE. Helicobacter pylori infection induces oxidative stress and programmed cell death in human gastric epithelial cells. Infect Immun. 2007;75:4030-4039. [PubMed] [DOI] |
| 14. | Cheng Y, Chaturvedi R, Asim M, Bussière FI, Scholz A, Xu H, Casero RA, Wilson KT. Helicobacter pylori-induced macrophage apoptosis requires activation of ornithine decarboxylase by c-Myc. J Biol Chem. 2005;280:22492-22496. [PubMed] [DOI] |
| 15. | Gobert AP, Cheng Y, Wang JY, Boucher JL, Iyer RK, Cederbaum SD, Casero RA, Newton JC, Wilson KT. Helicobacter pylori induces macrophage apoptosis by activation of arginase II. J Immunol. 2002;168:4692-4700. [PubMed] [DOI] |
| 16. | Thelen M, Dewald B, Baggiolini M. Neutrophil signal transduction and activation of the respiratory burst. Physiol Rev. 1993;73:797-821. [PubMed] |
| 17. | Kortylewski M, Xin H, Kujawski M, Lee H, Liu Y, Harris T, Drake C, Pardoll D, Yu H. Regulation of the IL-23 and IL-12 balance by Stat3 signaling in the tumor microenvironment. Cancer Cell. 2009;15:114-123. [PubMed] [DOI] |
| 18. | Huang XW, Luo RH, Zhao Q, Shen ZZ, Huang LL, An XY, Zhao LJ, Wang J, Huang YZ. Helicobacter pylori induces mitochondrial DNA mutation and reactive oxygen species level in AGS cells. Int J Med Sci. 2011;8:56-67. [PubMed] [DOI] |
| 19. | Obst B, Wagner S, Sewing KF, Beil W. Helicobacter pylori causes DNA damage in gastric epithelial cells. Carcinogenesis. 2000;21:1111-1115. [PubMed] [DOI] |
| 20. | Nagata K, Yu H, Nishikawa M, Kashiba M, Nakamura A, Sato EF, Tamura T, Inoue M. Helicobacter pylori generates superoxide radicals and modulates nitric oxide metabolism. J Biol Chem. 1998;273:14071-14073. [PubMed] [DOI] |
| 21. | Martindale JL, Holbrook NJ. Cellular response to oxidative stress: signaling for suicide and survival. J Cell Physiol. 2002;192:1-15. [PubMed] [DOI] |
| 22. | Pagliaro P, Mancardi D, Rastaldo R, Penna C, Gattullo D, Miranda KM, Feelisch M, Wink DA, Kass DA, Paolocci N. Nitroxyl affords thiol-sensitive myocardial protective effects akin to early preconditioning. Free Radic Biol Med. 2003;34:33-43. [PubMed] [DOI] |
| 23. | Zhu H, Bannenberg GL, Moldéus P, Shertzer HG. Oxidation pathways for the intracellular probe 2',7'-dichlorofluorescein. Arch Toxicol. 1994;68:582-587. [PubMed] [DOI] |
| 24. | Kooy NW, Royall JA, Ischiropoulos H. Oxidation of 2',7'-dichlorofluorescin by peroxynitrite. Free Radic Res. 1997;27:245-254. [PubMed] [DOI] |
| 25. | Kudin AP, Bimpong-Buta NY, Vielhaber S, Elger CE, Kunz WS. Characterization of superoxide-producing sites in isolated brain mitochondria. J Biol Chem. 2004;279:4127-4135. [PubMed] [DOI] |
| 26. | Grivennikov SI, Greten FR, Karin M. Immunity, inflammation, and cancer. Cell. 2010;140:883-899. [PubMed] [DOI] |
| 27. | Sakurai T, He G, Matsuzawa A, Yu GY, Maeda S, Hardiman G, Karin M. Hepatocyte necrosis induced by oxidative stress and IL-1 alpha release mediate carcinogen-induced compensatory proliferation and liver tumorigenesis. Cancer Cell. 2008;14:156-165. [PubMed] [DOI] |
| 28. | Su J, Lai H, Chen J, Li L, Wong YS, Chen T, Li X. Natural borneol, a monoterpenoid compound, potentiates selenocystine-induced apoptosis in human hepatocellular carcinoma cells by enhancement of cellular uptake and activation of ROS-mediated DNA damage. PLoS One. 2013;8:e63502. [PubMed] [DOI] |
| 29. | Jang SH, Lim JW, Morio T, Kim H. Lycopene inhibits Helicobacter pylori-induced ATM/ATR-dependent DNA damage response in gastric epithelial AGS cells. Free Radic Biol Med. 2012;52:607-615. [PubMed] [DOI] |
| 30. | Dulger AC, Aslan M, Nazligul Y, Horoz M, Bolukbas C, Bolukbas FF, Celik H, Kocyigit A. Peripheral lymphocyte DNA damage and oxidative status after eradication therapy in patients infected with Helicobacter pylori. Pol Arch Med Wewn. 2011;121:428-432. [PubMed] |