修回日期: 2014-10-16
接受日期: 2014-10-29
在线出版日期: 2014-12-08
目的: 研究多西他赛联合S-1(docetaxel plus S-1, DS)方案新辅助治疗可切除进展期胃癌的有效性.
方法: 收集220例可切除的局部进展期胃癌患者的临床资料, 随机分为两组, A组和B组. A组患者在第1天静脉滴注多西他赛(35 mg/m2)持续2 h, 第1-14天每天口服S-1[80 mg/(m2•d)], 4 wk进行2个疗程, 期间给予基本止吐药物预防不良反应, 而后进行D2胃癌根治术, B组患者仅进行D2胃癌根治术. 对两组患者的R0切除率, 病理完全缓解率, 术后并发症发生率和生存期进行比较和分析.
结果: 该研究未见治疗相关死亡病例. 因为经济原因, 107例患者(97.3%)化疗后进行了手术治疗. 两组患者吻合口瘘(1.8% vs 2.7%, P>0.05)和切口愈合不良(5.6% vs 4.5%, P>0.05)发生率差异无统计学意义, R0切除率(99.06% vs 92.73%, P<0.05)、病理完全缓解率(8.41% vs 1.81%, P<0.05)、复发率(18.6% vs 31.8%, P<0.05)、3年生存率(55.7% vs 40.6%, P<0.05)和5年生存率(31.3% vs 21.8%, P<0.05) 差异有统计学意义.
结论: 患者可以很好耐受DS方案, 对于可切除的局部进展期胃癌患者, DS方案新辅助化疗可以提高R0切除率和术后病理完全缓解率, 增加生存率, 降低术后3年内复发率, 并不增加术后并发症的发生率, DS方案是可切除进展期胃癌新辅助化疗的有效方案.
核心提示: 应用多西他赛联合S-1新辅助化疗治疗可切除进展期胃癌, 提高了患者R0切除率、病理完全缓解率和远期生存率, 降低了术后复发率, 而并未增加术后并发症, 提高了胃癌综合治疗的效果.
引文著录: 谢振山, 张谢夫, 刘光辉, 刘涛, 董新华, 杨振. 应用多西他赛联合S-1新辅助化疗方案治疗可切除的进展期胃癌的疗效. 世界华人消化杂志 2014; 22(34): 5334-5338
Revised: October 16, 2014
Accepted: October 29, 2014
Published online: December 8, 2014
AIM: To evaluate the efficacy of preoperative chemotherapy with docetaxel plus S-1 (DS regimen) for resectable advanced gastric cancer.
METHODS: Two hundred and twenty patients with operable locally advanced gastric cancer were collected and equally divided into two groups (A and B). In group A, patients received docetaxel (35 mg/m2) on day 1 for 2 h and daily oral administration of S-1 [80 mg/(m2•d)] on days 1-14 every 4 wk for two cycles, and prophylactic administration of antiemetic medication at a standard doses was routinely used to prevent nausea and vomiting. Then gastrectomy with D2 lymphadenectomy was performed. In group B, patients received only gastrectomy with D2 lymphadenectomy. The R0 resection rate, pathological complete response (pCR), postoperative complications, local recurrence rate and survival rate were compared between the two groups.
RESULTS: Treatment-related death or operative mortality was not found in this study. Because of economic reasons, only 107 (97.3%) patients underwent surgery. There was no significant difference in the incidence of anastomotic leakage (1.8% vs 2.7%, P > 0.05) or poor healing of incision (5.6% vs 4.5%, P > 0.05). There were significant differences in R0 radical resection rate (99.06% vs 92.73%, P < 0.05), pCR rate (8.41% vs 1.81%, P < 0.05) and local recurrence rate (18.6% vs 31.8%, P < 0.05) between the two groups. The 3- (55.7% vs 40.6%, P < 0.05) and 5-year survival rates (31.3% vs 21.8%, P < 0.05) also differed significantly between the two groups.
CONCLUSION: DS regimen as neoadjuvant chemotherapy for operable locally advanced gastric cancer can increase the rates of R0 radical resection, pCR and survival, and decrease the recurrence rate, without increasing the rate of complications.
- Citation: Xie ZS, Zhang XF, Liu GH, Liu T, Dong XH, Yang Z. Efficacy of docetaxel plus S-1 as neoadjuvant chemotherapy for operable advanced gastric cancer. Shijie Huaren Xiaohua Zazhi 2014; 22(34): 5334-5338
- URL: https://www.wjgnet.com/1009-3079/full/v22/i34/5334.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i34.5334
近年来胃癌的发病率有所降低, 但仍为引起人类死亡的主要原因[1]. 目前主要治疗方法仍是以手术为主的综合治疗, 由于早期诊断率低, 患者就诊较晚, 总体预后较差[2]. 术后以多西他赛联合S-1(docetaxel plus S-1, DS)方案给予化疗患者可以很好耐受并可以提高患者生存时间[3], 但是国内外鲜有文献报道DS方案应用于新辅助对患者远期生存的疗效, 本文探讨其对远期生存率的影响.
收集郑州大学第一附属医院胃肠外科2006-01/2009-06收治的220例可切除的局部进展期胃癌患者的临床资料, 随机分为两组, A组和B组. A组(n = 110)在第1天静脉滴注多西他赛(35 mg/m2), 第1-14天每天口服S-1[80 mg/(m2•d)], 4 wk进行2个疗程, 而后进行D2胃癌根治术; B组(n = 110)仅进行D2胃癌根治术. 入组条件为: (1)胃镜活检穿刺病理学证实为胃癌; (2)超声胃镜(ultrasonography, EUS), 腹部增强计算机断层扫描(computed tomography, CT)评估为美国癌症联合委员会(American Joint Committee on Cancer , AJCC)Ⅱ-Ⅲ期; (3)年龄20-70岁; (4)卡氏体能状态评分(Karnofsky performance status, KPS)>60; 东部肿瘤协作组(Eastern Cooperative Oncology Group, ECOG)体能状态评分为0-2分; 评估可行外科切除手术; (5)既往未曾行化疗; (6)血液检测和身体状况能够耐受化疗药物; (7)签署知情同意书. 该临床研究报郑州大学第一附属医院伦理委员会批准同意后进行. 两组患者年龄、性别比例、病理分期、吸烟史等方面统计学无显著性差异. 患者详细资料如表1.
| 临床资料 A组 B组 | P值 | ||
| 性别 | |||
| 男 | 52 | 56 | |
| 女 | 58 | 64 | |
| 年龄(岁) | |||
| <55 | 47 | 50 | |
| ≥55 | 63 | 60 | >0.05 |
| 平均年龄(岁) | 54.5 | 53.6 | |
| 临床分期 | |||
| ⅢA | 51 | 53 | |
| ⅢB | 59 | 57 | |
| 吸烟史 | |||
| 有 | 48 | 46 | |
| 无 | 62 | 54 | |
1.2.1 术前化疗: 术前化疗采取DS方案, 即2 wk为1个疗程, 多西他赛(35 mg/m2)在第1天静脉滴注持续2 h, S-1[80 mg/(m2•d)] 1-14 d每天口服, 术前进行2个疗程, 期间给予止吐、保肝等药物并充分水化.
1.2.2 手术治疗: A组患者化疗结束后4 wk在胃肠外科进行手术. A组与B组胃癌患者的手术均由同等资质、同等技术水平的医生完成. A组患者实施手术前复查血常规、肝肾功能等生化检查以及CT, 了解有无手术禁忌证, 对病变重新进行术前评估分期. 手术方式有全胃切除术和根治性胃大部切除术, 吻合器均采用同一厂家同类型吻合器械.
1.2.3 术后辅助治疗: A组患者无论术后病理结果如何, 如术前化疗有效且患者条件允许, 均接受DS化疗方案进行术后辅助治疗. B组患者根据术后病理情况, 如果患者条件允许, 以DS方案进行术后辅助治疗, 否则均参照NCCN胃癌指南给予对症处理.
1.2.4 术前新辅助化疗疗效评价: 化疗结束时, 复查超声内镜、CT、胃镜等. 手术标本及清扫淋巴结均无肿瘤病灶残留则可判定为病理完全缓解(pathological complete response, pCR).
1.2.5 术后治疗检测及随访: 术后每次辅助化疗之前复查血常规、肝肾功能和肿瘤标志物, 在最初的2年应1次/3 mo病史询问和系统的体格检查, 然后检查1次/6 mo, 术后3年内至少1次/6 mo的胸腹部CT扫描检查, 至少1次/1年胃镜或者超声胃镜检查, 总共5年. 随访采用住院复查、门诊随访和电话随访. 随访终止日期为2014-06-30.
统计学处理 应用SPSS17.0统计软件进行统计学分析, 计数资料采用χ2检验和Fisher确切概率法进行统计学分析, 生存分析采用Kaplan-Meier法和Log-rank检验进行统计学处理, P<0.05为差异有统计学意义.
2.1.1 A组患者术前化疗不良反应情况以及化疗效果: A组新辅助化疗期间的不良反应主要为粒细胞减少、胃肠道不良反应、外周神经毒性和轻度肝功能异常, 未见Ⅲ级及Ⅳ级不良反应出现. 经预防及对症处理均可缓解, 除3例患者因经济原因退出实验, 余未有延迟手术者.
2.1.2 手术及术后并发症情况: 两组患者均接受手术治疗, A组R0切除率明显高于B组(98.3% vs 90.0%, P<0.05), 术后并发症发生率差异无统计学意义(P>0.05). 其中A组2例吻合口瘘, 6例切口感染, B组3例吻合口瘘, 5例切口感染, 其余患者均顺利恢复, 出现并发症患者给予对症治疗后亦可恢复(表2, 3).
| 分组 | A组 | B组 | χ2值 | P值 |
| R0切除率 | 99.06(106/107) | 92.73(102/110) | 5.456 | 0.02 |
| pCR | 8.41(9/107) | 1.81(2/110) | 4.899 | 0.027 |
| 3年复发率 | 18.60(20/107) | 31.81(35/110) | 7.046 | 0.01 |
| 分组 | A组 | B组 | χ2值 | P值 |
| 吻合口瘘 | 1.8(2/107) | 2.7(3/110) | 0.177 | 0.674 |
| 切口愈合不良 | 5.6(6/107) | 4.5(5/110) | 0.127 | 0.722 |
2.2.1 两组患者术后3年局部复发率的比较: A组与B组者均获随访, A组随访时间16-80 mo, 中位随访时间为55 mo, 12位患者失访, 失访率为11.2%(12/107); B组患者随访时间为12-80 mo, 中位随访时间为50 mo, 14例患者失访, 失访率为12.7%(14/110). 随访止于2014-06-30, 患者死亡或失访随访亦终止. A组患者术后随访3年有20例出现复发, 其中4例发生远处转移至肝脏, 复发率为18.60%(20/107); B组患者术后随访3年有35例出现复发, 复发率为31.81%(35/110). 两组患者3年复发率比较差异有统计学意义(χ2 = 7.04, P = 0.010), A组3年复发率明显低于B组(18.6% vs 31.8%)(表2).
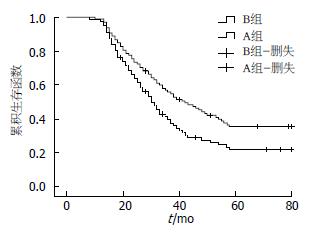
2.2.2 两组患者术后的生存率估计和生存曲线比较: 对两组患者的随访资料应用Kaplan-Meier法和Log-rank检验进行生存分析估计和生存曲线比较. 两组患者3年生存率(55.7% vs 40.6%)和5年生存率(31.3% vs 21.8%)进行对比, 3年生存率(χ2 = 4.511, P = 0.034)和5年生存率(χ2 = 4.338, P = 0.037)差异均有统计学意义. A组和B组生存曲线经Log-rank检验结果显示为不同生存曲线(χ2 = 4.909, P = 0.027), A组较B组生存期明显延长(图1).
目前随着人们生活水平的日益提高以及疾病筛查、诊断方法的进步, 早期胃癌的发现率逐年提高, 目前临床研究统计, 经确诊的胃癌大多数仍为进展期胃癌, 标准的淋巴结清扫和实现R0切除对提高胃癌患者的生存率有重要意义[4]. 然而, 即使我们达到了这个目的, 由于腹腔内可能有微转移灶的存在, 肿瘤也可能再次复发[5,6]. 1982年, Frei首先提出了新辅助化疗(neoadjuvant chemotherapy, NCT)的概念, 即在恶性肿瘤局部治疗、手术或放疗前给予的全身或局部化疗[7]. 对于进展期胃癌患者, NCT使术前降期成为可能. 从此新辅助治疗备受关注, 尤其是MAGIC试验[8,9], 为"新辅助化疗+手术+术后化疗"这种模式的应用提供了高级别循证医学证据. 同时各种新辅助化疗方案的疗效以及安全性也应引起重视.
多西他赛是从欧洲紫衫的针叶中提取前体物, 经半合成而获得, 该药能特异的结合到小管的β位点, 导致微管聚合成团块和囊状并使其稳定, 并能诱导微管束的装配, 但不改变原丝数量; 是细胞周期特异性药物, 能将细胞阻断于M期, 从而达到抗肿瘤作用[10], 多西他赛用于进展期胃癌获得较好的疗效[11,12]. S-1单药对进展期胃癌术后化疗的应用疗效, 3年总体生存率达80.1%, 术后无复发生存率达72.2%[13]. DS方案用于进展期胃癌的化疗, 主要不良反应为中性粒细胞减少或者是胃肠道反应, 给予对症治疗即可缓解, 并且提高了患者无进展生存期[14,15]. Yamaguchi等[16]、Yoshida等[17]表明DS方案应用于进展期胃癌不良反应较小, 中位生存期同样让人满意.
总之, 可切除进展期胃癌应用DS方案新辅助化疗, 患者可以很好耐受, 能够缩小瘤体, 降低分期, 实现肿瘤R0切除, 提高患者生存率, 有望成为可切除的进展期胃癌术前新辅助化疗的标准方案, 对于提高胃癌综合治疗效果具有重要临床意义.
胃癌是我国最常见的恶性肿瘤之一. 近年来, 对于进展期胃癌的治疗, 提倡进行以手术为主的综合治疗. 新辅助化疗是胃癌综合治疗的重要组成部分, 其目的在于减低肿瘤负荷, 降低临床分期, 提高手术切除率进而改善预后. 本研究选用较新的化疗方案[多西他赛联合S-1(docetaxel plus S-1, DS)方案]应用于可切除的进展期胃癌, 结果证明, 提高了患者5年生存率, 降低术后复发率, 而并未增加术后并发症, 值得临床推广.
黄颖秋, 教授, 本溪钢铁(集团)总医院消化内科
本文研究的重点是针对可切除的进展期胃癌患者术前应用DS方案新辅助化疗, 观察患者术后并发症以及术后长期生存率, 以期探讨胃癌新辅助化疗的标准方案, 提高胃癌综合治疗的效果, 但仍需大样本的前瞻性研究, 不断提高胃癌患者术后的生活质量以及远期生存率.
2006年的MAGIC(MRC Adjuvant Gastric Infusional Chemotherapy trial)证实了新辅助化疗在胃癌治疗中的重要性, Oki等的二期临床研究证实了可切除的Ⅲ期胃癌应用DS方案新辅助化疗的安全性, 本文重点研究DS方案新辅助化疗对胃癌患者远期生存率的影响.
本文化疗方案较新, 入组患者为可手术切除的进展期胃癌患者, 国内外鲜有文献报道DS方案应用于新辅助化疗对患者远期生存的影响, 本研究通过R0切除率, 病理完全缓解率, 术后复发率以及远期生存率评价其疗效.
新辅助化疗属于胃癌综合治疗的重要组成部分, 本研究说明可切除的进展期胃癌应用DS方案新辅助化疗可提高患者远期生存率, 值得临床进一步推广和应用.
新辅助化疗: 也称为诱导化疗(induction chemotherapy)或术前化疗(preoperative chemotherapy), 是希望通过术前化疗缩小肿瘤以提高完全切除率, 同时通过减少微转移灶而提高长期生存率的化疗方法. 新辅助化疗是在局部治疗前的化学治疗, 是在最早时间应用药物治疗的特殊策略, 目前已成为许多实体瘤多学科治疗体系中的一个重要组成部分.
本文探讨了DS方案新辅助化疗应用在可切除进展期胃癌的治疗效果, 实验设计合理, 结论客观, 对临床工作有一定的参考价值.
编辑: 郭鹏 电编:闫晋利
| 1. | Siegel R, Naishadham D, Jemal A. Cancer statistics, 2012. CA Cancer J Clin. 2012;62:10-29. [PubMed] [DOI] |
| 2. | Yang L. Incidence and mortality of gastric cancer in China. World J Gastroenterol. 2006;12:17-20. [PubMed] [DOI] |
| 3. | Wang M, Wu M, Wang W, Wang Q, Wang Y. Docetexal plus S-1 versus oxaliplatin plus S-1 for first-line treatment of patients with advanced gastric cancer: a retrospective study. Oncol Res Treat. 2014;37:24-28. [PubMed] [DOI] |
| 4. | Sasako M. Principles of surgical treatment for curable gastric cancer. J Clin Oncol. 2003;21:274s-275s. [PubMed] [DOI] |
| 5. | Cardoso R, Coburn NG, Seevaratnam R, Mahar A, Helyer L, Law C, Singh S. A systematic review of patient surveillance after curative gastrectomy for gastric cancer: a brief review. Gastric Cancer. 2012;15 Suppl 1:S164-S167. [PubMed] [DOI] |
| 6. | Okuyama T, Korenaga D, Edagawa A, Itoh S, Oki E, Kawanaka H, Ikeda Y, Kakeji Y, Tateishi M, Tsujitani S. Prognostic effects of oral anti-cancer drugs as adjuvant chemotherapy for 2 years after gastric cancer surgery. Surg Today. 2012;42:734-740. [PubMed] [DOI] |
| 7. | Macdonald JS, Smalley SR, Benedetti J, Hundahl SA, Estes NC, Stemmermann GN, Haller DG, Ajani JA, Gunderson LL, Jessup JM. Chemoradiotherapy after surgery compared with surgery alone for adenocarcinoma of the stomach or gastroesophageal junction. N Engl J Med. 2001;345:725-730. [PubMed] [DOI] |
| 8. | Cunningham D, Allum WH, Stenning SP, Thompson JN, Van de Velde CJ, Nicolson M, Scarffe JH, Lofts FJ, Falk SJ, Iveson TJ. Perioperative chemotherapy versus surgery alone for resectable gastroesophageal cancer. N Engl J Med. 2006;355:11-20. [PubMed] [DOI] |
| 9. | Yoshikawa T, Sasako M, Yamamoto S, Sano T, Imamura H, Fujitani K, Oshita H, Ito S, Kawashima Y, Fukushima N. Phase II study of neoadjuvant chemotherapy and extended surgery for locally advanced gastric cancer. Br J Surg. 2009;96:1015-1022. [PubMed] [DOI] |
| 10. | Unek IT, Akman T, Oztop I, Unal OU, Salman T, Yilmaz U. Bimonthly regimen of high-dose leucovorin, infusional 5-fluorouracil, docetaxel, and cisplatin (modified DCF) in advanced gastric adenocarcinoma. Gastric Cancer. 2013;16:428-434. [PubMed] [DOI] |
| 11. | Shigeyasu K, Kagawa S, Uno F, Nishizaki M, Kishimoto H, Gochi A, Kimura T, Takahata T, Nonaka Y, Ninomiya M. Multicenter phase II study of S-1 and docetaxel combination chemotherapy for advanced or recurrent gastric cancer patients with peritoneal dissemination. Cancer Chemother Pharmacol. 2013;71:937-943. [PubMed] [DOI] |
| 12. | Kunisaki C, Takahashi M, Ono HA, Hasegawa S, Tsuchida K, Oshima T, Ota M, Fukushima T, Tokuhisa M, Izumisawa Y. Biweekly Docetaxel and S-1 combination chemotherapy as first-line treatment for elderly patients with advanced gastric cancer. Anticancer Res. 2013;33:697-704. [PubMed] |
| 13. | Sakuramoto S, Sasako M, Yamaguchi T, Kinoshita T, Fujii M, Nashimoto A, Furukawa H, Nakajima T, Ohashi Y, Imamura H. Adjuvant chemotherapy for gastric cancer with S-1, an oral fluoropyrimidine. N Engl J Med. 2007;357:1810-1820. [PubMed] [DOI] |
| 14. | Bang YJ, Kang WK, Kang YK, Kim HC, Jacques C, Zuber E, Daglish B, Boudraa Y, Kim WS, Heo DS. Docetaxel 75 mg/m(2) is active and well tolerated in patients with metastatic or recurrent gastric cancer: a phase II trial. Jpn J Clin Oncol. 2002;32:248-254. [PubMed] [DOI] |
| 15. | Luo H, Yu Z, Gao H, Guan C, Xu M. Efficacy and tolerability of docetaxel and cisplatin plus S-1 for advanced gastric cancer. J BUON. 2013;18:154-161. [PubMed] |
| 16. | Yamaguchi K, Shimamura T, Hyodo I, Koizumi W, Doi T, Narahara H, Komatsu Y, Kato T, Saitoh S, Akiya T. Phase I/II study of docetaxel and S-1 in patients with advanced gastric cancer. Br J Cancer. 2006;94:1803-1808. [PubMed] [DOI] |
| 17. | Yoshida K, Ninomiya M, Takakura N, Hirabayashi N, Takiyama W, Sato Y, Todo S, Terashima M, Gotoh M, Sakamoto J. Phase II study of docetaxel and S-1 combination therapy for advanced or recurrent gastric cancer. Clin Cancer Res. 2006;12:3402-3407. [PubMed] [DOI] |