修回日期: 2014-06-14
接受日期: 2014-07-24
在线出版日期: 2014-12-08
目的: 幽门螺杆菌(Helicobacter pylori, H. pylori)感染与原发性肝癌(primary hepatic carcinoma, PHC)的发生发展.
方法: 收集2010-03/2013-10广西医科大学附属肿瘤医院首次诊断为PHC患者临床资料及非肿瘤患者临床资料. 探讨H. pylori与PHC发生发展的关系. 然后, 再对实验组进行二次收集, 分两组数据, 一组为乙型肝炎病毒(hepatitis B virus, HBV)组, 为同时检测H. pylori14C-UBt值与HBV DNA拷贝数; 另一组为甲胎蛋白(alpha-fetal protein, AFP)组, 为同时检测同时H. pylori14C-UBt值与AFP浓度患者. 分别研究H. pylori14C-UBt值与AFP浓度、HBV DNA拷贝数之间的关系, 间接证明H. pylori与PHC的相关性. 对于计数资料使用χ2检验, 若为有序资料则用秩和检验; 计量资料, 采用相关分析.
结果: PHC患者H. pylori阳性率为61.4%, 高于非肿瘤患者28.7%. 卡方检验结果示χ2 = 11.466, P<0.05, 差异有统计学意义. 胆管细胞型H. pylori的阳性率61.1%, 混合细胞型50%, 肝细胞型38.6%, 以胆管细胞型阳性率最高; 统计结果χ2 = 5.866, P<0.05, 差异具有统计学意义. 高分化28.5%, 中分化39.2%, 低分化48.9%; 分化程度低, 感染率高. 平均秩H. pylori阳性为124.9, 阴性145.2, P<0.05, 故分化程度越低则H. pylori感染阳性率越高. 分期方面, 分期较早的Ⅰ期14.2%、Ⅱ期10.7%较分期较晚的Ⅲ期41.28%、Ⅳ期48.2%高; 平均秩H. pylori阳性为164.9, 阴性为127.6, P = 0.00<0.05. 故分期越晚则H. pylori感染阳性率高. 高侵袭性患者的阳性率为59.7%; 低侵袭性为26.1%, 卡方检验结果为χ2 = 21.025, P<0.05, 两者差异有显著性. 性别、年龄间差异无统计学意义. H. pylori14C-UBt值与AFP浓度的相关系数r = 0.88, P = 0.00<0.05; 而其与HBV DNA拷贝数间的相关系数r = 0.657, P = 0.01<0.05, 两者均呈正相关关系, 差异均有统计学意义.
结论: H. pylori感染与PHC发生、发展关系较密切.
核心提示: 本研究发现原发性肝癌(primary hepatic carcinoma, PHC)侵袭性越高、临床分期较晚、细胞分化程度越低则患者幽门螺杆菌(Helicobacter pylori, H. pylori)感染阳性率越高, 且PHC病理分型中胆管细胞型较其他分型与H. pylori感染关系更密切. 此外, H. pylori感染更易受到乙型肝炎病毒(hepatitis B virus, HBV)感染、引起甲胎蛋白(alpha-fetal protein)升高. 故可能为PHC的一个独立致病因素, 或辅助HBV诱发PHC的发生.
引文著录: 石玲, 刘立义, 龚敏勇, 王志, 左宏波, 刘爱群. 幽门螺杆菌感染与原发性肝癌发生发展的关系. 世界华人消化杂志 2014; 22(34): 5266-5272
Revised: June 14, 2014
Accepted: July 24, 2014
Published online: December 8, 2014
AIM: To investigate the relationship between Helicobacter pylori (H. pylori) infection and primary hepatic carcinoma.
METHODS: Clinical data for patients who were newly diagnosed with primary hepatic carcinoma and patients with non-cancer diseases treated at Guangxi Medical University Cancer Hospital from March 2010 to October 2013 were retrospectively analyzed to assess the relationship between H. pylori infection and primary hepatic carcinoma. Patients with primary hepatic carcinoma were further divided into two groups, one undergoing detection of HBV DNA copy number and H. pylori14C-UBT, and the other undergoing the determination of alpha-fetal protein (AFP) concentrations and H. pylori14C-UBT. The relationship among 14C-UBT value, HBV DNA copy number and AFP concentrations were assessed.
RESULTS: The positive rate of H. pylori infection was significantly higher in primary hepatic carcinoma than in non-cancer diseases, in poorly differentiated primary hepatic carcinoma than in moderately and well differentiated carcinoma, in stage Ⅲ/Ⅳ carcinoma than in stage Ⅰ/Ⅱ, in highly invasive carcinoma than in minimally invasive, and in bile duct cell type than in other two types. Gender and age had no significant impact on the positive rate of H. pylori infection. 14C-UBT value was significantly positively correlated with AFP concentrations (r = 0.88) and HBV DNA copy number (r = 0.657).
CONCLUSION: H. pylori infection may be associated with the occurrence and development of primary hepatic carcinoma.
- Citation: Shi L, Liu LY, Gong MY, Wang Z, Zuo HB, Liu AQ. Relationship between Helicobacter pylori infection and primary hepatic carcinoma. Shijie Huaren Xiaohua Zazhi 2014; 22(34): 5266-5272
- URL: https://www.wjgnet.com/1009-3079/full/v22/i34/5266.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i34.5266
在我国80%左右肝癌的发生与乙型肝炎病毒(hepatitis B virus, HBV)长期慢性感染密切相关. 但仍有少部分肝癌病因不明. 肝螺杆菌(Helicobacter Hepaticus, HH)是唯一能引起原发性肝癌(primary hepatic carcinoma, PHC)的螺杆菌[1-6], 而其16S rRNA基因与幽门螺杆菌(Helicobacter pylori, H. pylori)存在非常高的同源性, 有些几乎达100%, 有研究甚至在肝脏组织中直接找到H. pylori的存在. 研究者们认为H. pylori感染可能为PHC发生的致病因素又或者为伴发感染, 并提出"H. pylori感染可能为PHC的另一致病因素"的新理论[7-9]. 此外, 研究发现乙型肝炎患者感染H. pylori的可能性越高, 处于HBV复制期的H. pylori感染率达75.6%. H. pylori感染在一定程度上可促进HBV的复制[10]. 我们对H. pylori14C-UBt值与HBV DNA拷贝数之间的关系进行研究, 进一步探讨H. pylori引起PHC可能的机制, 间接证实H. pylori影响PHC的发生发展. 甲胎蛋白(alpha-fetal protein, AFP)作为PHC早期诊断的肿瘤标志物, 与PHC的关系紧密, 对PHC患者的早期诊断、病情评估及疾病愈合等敏感性较高, 当PHC肿瘤越大, 一般AFP浓度越高[11]. 因此, 我们推测H. pylori14C-UBt值是否与AFP浓度、HBV DNA拷贝数之间存在某种相关, 使得H. pylori可能作为一种独立或辅助致病因素在肝癌发生发展过程中起桥梁作用或协同作用[12-14]. 我们通过回顾性分析探讨H. pylori与PHC的关系.
收集2010-03/2013-10广西医科大学附属肿瘤医院首次诊断为PHC患者及非肿瘤患者临床资料. 实验组为首诊为PHC患者共311例, 其中男272例, 女39例, 平均年龄为43岁; 对照组为非恶性肿瘤患者共87例, 其中男46例, 女41例, 平均年龄为38岁. 两组性别和年龄差异无统计学意义(P>0.05). 再从收集的311例PHC患者中又分别收集21例AFP组, 即同时检测了H. pylori14C-UBt值及AFP浓度患者的数据资料及HBV组, 即同时检测了H. pylori14C-UBt值及HBV DNA拷贝数. 纳入标准: (1)实验组: 经病理确诊或者两种影像学均支持诊断为HCC患者; (2)对照组: 非肿瘤患者. 剔除标准: (1)实验组: 可疑为PHC未能确诊者; 合并有胃十二指肠溃疡; 入住九江市第一人民医院前已行放化疗、肝动脉栓塞灌注等抗癌治疗; 无法获取原始病理或影像学诊断资料; 合并其他恶性肿瘤; 已抗H. pylori感染治疗; (2)对照组: 合并有胃十二指肠溃疡患者; 已抗H. pylori感染治疗; (3)AFP组剔除AFP>1210 ng/mL的开口资料; HBV组剔除已行抗癌、抗HBV感染治疗的患者.
1.2.1 14C呼气实验检: (1)检查前空腹或禁食2 h以后口服2粒14C胶囊静待25 min; (2)嘱受试者向CO2集气剂瓶内吹气1-3 min, 当瓶内液体由紫红色变为无色则停止; (3)向瓶内滴入4.5 mL闪烁液, 并在瓶壁标签上写上患者的姓名及编号, 盖紧摇匀, 置于检测仪上进行14C放射性(dpm)测定; (4)当14C-UBT检测值≥100 dpm/mmol CO2时, 为H. pylori感染阳性.
1.2.2 AFP及HBV DNA拷贝数定量测定: 抽取空腹血清分别采用化学发光法及酶联免疫吸附法检测AFP浓度及HBV DNA拷贝数, AFP浓度>20 ng/mL, HBV DNA拷贝数>1000 IU/mL为异常.
1.2.3 判断标准: PHC的诊断标准、病理组织分型、临床分期均参照卫生部关于2011年PHC诊疗规范[15]. 细胞分化程度按Emdondson标准进行划分. 侵袭性高低的划分[16]为: (1)同一肝叶内肿瘤数目≥2或癌灶旁有多个卫星结节; (2)门脉或肝内外胆管受侵; (3)肿瘤表面包膜不完整或缺如; (4)有远处器官转移或侵及邻近器官; (5)有肝门淋巴结转移. 符合其中任意一项即可认为是高侵袭性组, 相反若无, 则为低侵袭性组.
统计学处理 对计数资料使用四格表资料或行乘列表的χ2检验, 若为有序资料, 则进行秩和检验. 对计量资料, 先绘制散点图, 若呈直线分布趋势, 则行相关分析. 符合正态分布, 即采用直线相关分析; 若不符合正态分布, 即采用Spearman秩相关分析. 统计运算均采用统计软件SPSS16.0, 图片绘制采用Excel 2013. 取检验水准Q = 0.05. P<0.05为差异具有统计学意义.
PHC组311例, 其中男272例, 女39例; 非肿瘤组87例, 其中男46例, 女41例. AFP组及HBV组分别21例, 记录14C-UBt值、AFP浓度及HBV DNA拷贝数.
虽然>50岁患者H. pylori感染阳性率(63.0%)明显高于年龄<40岁患者(56.6%), 呈现随年龄增大, 阳性率增高的趋势, 但差异无统计学意义. 男女性别差异无统计学意义(表1).
| H. pylori(阳性/阴性) | 阳性率(%) | χ2值 | P值 | |
| 年龄(岁) | ||||
| <40 | 34(26) | 56.6 | 0.0739 | >0.05 |
| 40-50 | 65(40) | 61.9 | ||
| >50 | 92(54) | 63.0 | ||
| 性别 | ||||
| 男 | 167(105) | 61.4 | 0.000 | >0.05 |
| 女 | 24(15) | 61.5 |
PHC患者H. pylori感染的阳性率为61.4%, 而非肿瘤患者感染率为28.7%, 两者差异有统计学意义, PHC患者H. pylori感染感染率明显高于非肿瘤患者. χ2 = 11.466, P<0.05, 差异有统计学意义(表2).
| H. pylori(阳性/阴性) | 阳性率(%) | χ2值 | P值 | |
| 原发性肝癌 | 191(120) | 61.4 | 11.466 | <0.05 |
| 非肿瘤 | 25(62) | 28.7 |
PHC的病理组织类型中H. pylori感染阳性率在胆管细胞型为61.1%较肝细胞型38.6%明显升高, 与混合细胞型50%则差异无统计学意义. 因混合细胞型的理论频数≤1, 故使用确切概率法, 结果χ2 = 5.866, P<0.05, 差异有统计学意义(表3).
| H. pylori(阳性/阴性) | 阳性率(%) | χ2值 | P值 | |
| 肝细胞型 | 46/73 | 38.6 | 5.866 | <0.05 |
| 胆管细胞型 | 22/14 | 61.1 | ||
| 混合细胞型 | 1/1 | 50.0 |
细胞分化分为高、中、低分化, 为等级资料故采用秩和检验统计方法, 结果如表4. 阳性率方面, 低分化为48.9%, 中分化39.2%, 高分化28.5%, 低分化较高分化阳性率高, 差异有统计学意义(P<0.05). 平均秩计算结果, H. pylori阳性为124.9, 阴性145.2, 分化程度由低到高排列, 平均秩越低, 则分化程度越低, 故有此可见分化程度越低则H. pylori感染阳性率越高(表4).
| 分化程度 | H. pylori(1) | 阳性率(%) | 合计 | 秩次范围 | 平均秩次 | 秩和H. pylori | Z值 | P值 | ||
| (+) | (-) | (+) | (-) | |||||||
| 低分化 | 46 | 48 | 48.9 | 94 | 1-94 | 47.5 | 2185 | 2280 | -7.046 | <0.05 |
| 中分化 | 60 | 93 | 39.2 | 153 | 95-247 | 171 | 10260 | 15903 | ||
| 高分化 | 6 | 15 | 28.5 | 21 | 248-268 | 258 | 1548 | 3870 | ||
| 合计 | 112 | 156 | 13993 | 22653 | ||||||
根据PHC的侵袭性判断标准, 确定为高侵袭性者164例, H. pylori阳性率为59.7%; 低侵袭性患者65例, 阳性率为26.1%. 提示高侵袭性HCC较低侵袭性感染H. pylori阳性率高. 而χ2为21.025, P<0.05, 差异有统计学意义(表5).
| 侵袭性 | H. pylori(阳性/阴性) | 阳性率(%) | χ2值 | P值 |
| 高侵袭性 | 98/66 | 59.7 | 21.025 | <0.05 |
| 低侵袭性 | 17/48 | 26.1 |
PHC临床分期的比较, 采用秩和检验方法, 结果如表6, χ2 = -0.496, P<0.05, 差异有统计学意义; 计算平均秩, 可得H. pylori阳性的平均秩为164.9, 阴性为127.6. 分期由分期较早至分期较晚排列, 则平均秩越高分期越晚, 故H. pylori感染阳性者临床分期越晚. 与H. pylori感染的阳性率结果相符合. Ⅲ期H. pylori阳性率为41.28%、Ⅳ期阳性率为48.2%较Ⅰ期14.2%、Ⅱ期10.7%明显升高, 表明肝癌临床分期越晚, H. pylori感染率越高(表6).
| 分期 | H. pylori(n) | 阳性率(%) | 合计 | 秩次范围 | 平均秩次 | 秩和H. pylori | Z值 | P值 | ||
| (+) | (-) | (+) | (-) | |||||||
| Ⅰ期 | 1 | 6 | 14.2 | 7 | 1-7 | 4.0 | 4 | 24 | -0.496 | <0.05 |
| Ⅱ期 | 6 | 50 | 10.7 | 56 | 8-63 | 35.5 | 213 | 1775 | ||
| Ⅲ期 | 45 | 64 | 41.28 | 109 | 64-172 | 118.0 | 5310 | 7552 | ||
| Ⅳ期 | 67 | 72 | 48.2 | 139 | 110-311 | 210.5 | 14103.5 | 15156 | ||
| 合计 | 119 | 192 | 311 | 19630.5 | 24507 | |||||
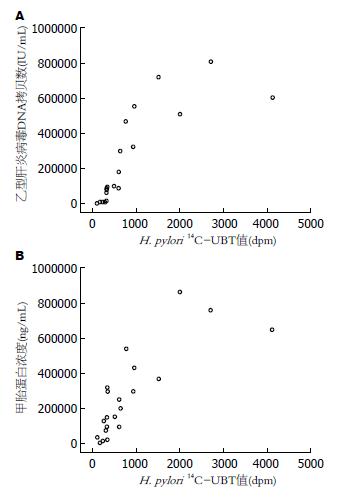
共有21例病例资料, 首先绘制散点如图1A, 所有的点基本在同一条直线上, 呈相关趋势. 因两组数据均为偏态分布, 故行Spearman秩相关分析, 结果相关系数r = 0.657, P = 0.01<0.05.
共21例病例资料, 散点图的绘制如图1B, 除外个别处于直线外, 其余点几乎在同一条直线上, 两者间呈现较明显相关趋势. 然后进一步进行相关性分析, 因两组数据均不服从正态分布, 故使用Spearman秩相关检验分析, 所得结果为, 相关系数r = 0.88, 而P = 0.00<0.05, 提示差异具有统计学意义.
引起PHC病因有多种, 即便基因型相同且同时合并HBV感染患者, 部分患者最终可发展成PHC, 而有些却终生不发病. 本研究从H. pylori入手, 发现PHC患者H. pylori感染阳性率明显较非肿瘤患者高且差异有统计学意义, 表明H. pylori感染与PHC的发生有关. H. pylori具有肝细胞毒作用引起肝细胞变形、破裂、凋亡[17,18]以及肝细胞不典型性增生, 最后引发PHC的发生[19].
高侵袭性肝癌患者H. pylori感染阳性率较低侵袭性患者高, 差异有统计学意义. 即高侵袭性PHC患者更易感染H. pylori. H. pylori高特异性16S rRNA基因在高侵袭性PHC患者检测率更高[20]. H. pylori与PHC的侵袭性可能存在一定相关性[21-23]. H. pylori组织中表达与PHC的转移密切相关蛋白Transgelin与Integrin 0.2[20], 而且H. pylori自身携带的cagA+基因能诱导与PHC发生、进展存在很大相关性的HepG2 cyclin D1、PCNA、c-fos mRNA和蛋白质的表达升高[24-26]. 因此, H. pylori通过调节相关蛋白、基因影响H. pylori的侵袭转移. 关于H. pylori与PHC病理组织学分型结果为胆管细胞癌的H. pylori阳性率较肝细胞型H. pylori感染阳性率明显高, 差别有统计学意义. 因胆管细胞型肝癌患者更易引起胆汁淤积, 降低胆道pH值, 为H. pylori提供适合生长的酸性环境[27]. 此外, H. pylori也易经十二指肠壶腹部逆流至胆管进而侵入肝脏[10].
PHC者阳性率在分期较晚的Ⅲ期、Ⅳ期的H. pylori感染阳性率较分期相对早的Ⅰ、Ⅱ期高, 差异有统计学意义; 结合平均秩的所得结果提示PHC分期较晚, 则H. pylori感染可能性较大. 不同细胞分化程度的PHC, 其H. pylori感染阳性率有所差别. 分化程度低的PHC患者感染H. pylori阳性率较高, 且差异有统计学意义, 结合平均秩的所得结果提示细胞分化程度越低, H. pylori感染率越高. H. pylori14C-UBt值与HBV DNA拷贝数的相关系数r = 0.657, 呈正相关关系, 相关程度较大, 即HBV DNA拷贝数越大, 则H. pylori14C-UBt值越高. 这是因为HBV的泛嗜性, 使他不但可以在胃黏膜表面定植还可以定植在肝脏, 引起全身免及肝脏的局部抵抗力低下; 损伤肝脏引起肝内胆汁pH降低利于H. pylori的定植导致H. pylori易感[27]. 而H. pylori感染后也能引起T细胞抑制效应和HBV特异的Th1细胞因子表达下调, 从而引起机体缺乏HBV特异性免疫而难以清除. H. pylori与HBV还可能通过诱导白介素(interleukin, IL)-1/IL-6/肿瘤坏死因子(tumor necrosis factor, TNF)-α和细胞间黏附分子(intercellular cell adhesion molecule, ICAM)-1的表达[28-31], 通过免疫途径对引起肝脏的损伤产生协同作用[32,33]. H. pylori可能与HBV起协同作用诱发PHC的发生[34]. H. pylori感染与PHC的侵袭进展等有关, 能引起肿块进行性增大; 而AFP浓度高低与肝癌肿块大小呈正相关关系[35]. 本研究对21例患者的AFP浓度、H. pylori14C-UBT相关性进行统计分析, 相关系数r = 0.88, 呈正相关, 呈现H. pylori14C-UBt值越高则AFP浓度越高趋势. 然而, 虽然AFP对PHC的诊断及预后具有重要价值[36], 但约70%PHC患者血清中AFP检测结果为阳性, 还有30%为阴性或浓度较低[37]. 故本研究虽然有统计学意义, 但尚不能确切的认为两者相关性很大.
总之, H. pylori感染与PHC的发生及其侵袭转移、病理组织学分型、细胞分化程度密切相关. 而H. pylori14C-UBt值与AFP浓度、HBV DNA拷贝数呈正相关, 即H. pylori14C-UBT检测值越高, AFP浓度以及HBV DNA的拷贝数越高, 从而间接证明H. pylori与PHC的发生发展密切相关, H. pylori可能为PHC的一个独立致病因素, 或者辅助HBV诱发PHC的发生, 但有待更多有力的实验证据支持, 并希望能在未来对PHC的预防、诊治提供新的参考.
感谢易伟冬和王秋婷在本研究中给予的支持与帮助.
尽管原发性肝癌(primary hepatic carcinoma, PHC)与乙型肝炎病毒(hepatitis B virus, HBV)感染密切相关. 但仍有少部分病因不明. 国内外众多研究发现PHC与肝螺杆菌关系密切, 而其16S rRNA基因与幽门螺杆菌(Helicobacter pylori, H. pylori)存在非常高的同源性, 有些可达100%, 有研究甚至在肝脏组织中直接找到H. pylori的存在. 由此引发思考, H. pylori与PHC是否存在某种相关性? 进行了一项回顾性分析.
姚登福,教授, 南通大学附属医院
近年来国内外众多研究更倾向从基因、分子生物学或病理学角度对H. pylori与PHC关系进行研究. 虽然发现两者存在较大相关性, 但H. pylori在未来能否如甲胎蛋白(alpha-fetal protein, AFP)那样参与PHC的临床诊断值得进一步探讨.
本研究参考的文献中, 有研究从基因学角度去研究, 发现引起肝癌的肝螺杆菌16S rRNA基因与H. pylori存在非常高的同源性, 可达100%. 另有研究直接在肝癌组织切片中找出H. pylori更能直接、明确的证实H. pylori感染与PHC的相关性.
本研究对H. pylori感染与PHC的侵袭性、临床分期、细胞分化、病理分型及其高危因素之间的关系进行研究, 成为本文亮点, 目前国内外对此研究尚缺乏.
对PHC的预防与诊治提供新的参考, 可对高危人群进行H. pylori疫苗注射, 从而降低患病率与死亡率.
本文具有一定指导意义.
编辑: 田滢 电编:闫晋利
| 1. | Nilsson HO, Taneera J, Castedal M, Glatz E, Olsson R, Wadström T. Identification of Helicobacter pylori and other Helicobacter species by PCR, hybridization, and partial DNA sequencing in human liver samples from patients with primary sclerosing cholangitis or primary biliary cirrhosis. J Clin Microbiol. 2000;38:1072-1076. [PubMed] |
| 2. | Kawaguchi M, Saito T, Ohno H, Midorikawa S, Sanji T, Handa Y, Morita S, Yoshida H, Tsurui M, Misaka R. Bacteria closely resembling Helicobacter pylori detected immunohistologically and genetically in resected gallbladder mucosa. J Gastroenterol. 1996;31:294-298. [PubMed] [DOI] |
| 3. | Ward JM, Fox JG, Anver MR, Haines DC, George CV, Collins MJ, Gorelick PL, Nagashima K, Gonda MA, Gilden RV. Chronic active hepatitis and associated liver tumors in mice caused by a persistent bacterial infection with a novel Helicobacter species. J Natl Cancer Inst. 1994;86:1222-1227. [PubMed] [DOI] |
| 4. | Fox JG, Yan L, Shames B, Campbell J, Murphy JC, Li X. Persistent hepatitis and enterocolitis in germfree mice infected with Helicobacter hepaticus. Infect Immun. 1996;64:3673-3681. [PubMed] |
| 5. | Singh R, Leuratti C, Josyula S, Sipowicz MA, Diwan BA, Kasprzak KS, Schut HA, Marnett LJ, Anderson LM, Shuker DE. Lobe-specific increases in malondialdehyde DNA adduct formation in the livers of mice following infection with Helicobacter hepaticus. Carcinogenesis. 2001;22:1281-1287. [PubMed] [DOI] |
| 6. | Fan XG, Peng XN, Huang Y, Yakoob J, Wang ZM, Chen YP. Helicobacter species ribosomal DNA recovered from the liver tissue of chinese patients with primary hepatocellular carcinoma. Clin Infect Dis. 2002;35:1555-1557. [PubMed] [DOI] |
| 7. | Avenaud P, Marais A, Monteiro L, Le Bail B, Bioulac Sage P, Balabaud C, Mégraud F. Detection of Helicobacter species in the liver of patients with and without primary liver carcinoma. Cancer. 2000;89:1431-1439. [PubMed] |
| 8. | Nilsson HO, Mulchandani R, Tranberg KG, Stenram U, Wadström T. Helicobacter species identified in liver from patients with cholangiocarcinoma and hepatocellular carcinoma. Gastroenterology. 2001;120:323-324. [PubMed] [DOI] |
| 10. | de Magalhães Queiroz DM, Santos A. Isolation of a Helicobacter strain from the human liver. Gastroenterology. 2001;121:1023-1024. [PubMed] [DOI] |
| 12. | Fagoonee S, Pellicano R, Rizzetto M, Ponzetto A. The journey from hepatitis to hepatocellular carcinoma. Bridging role of Helicobacter species. Panminerva Med. 2001;43:279-282. [PubMed] |
| 16. | 陈 燕凌, 王 小众. 幽门螺杆菌与肝癌相关性及其分子机制的初步研究. 福州市: 福建医科大学 2007; . |
| 19. | Fukui T, Okazaki K, Tamaki H, Kawasaki K, Matsuura M, Asada M, Nishi T, Uchida K, Iwano M, Ohana M. Immunogenetic analysis of gastric MALT lymphoma-like lesions induced by Helicobacter pylori infection in neonatally thymectomized mice. Lab Invest. 2004;84:485-492. [PubMed] [DOI] |
| 21. | Lin TT, Yeh CT, Wu CS, Liaw YF. Detection and partial sequence analysis of Helicobacter pylori DNA in the bile samples. Dig Dis Sci. 1995;40:2214-2219. [PubMed] [DOI] |
| 22. | Fox JG, Yan LL, Dewhirst FE, Paster BJ, Shames B, Murphy JC, Hayward A, Belcher JC, Mendes EN. Helicobacter bilis sp. nov., a novel Helicobacter species isolated from bile, livers, and intestines of aged, inbred mice. J Clin Microbiol. 1995;33:445-454. [PubMed] |
| 23. | Stanley J, Linton D, Burnens AP, Dewhirst FE, On SL, Porter A, Owen RJ, Costas M. Helicobacter pullorum sp. nov.-genotype and phenotype of a new species isolated from poultry and from human patients with gastroenteritis. Microbiology. 1994;140:3441-3449. [PubMed] [DOI] |
| 24. | 张 艳, 范 学工. 幽门螺杆菌对肝细胞的病理作用研究. 长沙: 中南大学 2004; . |
| 25. | Joo M, Kang YK, Kim MR, Lee HK, Jang JJ. Cyclin D1 overexpression in hepatocellular carcinoma. Liver. 2001;21:89-95. [PubMed] [DOI] |
| 26. | Yuen MF, Wu PC, Lai VC, Lau JY, Lai CL. Expression of c-Myc, c-Fos, and c-jun in hepatocellular carcinoma. Cancer. 2001;91:106-112. [PubMed] [DOI] |
| 27. | Myung SJ, Kim MH, Shim KN, Kim YS, Kim EO, Kim HJ, Park ET, Yoo KS, Lim BC, Seo DW. Detection of Helicobacter pylori DNA in human biliary tree and its association with hepatolithiasis. Dig Dis Sci. 2000;45:1405-1412. [PubMed] [DOI] |
| 28. | Agrawal A, Gupta A, Chandra M, Koowar S. Role of Helicobacter pylori infection in the pathogenesis of minimal hepatic encephalopathy and effect of its eradication. Indian J Gastroenterol. 2011;30:29-32. [PubMed] [DOI] |
| 29. | Mishra RR, Tewari M, Shukla HS. Helicobacter pylori and pathogenesis of gallbladder cancer. J Gastroenterol Hepatol. 2011;26:260-266. [PubMed] [DOI] |
| 30. | Fox JG, Dewhirst FE, Tully JG, Paster BJ, Yan L, Taylor NS, Collins MJ, Gorelick PL, Ward JM. Helicobacter hepaticus sp. nov., a microaerophilic bacterium isolated from livers and intestinal mucosal scrapings from mice. J Clin Microbiol. 1994;32:1238-1245. [PubMed] |
| 31. | Bostanoğlu E, Karahan ZC, Bostanoğlu A, Savaş B, Erden E, Kiyan M. Evaluation of the presence of Helicobacter species in the biliary system of Turkish patients with cholelithiasis. Turk J Gastroenterol. 2010;21:421-427. [PubMed] |
| 32. | Pan CQ, Zhang JX. Natural History and Clinical Consequences of Hepatitis B Virus Infection. Int J Med Sci. 2005;2:36-40. [PubMed] [DOI] |
| 33. | Vandenplas Y. Helicobacter pylori infection. World J Gastroenterol. 2000;6:20-31. [PubMed] |