修回日期: 2014-09-16
接受日期: 2014-10-02
在线出版日期: 2014-11-18
目的: 观察大鼠肝移植术后外周血CD4+/CD8+ T细胞亚群比例的变化, 探讨其与移植后免疫排斥反应的关系.
方法: 近郊系大鼠随机分为同基因肝移植组I组(Isograft组: Lewis→Lewis), 异基因肝移植组A组(Allograft组: DA→Lewis), 每组12对大鼠, 另设12只假手术Lewis大鼠作为正常对照(C组). 假手术组仅打开腹腔后即缝合, 大鼠原位肝移植模型的建立采用改良"二袖套法". 观察术后1、2 wk存活率, 移植肝病理组织学改变和受体外周血CD4+/CD8+ T细胞亚群比例的变化. 病理检查采用HE染色, 外周血CD4+/CD8+ T细胞亚群比例的变化采用流式细胞术检测.
结果: I组和A组1 wk存活率分别是100.0%和41.7%, 2 wk存活率分别是75%和8.3%(P<0.05). 术后7 d, A组移植肝均呈现严重急性排斥反应表现, 而I组移植肝未发现明显急性排斥反应改变. 术后7 d流式细胞术检测结果显示: A组外周血CD4+ T细胞亚群比例最高, 与I组比较差异有统计学意义(P<0.05); CD8+ T细胞亚群比例3组中I组最低, I组与C组、A组比较差异均有统计学意义(P<0.05); CD4+/CD8+ T细胞比值A组最高, A组与I、C组比较差异均有统计学意义(P<0.05). A组外周血中γ-干扰素(interferon-γ, IFN-γ)水平最高、白介素-10(interleukin-10, IL-10)水平最低, 与I、C组比较差异均有统计学意义(P<0.05).
结论: 外周血CD4+/CD8+ T细胞亚群的动态平衡与大鼠肝移植免疫排斥反应及免疫耐受的发生均密切相关, CD4+ T细胞增生活跃及CD4+/CD8+ T细胞比值升高诱发急性排斥反应, CD8+ T细胞分化减少可能是免疫耐受发生的机制之一.
核心提示: 肝移植急性排斥反应发生时, CD4+ T细胞增生活跃, 比例升高; CD8+ T细胞比例降低, 两者比值失调. 细胞因子γ-干扰素(interferon-γ)和白介素-10(interleukin-10)可能在这个过程中发挥一定作用. 动态检测患者外周血T细胞亚群的比例变化及其分泌的细胞因子的改变, 可预测急性排斥的发生及程度.
引文著录: 林拥华, 江艺, 章宝燕, 李新丰, 洪本祖, 王伟. 外周血T细胞亚群与大鼠原位肝移植排斥反应的关系. 世界华人消化杂志 2014; 22(32): 4948-4953
Revised: September 16, 2014
Accepted: October 2, 2014
Published online: November 18, 2014
AIM: To investigate the changes of CD4+/CD8+ T-lymphocyte subsets in peripheral blood in rats after liver transplantation, and to evaluate their effect on acute rejection.
METHODS: Inbred DA and Lewis rats were randomly divided into three groups: a liver isograft group (group I: Lewis → Lewis, n = 12), a liver allograft group (A group: DA → Lewis, n = 12), and a sham-operated group (group C: Lewis rats, n = 12). Modified "two-cuff technique" was used to perform rat orthotopic liver transplantation. Survival rates at 1 and 2 wk were computed. Histological changes of graft and the changes of CD4+/CD8+ T-lymphocyte subsets in peripheral blood after transplantation were examined by HE staining and flow cytometry, respectively.
RESULTS: One-week survival rates in group I and group A were 100% and 41.7%, respectively. Two-week survival rates were 75% and 8.3%, respectively (P < 0.05). Group A showed severe acute graft rejection 7 d after transplantation, but this did not occur in group I. The percentage of CD4+ T cells was significantly higher in group A than in group I and group C (P < 0.05). The percentage of CD8+ T cells was significantly lower in group I than in group A (P < 0.05). The ratio of CD4+/CD8+ T cells was significantly higher in group A than in group I and group C (P < 0.05). Serum levels of interferon-γ (IFN-γ) were markedly increased in group A, but decreased in groups I and C, while interleukin-10 (IL-10) showed an opposite trend.
CONCLUSION: The changes of CD4+/CD8+ T-lymphocyte subsets in peripheral blood are closely related to rejection and tolerance after rat liver transplantation. CD4+ T cell proliferative activity and the ratio of CD4+/CD8+ T cells induce acute rejection, and CD8+ T cell reduction may be one of the mechanisms of immune tolerance.
- Citation: Lin YH, Jiang Y, Zhang BY, Li XF, Hong BZ, Wang W. Relationship between T-lymphocyte subsets in peripheral blood and acute rejection after liver transplantation in rats. Shijie Huaren Xiaohua Zazhi 2014; 22(32): 4948-4953
- URL: https://www.wjgnet.com/1009-3079/full/v22/i32/4948.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i32.4948
肝移植已成为终末期肝病及急性肝功能衰竭的有效治疗方法, 然而术后排斥反应仍然是影响受者生存的一大障碍[1], 因此早期识别移植肝排斥反应的发生显得尤为重要. 临床器官移植排斥反应本质上是由于供受体之间人类白细胞抗原(human leucocyte antigen, HLA)不相容, 从而引起依赖于T淋巴细胞的免疫反应[2]. 研究已表明, 不同的CD4+ T细胞亚群与肾脏移植后慢性排斥反应及长期保持移植肾功能正常关系密切[3]. T淋巴细胞在移植免疫过程中的作用, 是通过其不同亚群之间相互调节、相互制约实现的[4]. 因此, 在受体肝移植后免疫应答过程中, 外周血T淋巴细胞亚群及其分泌的各种细胞因子发生何种变化? 与排斥反应关系如何? 本研究旨在初步探明上述问题.
清洁级♂DA、Lewis大鼠, 8-10周龄, 体质量250-280 g, 受体体质量略大于供体; 购自上海斯莱克实验动物有限责任公司[合格证: SCXK(沪)2007-0005]. ELISA试剂盒[大鼠γ-干扰素(interferon-γ, IFN-γ)、白介素-10(interleukin-10, IL-10)](上海西唐生物科技有限公司); FITC anti-rat CD3(1F4, IgM)及Isotype、FITC anti-rat CD8a(OX8, IgG1)及Isotype、FITC anti-rat CD4(OX38, IgG2a)及Isotype(Biolegend); Ficoll、Percoll淋巴细胞分离液(Pharmacia); 噻唑篮(Amersco); RMPI 1640(GIBCO). COULTER EPICS XL型流式细胞仪(Beckman Coulter, USA); BIO-RAD伯乐酶标仪(Bio-Rad Laboratories, USA). FLOW-COUNT荧光微球(Beckman Coulter, USA).
1.2.1 模型的建立: Lewis或DA大鼠作为供体, DA大鼠作为受体, 采用Kamada"二袖套法"[5], 并结合自身经验加以改良, 建立大鼠原位肝移植模型.
1.2.2 动物分组: 采用同期随机分配原则, DA、Lewis大鼠分别作为供受体, 分为3组, 每组12对大鼠, 即n = 12. 即同基因移植组I组(Isograft组: Lewis→Lewis), 异基因移植组A组(Allograft组: DA→Lewis), 以及假手术组(Control组, C组), C组仅打开腹腔后即缝合.
1.2.3 检测指标: 观察术后1、2 wk存活率, 移植肝组织学改变, 受体外周血CD4+/CD8+ T细胞亚群比例的变化, 以及外周血细胞因子IFN-γ、IL-10的表达情况. 移植肝组织病理学改变采用HE染色检测; 外周血CD4+/CD8+ T细胞亚群比例的变化采用流式细胞术检测; 细胞因子的检测采用ELISA法(参照试剂盒说明操作).
统计学处理 量化的统计数据以mean±SD表示, 采用SPSS11.0软件进行. 组间均数比较采用单因素方差分析, 率的比较采用χ2检验, P<0.05为差异有统计学意义.
I组和A组1 wk存活率分别是100.0%和41.7%, 2 wk存活率分别是75.0%和8.3%, 两者差异均有统计学意义(P<0.05).
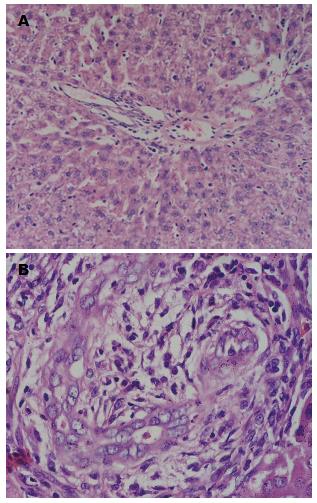
光镜显示术后7 d, A组移植肝均呈现严重急性排斥反应, 表现为: 大量炎性细胞浸润汇管区, 并蔓延至周边肝组织, 可见肝细胞变性、坏死; 移植肝胆管炎症显著, 内皮细胞坏死、崩解, 部分胆管消失; 中央静脉内皮下大量淋巴细胞浸润, 炎症累及邻近肝实质. 而I组移植肝未发现明显急性排斥反应改变(图1).
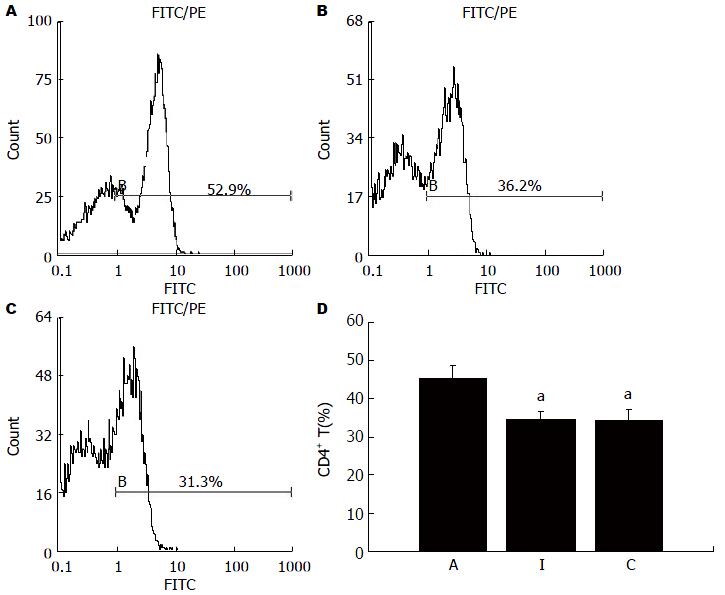
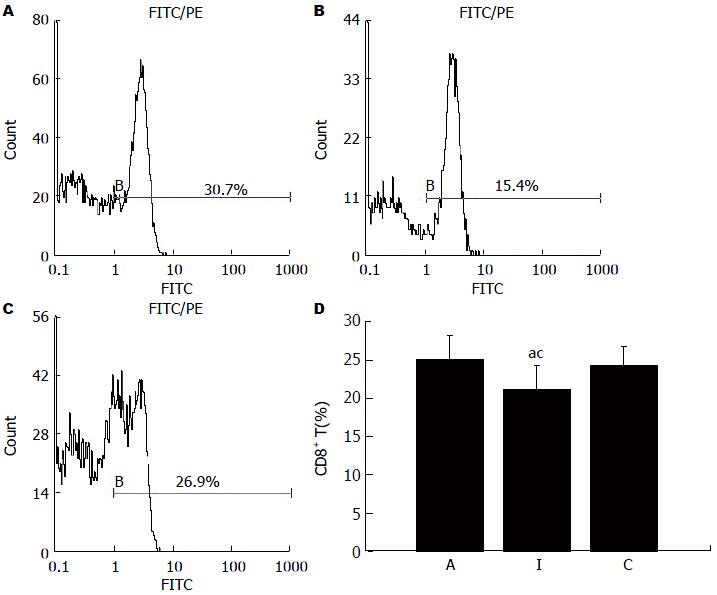
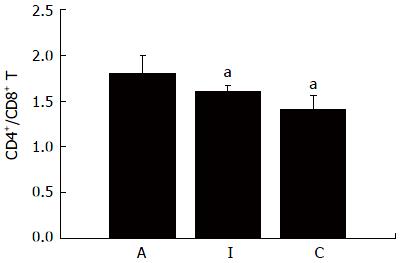
术后7 d流式细胞术检测结果显示: A、I、C组外周血CD4+ T细胞亚群分别为45.35%±3.13%、34.55%±2.09%和34.15%±2.89%, A组与I组比较差异有统计学意义(P<0.05)(图2). CD8+ T细胞亚群分别为25.10%±3.06%、21.10%±3.20%、24.30%±2.48%, I组与A组、C组比较差异均有统计学意义(P<0.05)(图3). CD4+/CD8+ T细胞分别为1.81±0.20、1.61±0.07、1.41±0.15, A组与I组比较差异有统计学意义(P<0.05), A组与C组比较差异有统计学意义(P<0.05)(图4). 提示同种异基因大鼠肝移植术后, CD4+ T细胞的比例随着排斥反应的加重而升高, CD8+ T细胞比例改变情况则相反, 两者比值升高.
术后7 d ELISA法检测结果显示: A、I、C组外周血IFN-γ分别为: 617.63 ng/mL±14.40 ng/mL、142.71 ng/mL±18.73 ng/mL、82.69 ng/mL±5.10 ng/mL, A组与I组比较差异有统计学意义(P<0.05); A、I、C组外周血IL-10分别为: 60.49 pg/mL±2.06 pg/mL、72.22 pg/mL±3.52 pg/mL、114.93 pg/mL±9.19 pg/mL, A组与I组比较差异有显著统计学意义(P<0.01). 提示在发生重度排斥反应时, 分泌IL-10的CD8+ T(Th2)细胞功能下降.
研究显示, 近交系大鼠肝移植模型是理想的大鼠肝移植急性排斥反应模型, 其具有排斥反应典型、稳定、可重复性好的特点, 排斥反应呈进行性加重, 一般发生于术后5-7 d[6,7]. 本研究采用近交系DA→Lewis大鼠建立同种异基因(A组)肝移植模型, 可产生稳定的移植肝急性排斥反应, 所有受体移植后7 d病理显示移植肝均呈重度排斥反应, 术后14 d大部分受体已死亡. 而同种同基因(I组)移植肝病理检测未发现明显急性排斥反应改变, 大部分受体术后14 d仍存活. 近交系大鼠之间, 具有不完全匹配的MHC基因, 其所编码的抗原不同, 供受体移植后, 供体内抗原激活受体内免疫系统, 诱导一系列免疫反应发生, 包括T细胞活化、增殖、分泌各种不同细胞因子, B细胞成熟并产生抗体, 单核吞噬细胞、树实状细胞等抗原递呈细胞的趋化、成熟、递呈抗原等, 从而促进急性排斥反应的发生[8].
T淋巴细胞介导的免疫反应是器官移植排斥反应的主要机制[2]. 研究表明, 机体内正常免疫应答维持的原因之一, 是通过T淋巴细胞亚群比例之间保持动态平衡来实现的. 不同亚群T细胞占外周血T淋巴细胞总数的比例是相对稳定的: CD4+ T淋巴细胞约占外周血CD3+ T淋巴细胞总数的65%, CD8+ T淋巴细胞约占35%; 正常状态下, 二者之间的比值介于1.7-2.0之间, 比值下降时常提示机体的免疫功能受损或缺陷[9,10]. 研究发现, 器官移植免疫排斥反应过程中, CD4+/CD8+ T比值上升与急性排斥反应有关; 二者比值下降可能是诱导免疫耐受发生的原因之一[11,12]. 本研究结果显示, 术后7 d, 异基因移植组(A组)CD4+ T细胞比例最高, 同基因移植组(I组)与对照组(C组)差别不大; A组CD4+ T细胞与CD8+ T细胞比值最大, 发生重度排斥反应, 两者一致. T细胞还通过分泌不同的细胞因子来发挥其免疫调节作用. 主要有两类细胞Th1(CD4+)和Th2(CD8+). 由Th1细胞分泌的细胞因子主要包括IL-2、IFN-γ、肿瘤坏死因子β, 参与细胞免疫的发生发展; 由Th2细胞分泌的细胞因子主要包括IL-4、5、6、10、13, 参与B淋巴细胞的激活过程, 介导体液免疫. Th1细胞和Th2细胞通过分泌不同细胞因子在T细胞的增殖过程中相互抑制: 其中, IFN-γ可抑制Th2细胞的分化和功能, IL-10可抑制Th1细胞的分化和功能, 从而在维持机体T细胞比例稳定过程中发挥一定作用[13-15]. 本研究结果显示, 术后7 d, 异基因移植组(A组)IFN-γ水平最高、IL-10水平最低, 同基因移植组(I组)与对照组(C组)差别不大, 说明排斥反应发生时, Th1细胞分化活跃, 证实了Th1细胞在排斥反应中的作用. 应该说明的是, 随着分子生物学技术的发展, 越来越多的特殊类型的T细胞亚型被发现在器官移植免疫过程中发挥着重要作用. 如浦立勇等[16]研究发现, CD4+CD25+调节性T细胞可以明显减轻大鼠肝脏移植的急性排斥反应, 延长生存期. 体内尚有其他免疫细胞参与分泌各种活性细胞因子. 这些都值得我们更广泛深入的研究. 然而, 目前临床上CD4+与CD8+ T细胞的检测技术无疑是最成熟而简便易行的.
总之, 移植肝急性排斥反应发生时, CD4+ T细胞增生活跃, 并通过分泌IFN-γ, 抑制CD8+ T细胞的分化及分泌功能, 从而导致CD4+/CD8+ T细胞比值升高; 而CD8+ T细胞分化减少可能是诱导免疫耐受发生的机制之一. 临床实践中, 检测患者外周血T细胞亚群的比例变化及由其主要分泌的细胞因子的改变, 可预测急性排斥的发生及程度, 并成为治疗的策略之一.
自1963年Starzl教授成功施行第一例人类肝脏移植以来, 肝移植已成为终末期肝病及急性肝功能衰竭的有效治疗手段. 然而, 术后排斥反应仍然是影响受体生存的一大障碍. 同种异体移植排斥反应本质上是对白细胞抗原不相容而引起的依赖于以T淋巴细胞为主的免疫反应. T细胞可分为多个亚型, 分泌不同细胞因子, 在免疫反应过程中发挥不同作用. 因此, 检测肝移植受体外周血T淋巴细胞亚群及其分泌的细胞因子水平的变化, 可以监测移植后排斥反应的发生.
吕凌, 副教授, 江苏省人民医院肝脏外科
诱导器官移植术后受体产生免疫耐受, 是当前移植医学研究的热点. 肝脏作为"免疫特惠器官", 诱导免疫耐受更易实现. T淋巴细胞亚群动态平衡与器官移植排斥反应关系密切, 寻求调节受体体内T淋巴细胞亚群向有利于产生免疫耐受方向分化的有效方法或分子生物学技术是当前亟待解决的问题.
研究表明, 骨髓移植中, 受体CD4+/CD8+ T比值上升预示急性排斥反应的发生; 二者比值下降可能是诱导免疫耐受发生的原因之一. 国内学者建立自发大鼠肝移植自发耐受模型, 监测受体外周血T细胞亚群变化, 亦观察到相似结果.
本研究采用近交系大鼠DA、Lewis建立肝移植模型, 排斥反应典型、稳定、可重复性好, 采用的模型更加接近肝移植排斥反应的真实情况. 应用流式细胞技术、ELISA法, 监测T细胞亚群的比例, 同时监测以其为主要分泌来源的细胞因子的变化, 结合其病理表现, 研究方法多样, 结果更加有说服力.
近交系大鼠DA、Lewis肝移植模型可作为肝移植急性排斥反应经典的动物模型, 可以广泛应用. 检测受体外周血T细胞亚群的比例变化及其分泌的细胞因子的改变作为预测急性排斥反应发生的指标时, 应与病理结合, 排除肝脏缺血再灌注损伤对结果的干扰.
本文选题有一定的价值, 设计合理, 研究结果较为丰富, 结论可靠.
编辑: 韦元涛 电编:闫晋利
| 1. | Bilezikçi B, Demirhan B, Kocbiyik A, Arat Z, Haberal M. Relevant histopathologic findings that distinguish acute cellular rejection from cholangitis in hepatic allograft biopsy specimens. Transplant Proc. 2008;40:248-250. [PubMed] [DOI] |
| 2. | Adams D. Mechanisms of liver allograft rejection in man. Clin Sci (Lond). 1990;78:343-350. [PubMed] |
| 3. | Giaretta F, Bussolino S, Beltramo S, Fop F, Rossetti M, Messina M, Cantaluppi V, Ranghino A, Basso E, Camussi G. Different regulatory and cytotoxic CD4+ T lymphocyte profiles in renal transplants with antibody-mediated chronic rejection or long-term good graft function. Transpl Immunol. 2013;28:48-56. [PubMed] [DOI] |
| 4. | Wang YL, Tang ZQ, Gao W, Jiang Y, Zhang XH, Peng L. Influence of Th1, Th2, and Th3 cytokines during the early phase after liver transplantation. Transplant Proc. 2003;35:3024-3025. [PubMed] [DOI] |
| 5. | Kamada N, Calne RY. A surgical experience with five hundred thirty liver transplants in the rat. Surgery. 1983;93:64-69. [PubMed] |
| 7. | Cordoba SP, Wang C, Williams R, Li J, Smit L, Sharland A, Allen R, McCaughan G, Bishop A. Gene array analysis of a rat model of liver transplant tolerance identifies increased complement C3 and the STAT-1/IRF-1 pathway during tolerance induction. Liver Transpl. 2006;12:636-643. [PubMed] [DOI] |
| 8. | Gerlach UA, Vogt K, Schlickeiser S, Meisel C, Streitz M, Kunkel D, Appelt C, Ahrlich S, Lachmann N, Neuhaus P. Elevation of CD4+ differentiated memory T cells is associated with acute cellular and antibody-mediated rejection after liver transplantation. Transplantation. 2013;95:1512-1520. [PubMed] [DOI] |
| 9. | Ji SM, Li LS, Sun QQ, Chen JS, Sha GZ, Liu ZH. Immunoregulation of thymosin alpha 1 treatment of cytomegalovirus infection accompanied with acute respiratory distress syndrome after renal transplantation. Transplant Proc. 2007;39:115-119. [PubMed] [DOI] |
| 11. | Bradley JA, Bolton EM, Pettigrew G. Monitoring T cell alloreactivity after organ transplantation. Clin Exp Immunol. 2005;142:229-232. [PubMed] [DOI] |
| 13. | Minguela A, Torío A, Marín L, Sánchez-Bueno F, García-Alonso AM, Ontañón J, Parrilla P, Alvarez-López MR. Implication of Th1, Th2, and Th3 cytokines in liver graft acceptance. Transplant Proc. 1999;31:519-520. [PubMed] [DOI] |
| 14. | Yang JS, Xu LY, Xiao BG, Hedlund G, Link H. Laquinimod (ABR-215062) suppresses the development of experimental autoimmune encephalomyelitis, modulates the Th1/Th2 balance and induces the Th3 cytokine TGF-beta in Lewis rats. J Neuroimmunol. 2004;156:3-9. [PubMed] [DOI] |
| 15. | Li B, Tian L, Diao Y, Li X, Zhao L, Wang X. Exogenous IL-10 induces corneal transplantation immune tolerance by a mechanism associated with the altered Th1/Th2 cytokine ratio and the increased expression of TGF-β. Mol Med Rep. 2014;9:2245-2250. [PubMed] [DOI] |