修回日期: 2014-09-09
接受日期: 2014-09-17
在线出版日期: 2014-11-08
目的: 探讨EphB2及其配体EphrinB2在锯齿状息肉癌变过程中的作用.
方法: 应用免疫组织化学方法检测受体EphB2及其配体EphrinB2在72例结直肠癌(colorectal cancer, CRC)组织, 64例锯齿状息肉和33例正常结肠组织中的表达.
结果: EphB2受体和EphrinB2配体蛋白阳性表达均主要位于胞膜和胞质中. EphB2阳性表达部位主要位于隐窝基底部和中下2/3区域; 绝大多数正常结肠黏膜中EphB2表达阳性, 其在CRC组织中表达水平低于在锯齿状息肉及正常结肠组织; EphrinB2阳性表达主要位于隐窝全层, 在锯齿状息肉和CRC中的表达呈递增趋势, 在正常黏膜组织中的表达阳性率低于在CRC组织和锯齿状息肉中的表达.
结论: EphB2在锯齿状息肉癌变过程中其抑制作用, 而其配体EphrinB2高水平表达可能促进锯齿状息肉的恶变及肿瘤的发生.
核心提示: 本文研究了EphB2和EphrinB2在正常肠黏膜, 传统锯齿状息肉, 增生性息肉、无蒂锯齿状腺瘤和结直肠癌的表达差异, 提示EphB2及其配体EphrinB2在锯齿状息肉的恶变及肿瘤的发生中可能起到不同甚至相反的作用.
引文著录: 刘成霞, 刘海燕, 李学峰, 牛琼, 贾兴芳. 锯齿状息肉癌变途径中EphB2及EphrinB2的表达及作用. 世界华人消化杂志 2014; 22(31): 4872-4877
Revised: September 9, 2014
Accepted: September 17, 2014
Published online: November 8, 2014
AIM: To explore the role of EphB2 and its ligand EphrinB2 in colorectal tumorigenesis.
METHODS: The expression of EphB2 and EphrinB2 in 72 colorectal cancer, 64 serrated polyp and 33 normal colon tissues was detected by immunohistochemistry.
RESULTS: The area of EphB2 positive signal was located in the crypt base and the lower 2/3 region, while the positive area of EphrinB2 was mainly located throughout the crypt. EphB2 was expressed in the majority of normal colonic mucosa tissues, but showed a decreasing trend in serrated polyps and colorectal cancer. The positive rate of EphrinB2 in the normal mucosa was significantly lower than those in colorectal cancer and serrated polyps (P < 0.05). The expression rate of EphrinB2 in the normal colonic mucosa was significantly higher than those in serrated polyps and colorectal cancer (P < 0.05).
CONCLUSION: EphB2 may inhibit the occurrence of colorectal cancer. EphrinB2 may promote intestinal tumor growth.
- Citation: Liu CX, Liu HY, Li XF, Niu Q, Jia XF. Expression of EphB2/EphrinB2 in canceration of serrated polyps. Shijie Huaren Xiaohua Zazhi 2014; 22(31): 4872-4877
- URL: https://www.wjgnet.com/1009-3079/full/v22/i31/4872.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i31.4872
结直肠癌(colorectal cancer, CRC)是最常见的恶性肿瘤之一. 在对CRC分子生物学机制的深入研究中, 锯齿状途径, 即由锯齿状息肉演变为CRC的途径日益受到关注. 锯齿状息肉是一组具有特殊锯齿状结构和分子遗传学特征的病变, 包括增生性息肉(hyperplastic polyps, HP)、传统锯齿状腺瘤(traditional serrated adenoma, TSA)和无蒂锯齿状腺瘤(sessile serrated adenoma, SSA), 具有较高的恶变潜能. 而EphB2受体作为酪氨酸蛋白激酶受体家族成员之一, 与其配体EphrinB2共同作用, 可调控结肠隐窝上皮细胞区室化、锯齿状结构和息肉的形成, 并在CRC等多种肿瘤中差异表达. 然而目前有关该受体及其配体与锯齿状息肉的相关性研究甚少. 本研究从参与细胞迁徙调控基因EphB2受体及其配体EphrinB2入手, 采用免疫组织化学技术检测检测锯齿状息肉癌变途经中该基因的表达, 以初步探讨其在锯齿状息肉癌变途径中的作用.
72例CRC、26例TSA、9例SSA、29例HP、33例正常结肠组织均为滨州医学院附属医院2006-05/2011-05经手术切除和电子结肠镜检出的病例的存档蜡块, 临床资料完整. 所有蜡块均3 μm连续切片, 每例样本组织切片4张, 其中3张做EphB2、EphrinB2基因蛋白免疫组织化学染色, 1张做空白对照. EphB2(AF467)由美国R&D公司进口分装. EphrinB2(H-83)和ABC Stanin System试剂盒(sc-2018、SC-2023)均由Santa Cruz Biotechnology进口分装.
1.2.1 免疫组织化学检测: 标本组织3 μm连续切片后, 脱蜡水化, PBS洗5 min×3次; 3%H2O2滴加在切片上, 室温静置10 min; PBS洗5 min×3次; 柠檬酸盐缓冲液高压热修复; PBS洗5 min×3次; 滴加正常血清封闭液, 室温20 min, 甩去多余液体; 滴加一抗EphrinB2(稀释浓度1:100), EphB2抗体浓度为3 μg/mL, 4 ℃过夜; 4 ℃过夜后37 ℃复温45 min, PBS洗5 min×3次, 滴加二抗, 37 ℃孵育1 h; PBS洗5 min×3次; 滴加AB酶孵育30 min; DAB显色; 自来水冲洗10 min; 苏木精复染2 min, 盐酸酒精分化; 自来水冲洗10-15 min; 脱水、透明、封片、观察.
1.2.2 结果判读: 随机选取10个视野, 将染色强度按以下标准分4个等级: 阴性"-"表示未见染色以及轻微模糊染色或染色的阳性细胞数<25%; 弱阳性"+"级表示轻度染色或染色的阳性细胞数25%-49%; 阳性"++"级表示中度染色或染色阳性的细胞数50%-74%; 强阳性"+++"级表示重度染色或染色阳性的细胞数≥75%.
统计学处理 用SPSS13.0软件, 免疫组织化学结果进行χ2检验, 以P<0.05为差异具有统计学意义.
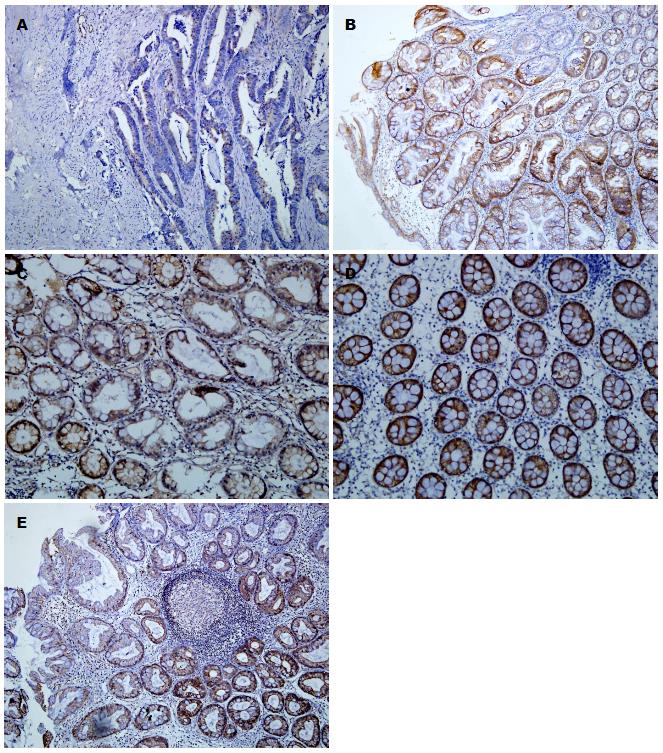
EphB2在几乎所有正常结肠黏膜中表达, 阳性表达部位主要位于隐窝基底部细胞膜上; CRC组织中, EphB2主要表达于胞膜和胞质中. HP、SSA和TSA组织中, EphB2主要表达于隐窝基底部和隐窝中下2/3, 并且锯齿状结构内EphB2的表达阳性强度大于非锯齿状结构(图1). EphB2在正常结肠黏膜、HP、SSA、TSA、CRC组织中的表达阳性率分别为: 90.9%(30/33), 72.4%(21/29), 55.6%(5/9), 80.8%(21/26), 56.9%(41/72). TSA中EphB2的表达与HP相近(χ2 = 0.53, P = 0.467>0.05), 并略低于正常结直肠组织(χ2 = 1.276, P = 0.259>0.250), 明显高于CRC(χ2 = 4.665, P = 0.031<0.05), 差异有统计学意义; SSA中EphB2的表达与CRC相近(χ2 = 0.006, P = 0.937>0.05), 低于与正常组织(χ2 = 6.364, P = 0.012<0.05), CRC组织中EphB2的表达低于正常结直肠组织, 差异有统计学意义(χ2 = 11.922, P = 0.001<0.005)(表1).
| 分组 | n | EphB2表达 | EphrinB2表达 | ||
| 阳性 | 阴性 | 阳性 | 阴性 | ||
| CRC | 72 | 41 | 31 | 50 | 22 |
| TSA | 26 | 21 | 5 | 24 | 2 |
| SSA | 9 | 5 | 4 | 1 | 8 |
| HP | 29 | 21 | 8 | 19 | 10 |
| 正常结肠 | 33 | 30 | 3 | 13 | 20 |
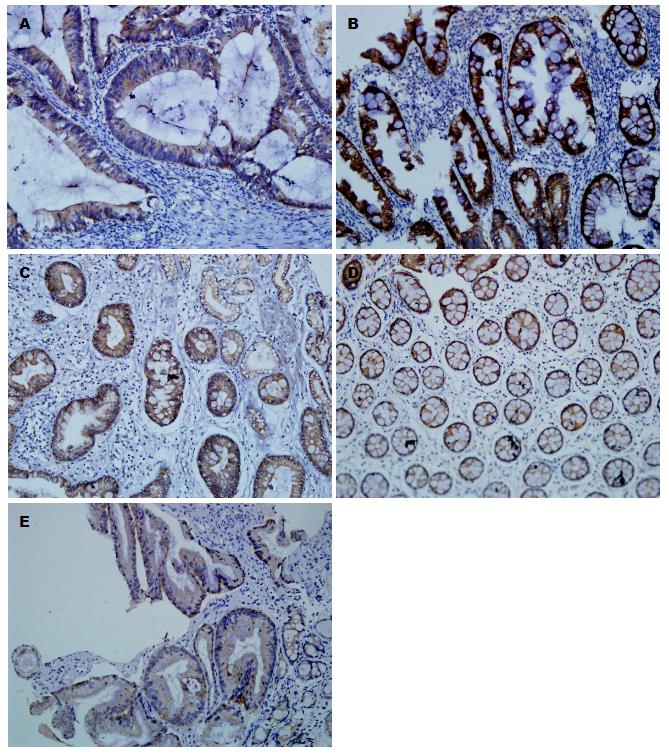
EphrinB2在大多数CRC组织中表达, 主要表达在胞膜和胞质中, 表现为棕黄色颗粒. 在HP、SSA和TSA中, 其表达部位位于隐窝全层, 并且锯齿状结构中EphrinB2的阳性表达强度大于非锯齿状结构(图2). EphrinB2在正常结直肠组织、HP、SSA、TSA和CRC中表达阳性率分别为: 39.4%(13/33)、65.5%(19/29)、11.1%(1/9)、92.3%(24/26)、69.4%(50/72). 正常结肠组织中EphrinB2的表达低于CRC组织, 差异有统计学意义(χ2 = 8.514, P = 0.004<0.005); HP中EphrinB2的表达阳性率大于正常结肠组织(χ2 = 4.218, P = 0.040<0.05), 小于TSA组织, 与CRC中的表达相近; 大多数TSA中EphrinB2表达强阳性, 并且其表达水平高于正常结肠组织(χ2 = 17.412, P = 0.000<0.005)和CRC(χ2 = 5.400, P = 0.020<0.025). EphrinB2在SSA中的表达明显低于TSA(χ2 = 21.598, P = 0.000<0.001), 并且低于CRC组织(χ2 = 11.674, P = 0.001<0.005)及HP(χ2 = 8.155, P = 0.004<0.005), 略低于正常结肠黏膜(χ2 = 2.545, P = 0.111>0.05). 与正常结肠组织、癌组织相比较, EphrinB2在TSA中显著的强阳性表达, 提示其在正常结肠组织-HP-TSA-CRC演变过程中出现暂时性的高水平(表1).
传统的观念认为CRC均起源于腺瘤样结肠息肉易感基因(adenomatous polyposis coil, APC)突变诱发的传统的"腺瘤-癌"途径. 然而随着对CRC分子机制的深入研究, "锯齿状途径"受到研究者的广泛关注. 有研究显示由锯齿状途径导致CpG岛甲基化表型CRC约占所有CRC的35%[1]. 2011年世界卫生组织(World Health Organization, WHO)出版的第4版蓝皮书中, 将HP、TSA和SSA归类于锯齿状息肉[2]. 隐窝上皮"锯齿状"内折是所有锯齿状息肉的标志性特征. 锯齿状息肉由几种形态特征相似的特殊亚型组成, 研究推测锯齿状息肉的亚型可能是呈连续型发展的多种恶变潜能的病变, 也可能其不同亚型有不同的癌变分子途径. 这些病变发展为CRC的途径构成了所谓的"锯齿状途径"[3]. 这一途径的提出, 推翻了以往将锯齿状病变归类于增生或者化生息肉, 并且认为其无恶变潜能的观点. 近年来对锯齿状息肉癌变途径及其分子生物学机制的研究日益被重视.
EphB2为酪氨酸蛋白激酶受体家族成员之一, 与相应的配体EphrinB2结合介导双向信号转导, 在肿瘤发生发展过程中起重要的作用[4]. EphB-EphrinB之间相互作用可引起EphB表达细胞和EphrinB表达细胞的收缩、分离, 也可引起对应细胞间的黏附和聚集. 调节细胞间相互作用的主要的调节器是EphB和EphrinB表达细胞的聚集程度、活化和磷酸化作用[5]. 肠道是研究肿瘤的发生和发展中Eph受体对细胞增殖和迁移影响作用的较合适的系统. 肠道干细胞存在于隐窝基底部, 并随细胞周期的变化而变化. EphB通过非依赖EphB激酶活性的级联信号(通过PI3激酶介导)调节肠道细胞迁移[6]. 研究[7]显示, EphB受体和EphrinB的配体在肠上皮细胞呈反梯度表达. 在小鼠实验中, 通过对EphB2和EphB3受体基因的消融或应用拮抗剂, 破坏这些梯度, 可导致细胞沿着隐窝鞭毛轴定位紊乱以及祖细胞增殖减少超过50%. Genander等[8]应用低聚寡核苷酸微点阵数据和定量RT-PCR研究, 认为EphB2在CRC形成过程中起正向调节作用. Genander等[9]通过检测EphB2在正常肠黏膜隐窝干细胞、腺瘤、CRC、CRC淋巴结转移细胞中表达, 结果显示EphB2在肿瘤发展过程中的表达呈递减趋势; 并且通过沉默小鼠结直肠肿瘤模型中EphB2基因的研究, 发现EphB2缺失可促进肿瘤的形成. EphrinB2作为EphB2受体的配体, 是新近发现的一种血管内皮生长因子. Snover等[10]通过将EphrinB2转染到KM12L4结肠癌细胞株并构建小鼠肿瘤模型的研究, 推测EphrinB2在CRC细胞中的过表达可以抑制肿瘤细胞的生长和肿瘤血管的功能. EphB2及EphrinB2为Wnt信号途径的靶基因. Wnt信号途径被APC突变激活后, 可促使细胞核内辅激活物β-catenin磷酸化, 结合转录因子TCF/LEF, β-catenin/Tcf控制上皮细胞沿着隐窝轴区室化并调节细胞有序迁移[11]. 甚至在CRC癌前病变(隐窝异型增生)中发现Wnt信号通路突变激活[12]. 在小鼠研究中, Wnt信号通路激活可导致异型增生隐窝的形成, 并且促使良性腺瘤恶变[13]. 由此推测EphB2及其配体参与肠道上皮具有增殖能力细胞的准确定位及肠道上皮细胞的区室化和迁移. 而作为具有相似"锯齿状"形态学特征的具有高度恶变潜能的锯齿状息肉, EphB2及其配体在其隐窝锯齿状结构的形成及细胞异常迁移定位过程中可能起到很大作用. 然而目前还没有足够的证据表明其参与了锯齿状结构的形成以及锯齿状息肉的癌变过程.
本项研究通过免疫组织化学技术对正常结肠组织、锯齿状息肉各亚型、CRC中EphB2蛋白表达情况进行检测, 发现大部分正常结肠黏膜隐窝的基底部均表达EphB2受体; 锯齿状息肉中, EphB2主要表达于隐窝基底部和隐窝中下2/3, 并且锯齿状结构内EphB2的表达阳性强度大于非锯齿状结构. EphB2在CRC组织中的表达水平低于正常结直肠组织, 在TSA中EphB2的表达低于正常结直肠组织, 高于CRC, SAA中EphB2表达低于正常结肠组织; HP中EphB2的表达低于TSA, 高于CRC. 即EphB2在正常结肠组织、锯齿状息肉、CRC中的表达基本呈递减趋势. 高水平EphrinB2配体表达可能促进肠道肿瘤的发生. 大多数TSA中EphrinB2表达强阳性, 并且其表达水平高于正常结肠组织和CRC; HP中的表达少于TSA组织, 与CRC中的表达相近, EphrinB2在SSA中的表达明显低于TSA, 并且低于CRC组织, 即EphrinB2在正常结肠组织演变为CRC的过程中出现暂时性的高水平. 目前对于其一过性高水平表达的机制仍不清楚. Yachida等[14]通过免疫组织化学技术和基因测序研究证实在锯齿状息肉中Wnt信号传导通路被激活, 我们初步推测, 结直肠黏膜锯齿状结构的形成与Wnt信号途径有关, 在Wnt信号调节结肠黏膜隐窝细胞增殖、分化和迁移过程中, Wnt信号的活化导致其靶基因EphrinB2表达增高. 我们研究显示EphB2受体与其配体EphrinB2在锯齿状息肉癌变中差异表达, 由此推测两者可能起到不相同甚至相反的作用, 这可能与EphB受体和EphrinB的配体在肠上皮细胞呈反梯度表达的特征有关. 在小鼠实验中, 通过对EphB2受体基因消融或应用拮抗剂, 破坏这些梯度, 可导致细胞沿着隐窝鞭毛轴定位紊乱以及祖细胞增殖减少超过50%[15]. 肿瘤细胞EphB2表达缺失, 导致其不能感应配体EphrinB2, 而因此获得侵袭周围组织的能力.
锯齿状息肉癌变途径的分子机制研究甚少, 而EphB2及其配体EphrinB2在这一途径中的作用仍不明确. 我们应用免疫组织化学方法检测EphB2及其配体EphrinB2在锯齿状息肉、CRC和正常结肠黏膜组织中的表达水平, 首例初步探讨了其在CRC发生的"锯齿状途径"中的作用. 而针对锯齿状息肉癌变途径的研究将有助于提高临床和病理医师的诊断意识与诊疗水平, 对于CRC的临床诊治具有实质性的指导意义.
结直肠癌(col-orectal cancer, CRC)是最常见的恶性肿瘤之一, 在对其分子生物学机制研究过程中, 一种新的癌变途径"锯齿状途径"逐渐受到广泛关注. 锯齿状息肉为此途径中的癌前病变, 其标志性特征为隐窝上皮锯齿状内折, 具有高度的恶变潜能. EphB2受体及其配体EphrinB2可介导隐窝上皮细胞增殖、迁移及分化, 在锯齿状息肉的形成及恶变过程中可能起重要作用. 研究EphB及其配体在锯齿状途径中的作用具有重要的临床意义.
万军, 教授, 中国人民解放军总医院南楼老年消化科
锯齿状息肉癌变途径为新近发现的CRC癌变途径, 针对其癌前病变的组织形态学研究已经有一定的进展, 然而对锯齿状息肉发生、癌变过程中分子生物学机制的研究目前仍甚少.
Solanas等通过检测EphB2在正常肠黏膜隐窝干细胞、腺瘤、CRC、中表达, 结果显示EphB2在肿瘤发展过程中的表达呈递减趋势; 并且通过沉默小鼠结直肠肿瘤模型中EphB2基因的研究, 发现EphB2缺失可促进肿瘤的形成.
本文应用免疫组织化学技术, 首次研究了锯齿状息肉癌变途径中EphB2及其配体EphrinB2的表达及作用, 为CRC锯齿状途径分子机制的研究提供理论依据.
对EphB2及其配体在锯齿状息肉途径中表达的检测, 有助于对锯齿状息肉癌变分子机制进一步研究.
本文立题较新颖, 研究方法正确, 有助于进一步深入认识锯齿状息肉癌变的分子机制.
编辑: 郭鹏 电编:都珍珍
| 1. | Jass JR. Classification of colorectal cancer based on correlation of clinical, morphological and molecular features. Histopathology. 2007;50:113-130. [PubMed] [DOI] |
| 2. | Aust DE. [WHO classification 2010 for the lower gastrointestinal tract: what is new?]. Pathologe. 2011;32 Suppl 2:326-331. [PubMed] |
| 3. | Sandmeier D, Benhattar J, Martin P, Bouzourene H. Serrated polyps of the large intestine: a molecular study comparing sessile serrated adenomas and hyperplastic polyps. Histopathology. 2009;55:206-213. [PubMed] [DOI] |
| 4. | Herath NI, Spanevello MD, Doecke JD, Smith FM, Pouponnot C, Boyd AW. Complex expression patterns of Eph receptor tyrosine kinases and their ephrin ligands in colorectal carcinogenesis. Eur J Cancer. 2012;48:753-762. [PubMed] [DOI] |
| 5. | Arain MA, Sawhney M, Sheikh S, Anway R, Thyagarajan B, Bond JH, Shaukat A. CIMP status of interval colon cancers: another piece to the puzzle. Am J Gastroenterol. 2010;105:1189-1195. [PubMed] |
| 6. | Chen G, Wang Y, Zhou M, Shi H, Yu Z, Zhu Y, Yu F. EphA1 receptor silencing by small interfering RNA has antiangiogenic and antitumor efficacy in hepatocellular carcinoma. Oncol Rep. 2010;23:563-570. [PubMed] [DOI] |
| 7. | Janes PW, Nievergall E, Lackmann M. Concepts and consequences of Eph receptor clustering. Semin Cell Dev Biol. 2012;23:43-50. [PubMed] |
| 8. | Genander M, Halford MM, Xu NJ, Eriksson M, Yu Z, Qiu Z, Martling A, Greicius G, Thakar S, Catchpole T. Dissociation of EphB2 signaling pathways mediating progenitor cell proliferation and tumor suppression. Cell. 2009;139:679-692. [PubMed] [DOI] |
| 9. | Genander M, Frisén J. Eph receptors tangled up in two: Independent control of cell positioning and proliferation. Cell Cycle. 2010;9:1865-1866. [PubMed] [DOI] |
| 10. | Snover DC. Update on the serrated pathway to colorectal carcinoma. Hum Pathol. 2011;42:1-10. [PubMed] |
| 11. | Rutkowski R, Mertens-Walker I, Lisle JE, Herington AC, Stephenson SA. Evidence for a dual function of EphB4 as tumor promoter and suppressor regulated by the absence or presence of the ephrin-B2 ligand. Int J Cancer. 2012;131:E614-E624. [PubMed] [DOI] |
| 12. | Sweetser S, Smyrk TC, Sugumar A. Serrated polyps: critical precursors to colorectal cancer. Expert Rev Gastroenterol Hepatol. 2011;5:627-635. [PubMed] [DOI] |
| 13. | Solanas G, Batlle E. Control of cell adhesion and compartmentalization in the intestinal epithelium. Exp Cell Res. 2011;317:2695-2701. [PubMed] |
| 14. | Yachida S, Mudali S, Martin SA, Montgomery EA, Iacobuzio-Donahue CA. Beta-catenin nuclear labeling is a common feature of sessile serrated adenomas and correlates with early neoplastic progression after BRAF activation. Am J Surg Pathol. 2009;33:1823-1832. [PubMed] [DOI] |
| 15. | Wybieralska E, Łaczna E, Madeja Z. [Role of ephrins in regulation of tumour cell migration]. Postepy Biochem. 2009;55:153-162. [PubMed] |