修回日期: 2014-06-06
接受日期: 2014-07-28
在线出版日期: 2014-10-28
目的: 探讨胃混合性癌组织中人表皮生长因子受体2(human epidermal growth factor receptor-2, HER2)蛋白表达的判读要点.
方法: 采用免疫组织化学(immunohistochemical, IHC)和荧光原位杂交(fluorescence in situ hybridization, FISH)技术对277例胃混合性癌进行HER2蛋白表达的检测.
结果: HER2蛋白表达阳性率41.5%(115/277), 其中HER2蛋白表达3+广泛型7例、部分型12例、局灶型4例, 占10.1%(28/277). HER2蛋白表达2+广泛型9例、部分型16例、局灶型6例, 占13.4%(37/277). HER2蛋白表达1+广泛型11例、部分型24例、局灶型7例, 占18.1%(50/277). 阴性162例, 占58.5%(162/277). HER2基因扩增率为40.9%(47/115), 其中HER2蛋白表达3+者中占89.3%(25/28)、HER2蛋白2+者占45.9%(17/37)和HER2蛋白1+者占10.0%(5/50). 47例HER2基因扩增阳性中除一例是胃混合性癌中的鳞状细胞癌区域扩增外, 其余46例均为混合性癌中的腺癌区域扩增.
结论: 胃混合性癌HER2检测有很大的异质性, 检测HER2蛋白阳性表达划分为广泛型、部分型和局灶型, 此种划分能更好地为靶向抗肿瘤药物治疗过程中受益提供量化的参考指标.
核心提示: 人表皮生长因子受体2(human epidermal growth factor receptor-2)蛋白阳性表达划分为将阳性肿瘤细胞≥80%为广泛型、79%-21%为部分型、≤20%为局灶型, 此划分能更好地为靶向抗肿瘤药物治疗过程中受益提供量化的参考指标.
引文著录: 李滢滢, 王苏南, 徐正顺, 王建军, 王仰坤. 胃混合性癌组织中HER2蛋白表达的判读要点. 世界华人消化杂志 2014; 22(30): 4627-4633
Revised: June 6, 2014
Accepted: July 28, 2014
Published online: October 28, 2014
AIM: To investigate the expression and amplification of human epidermal growth factor receptor-2 (HER2) in mixed-type gastric carcinoma.
METHODS: Immunohistochemistry (IHC) and fluorescence in situ hybridization (FISH) were used to detect the expression and amplification of HER2 in 277 cases of mixed-type gastric carcinoma, respectively.
RESULTS: The overall expression rate of HER2 protein was 41.5% (115/277). Strong HER2 protein expression (+++) accounted for 10.1% (28/277), including diffuse expression in 7 cases, partial expression in 12 cases, and focal expression in 4 cases. Moderate HER2 protein expression (++) accounted for 13.4% (37/277), including diffuse expression in 9 cases, partial expression in 16 cases, and focal expression in 6 cases. Weak HER2 protein expression (+) accounted for 18.1% (50/277), including diffuse expression in 11 cases, partial expression in 24 cases, and focal expression in 7 cases. Negative HER2 protein expression was noted in 162 cases, which accounted for 58.5% (162/277). The overall rate of HER2 gene amplification was 40.9% (47/115), including 89.3% (25/28) of cases with strong HER2 protein expression, 45.9% (17/37) of cases with moderate HER2 protein expression and 10% (5/50) of cases with weak HER2 protein expression. Of the 47 cases with amplification of the HER2 gene, only one case occurred in the region of squamous cell carcinoma, and the remaining 46 cases occurred in the adenocarcinoma region.
CONCLUSION: HER2 expression has great heterogeneity in mixed-type gastric carcinoma, and the classification of positive HER2 protein expression into diffuse, partial and focal types can provide a better quantitative parameter for targeted therapy with anti-tumor drugs.
- Citation: Li YY, Wang SN, Xu ZS, Wang JJ, Wang YK. Expression and amplification of HER2 in mixed-type gastric carcinoma. Shijie Huaren Xiaohua Zazhi 2014; 22(30): 4627-4633
- URL: https://www.wjgnet.com/1009-3079/full/v22/i30/4627.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i30.4627
靶向治疗实属病理生理治疗, 也就是封闭肿瘤发展过程中的关键受体和纠正其病理过程. 由于这类药物具有靶向性和非细胞毒性的特点, 主要对肿瘤细胞起调节作用和稳定作用, 因此, 与细胞毒性药物有很大区别. 近年来, 针对信号转导、生长因子及其受体, 人们正在研发几种新型药物, 并且已取得了重要成果, 其表达的蛋白产物为人表皮生长因子受体2(human epidermal growth factor receptor-2, HER2), 后者的高表达可活化细胞信号转导系统, 导致细胞转化、增殖[1,2]. 乳腺癌中HER2是一种广泛采用的治疗靶点[3,4], 越来越多的证据表明, HER2也是胃癌的重要标志物, 高HER2表达的肿瘤患者最为受益[5-7]. 但胃癌表现出独特的免疫染色特性, 特别是胃混合性癌HER2表达阳性病例中有较高的肿瘤异质性[8], 胃及食管胃连接部的混合性癌中有混合性腺癌和非腺癌混合, 包括鳞癌、神经内分泌癌混合等. 因此, 规范胃癌HER2检测是正确指导用药的保证. 我们采用免疫组织化学(immunohistochemistry, IHC)技术检测胃混合性癌HER2蛋白表达水平、荧光原位杂交(fluoresce in situ hybridization, FISH)技术检测胃混合性癌HER2基因扩增状态, 探讨IHC和FISH技术检测胃混合性癌判读标准, 以便更好地为靶向抗肿瘤药物治疗过程中的受益提供量化的参考指标.
收集洛阳市第150中心医院于2010-05/2011-12外科手术切除的胃及食管胃连接部混合性癌根治标本277例, 组织学诊断标准按照文献胃肿瘤病理学[9]和世界卫生组织消化系肿瘤(World Health Organization digestive system tumors)胃癌组织学分类[10]. 本组年龄25-76岁(中位年龄64.7岁). 手术离体后标本均在30 min内固定, 经新鲜配置的40 g/L甲醛固定8-48 h, 固定液与组织体积比为10:1. 切取肿瘤组织4-6块(常规切取近端、远端切缘, 肿瘤及临近胃黏膜等处组织标本块不包括在内), 包括最深浸润点及最邻近浆膜层, 分别进行HE、IHC和FISH技术检测. 采用美国食品药品监督管理局(Food and Drug Administration, FDA)批准的HER2免疫组织化学染色试剂盒, 即HER2 HercepTestTM Kit和pharmDxTM Kit, 均购自Dako Cytomation公司. Paraffin Pretreatment Kit Ⅱ试剂盒(其中主要含有预处理溶液和蛋白酶溶液)和Path VysionTM HER2探针试剂盒, 均购自Vysis公司.
1.2.1 HE染色: 常规脱水, 石蜡包埋, 4 μm厚切片, HE染色, 光镜观察组织结构及细胞形态.
1.2.2 免疫组织化学染色: 采用SP法, 抗体及克隆号为: HER2(SP3). 即用型试剂盒和一抗均购自福州迈新生物技术开发有限公司. DAB显色, 苏木精衬染, 用TBS液代替第一抗体作阴性对照, 每次染色均设阴性及阳性对照. 染色阳性强度的结果判读: 每例分析4-6张切片, 若肿瘤细胞的细胞膜均无染色, 结果为0; 若肿瘤细胞微弱或隐约可见膜染色者, 结果为1+; 若肿瘤细胞的基底膜、侧面膜或完整性的膜有弱至中度染色者, 结果为2+; 肿瘤细胞的基底膜、侧面膜或完整性的膜有强阳性染色者, 结果为3+. 染色阳性面积的结果判读: 每例分析4-6张切片, 若肿瘤细胞的细胞膜均无着色为阴性, 若≥80%着色为广泛型、79%-21%着色为部分型、≤20%着色为局灶型.
1.2.3 FISH技术检测: 石蜡包埋胃癌组织切片的预处理程序及FISH操作步骤按照文献[11]及试剂盒说明书进行. FISH结果判断: 根据IHC检测切片的HER2阳性区域, 进行FISH技术检测. 首先在HE染色切片上确认癌细胞阳性区域, 然后在10×物镜下, 于FISH切片上找到HE的同一视野, 在40×物镜下观察整张切片, 75%以上癌细胞核中都有杂交信号视为结果满意, 然后换成100×物镜, 计数至少30个边界完整、孤立无重叠的癌细胞. HER2基因扩增评价标准: 随机计数30个癌细胞核中HER2基因拷贝数与17号染色体数量的比值, 若比值>2.2为阳性结果, 提示样本中扩增HER2基因, 若比值<1.8为阴性结果, 提示该样本无HER2基因扩增; 如果比值在1.8-2.2之间, 可选择其他肿瘤组织区域再进行30个肿瘤细胞计数以确定最后结果.
统计学处理 采用SPSS13.0统计软件分析, 应用t检验和χ2检验比较两组HER2基因状态患者的生存率. P<0.05为差异有统计学意义.
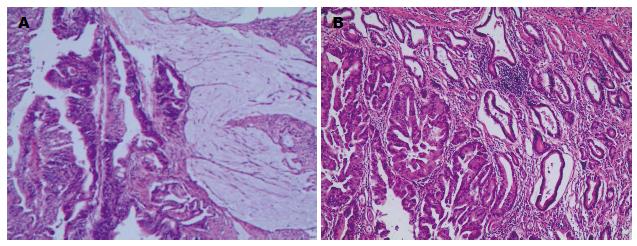
胃混合性腺癌216例, 包括乳头状腺癌、腺管状腺、黏液腺癌和低黏附性腺癌的不同组织学结构混合(图1); 腺鳞癌34例; 胃混合性腺癌-神经内分泌癌22例, 包括一种或一种以上的腺癌与神经内分泌肿瘤的混合; 胃混合性腺癌-鳞癌-神经内分泌癌5例. 均为pT2-4期.
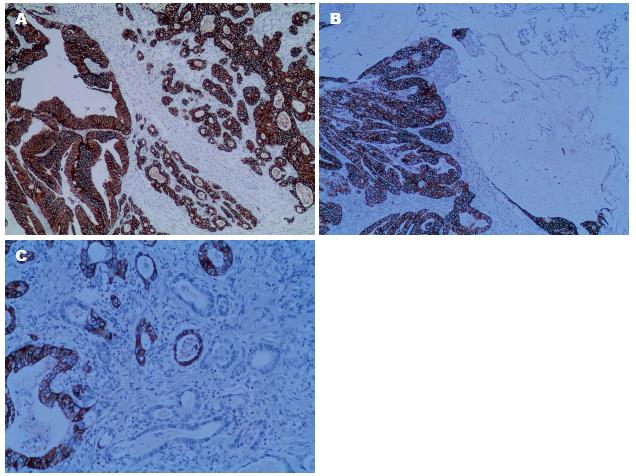
胃混合性癌HER2蛋白表达率与组织学类型的关系如表1. HER2蛋白阳性表达定位在细胞膜, 阳性表达率为41.5%(115/277), 其中HER2蛋白表达3+广泛型7例(图2A)、部分型12例(图2B)、局灶型(图2C)4例, 占10.1%(28/277); HER2蛋白表达2+广泛型9例、部分型16例、局灶型6例, 占13.4%(37/277); HER2蛋白表达1+广泛型11例、部分型24例、局灶型7例, 占18.1%(50/277). 阴性162例, 占58.5%(162/277).
| 类型 | n | IHC(n) | ||||
| - | 1+ | 2+ | 3+ | 阳性率[n(%)] | ||
| 混合性腺癌 | 216 | |||||
| ≥80% | 13 | 10 | 8 | 31(14.4) | ||
| 79%-21% | 21 | 15 | 14 | 50(23.1) | ||
| ≤20% | 7 | 5 | 3 | 15(6.9) | ||
| 阴性 | 120 | 120(55.6) | ||||
| 腺鳞癌 | 34 | |||||
| ≥80% | 0 | 1 | 0 | 1(2.9) | ||
| 79%-21% | 3 | 1 | 1 | 5(14.7) | ||
| ≤20% | 2 | 1 | 1 | 4(11.8) | ||
| 阴性 | 24 | 24(70.6) | ||||
| 混合性腺癌-神3/4内分泌癌 | 22 | |||||
| ≥80% | 0 | 0 | 0 | 0(0) | ||
| 79%-21% | 2 | 2 | 0 | 4(13.6) | ||
| ≤20% | 1 | 1 | 1 | 3(14.3) | ||
| 阴性 | 15 | 15(68.1) | ||||
| 混合性腺癌-鳞癌-神3/4内分泌癌 | 5 | |||||
| ≥80% | 0 | 0 | 0 | 0(0) | ||
| 79%-21% | 1 | 0 | 0 | 1(20.0) | ||
| ≤20% | 0 | 1 | 0 | 1(20.0) | ||
| 阴性 | 3 | 3(60.0) | ||||
| 合计[n(%)] | 277 | 162(58.5) | 50(18.1) | 37(13.4) | 28(10.1) | 115(41.5) |
胃混合性癌HER2蛋白表达的显著特点是异质性, 每例4-6张切片中若只有广泛型、部分型、局灶型和阴性的任何一种类型者, 称为单信号型, 本次研究中占36.5%(42/115); 每例分析4-6张切片中同时有广泛型、部分型、局灶型的一种或一种以上者, 称为多信号型, 本次研究占63.5%(73/115)(表2). 34例腺鳞癌中HER2蛋白表达阳性12例, 其中2例为鳞癌部分阳性, 其他均为腺癌部分阳性; 22例混合性腺癌-神经内分泌癌和5例混合性腺癌-鳞癌-神经内分泌癌中, HER2蛋白表达阳性区域均在腺癌部分.
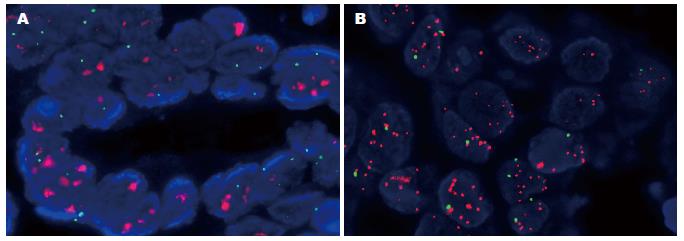
HER2基因扩增率为40.9%(47/115), 其中HER2蛋白表达3+者中占89.3%(25/28)、HER2蛋白2+者占45.9%(17/37)和HER2蛋白1+者占10.0%(5/50). 47例HER2基因扩增阳性中除1例是胃混合性癌中的鳞状细胞癌区域扩增外, 其余46例均为混合性癌中的腺癌区域扩增(图3).
近年来随着对肿瘤生物学研究的不断深入, 新的分子靶向治疗药物也不断出现. 与传统的细胞毒性药物不同, 他们在分子、生物化学和基因水平上选择性作用于癌细胞, 特异性阻断癌细胞膜上的异常途径, 而对正常细胞功能仅有轻微影响. 曲妥珠单抗(herceptin)是一种人鼠嵌合型单克隆抗体. 1998年美国FDA批准在HER2过表达的晚期乳腺癌患者中应用, 目前已经成为乳腺癌一线治疗药物[8,9]. HER2也是胃癌重要的生物标志物[12], 用herceptin对HER2蛋白过表达的进展期、复发/或转移性胃癌患者进行治疗, 生存率明显提高[10]. 我们采用IHC和FISH技术检测277例胃混合性癌, 发现HER2蛋白表达阳性率41.5%(115/277), 其中HER2蛋白表达3+广泛型7例、部分型12例、局灶型4例, 占10.1%(28/277). HER2蛋白表达2+广泛型9例、部分型16例、局灶型6例, 占13.4%(37/277). HER2蛋白表达1+广泛型11例、部分型24例、局灶型7例, 占18.1%(50/277). 阴性162例, 占58.5%(162/277). HER2基因扩增率为40.9%(47/115), 其中HER2蛋白表达3+者中占89.3%(25/28)、HER2蛋白2+者占45.9%(17/37)和HER2蛋白1+者占10.0%(5/50). 我们的研究结果同文献报道一致, HER2表达水平越高, 则越有可能从以HER2为靶点的抗肿瘤药物治疗过程中受益[13]. 但文献对胃癌HER2蛋白表达的判读标准确定>10%的肿瘤细胞为3+者视为受益, 然而, 在临床随访中发现5%的患者也是有效果的, 另外, >80%比10%的临床效果显著得多, 由此, 我们提出将HER2蛋白表达结果检测划分为广泛型、部分型和局灶型, 能更好地为靶向抗肿瘤药物治疗过程中的受益提供量化的参考指标. 每例4-6张切片中只有广泛型、部分型、局灶型的任何一种类型为单信号型; 每例4-6张切片中同时有广泛型、部分型、局灶型或两种以上者为多信号型. 这种单型号与多信号划分主要是区分出异质性的肿瘤, 但对靶向抗肿瘤药物治疗过程中的受益多信号有待更多病例的随访.
胃癌HER2检测与乳腺癌不同, 其检测结果受到诸多因素的影响, 包括标本的术前处理、固定、检测的试剂及方法、实验室的质量控制、染色结果的判读等[14]. 由于在临床病理工作中还存在相当数量检测结果的不确定性或不可重复性, 常导致胃癌临床治疗方面的困惑, 临床医师难以准确制订治疗方案而可能造成误治. 因此, 将HER2表达水平的检测结果详细而准确地告诉临床, 可使以HER2为靶点的抗肿瘤药物治疗过程受益[15]. 我们通过实践观察总结6方面的检测体会: (1)手术标本必须在离体30 min内固定于新鲜配置的40 g/L中性甲醛溶液, 同时记录肿瘤的大体类型, 大体照相并剪开; (2)固定液是组织的5倍, 时间固定24-36 h不超过48 h; (3)强调在胃癌组织的不同区域取材和组织块的数量, 除常规切取近端、远端切缘, 肿瘤及临近胃黏膜等处组织标本块之外, 至少切取肿瘤组织4-6块, 包括最深浸润点及邻近浆膜层, 分别进行IHC技术检测, 以防因胃癌的异质性而漏检; (4)试剂的厂商较多, 选择试剂时, 应采用美国FDA批准的HER2免疫组织化学染色试剂盒, 同时设立已知的HER2蛋白表达阳性3+、阳性2+、阳性1+和HER2蛋白表达阴性切片作对照; (5)混合性胃腺癌的判读, 显示乳头状、管样结构腺癌的癌细胞主要观察基底膜和侧面膜是否阳性; 非乳头和管状结构的实体巢状、低黏附性胃癌观察完整的细胞膜; (6)HER2蛋白表达的检测报告, 应详细写明HER2阳性表达的强度、面积分别所占百分比或写明HER2蛋白阳性表达3+广泛型、3+部分型和3+局灶型. 其意义在于文献报道的判读标准确定>10%的肿瘤细胞为3+者视为受益, 但实践证明>80%比仅占10%的阳性肿瘤细胞的效果显著的多, 所以, 将阳性肿瘤细胞≥80%为广泛型、79%-21%为部分型、≤20%为局灶型, 方便受益效果的观察.
FISH技术检测胃癌HER2基因扩增状态, 其特异性高于IHC方法, 并能提供定量数据, 能有效减少试验操作人员的主观印象干扰和实验室之间的变异[16]. 但FISH技术检测胃癌HER2基因扩增有很大的局限性, 尤其是胃混合性癌. 因此, 根据IHC检测HER2蛋白表达结果, 首先分析HER2蛋白表达阳性3+区域, 如果无扩增再对HER2蛋白表达2+或HER2蛋白表达1+的区域进行FISH检测. 同时强调, 即使IHC检测HER2蛋白表达阳性3+患者也要进行HER2基因检测, 我们发现HER2蛋白表达阳性3+广泛型仍有7.1%(2/28)的患者为基因扩增检测阴性. 计数至少30个肿瘤细胞核中HER2基因拷贝数与17号染色体数量的比值, 比值>2.2为阳性结果, 提示样本中存在HER2基因扩增; 若比值<1.8为阴性结果, 提示该样本无HER2基因扩增. 如果比值在1.8-2.2之间, 可选择其他肿瘤组织区域再进行30个肿瘤细胞计数以确定最后结果. 如果比值接近2.0, 但HER2基因为高拷贝数(即≥6个拷贝)也可视为HER2基因扩增阳性, 并且在检测报告中必须写明30个细胞中高拷贝数占多少个.
总之, 胃癌组织中HER2检测有很大的异质性, 尤其是胃混合性癌, HER2检测规范和细化是正确指导用药的保证. 在采用分子靶向治疗时每例胃标本切取肿瘤组织6-8块, 以防漏检; 同时, 强调HER2检测的强度和范围, 将HER2蛋白表达阳性划分为广泛型、部分型和局灶型, 能更好地为靶向抗肿瘤药物治疗过程中的受益提供量化的参考指标. HER2检测时, 即使是HER2蛋白表达阳性3+广泛型仍有7.1%(2/28)的患者无HER2基因扩增, 而HER2蛋白表达阳性1+中却有10.0%(5/50)的患者有HER2基因扩增. 因此, 在采用分子靶向治疗前, 进行HER2基因扩增的检测更为正确.
近年来, 随着对肿瘤生物学研究的不断深入, 新的分子靶向治疗药物也不断出现. 胃及食管胃连接部的混合性癌中有混合性腺癌和非腺癌混合, 包括鳞癌、神经内分泌癌混合等. 因此, 规范胃癌人表皮生长因子受体2(human epidermal growth factor receptor-2, HER2)检测是正确指导用药的保证.
陈国忠, 主任医师, 广西医科大学
以HER2为靶点的抗肿瘤作用成为各国医学研究的热点. HER2过表达常见于乳腺癌、胃癌HER2基因状态的研究近年来有较少的报道. 但如何更好地为靶向抗肿瘤药物治疗过程中受益提供量化的参考指标亟待研究的问题.
胃癌组织中HER2检测有很大的异质性, 尤其是胃混合性癌, HER2检测规范和细化是正确指导用药的保证. 在采用分子靶向治疗时每例胃标本切取肿瘤组织6-8块, 以防漏检.
其意义在于国内外文献把胃癌组织中HER2检测判读标准定为≤10%为阴性是不妥, 临床实践发现胃癌组织中HER2检测10%阳性细胞个体化治疗仍有意义, 所以, 将阳性肿瘤细胞≥80%为广泛型、79%-21%为部分型、≤20%为局灶型, 方便受益效果的观察.
HER2检测时, 即使是HER2蛋白表达阳性3+广泛型仍有7.1%(2/28)的患者无HER2基因扩增, 而HER2蛋白表达阳性1+中却有10.0%(5/50)的患者有HER2基因扩增. 因此, 在采用分子靶向治疗前, 进行HER2基因扩增的检测更为正确.
本研究通过免疫组织化学检测胃混合性癌HER2蛋白表达水平、荧光原位杂交技术检测胃混合性癌HER2基因扩增状态, 探讨IHC和FISH技术检测胃混合性癌判读标准, 以便更好地为靶向抗肿瘤药物治疗过程中的受益提供量化的参考指标, 有较好的科学意义和临床应用价值.
编辑: 郭鹏 电编:闫晋利
| 1. | García-García E, Gómez-Martín C, Angulo B, Conde E, Suárez-Gauthier A, Adrados M, Perna C, Rodríguez-Peralto JL, Hidalgo M, López-Ríos F. Hybridization for human epidermal growth factor receptor 2 testing in gastric carcinoma: a comparison of fluorescence in-situ hybridization with a novel fully automated dual-colour silver in-situ hybridization method. Histopathology. 2011;59:8-17. [PubMed] [DOI] |
| 2. | Isinger-Ekstrand A, Johansson J, Ohlsson M, Francis P, Staaf J, Jönsson M, Borg A, Nilbert M. Genetic profiles of gastroesophageal cancer: combined analysis using expression array and tiling array--comparative genomic hybridization. Cancer Genet Cytogenet. 2010;200:120-126. [PubMed] [DOI] |
| 3. | Rieck LD, Pottala JV, Eliason SL, Koch MR, Egland PG, Egland KA. Status of HER-2 gene amplification in breast cancers from Native American women. Cancer Genet Cytogenet. 2008;187:54-56. [PubMed] [DOI] |
| 4. | Gumuskaya B, Alper M, Hucumenoglu S, Altundag K, Uner A, Guler G. EGFR expression and gene copy number in triple-negative breast carcinoma. Cancer Genet Cytogenet. 2010;203:222-229. [PubMed] [DOI] |
| 5. | Berezowska S, Novotny A, Bauer K, Feuchtinger A, Slotta-Huspenina J, Becker K, Langer R, Walch A. Association between HSP90 and Her2 in gastric and gastroesophageal carcinomas. PLoS One. 2013;8:e69098. [PubMed] [DOI] |
| 8. | Gordon MA, Gundacker HM, Benedetti J, Macdonald JS, Baranda JC, Levin WJ, Blanke CD, Elatre W, Weng P, Zhou JY. Assessment of HER2 gene amplification in adenocarcinomas of the stomach or gastroesophageal junction in the INT-0116/SWOG9008 clinical trial. Ann Oncol. 2013;24:1754-1761. [PubMed] [DOI] |
| 11. | Yk W, Cf G, T Y, Z C, Xw Z, Xx L, Nl M, Wz Z. Assessment of ERBB2 and EGFR gene amplification and protein expression in gastric carcinoma by immunohistochemistry and fluorescence in situ hybridization. Mol Cytogenet. 2011;4:14. [PubMed] [DOI] |
| 12. | 王 仰坤, 高 春芳, 张 现伟, 贠 田, 李 富林, 赵 元珍, 赵 文召, 蒙 念龙. 利用FISH技术检测胃癌组织中HER2基因及其与p53蛋白表达的相关性. 临床与实验病理学杂志. 2011;27:126-129. |
| 14. | 王 仰坤, 高 春芳, 贠 田, 张 现伟, 赵 文召, 郑 国宝, 刘 广洛. HER2和EGFR基因在胃癌组织中的状态及其临床病理的关系. 世界华人消化杂志. 2010;18:2642-2647. |
| 15. | Brabender J, Danenberg KD, Metzger R, Schneider PM, Park J, Salonga D, Hölscher AH, Danenberg PV. Epidermal growth factor receptor and HER2-neu mRNA expression in non-small cell lung cancer Is correlated with survival. Clin Cancer Res. 2001;7:1850-1855. [PubMed] |
| 16. | Pala EE, Bayol U, Ozguzer A, Akman O. HER2 status in gastric cancer: a comparison of two novel in situ hybridization methods (IQ FISH and dual color SISH) and two immunohistochemistry methods (A0485 and HercepTest™). Pathol Res Pract. 2013;209:548-554. [PubMed] [DOI] |