修回日期: 2014-09-11
接受日期: 2014-09-17
在线出版日期: 2014-10-28
目的: 研究人参皂苷Rg1在体外和体内对结肠癌的增殖抑制作用, 并对其机制做初步探索.
方法: 体外比较正常结肠细胞与结肠癌细胞在添加不同浓度的人参皂苷Rg1以后细胞增殖情况差异, 并对细胞周期及相关蛋白进行检测; 对结肠癌模型小鼠灌胃给予人参皂苷Rg1, 检测小鼠结肠癌生长情况, 并对相关蛋白进行检测.
结果: 人参皂苷Rg1在体外能够特异性抑制肿瘤细胞增殖, 引起细胞周期改变, 在体内试验中也可以抑制肿瘤的生长, 且肿瘤生长相关蛋白表达降低.
结论: 人参皂苷Rg1能通过下调肿瘤细胞周期及增殖相关蛋白的表达从而有效的抑制结肠癌肿瘤的增殖与生长.
核心提示: 在使用药物Rg1分别处理结肠癌细胞SW480和正常结肠组织细胞CCD-18Co后发现, SW480结肠癌细胞的增殖明显受到抑制, 而正常结肠组织细胞CCD-18Co则不受影响, 进一步进行细胞周期分析发现, 受Rg1处理后, SW480细胞中处于G0/G1期的细胞增加, S期细胞减少, 说明Rg1可能通过周期抑制进而特异性抑制肿瘤细胞的增殖.
引文著录: 张龙江, 周二付. 人参皂苷Rg1对结肠癌肿瘤在体外和体内的增殖抑制作用. 世界华人消化杂志 2014; 22(30): 4599-4603
Revised: September 11, 2014
Accepted: September 17, 2014
Published online: October 28, 2014
AIM: To assess the inhibitory effects of ginsenoside Rg1 on colon cancer cell proliferation in vivo and in vitro, and to investigate the possible underlying mechanism.
METHODS: The proliferation of normal colon cells and colon cancer cells treated with different concentrations of ginsenoside Rg1 was assessed in vitro, and related protein expression was also detected. A mouse model of colon cancer was created, and model mice were given different concentrations of ginsenoside Rg1 by gavage administration. Tumor growth and related protein expression in tumor tissue were then measured.
RESULTS: Ginsenoside Rg1 could not only inhibit colon cancer cell proliferation and alter cell cycle progression in vitro, but also suppress tumor growth and decrease cancer growth related protein expression in vivo.
CONCLUSION: Ginsenoside Rg1 can inhibit colon cancer growth and proliferation effectively possibly by down-regulating the expression of cell cycle- and proliferation-related proteins.
- Citation: Zhang LJ, Zhou EF. In vitro and in vivo inhibitory effects of ginsenoside Rg1 on proliferation of colon cancer cells. Shijie Huaren Xiaohua Zazhi 2014; 22(30): 4599-4603
- URL: https://www.wjgnet.com/1009-3079/full/v22/i30/4599.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i30.4599
目前, 结肠癌已经成为威胁人类健康最重要的恶性肿瘤之一, 尽管以手术、放疗、化疗等为主的治疗方式近年来发展迅速, 但由于结肠癌患者常发生远处转移, 目前结肠癌患者的5年生存率只有15%左右. 而采用中药配合化疗方法可减轻由其引起的多种不良反应, 增加化疗药物的疗效, 而且还可以提高机体免疫力和癌能力, 改善生活质量, 不良反应小, 易被患者接受. 人参是我国一种传统的名贵中药材, 具有良好的保健作用. 目前, 学者研究发现无论是其初提物[1,2], 还是明确成分提取物[3-5], 在抑制肿瘤等方面都有显著效果. 其中人参的主要活性成分-人参皂苷Rg1具有抗氧化[6,7]、促进记忆[8-10]、增强免疫[11-13]多种生物活性, 近年来被证实可以抑制骨肉瘤细胞的发展[14], 可抑制人乳腺癌细胞的体外增殖过程[15], 而其对结肠损伤的保护作用也已经被发现[16], 但其对于结肠癌是否具有治疗作用目前还未见深入报道. 本研究选取人参皂苷的主要活性成分之一Rg1, 比较其对正常结肠细胞和结肠癌细胞抑制作用的差异, 并对其机制进行细胞水平研究. 通过建立结肠癌小鼠模型, 给予人参皂苷治疗, 观察人参皂苷对小鼠中肿瘤生长的影响, 并对肿瘤组织中相关蛋白的表达进行检测, 在动物水平进一步验证人参皂苷Rg1的抗肿瘤效果, 为人参皂苷Rg1最终作为药物应用于抗肿瘤治疗奠定基础.
实验动物C57BL/6小鼠60只, 雌雄各半, 6周龄, 购自中国医学科学研究院实验动物研究所; 人正常结肠组织细胞CCD-18Co、人结肠腺癌细胞SW480、小鼠Lewis结肠癌细胞ct26购自中科院上海细胞库; 人参皂苷Rg1购自上海研拓生物科技有限公司; RPMI 1640、DMEM培养基购自GIBCO; FBS购自Hyclone. RIPA裂解液购自碧云天; 血管内皮生长因子(vascular endothelial growth factor, VEGF)、增殖细胞核抗原(proliferating cell nuclear antigen, PCNA)、细胞周期素D1(Cyclin D1)一抗和兔二抗均购自Abcam.
1.2.1 人参皂苷Rg1对人结肠正常细胞和结肠癌细胞的增殖抑制作用: 人正常结肠组织细胞CCD-18Co, 人结肠癌细胞SW480皆培养于含10%FBS的RPMI 1640培养基中, 37 ℃、50 mL/L CO2浓度. 分别取以上两种对数生长期细胞, 分别以1×105 cells/mL接种于96孔板中, 向实验组细胞分别添加5、10、20、40、80 μg/mL的人参皂苷Rg1, 对照组添加无菌PBS. 加药继续培养48 h后, 换液处理, 每孔加入5 mg/mL MTT 20 μL, 37 ℃孵育4 h后吸去培养液, 每孔加入150 μL DMSO, 震荡混匀后置酶标仪(Thermo Fisher)上测定570 nm处吸光度(A)值. 生长抑制率 = 1-药物组A值/对照组A值.
1.2.2 人参皂苷Rg1对人结肠正常细胞和结肠癌细胞周期的影响: 取对数生长期的人正常结肠细胞CCD-18Co, 人结肠癌细胞SW480细胞, 分别以1×105 cells/mL接种于6孔板中, 向实验组细胞添加10 μg/mL的人参皂苷Rg1, 对照组添加无菌PBS. 加药继续培养12 h后, 0.25%胰酶室温消化2 min, 消化终止后, PBS洗涤2遍后重悬, 加入2 mL预冷的700 mL/L乙醇, 冰上固定30 min后300 g离心去上清, 加入200 μL guava cell cycle reagent(Milipore), 37 ℃避光孵育30 min后上Guava流式细胞仪(Milipore)检测.
1.2.3 人参皂苷Rg1对Lewis结肠癌模型小鼠作用影响: 参考文献[17], 将ct26细胞培养于含10%FBS的DMEM培养基中, 37 ℃、50 mL/L CO2浓度, 待细胞长至70%饱和度时, 胰酶消化细胞, 无菌PBS洗涤两次后制成密度为2×107 cells/mL的单细胞悬液, 立即对每只实验小鼠左腋窝下皮进行注射接种, 注射量为100 μL. 接种5 d后, 选取造模成功的小鼠40只, 随机分为4组: 100、200、300、400 mg/kg Rg1组, 20 mL/kg生理盐水对照组, 每组10只, 每日清晨空腹灌胃给药. 连续给药10 d后, 然后放血法处死小鼠, 剥离肿瘤. 抑瘤率 = (模型组肿瘤平均重量-实验组肿瘤平均重量)/模型组肿瘤平均重量.
1.2.4 Western blot检测VEGF、PCNA、Cyclin D1等基因在蛋白水平的表达变化: 取剪切成细小碎片的肿瘤组织, 按照20 mg样品/200 μL RIPA裂解液的比例加入裂解液, 裂解数分钟之前加入终浓度为1 mmol的PMSF, 裂解5 min后13000 g离心5 min, 取上清, 测定总蛋白浓度, 取每份样品20 μg蛋白质, SDS-聚丙烯酰胺凝胶电泳分离蛋白质. 将分离的条带电转移至PVDF膜上, 用5%脱脂奶粉(Wyeth)室温封闭2 h, 加入一抗, 4 ℃孵育过夜, 加入辣根过氧化物酶标记的抗兔IgG二抗, 室温1 h, 用ECL化学发光底物显色, X线片曝光后显影定影, 以β-actin为对照.
统计学处理 采用SPSS19.0软件包进行统计学处理, 实验数据以mean±SD表示, 进行方差分析和相关性分析, P<0.05表示差异具有统计学意义.
对人正常结肠细胞CCD-18Co和人结肠癌细胞SW480细胞给予不同浓度的人参皂苷Rg1以后, 对细胞的抑制率如表1所示: 在添加不同浓度的人参皂苷Rg1后, 人正常结肠细胞受到抑制较小, 最大抑制率仅为7.4%±0.2%; 与MRC-5细胞相比, 人结肠癌细胞SPC-A-1生长则受到明显的抑制, 且在人参皂苷Rg1浓度为10 μg/mL时达到最大, 为47.6%±2.2%.
| 分组 | 5 μg/mL | 10 μg/mL | 20 μg/mL | 40 μg/mL | 80 μg/mL |
| CCD-18Co组 | 3.2±0.2 | 7.4±0.2 | 6.4±0.2 | 7.3±0.2 | 7.2±0.2 |
| SW480组 | 7.3±2.2 | 47.6±2.2 | 45.1±2.2 | 43.6±2.2 | 32.3±2.2 |
对给药10 μg/mL的人参皂苷Rg1的实验组和添加无菌PBS的对照组的两种细胞进行周期检测, 结果如表2所示, 正常结肠细胞在Rg1处理后细胞周期改变不大, 而结肠癌细胞SPC-A-1在Rg1处理后, G0/G1期细胞显著增多, 而S期和G2期细胞不同程度减少.
| 分组 | G0/G1期 | S期 | G2期 |
| CCD-18Co对照组 | 64.0±1.0 | 25.0±1.0 | 11.0±0.5 |
| CCD-18Co实验组 | 68.0±2.0 | 24.0±1.0 | 8.0±0.4 |
| SW480对照组 | 57.0±1.0 | 28.0±2.0 | 15.0±0.2 |
| SW480实验组 | 71.0±2.0 | 19.0±1.0 | 10.0±0.4 |
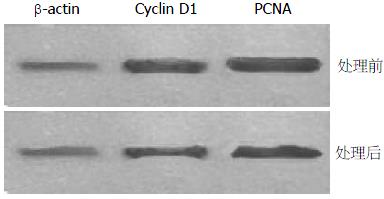
对给药浓度为10 μg/mL Rg1的该结肠癌细胞进行Western blot蛋白表达测定, 以β-actin为对照, 结果如图1所示, 在Rg1处理后, 促进细胞增殖的PCNA以及促使G1期变短的Cyclin D1蛋白表都有所降低.
2.4.1 不同浓度人参皂苷Rg1对Lewis结肠癌模型小鼠肿瘤生长的抑制作用: 与对照组相比, 在添加不同浓度的人参皂苷Rg1后, 小鼠肿瘤的大小均有所降低, 对肿瘤生长均呈现出抑制作用, 当给药浓度为100 mg/kg和200 mg/kg时, 肿瘤抑制率分别为5.2%±0.2%和14.4%±0.2%, 当给药浓度达到300 mg/kg之后, 肿瘤抑制率为26.4±0.2, 可达最大抑制率25%左右, 此后再进一步加大给药剂量对肿瘤抑制率改变不大.
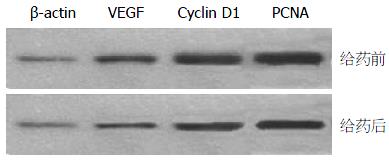
2.4.2 不同浓度人参皂苷Rg1对VEGF、PCNA、Cyclin D1基因等在蛋白水平的表达变化: 对给药浓度为300 mg/kg的小鼠肿瘤组织进行Western blot检测细胞中VEGF、PCNA、Cyclin D1蛋白的表达, 并与对照组进行比较, 结果如图2所示.
由图2可知, 在给药后肿瘤细胞中VEGF、Cyclin D1以及PCNA的表达量都呈现出不同程度的下降, 说明在给予人参皂苷Rg1后, 对这3种蛋白的表达均有一定的抑制作用.
正常的细胞周期是细胞实现增殖的前提, 肿瘤细胞能够无限制的生长, 与其旺盛的代谢合成密切相关. 在使用药物Rg1分别处理结肠癌细胞SW480和正常结肠组织细胞CCD-18Co后发现, SW480结肠癌细胞的增殖明显受到抑制, 而正常结肠组织细胞CCD-18Co则不受影响, 进一步进行细胞周期分析发现, 受Rg1处理后, SW480细胞中处于G0/G1期的细胞增加, S期细胞减少, 说明Rg1可能通过周期抑制进而特异性抑制肿瘤细胞的增殖.
Cyclin D1含295个氨基酸, 由染色体11q13上的CCND1基因编码. 其过度表达可使细胞G1期缩短, Cyclin D1蛋白表达增加主要见于一些原发性恶性肿瘤; PCNA与细胞DNA合成关系密切, 在细胞增殖的启动上起重要作用, 是反映细胞增殖状态的良好指标; VEGF则是促进肿瘤血管生长最有效因子, 因此以其为靶点的抗癌药物一直是癌症研究的热点. 在本研究中, 在对结肠癌模型小鼠给予人参皂苷Rg1后发现, 对小鼠肿瘤的生长都起到了一定的抑制作用, 进一步对肿瘤组织中的以上3种蛋白进行分析发现, 与对照相比, 他们的表达量都不同程度的有所降低, 这说明Rg1可能是通过抑制这3种基因的表达从而发挥其抑癌作用.
研究显示, 人参(山参)提取物可通过激活肿瘤抑制基因[18,19]、抑制NF-κB的核转运[2]来显示出抗结肠癌细胞活性的效用. 在本研究中, 我们发现Rg1不仅在体外对结肠癌细胞具有特异性抑制作用, 产生结肠癌细胞G1期阻滞, 而且在体内试验中对肿瘤的生长于发展也起到同样的抑制作用, 并且下调肿瘤组织中Cyclin D1、PCNA以及VEGF 3种蛋白的表达, 说明Rg1抑制促进肿瘤发生相关基因的表达可能是其抑制癌症的主要途径.
目前, 结肠癌已经成为威胁人类健康最重要的恶性肿瘤之一, 尽管以手术、放疗、化疗等为主的治疗方式近年来发展迅速, 但由于结肠癌患者常发生远处转移, 目前结肠癌患者的5年生存率只有15%左右. 而采用中药配合化疗方法可减轻由其引起的多种不良反应, 增加化疗药物的疗效, 而且还可以提高机体免疫力和抗癌能力, 改善生活质量, 不良反应小, 易被患者接受.
卢宁, 副主任医师, 中国人民解放军兰州军区乌鲁木齐总医院肿瘤科
人参是我国一种传统的名贵中药材, 具有良好的保健作用. 目前, 学者研究发现无论是其初提物, 还是明确成分提取物, 在抑制肿瘤等方面都有显著效果. 其中人参的主要活性成分-人参皂苷Rg1具有抗氧化、促进记忆、增强免疫多种生物活性, 近年来被证实可以抑制骨肉瘤细胞的发展, 可抑制人乳腺癌细胞的体外增殖过程.
人参皂苷Rg1对结肠损伤的保护作用也已经被发现, 但其对于结肠癌是否具有治疗作用目前还未见深入报道.
本研究选取人参皂苷的主要活性成分之一-Rg1, 比较其对正常结肠细胞和结肠癌细胞抑制作用的差异, 并对其机制进行细胞水平研究. 通过建立结肠癌小鼠模型, 给予人参皂苷治疗, 观察人参皂苷对小鼠中肿瘤生长的影响, 并对肿瘤组织中相关蛋白的表达进行检测, 在动物水平进一步验证人参皂苷Rg1的抗肿瘤效果, 为人参皂苷Rg1最终作为药物应用于抗肿瘤治疗奠定基础.
在本研究中, 我们发现Rg1不仅在体外对结肠癌细胞具有特异性抑制作用, 产生结肠癌细胞G1期阻滞, 而且在体内试验中对肿瘤的生长于发展也起到同样的抑制作用, 并且下调肿瘤组织中细胞周期素D1(Cyclin D1)、增殖细胞核抗原(proliferating cell nuclear antigen)以及血管内皮生长因子(vascular endothelial growth factor)3种蛋白的表达, 说明Rg1抑制促进肿瘤发生相关基因的表达可能是其抑制癌症的主要途径.
Cyclin D1: 含295个氨基酸, 由染色体11q13上的CCND1基因编码. 其过度表达可使细胞G1期缩短, Cyclin D1蛋白表达增加主要见于一些原发性恶性肿瘤.
通过建立结肠癌小鼠模型, 在动物水平进一步验证人参皂苷Rg1的抗肿瘤效果. 内容客观, 实验方法成熟, 观点新颖, 具有一定的科学意义.
编辑: 韦元涛 电编:闫晋利
| 1. | Wong VK, Cheung SS, Li T, Jiang ZH, Wang JR, Dong H, Yi XQ, Zhou H, Liu L. Asian ginseng extract inhibits in vitro and in vivo growth of mouse lewis lung carcinoma via modulation of ERK-p53 and NF-κB signaling. J Cell Biochem. 2010;111:899-910. [PubMed] [DOI] |
| 2. | Hwang JW, Oh JH, Yoo HS, Lee YW, Cho CK, Kwon KR, Yoon JH, Park J, Her S, Lee ZW. Mountain ginseng extract exhibits anti-lung cancer activity by inhibiting the nuclear translocation of NF-κB. Am J Chin Med. 2012;40:187-202. [PubMed] [DOI] |
| 3. | Park TY, Park MH, Shin WC, Rhee MH, Seo DW, Cho JY, Kim HM. Anti-metastatic potential of ginsenoside Rp1, a novel ginsenoside derivative. Biol Pharm Bull. 2008;31:1802-1805. [PubMed] |
| 4. | Wang W, Rayburn ER, Hang J, Zhao Y, Wang H, Zhang R. Anti-lung cancer effects of novel ginsenoside 25-OCH(3)-PPD. Lung Cancer. 2009;65:306-311. [PubMed] [DOI] |
| 5. | Xu TM, Cui MH, Xin Y, Gu LP, Jiang X, Su MM, Wang DD, Wang WJ. Inhibitory effect of ginsenoside Rg3 on ovarian cancer metastasis. Chin Med J (Engl). 2008;121:1394-1397. [PubMed] |
| 6. | Liu Q, Kou JP, Yu BY. Ginsenoside Rg1 protects against hydrogen peroxide-induced cell death in PC12 cells via inhibiting NF-κB activation. Neurochem Int. 2011;58:119-125. [PubMed] [DOI] |
| 7. | Saw CL, Yang AY, Cheng DC, Boyanapalli SS, Su ZY, Khor TO, Gao S, Wang J, Jiang ZH, Kong AN. Pharmacodynamics of ginsenosides: antioxidant activities, activation of Nrf2, and potential synergistic effects of combinations. Chem Res Toxicol. 2012;25:1574-1580. [PubMed] [DOI] |
| 8. | Chen ZY, DU TM, Chen SC. [Effects of ginsenoside Rg1 on learning and memory function and morphology of hippocampal neurons of rats with electrical hippocampal injuries]. Nan Fang Yi Ke Da Xue Xue Bao. 2011;31:1039-1042. [PubMed] |
| 9. | Fang F, Chen X, Huang T, Lue LF, Luddy JS, Yan SS. Multi-faced neuroprotective effects of Ginsenoside Rg1 in an Alzheimer mouse model. Biochim Biophys Acta. 2012;1822:286-292. [PubMed] [DOI] |
| 10. | Wu W, Yang JQ, He ZY. [Effect of ginsenoside Rg1 on the spatial learning-memory ability in dementia rats after transplanted with bone marrow mesenchymal stem cells]. Zhongguo Zhong Xi Yi Jie He Za Zhi. 2011;31:799-802. [PubMed] |
| 11. | Yu SH, Huang HY, Korivi M, Hsu MF, Huang CY, Hou CW, Chen CY, Kao CL, Lee RP, Lee SD. Oral Rg1 supplementation strengthens antioxidant defense system against exercise-induced oxidative stress in rat skeletal muscles. J Int Soc Sports Nutr. 2012;9:23. [PubMed] [DOI] |
| 12. | Wu J, Pan Z, Wang Z, Zhu W, Shen Y, Cui R, Lin J, Yu H, Wang Q, Qian J. Ginsenoside Rg1 protection against β-amyloid peptide-induced neuronal apoptosis via estrogen receptor α and glucocorticoid receptor-dependent anti-protein nitration pathway. Neuropharmacology. 2012;63:349-361. [PubMed] [DOI] |
| 13. | Chen H, Yin J, Deng Y, Yang M, Xu L, Teng F, Li D, Cheng Y, Liu S, Wang D. The protective effects of ginsenoside Rg1 against hypertension target-organ damage in spontaneously hypertensive rats. BMC Complement Altern Med. 2012;12:53. [PubMed] [DOI] |
| 14. | Shi SL, Li QF, Liu QR, Xu DH, Tang J, Liang Y, Zhao ZL, Yang LM. Nuclear matrix protein, prohibitin, was down-regulated and translocated from nucleus to cytoplasm during the differentiation of osteosarcoma MG-63 cells induced by ginsenoside Rg1, cinnamic acid, and tanshinone IIA (RCT). J Cell Biochem. 2009;108:926-934. [PubMed] [DOI] |
| 15. | Lau WS, Chen WF, Chan RY, Guo DA, Wong MS. Mitogen-activated protein kinase (MAPK) pathway mediates the oestrogen-like activities of ginsenoside Rg1 in human breast cancer (MCF-7) cells. Br J Pharmacol. 2009;156:1136-1146. [PubMed] [DOI] |
| 16. | Shen L, Han JZ, Li C, Yue SJ, Liu Y, Qin XQ, Liu HJ, Luo ZQ. Protective effect of ginsenoside Rg1 on glutamate-induced lung injury. Acta Pharmacol Sin. 2007;28:392-397. [PubMed] [DOI] |
| 17. | Liu X, Wu Z, Zuo S, Zhou Y, Chen Y, Wang X. [Establishment of orthotopic Lewis lung cancer model in mouse]. Zhongguo Fei Ai Za Zhi. 2010;13:42-47. [PubMed] [DOI] |
| 18. | Wang Y, Ye X, Ma Z, Liang Q, Lu B, Tan H, Xiao C, Zhang B, Gao Y. Induction of cytochrome P450 1A1 expression by ginsenoside Rg1 and Rb1 in HepG2 cells. Eur J Pharmacol. 2008;601:73-78. [PubMed] [DOI] |
| 19. | Leung KW, Pon YL, Wong RN, Wong AS. Ginsenoside-Rg1 induces vascular endothelial growth factor expression through the glucocorticoid receptor-related phosphatidylinositol 3-kinase/Akt and beta-catenin/T-cell factor-dependent pathway in human endothelial cells. J Biol Chem. 2006;281:36280-36288. [PubMed] |