修回日期: 2014-09-10
接受日期: 2014-09-21
在线出版日期: 2014-10-28
目的: 构建白介素(interleukin, IL)-1β siRNA腺病毒载体并评估其联合骨髓间充质干细胞(mesenchymal stem cell, MSC)移植治疗急性肝衰竭(acute liver failure, ALF)的协同作用.
方法: 构建IL-1β siRNA腺病毒载体并体外验证其对IL-1β的的抑制能力; 体内实验筛选IL-1β siRNA腺病毒载体的最佳干扰计量和最佳干扰时间点并检测其免疫源性; 分离培养Balb/c小鼠骨髓MSC并进行鉴定, 慢病毒稳定转染GFP; 20%(v/v)四氯化碳(CCl4)橄榄油溶液8 μg/L腹腔注射诱导小鼠ALF模型. 100只小鼠随机分为5组: 正常对照组(n = 20); ALF组(n = 20); ALF+IL-1β siRNA组(n = 20); ALF+MSC组(n = 20); ALF+IL-1β siRNA+MSC组(n = 20). 各组小鼠行干预后检测肝功能、生存率、血清炎症因子水平、组织病理学改变、肝细胞凋亡、增殖和肝脏中血管内皮生长因子(vascular endothelial growth factor, VEGF)和肝细胞生长因子(hepatocyte growth factor, HGF)含量. 免疫组织化学和荧光显微镜观察肝脏组织切片中GFP阳性细胞.
结果: 分离获取的MSC表达CD45阴性、CD44阳性、CD90阳性和CD29阳性. IL-1β siRNA腺病毒载体在体外能够抑制脂多糖刺激后的Raw264.7细胞株分泌IL-1β. qPCR实验显示腺病毒剂量为1×108 pfu、注射36 h后时体内干扰效率最高. 尾静脉注射1×108 pfu腺病毒空载体4 h后, 血清中干扰素(interferon, IFN)-γ、肿瘤坏死因子(tumor necrosis factor, TNF)-α和IL-6水平无明显升高. 联合治疗组CXCL1、IL-1β、IL-10、IL-6、谷丙转氨酶(alanine aminotransferase, ALT)和谷草转氨酶(aspartate aminotransferase, AST)水平与单纯MSC组相比具有统计学差异, 但与IL-1β siRNA组相比无统计学差异; 联合治疗组在促进肝细胞增殖、降低肝细胞凋亡、分泌VEGF和HGF水平上与IL-1β siRNA组或者MSC组相比均具有统计学差异; 免疫组织化学及荧光显微镜显示联合治疗组存活MSC数量比MSC组明显增多, 具有统计学差异.
结论: IL-1β siRNA能够有效降低ALF体内炎症反应, 并通过提高移植MSC的存活增强其组织修复与再生的能力. 两者联合应用具有更好的肝保护作用.
核心提示: 白介素(interleukin, IL)-1β siRNA能够有效地干扰体内IL-1β的合成, 通过降低急性肝衰竭(acute liver failure, ALF)体内过激的炎症反应, 不仅减轻肝细胞损伤, 同时还能发挥对移植骨髓间充质干细胞(mesenchymal stem cell, MSC)的保护作用, 进而增强MSC修复损伤组织的能力. 基于此, IL-1β siRNA联合MSC治疗ALF具有协同作用.
引文著录: 马虎成, 施晓雷, 丁义涛. 白介素-1β siRNA联合骨髓间充质干细胞协同治疗急性肝衰竭. 世界华人消化杂志 2014; 22(30): 4547-4558
Revised: September 10, 2014
Accepted: September 21, 2014
Published online: October 28, 2014
AIM: To construct an adenovirus vector expressing interleukin (IL)-1β siRNA and assess the synergistic effect of treatment with this vector and mesenchymal stem cells (MSCs) in acute liver failure (ALF) in mice.
METHODS: An adenovirus vector expressing IL-1β siRNA was constructed and its interference ability for IL-1β was tested in vitro by enzyme-linked immunosorbent assay (ELISA). qPCR assay was employed to determine the optimal dose and timing of administration of IL-1β siRNA. The immunogenicity of adenovirus vector was also detected. Bone marrow MSCs were obtained from Balb/c mice and transfected with GFP by lentivirus. ALF was induced in mice by intraperitoneal infusion of 20% (v/v) CCl4 dissolved in olive oil at a dose of 8 μL/g. One hundred mice were divided randomly into five groups: a normal control group (n = 20), an ALF group (n = 20), an ALF + IL-1β siRNA group (n = 20), an ALF + MSCs group (n = 20), and an ALF + IL-1β siRNA + MSCs group (n = 20). At different time points after intervention, the mice were sacrificed with an overdose of isoflurane. Liver function, serum levels of inflammatory factors, histopathology, apoptosis and proliferation of hepatocytes, vascular endothelial growth factor (VEGF) and hepatocyte growth factor (HGF) levels were detected. GFP-positive cells in liver tissue were detected by immunohistochemistry and fluorescence microscopy.
RESULTS: MSCs obtained from Balb/c mice were positive for CD44, CD90 and CD29, and negative for CD45. In vitro, IL-1β siRNA could suppress IL-1β secretion in lipopolysaccharide-stimulated Raw 264.7 cells. In vivo, qPCR assay showed that 1 × 108 pfu was the optimal dose and 36 h after infusion was the optimal time point. Serum interferon (IFN)-γ, tumor necrosis factor (TNF)-α, and IL-6 levels exhibited no significant changes after administration of a null adenovirus vector. Compared with the ALF + MSCs group, the levels of CXCL1, IL-1β, IL-10, IL-6, alanine aminotransferase (ALT) and aspartate aminotransferase (AST) significantly changed in the ALF + IL-1β siRNA + MSCs group, but there was no significant difference between the ALF + IL-1β siRNA + MSCs group and ALF + IL-1β siRNA group. Interestingly, the ALF + IL-1β siRNA + MSCs group had better hepatocyte proliferation and reduced hepatocyte apoptosis compared with other groups. Meanwhile, the ALF + IL-1β siRNA + MSCs group secreted more VEGF and HGF than the other groups. Immunohistochemistry and fluorescence microscopy revealed that the number of surviving MSCs in the ALF + IL-1β siRNA + MSCs group was significantly more than that in the ALF + MSCs group.
CONCLUSION: IL-1β siRNA could inhibit the inflammatory response in ALF and enhance the ability of MSCs to promote tissue repair and regeneration by increasing the survival rate of MSCs. Therefore, combination of IL-1β siRNA with MSCs has a better hepatoprotective effect.
- Citation: Ma HC, Shi XL, Ding YT. Synergistic effect of IL-1β siRNA combined with mesenchymal stem cells in treatment of acute liver failure in mice. Shijie Huaren Xiaohua Zazhi 2014; 22(30): 4547-4558
- URL: https://www.wjgnet.com/1009-3079/full/v22/i30/4547.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i30.4547
急性肝衰竭(acute liver failure, ALF)是一种以短期剧烈肝功能丧失以及大量肝细胞坏死为特点的临床重症, 坏死细胞释放的细胞碎片以及微血管的损伤会导致血管通透性的增加并且强化巨噬细胞和中性粒细胞的渗透作用. 更重要的是, 坏死细胞引起的吞噬作用会导致一系列促炎因子的级联式释放, 包括白介素(interleukin, IL)-1β、IL-6、肿瘤坏死因子(tumor necrosis factor, TNF)-α、趋化因子和白三烯[1]等. 目前有研究表明: 失控的肝内免疫反应是ALF发生与发展的首要病理机制[2].
骨髓间充质干细胞(mesenchymal stem cell, MSC)已被证实具有免疫调节和修复损伤组织的能力[3,4]. 大量基于干细胞移植治疗的研究已在医学领域取得了令人瞩目的成果, 为多种疾病的治疗带来了新的希望. MSC移植也已被用于治疗包括急性肝衰竭在内的各种终末期肝病的实验及临床研究[5-8]. 但同时国内外的许多研究也发现了细胞移植疗效不佳的现象, 对这一系列文献的回顾性研究我们发现: 肝衰竭体内过激炎症反应抑制了MSC的活性, 限制其移植治疗ALF的疗效[9]. 最近有研究表明, MSC和炎症微环境的相互作用会影响MSC移植的疗效. 如Liu等[10]发现炎症性T细胞通过分泌TNF和IFNG, 诱导MSC的凋亡并限制MSC介导的骨组织再生. 而Dang等[11]最近发现一些炎症因子如TNF和IFNG会诱导MSC发生细胞自噬进而影响其免疫调节能力. 在其他系统的疾病中, 如急性肺损伤, 炎症因子不仅对肺组织具有不良反应, 同时对于移植的干细胞也具有损伤作用[12]. 因此, 提高MSC治疗ALF疗效的首要目标即是降低ALF体内过激的炎症反应.
参与炎症反应的主要细胞因子包括IL-1、IL-6和TNF-α等, 其中IL-1是激活免疫炎症反应的中心枢纽. IL-1能够激活T细胞和巨噬细胞, 抑制内皮细胞的增殖并诱导其表达黏附分子, 进而引起炎性细胞的募集和浸润[13,14], 最终导致组织损伤, 特别是肝脏[15]. 目前临床上抑制炎症反应的方法主要包括免疫抑制剂和炎症因子受体拮抗剂, 但是免疫抑制剂具有骨髓抑制、肝功能损害和性机能损害等一系列不良反应. 而炎症因子受体拮抗剂也具有一些不可忽视的缺陷[16], 首先他是一种外源性的药物, 进入机体后会很快被清除; 另外为了维持疗效, 必须反复给予受体拮抗剂, 导致其用量和费用较高, 这在一定程度上限制了IL-1Ra的临床应用前景. 于是, 本研究期望采用RNA干扰技术来达到控制体内炎症水平的目的. 其中小干扰RNA(small interfering RNA, siRNA)是RNAi发挥作用的重要中间效应分子[17], 并且具有设计简便、特异性高和低毒性的优势[18-20], 具有潜在的临床应用价值, 近些年来, siRNA用于治疗急性肝衰竭也取得了一些进展[21-23]. 为多种疾病的治疗带来了新的希望.
通过本研究我们希望利用腺病毒载体将IL-1β siRNA转染至生物体细胞内, 在基因层面上调节IL-1β的水平. 此方法不仅能够高效地抑制急性肝衰竭体内IL-1β水平, 在成本上较IL-1Ra也将更加低廉, 更具有临床可行性. 因此, 本研究设想预先使用IL-1β siRNA抑制ALF体内严重的炎症水平, 改善炎症微环境, 再联合MSC移植, 评价该联合疗法治疗ALF的协同效应.
IL-1β siRNA腺病毒载体购自上海Invotrogen公司; GFP转染MSC由上海Invotrogen公司完成; ♂, Balb/c小鼠(nu/nu)100只, 体质量18-22 g, 由南京大学医学院附属鼓楼医院实验动物中心提供; Raw264.7细胞株购自中国科学院上海生命科学研究院细胞资源库; 脂多糖(lipopolysaccharide, LPS)(Lot. No. L4391)、四氯化碳(CCl4)购自美国Sigma公司; L-DMEM培养液、特级胎牛血清、胰蛋白酶购自Gibco公司; RT-PCR试剂盒(南京Biouniquer公司); IL-1α、IL-1β、IL-2、IL-6、IL-10、TNF-α、G-CSF、Eotaxin/CCL11、CXCL1、干扰素-γ(interferon-γ, IFN-γ)、血管内皮生长因子(vascular endothelial growth factor, VEGF)、肝细胞生长因子(hepatocyte growth factor, HGF)ELISA试剂盒(美国R&D公司); 抗小鼠CD45抗体、小鼠CD44抗体、抗小鼠CD90抗体、抗小鼠CD29抗体、Ki-67抗体、抗GFP抗体(Abcam公司); TUNEL细胞凋亡检测试剂盒(瑞士Roche公司).
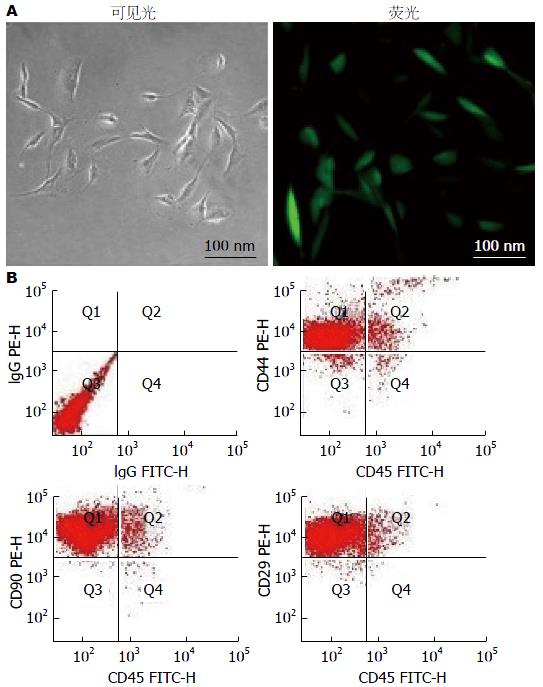
1.2.1 MSC的获取和鉴定: 我们采用贴壁筛选法分离获取MSC[24]. 2%戊巴比妥钠麻醉Balb/c小鼠, 体积分数750 mL/L乙醇全身浸泡消毒10 min. 无菌条件取股骨及胫骨, PBS清洗3次. 剪掉股骨和胫骨的骨骺端, 露出骨髓腔, 用添加青、链霉素的L-DMEM培养基冲出骨髓, 反复吹打; 将冲出的骨髓制成单细胞悬液, 453 g离心5 min, 弃上清, L-DMEM培养基重悬后接种于25 cm2培养瓶中, 置37 ℃、CO2饱和湿度培养箱中培养. 选择第三代MSC进行表型鉴定: 大约1×106个细胞装入流式管中1500 r/min离心5 min, 加入1 mL PBS重悬, 加入20 μL FITC标记的抗小鼠CD45抗体和PE标记的抗小鼠CD44抗体. 室温避光孵育20 min, 1500 r/min离心5 min, 1 mL PBS洗3遍. 500 μL PBS重悬, 上流式细胞仪检测. 同样方法检测CD45、CD90双标细胞比例和CD45、CD29双标细胞比例.
1.2.2 IL-1β siRNA干扰Raw264.7细胞株体外实验: Raw264.7细胞按照5×105/孔的密度接种于六孔板中, 采用含有10%FBS的高糖DMEM培养基, 细胞黏附12 h后加入1×108 pfu IL-1β siRNA腺病毒, 12 h后加入LPS, LPS终浓度为2 μg/mL, 24 h后收集细胞培养基, ELISA检测IL-1β的浓度.
1.2.3 qPCR筛选最佳计量和时间点: 2×107、5×107、1×108和2×108 pfu不同剂量的IL-1β siRNA腺病毒载体尾静脉注射, 36 h后qPCR检测肝脏IL-1β水平, 筛选最佳计量. 随后使用最佳计量尾静脉注射, 注射后不同时间点取小鼠肝脏, qPCR检测IL-1β相对表达量, 寻找最佳干扰时间点. 具体如下: 在EP管中加入10 μL DEPC水, 1 μL引物, 1 μL模板RNA, 1 μL dNTP, 短暂离心后65 ℃水浴5 min, 立刻0 ℃冰水浴至少1 min. 短暂离心后冰上操作: 加入4 μL 5×First-Strand Buffer, 1 μL 0.1 mol/L dTT, 1 μL RNase Inhibitor, 1 μL SSⅢ逆转录酶, 短暂离心后50 ℃水浴60 min进行逆转录, 70 ℃水浴15 min灭火逆转录酶, 立即进行PCR. PCR反应条件为94 ℃ 1 min, 58 ℃ 50 s, 72 ℃ 90 s, 进行40个循环, 然后72 ℃ 10 min完成. 目的基因引物序列(5'-3'): Mus musculus IL-1β-F: ATGCCACCTTTTGACAGTGATG; Mus musculus IL-1β-R: TGATGTGCTGCTGCGAGATT.
1.2.4 载体免疫源性检测: 为评估腺病毒载体是否引起机体非特异性免疫反应, 我们选取健康小鼠尾静脉注射不含IL-1β siRNA的腺病毒空载体, 4 h后ELISA检测血清IFN-γ、TNF-α和IL-6水平.
1.2.5 小鼠急性肝衰竭模型建立和分组: 将CCl4按照体积比1:4溶于橄榄油配成体积分数为20%的CCl4橄榄油溶液; CCl4橄榄油溶液以8 μg/L的量腹腔注射诱导小鼠ALF模型. 所有小鼠建模后随机分为5组, A组: 正常组(n = 20); B组: ALF组(n = 20), 8 μL/g剂量腹腔注射CCl4橄榄油溶液诱导ALF模型; C组: ALF+MSC组(n = 20), ALF模型诱导后24 h尾静脉注射MSC的PBS悬液100 μL(约含细胞1×106个); D组: ALF+IL-1β siRNA组(n = 20), ALF模型诱导前36 h尾静脉注射含有IL-1β siRNA的腺病毒液100 μL和E组: ALF+MSC+IL-1β siRNA组(n = 20), ALF模型诱导前36 h尾静脉注射含有IL-1β siRNA的腺病毒液100 μL, 诱导后24 h尾静脉注射MSC的PBS悬液100 μL(约含细胞1×106个).
1.2.6 炎症因子检测: 为评估IL-1β siRNA腺病毒载体联合MSC对炎症反应的控制作用, 我们在ALF模型诱导后3 d通过ELISA检测了以下9种细胞因子的浓度: G-CSF/CSF-3、IL-6、Eotaxin/CCL11、IL-1α、IL-1β、IL-10、IL-2、TNF-α以及CXCL1.
1.2.7 肝功能、组织病理学、生存期、肝细胞增殖、凋亡和生长因子检测: 5组小鼠每组随机抽取10只小鼠进行生存期的比较. 余下的每组10只细胞移植后1-5 d和1-3 wk定期抽血检测肝功能并观察组织病理学改变. 小鼠在ALF模型建立后第14天处死, 获取肝脏组织, 做石蜡切片并行Ki67和TUNEL免疫组织化学染色, 随机选择5个高倍视野, 计算阳性细胞数(细胞核呈现棕色), 评估肝脏细胞增殖和凋亡情况. 为探讨IL-1β siRNA腺病毒载体联合MSC的治疗机制, 我们在ALF模型诱导后2 wk检测了血清中VEGF和HGF含量.
1.2.8 存活MSC检测: 在移植后第2周取肝脏组织制成冰冻切片, 荧光显微镜下观察GFP阳性细胞; 在移植后第2周取肝脏组织制成石蜡切片, 行GFP免疫组织化学染色, 随机选择5个高倍视野, 计算阳性细胞数(细胞核呈现棕色), 评估IL-1β siRNA对MSC的保护作用.
统计学处理 实验结果用mean±SD表示. 采用SPSS19.0统计学软件进行数据处理, 组间比较应用独立样本t检验, 生存期分析采用Kaplan-Meire曲线, P<0.05为差异有统计学意义.
我们分离获取的第三代MSC表达CD44阳性、CD90阳性、CD29阳性、CD45阴性, 光学显微镜下呈现典型梭形形态, 转染GFP后在荧光显微镜下可见绿色荧光(图1).
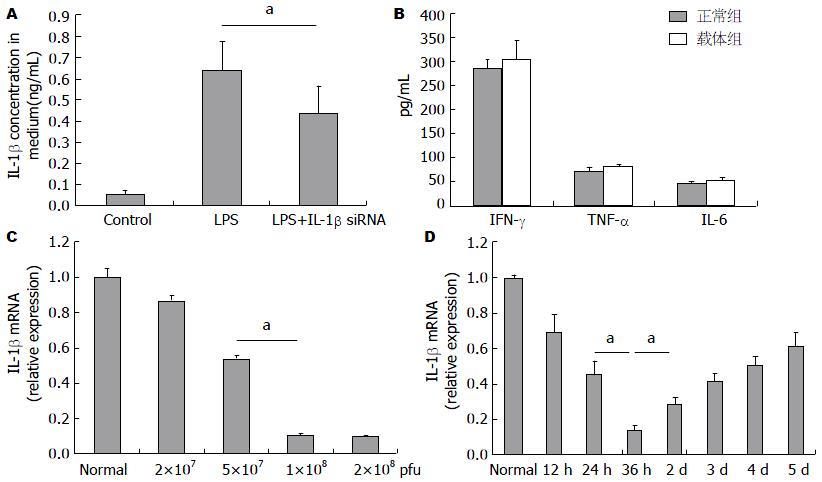
我们使用LPS刺激Raw264.7细胞后, 后者能够分泌大量IL-1β; 而如果预先使用IL-1β siRNA病毒液转染Raw264.7细胞株, 后者在LPS刺激下分泌IL-1β的能力显著下降, 两者相比具有统计学差异(图2A).
我们注射不同体积的病毒液来筛选最佳干扰计量. 当注射剂量为2×107 pfu(20 μL病毒液)时, 干扰效率大约为13%, 当剂量增加到5×107 pfu(50 μL病毒液)时, 干扰效率大约有50%, 继续将剂量增加到1×108 pfu(100 μL病毒液), 干扰效率增加到约89%, 但是当注射2×108 pfu(200 μL病毒液)时, 干扰效率并没有继续增加(图2C). 该结果表明我们构建的IL-1β siRNA腺病毒载体的有效剂量大约为1×108-2×108 pfu, 基于以上结果, 我们选择1×108 pfu(100 μL病毒液)作为后续实验的治疗剂量.
我们通过尾静脉注射了1×108 pfu的IL-1β siRNA腺病毒载体, 在不同时间点后获取肝脏组织, qPCR检测肝脏中IL-1β的基因相对表达量, 结果显示注射IL-1β siRNA腺病毒载体36 h后, 干扰效率最高, 大约为76%, 随后干扰效率逐渐降低; 当注射5 d后, 干扰效率降低到40%左右(图2D). 表明IL-1β siRNA腺病毒载体注射后36 h干扰效率最佳. 基于以上结果, 我们选择在ALF诱导前36 h注射IL-1β siRNA腺病毒载体.
为评估构建的IL-1β siRNA腺病毒载体是否会引起机体不必要的免疫反应, 我们注射了空载的腺病毒载体(避免IL-1β siRNA的干扰作用), 4 h后通过ELISA检测了血清中IFN-γ、TNF-α和IL-6水平. 结果显示注射空载的腺病毒载体后血清中这些炎症因子的水平与正常小鼠相比无统计学意义(图2B). 因此我们认为构建的腺病毒载体不引起机体的免疫反应, 具有低的免疫源性, 安全性较好.
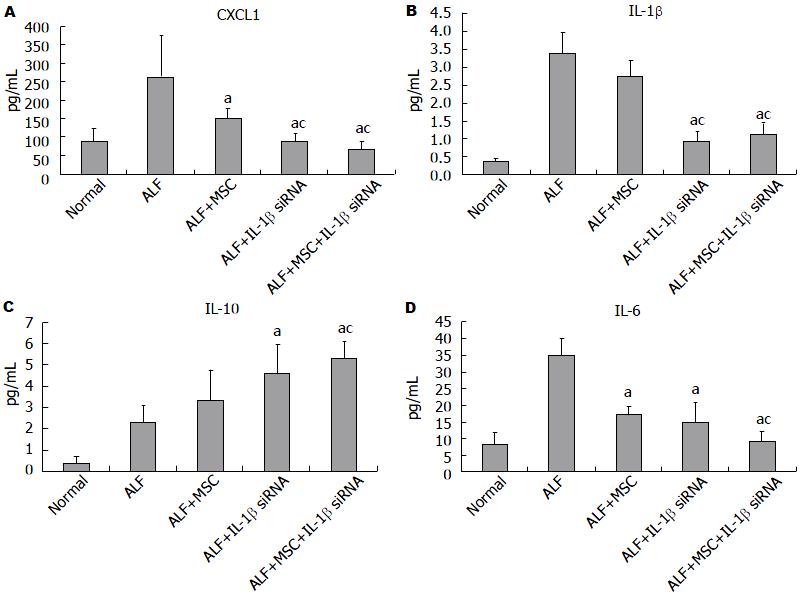
我们在ALF模型诱导后第3天通过ELISA检测了多个细胞因子(G-CSF/CSF-3、IL-6、Eotaxin/CCL11、IL-1α、IL-1β、IL-10、IL-2、TNF-α以及CXCL1)在血清中的浓度, 最终我们列出了CXCL1、IL-1β、IL-10、和IL-6这4因子的水平, 其余因子差异不显著, 故未列出. 结果显示: MSC组CXCL1、IL-6水平与ALF组相比显著降低; IL-1β siRNA组CXCL1、IL-1β、IL-6水平较ALF组明显降低, 同时CXCL1、IL-1β水平较MSC组也明显降低, IL-10水平较ALF组明显升高; 而IL-1β siRNA+MSC组CXCL1、IL-1β、IL-6水平较ALF组和MSC组均明显降低, 同时IL-10水平较ALF组和MSC组明显升高, 但是CXCL1、IL-1β、IL-10和IL-6水平与IL-1β siRNA组相比无统计学差异(图3).
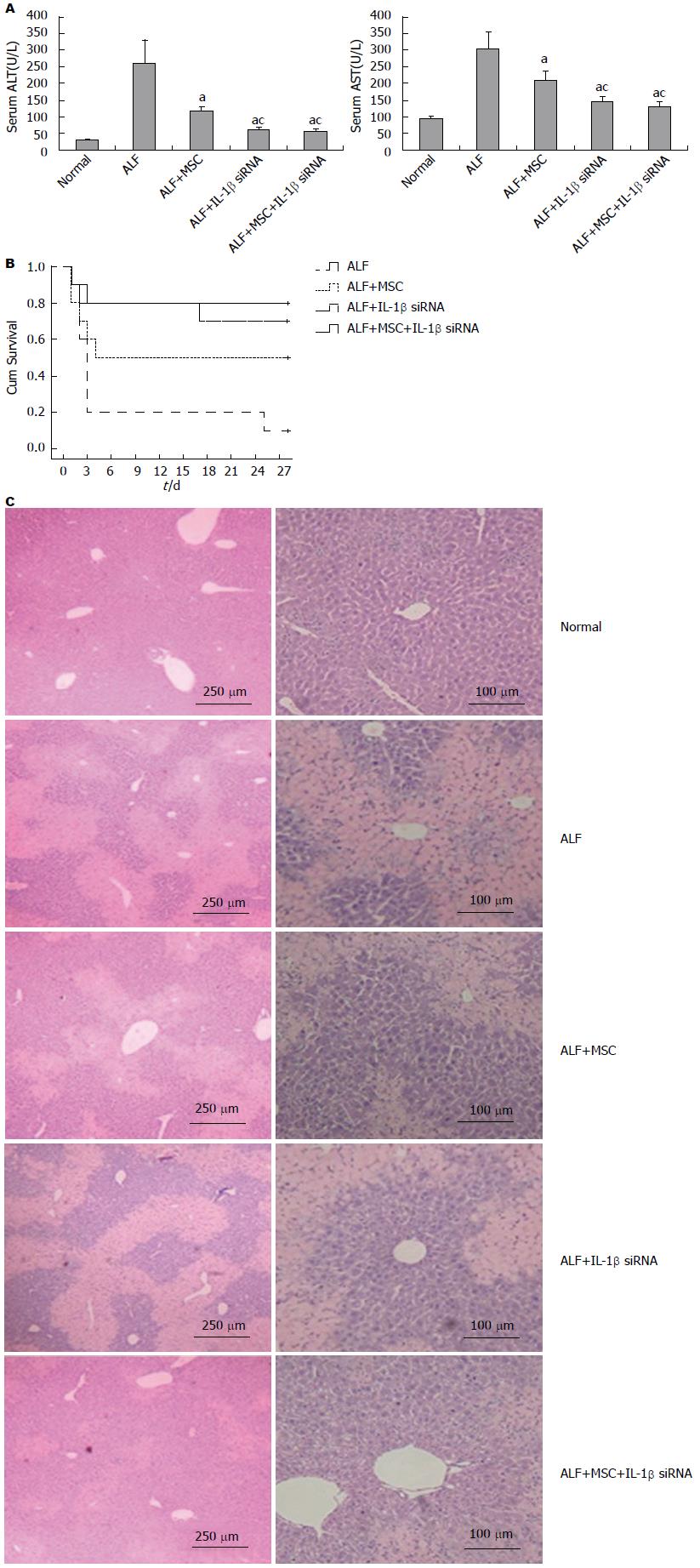
肝功能检测显示在第7天时, 各组谷丙转氨酶(alanine aminotransferase, ALT)水平分别为: ALF组, 263.11 U/L±71.05 U/L; ALF+MSC组, 121.16 U/L±11.93 U/L; ALF+IL-1β siRNA组, 62.92 U/L±7.82 U/L; ALF+MSC+IL-1β siRNA组, 57.34 U/L±8.51 U/L. 而各组谷草转氨酶(aspartate aminotransferase, AST)水平分别为: ALF组, 304.89 U/L±28.47 U/L; ALF+MSC组, 210.02 U/L±22.43 U/L; ALF+IL-1β siRNA组, 146.34 U/L±11.89 U/L; ALF+MSC+IL-1β siRNA组, 130.56 U/L±16.87 U/L(图4A).
我们从各组小鼠中随机选取10只观察生存期, 观察时间为4 wk(腹腔注射CCl4为第0天). 结果显示: ALF组28 d时的存活率仅为10%, MSC组28 d的存活率为50%, IL-1β siRNA组28 d存活率达到70%, 而MSC+IL-1β siRNA组28 d的存活率为80%(图4B).
2 wk时HE染色显示正常肝脏颜色均匀, 具有完整的肝小叶结构; 而急性肝衰竭肝脏呈现出大片坏死, 肝细胞肿胀、充血(浅色区域), 肝小叶结构遭到破坏. MSC组和IL-1β siRNA组均肝细胞坏死区域减少, 而IL-1β siRNA+MSC组坏死区域面积要比MSC组和IL-1β siRNA组少(图4C).
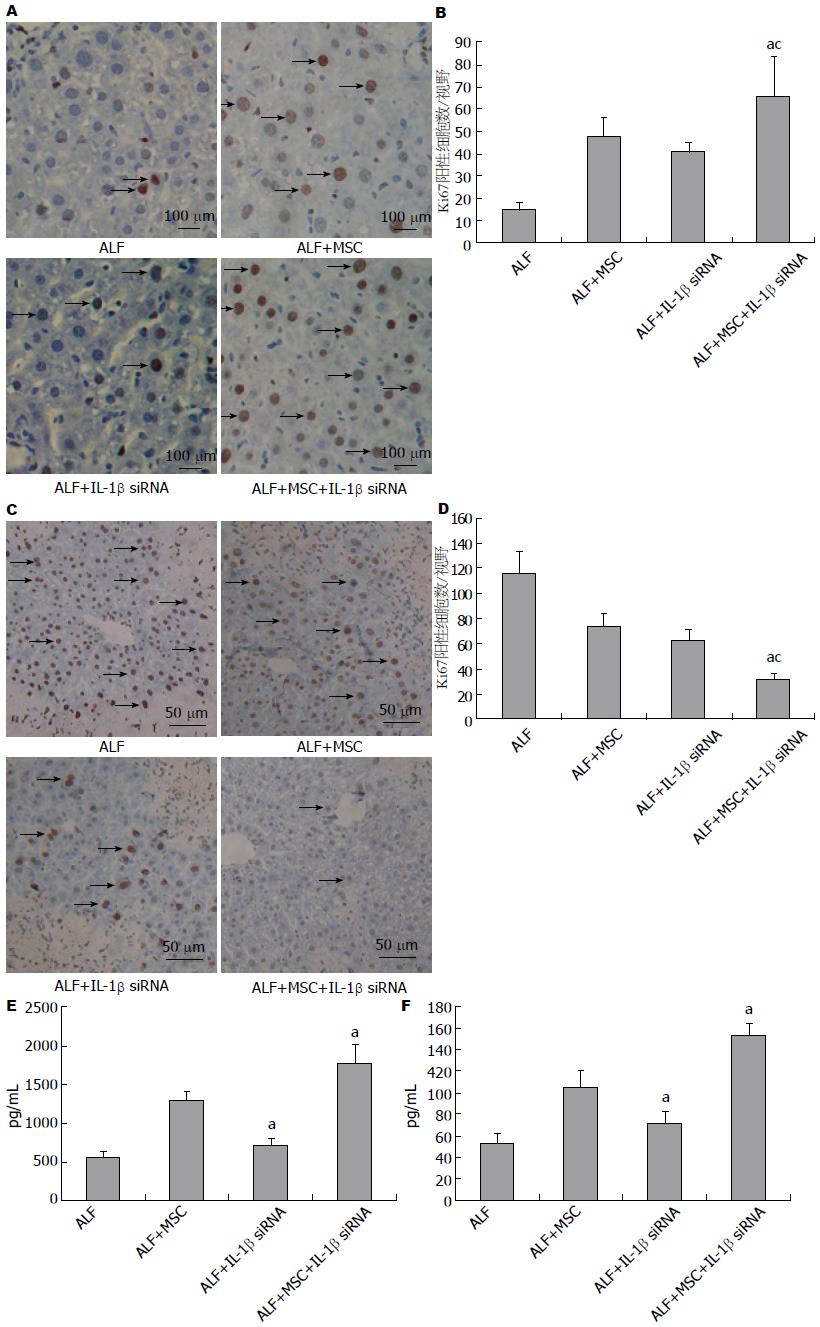
我们通过Ki67染色和TUNEL实验检测肝组织中处于增殖期和凋亡的肝细胞, 结果表明MSC组Ki67+细胞数略高于IL-1β siRNA组, 而凋亡细胞数略低于IL-1β siRNA组, 但两者均无统计学差异(图5A, B); IL-1β siRNA+MSC组Ki67+细胞数明显高于MSC组和IL-1β siRNA组, 凋亡细胞数明显低于MSC组和IL-1β siRNA组(图5C, D).
我们在ALF模型诱导2 wk时通过ELISA检测了各组小鼠血清中HGF和VEGF的浓度, 结果显示ALF+MSC组HGF和VEGF浓度高于ALF组和ALF+IL-1β siRNA组, 两者有统计学差异; 而ALF+IL-1β siRNA+MSC组HGF和VEGF浓度明显高于MSC组, 两者具有统计学差异(图5E, F).
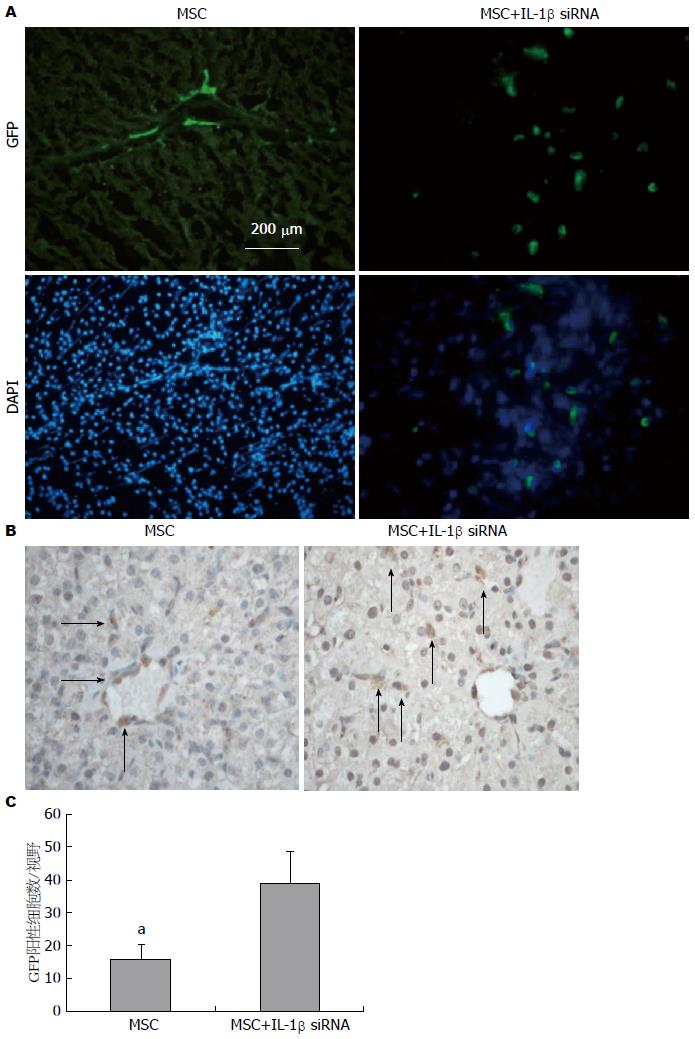
我们通过荧光显微镜和GFP免疫组织化学染色两种方法观察了肝脏组织中存活的MSC数量. 可见2 wk末时IL-1β siRNA+MSC组移植细胞数较MSC组明显增多, 前者肝小叶实质内可见散在分布的移植细胞, 后者移植细胞沿血管周围分布(图6A, 绿色荧光为阳性细胞, 蓝色为DAPI特染的细胞核); 免疫组织化学显示每高倍镜视野细胞数IL-1β siRNA+MSC组明显高于MSC组(图6B, C), 差异具有统计学意义, 结果同荧光显微镜一致.
前言部分我们提到, ALF体内过激的炎症反应不仅会导致肝细胞的大量损伤, 也影响MSC的活性[9-11]. 因此降低炎症反应在干细胞移植治疗ALF中至关重要. 本研究采用IL-1β siRNA技术来控制ALF体内的炎症反应. 但是siRNA治疗面临一个亟待解决的问题, 那就是如何将siRNA高效地输送到靶点[25,26]. 因为单纯的siRNA在体内极不稳定, 在血清中很快被酶降解, 半衰期短, 并且在细胞内的吸收利用率很低, 所以siRNA的输送必须借助于合适的载体. 目前可用于表达siRNA的载体主要包括质粒载体、病毒载体和脂质体载体[27-29]. 本实验中我们选择腺病毒作为IL-1β siRNA的载体, 由于考虑到逆转录病毒不能感染非分裂细胞, 而慢病毒对工作人员具有潜在的危害, 因此腺病毒载体较为适合本课题的研究[30]. 虽然腺病毒载体目的基因表达时间较短, 但由于ALF炎症最剧烈的时期大约在诱导后1 wk以内(大多数未治疗小鼠在此期间死亡), 往后会慢慢自我恢复, 因此腺病毒载体可以满足控制炎症的目的.
我们在检测炎症因子时发现: IL-1β siRNA+MSC组CXCL1、IL-1β、IL-6水平较MSC组明显降低, 同时IL-10水平较MSC组明显升高, 但是CXCL1、IL-1β、IL-10和IL-6水平与IL-1β siRNA组相比无统计学差异. 可见在控制炎症反应方面, 联合治疗组并不优于IL-1β siRNA组. 在转氨酶的检测中我们也发现了类似的情况. MSC+IL-1β siRNA在降低转氨酶方面具有比单纯MSC移植更好的效果, 但是与单纯IL-1β siRNA相比并无明显优势. 其中可能的原因我们认为是由于转氨酶反映的是肝细胞损伤和坏死情况, 而ALF中造成肝细胞损伤的主要原因是急性炎症反应. 由于联合组和单纯IL-1β siRNA组中都有IL-1β siRNA, 炎症反应得到抑制, 而MSC虽然也具有调节炎症反应的作用, 但是该作用与IL-1β siRNA相比可以忽略不计, 因此联合治疗组与单纯IL-1β siRNA在转氨酶水平上无明显差异. 结合以上两点, 似乎联合治疗并无必要, 但我们并不这么认为. 虽然在控制炎症和肝损伤方面, 和联合治疗组相比, 单纯IL-1β siRNA具有相似的效果, 但是在促进肝再生方面, 单纯IL-1β siRNA并无效果.
我们检测了2 wk末各组小鼠血清中HGF和VEGF的浓度, IL-1β siRNA+MSC组这两种因子浓度明显高于MSC组和IL-1β siRNA组, 具有统计学差异; 肝细胞增殖和凋亡检测表明IL-1β siRNA+MSC组在促进肝细胞增殖和抑制肝细胞凋亡作用方面均优于单独应用IL-1β siRNA或MSC. 综合以上结果我们证明: MSC+IL-1β siRNA组在促进肝再生方面效果优于单纯MSC组或者是IL-1β siRNA组. 反映到存活率上, 联合治疗组小鼠4 wk时存活率为80%, 高于MSC组的50%和IL-1β siRNA组的70%. 实际上, 控制炎症和促进肝再生是ALF治疗中两个同等重要的方面, 只有双管齐下才能达到最佳的疗效.
我们还发现了一个现象, 那就是联合IL-1β siRNA后, MSC分泌的生长因子VEGF和HGF水平升高, 我们猜测是因为IL-1β siRNA抑制了ALF体内过激的炎症反应从而提高了存活的MSC数量所致. 为证实这一点, 于是我们利用荧光显微镜和抗GFP免疫组织化学检测了肝脏组织中存活的MSC数量, 结果和我们预想的一致: IL-1β siRNA+MSC组中移植细胞的数量明显多于MSC组, 说明IL-1β siRNA能够提高MSC在衰竭肝脏组织中的存活率, 促进其更好的发挥肝细胞保护作用.
总之, IL-1β siRNA能够有效地干扰体内IL-1β的合成, 降低ALF体内过激的炎症反应, 不仅减轻肝细胞损伤, 同时还能发挥对移植MSC的保护作用, 进而增强MSC修复损伤组织的能力. 基于此, IL-1β siRNA联合MSC治疗ALF具有协同作用.
骨髓间充质干细胞(mesenchymal stem cell, MSC)移植治疗肝脏疾病的有效性已被证实. 但是急性肝衰竭体内过激的炎症反应制约了MSC的活性和疗效. 为解决这一问题, 本研究通过在MSC移植前预先使用白介素(interleukin, IL)-1β siRNA控制急性肝衰竭体内过激炎症反应, 提高MSC的活性进而增强MSC移植治疗急性肝衰竭的疗效.
刘亮明, 副教授, 主任医师, 上海交通大学附属第一人民医院松江分院肝病科
MSC具有自我更新、免疫调节和旁分泌的作用, 是再生医学领域中最有前景的细胞来源之一. 本研究聚焦于炎症微坏境对MSC活性的影响. 诸多研究已经证实过激的炎症反应会抑制MSC的活性, 同时, RNA干扰技术的发展也为控制炎症反应提供了新的方法. 本研究期望预先使用IL-1β siRNA控制急性肝衰竭(acute liver failure, ALF)体内过激的炎症反应. 在降低肝细胞损伤的同时保护移植的MSC, 进而促进MSC发挥组织修复和再生的能力.
有研究显示MSC和炎症微环境的相互作用会影响MSC移植的疗效. 如T细胞通过分泌TNF和IFNG, 诱导MSC的凋亡并限制MSC介导的骨组织再生. 另外在急性肺损伤中, 炎症因子不仅对肺组织具有毒性作用, 同时对于移植的干细胞也具有损伤作用. 因此, 在采用MSC移植治疗炎症相关的疾病时, 需要考虑到炎症本身对MSC的损伤作用.
本研究采用RNA干扰技术构建了IL-1β siRNA, 以此控制ALF体内过激的炎症反应. 并证明了IL-1β siRNA通过提高MSC的存活进而增强MSC移植治疗ALF的疗效的观点.
本研究证实了IL-1β siRNA能够控制急性肝衰竭体内炎症反应和提高移植MSC的活性. 联合使用IL-1β siRNA和MSC移植或能够成为干细胞移植治疗急性肝衰竭更为有效的一种方法.
本文立题新颖, 设计思路清晰, 具有一定指导意义.
编辑: 田滢 电编:闫晋利
| 1. | Krysko DV, Denecker G, Festjens N, Gabriels S, Parthoens E, D'Herde K, Vandenabeele P. Macrophages use different internalization mechanisms to clear apoptotic and necrotic cells. Cell Death Differ. 2006;13:2011-2022. [PubMed] [DOI] |
| 2. | Leifeld L, Dumoulin FL, Purr I, Janberg K, Trautwein C, Wolff M, Manns MP, Sauerbruch T, Spengler U. Early up-regulation of chemokine expression in fulminant hepatic failure. J Pathol. 2003;199:335-344. [PubMed] [DOI] |
| 3. | Uccelli A, Moretta L, Pistoia V. Mesenchymal stem cells in health and disease. Nat Rev Immunol. 2008;8:726-736. [PubMed] [DOI] |
| 4. | Phinney DG, Prockop DJ. Concise review: mesenchymal stem/multipotent stromal cells: the state of transdifferentiation and modes of tissue repair--current views. Stem Cells. 2007;25:2896-2902. [PubMed] [DOI] |
| 5. | Petersen BE, Bowen WC, Patrene KD, Mars WM, Sullivan AK, Murase N, Boggs SS, Greenberger JS, Goff JP. Bone marrow as a potential source of hepatic oval cells. Science. 1999;284:1168-1170. [PubMed] [DOI] |
| 6. | Moore JK, Stutchfield BM, Forbes SJ. Systematic review: the effects of autologous stem cell therapy for patients with liver disease. Aliment Pharmacol Ther. 2014;39:673-685. [PubMed] [DOI] |
| 7. | Levine P, McDaniel K, Francis H, Kennedy L, Alpini G, Meng F. Molecular mechanisms of stem cell therapy in alcoholic liver disease. Dig Liver Dis. 2014;46:391-397. [PubMed] [DOI] |
| 8. | Salomone F, Barbagallo I, Puzzo L, Piazza C, Li Volti G. Efficacy of adipose tissue-mesenchymal stem cell transplantation in rats with acetaminophen liver injury. Stem Cell Res. 2013;11:1037-1044. [PubMed] [DOI] |
| 9. | Chan JL, Tang KC, Patel AP, Bonilla LM, Pierobon N, Ponzio NM, Rameshwar P. Antigen-presenting property of mesenchymal stem cells occurs during a narrow window at low levels of interferon-gamma. Blood. 2006;107:4817-4824. [PubMed] [DOI] |
| 10. | Liu Y, Wang L, Kikuiri T, Akiyama K, Chen C, Xu X, Yang R, Chen W, Wang S, Shi S. Mesenchymal stem cell-based tissue regeneration is governed by recipient T lymphocytes via IFN-γ and TNF-α. Nat Med. 2011;17:1594-601. [PubMed] [DOI] |
| 11. | Dang S, Xu H, Xu C, Cai W, Li Q, Cheng Y, Jin M, Wang RX, Peng Y, Zhang Y. Autophagy regulates the therapeutic potential of mesenchymal stem cells in experimental autoimmune encephalomyelitis. Autophagy. 2014;10:1301-1315. [PubMed] [DOI] |
| 12. | Ortiz LA, Dutreil M, Fattman C, Pandey AC, Torres G, Go K, Phinney DG. Interleukin 1 receptor antagonist mediates the antiinflammatory and antifibrotic effect of mesenchymal stem cells during lung injury. Proc Natl Acad Sci U S A. 2007;104:11002-11007. [PubMed] [DOI] |
| 13. | Girard S, Kadhim H, Larouche A, Roy M, Gobeil F, Sébire G. Pro-inflammatory disequilibrium of the IL-1 beta/IL-1ra ratio in an experimental model of perinatal brain damages induced by lipopolysaccharide and hypoxia-ischemia. Cytokine. 2008;43:54-62. [PubMed] [DOI] |
| 14. | Kay J, Calabrese L. The role of interleukin-1 in the pathogenesis of rheumatoid arthritis. Rheumatology (Oxford). 2004;43 Suppl 3:iii2-iii9. [PubMed] [DOI] |
| 15. | Tron K, Novosyadlyy R, Dudas J, Samoylenko A, Kietzmann T, Ramadori G. Upregulation of heme oxygenase-1 gene by turpentine oil-induced localized inflammation: involvement of interleukin-6. Lab Invest. 2005;85:376-387. [PubMed] [DOI] |
| 16. | Xiao JQ, Shi XL, Ma HC, Tan JJ, Lin-zhang Q, Ding YT. Administration of IL-1Ra chitosan nanoparticles enhances the therapeutic efficacy of mesenchymal stem cell transplantation in acute liver failure. Arch Med Res. 2013;44:370-379. [PubMed] [DOI] |
| 17. | Corey DR. Chemical modification: the key to clinical application of RNA interference? J Clin Invest. 2007;117:3615-3622. [PubMed] [DOI] |
| 18. | Kawakami S, Hashida M. Targeted delivery systems of small interfering RNA by systemic administration. Drug Metab Pharmacokinet. 2007;22:142-151. [PubMed] [DOI] |
| 19. | Akhtar S, Benter I. Toxicogenomics of non-viral drug delivery systems for RNAi: potential impact on siRNA-mediated gene silencing activity and specificity. Adv Drug Deliv Rev. 2007;59:164-182. [PubMed] [DOI] |
| 20. | Ryther RC, Flynt AS, Phillips JA, Patton JG. siRNA therapeutics: big potential from small RNAs. Gene Ther. 2005;12:5-11. [PubMed] [DOI] |
| 21. | Song E, Lee SK, Wang J, Ince N, Ouyang N, Min J, Chen J, Shankar P, Lieberman J. RNA interference targeting Fas protects mice from fulminant hepatitis. Nat Med. 2003;9:347-351. [PubMed] [DOI] |
| 22. | Saito Y, Kon S, Fujiwara Y, Nakayama Y, Kurotaki D, Fukuda N, Kimura C, Kanayama M, Ito K, Diao H. Osteopontin small interfering RNA protects mice from fulminant hepatitis. Hum Gene Ther. 2007;18:1205-1214. [PubMed] [DOI] |
| 23. | Sato A, Takagi M, Shimamoto A, Kawakami S, Hashida M. Small interfering RNA delivery to the liver by intravenous administration of galactosylated cationic liposomes in mice. Biomaterials. 2007;28:1434-1442. [PubMed] [DOI] |
| 24. | Kitano Y, Radu A, Shaaban A, Flake AW. Selection, enrichment, and culture expansion of murine mesenchymal progenitor cells by retroviral transduction of cycling adherent bone marrow cells. Exp Hematol. 2000;28:1460-1469. [PubMed] |
| 25. | Foged C. siRNA delivery with lipid-based systems: promises and pitfalls. Curr Top Med Chem. 2012;12:97-107. [PubMed] [DOI] |
| 26. | Gooding M, Browne LP, Quinteiro FM, Selwood DL. siRNA delivery: from lipids to cell-penetrating peptides and their mimics. Chem Biol Drug Des. 2012;80:787-809. [PubMed] [DOI] |
| 27. | Mizuguchi Y, Yokomuro S, Mishima T, Arima Y, Shimizu T, Kawahigashi Y, Kanda T, Yoshida H, Takizawa T, Tajiri T. Short hairpin RNA modulates transforming growth factor beta signaling in life-threatening liver failure in mice. Gastroenterology. 2005;129:1654-1662. [PubMed] |
| 28. | Liu MS, Zhao ZF, Wang L, Zhang GY, Zhang Y, Yang H, Qiao JG, Han DW. [Recombinant adenovirus vector with Fas (CD95)-targeted shRNAs inhibited LPS-inducing Fas overexpression of mouse hepatocytes]. Zhonghua Gan Zang Bing Za Zhi. 2007;15:475-476. [PubMed] |
| 29. | Jiang N, Zhang X, Zheng X, Chen D, Siu K, Wang H, Ichim TE, Quan D, McAlister V, Chen G. A novel in vivo siRNA delivery system specifically targeting liver cells for protection of ConA-induced fulminant hepatitis. PLoS One. 2012;7:e44138. [PubMed] [DOI] |
| 30. | Koppers-Lalic D, Hogenboom MM, Middeldorp JM, Pegtel DM. Virus-modified exosomes for targeted RNA delivery; a new approach in nanomedicine. Adv Drug Deliv Rev. 2013;65:348-356. [PubMed] [DOI] |