修回日期: 2014-08-06
接受日期: 2014-08-26
在线出版日期: 2014-10-08
目的: 与已知治疗肝硬化有效药物熊去氧胆酸(ursodeoxycholic acid, UDCA)(商品名: 优思弗)进行比较, 评估牛磺熊去氧胆酸(tauroursodeoxycholic acid, TUDCA)(商品名: 滔罗特)治疗肝硬化患者的安全性及有效性.
方法: 2011-06/2014-01于华中科技大学同济医学院协和医院及湖北省新华医院门诊或病房收集肝硬化患者48例, 所有符合入选条件的患者填写知情同意书后随机分为TUDCA组(实验组)和UDCA组(对照组), 其中实验组有4例在治疗前后均自愿接受肝活检, 对照组有2例治疗前后接受肝活检. 实验组口服TUDCA胶囊15 mg/(kg·d), 对照组按相同剂量口服UDCA, 治疗6 mo. 观察记录服药期间患者临床症状、生化及组织学的变化, 以评估疗效.
结果: 试验共纳入48例肝硬化患者, 试验期间脱落及退出5例, 43例完成药物观察, 其中实验组21例, 对照组22例. 治疗前两组患者性别组成、病因分类、年龄及生化学指标无明显差异, 在治疗3 mo时, 实验组: 谷丙转氨酶(alanine aminotransferase, ALT)、谷草转氨酶(aspartate aminotransferase, AST)、碱性磷酸酶(alkaline phosphatase, ALP)、γ谷氨酰转移酶(γ-glutamyl transferase, GGT)及白蛋白较前明显改善, 治疗前后具有统计学意义; 对照组: AST及白蛋白较治疗前明显改善, 治疗前后具有明显统计学意义; 在治疗6 mo时, 实验组血清AST、ALP、GGT和白蛋白较治疗前有明显改善, 治疗前后差异具有统计学意义(P<0.05); 对照组血清ALT、GGT和白蛋白水平有明显改善, 治疗前后差异具有统计学意义(P<0.05); 而且, 治疗结束时实验组ALP、AST下降较对照组明显, 具有明显统计学意义(P<0.05); 实验组两例肝穿患者中有2例肝穿组织学分别由治疗前G2S3、G3S2转变为G2S1、G2S1, 另外2例组织学治疗前后无明显变化, 对照组两例治疗前后组织学无明显变化; 两组肝纤维化指标较治疗前均降低, 但差异无统计学意义; 两组血常规、肾功能、血沉、大小便常规及电解质水平较治疗前无明显变化, 无统计学意义; 两种治疗耐受性良好, 治疗过程中无明显不良反应发生.
结论: 口服TUDCA[15 mg/(kg·d)]能改善改善肝硬化患者的肝功能指标, 尤其是改善胆汁淤积指标水平, 并可能延缓患者的肝纤维化进程, 是治疗肝硬化患者安全有效的药物, 其作用可能略优于UDCA.
核心提示: 牛磺熊去氧胆酸(tauroursodeoxycholic acid, TUDCA)作为熊去氧胆酸(ursodeoxycholic acid)的衍生物, 能改善肝硬化患者由于小胆管闭塞所致胆汁淤积水平, 并可能延缓肝硬化进展甚至逆转早期肝纤维化, 口服TUDCA[15 mg/(kg·d)]治疗肝硬化是安全有效的.
引文著录: 赵莉, 潘晓莉, 黄景荣, 计春燕, 屈银宗, 汪毅, 叶进. 牛磺熊去氧胆酸与熊去氧胆酸治疗肝硬化的临床效果比较. 世界华人消化杂志 2014; 22(28): 4338-4344
Revised: August 6, 2014
Accepted: August 26, 2014
Published online: October 8, 2014
AIM: To evaluate the efficacy and safety of tauroursodeoxycholic acid (TUDCA) vs ursodeoxycholic acid (UDCA) in patients with liver cirrhosis.
METHODS: Forty-eight patients with cirrhosis treated at Wuhan Union Hospital and Hubei Province Xinhua Hospital were enrolled. The patients were randomly divided into either a TUDCA group or a UDCA group. The TUDCA group had four cases receiving liver biopsy and the UDCA group had two cases. Both drugs were administered at a daily dose of 15 mg/(kg·d) in a randomly assigned sequence for a 6 mo period. Clinical, biochemical and histological features were recorded before and after the treatments to assess the clinical effects of TUDCA.
RESULTS: Forty-three patients were included in the final analysis. The TUDCA group had 21 patients and the UDCA group had 22 patients. Before treatment, there were no significant differences in age, sex or blood chemistry parameters between the two groups. After three months of treatment, serum alanine aminotransferase (ALT), aspartate aminotransferase (AST), γ-glutamyl transferase (GGT) and alkaline phosphatase (ALP) levels in the TUDCA group while only AST level in the UDCA group significantly reduced from baseline (P < 0.05). Serum albumin levels significantly increased in both groups (P < 0.05), and serum AST levels decreased more significantly in the TUDCA group than in the UDCA group. After 6 mo of treatment, serum AST, GGT and ALP levels in the TUDCA group while ALT and GGT levels in the UDCA group significantly reduced from baseline (P < 0.05). Serum albumin levels significantly increased in both groups (P < 0.05). Moreover, serum AST and ALP levels in the TUDCA group decreased more significantly than those in the UDCA group. Two patients in the TUDCA group had significant histological relief. Both treatments were well tolerated, and there was no side effect associated with treatment.
CONCLUSION: TUDCA [15 mg/(kg·d)] therapy is safe and appears to be more effective than UDCA in the treatment of liver cirrhosis, particularly in the improvement of biochemical parameters. TUDCA may delay the progression of liver fibrosis.
- Citation: Zhao L, Pan XL, Huang JR, Ji CY, Qu YZ, Wang Y, Ye J. Clinical effects of tauroursodeoxycholic acid vs ursodeoxycholic acid in treatment of liver cirrhosis. Shijie Huaren Xiaohua Zazhi 2014; 22(28): 4338-4344
- URL: https://www.wjgnet.com/1009-3079/full/v22/i28/4338.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i28.4338
肝硬化是各种病因引起的慢性肝病的最终结局, 其并发症如肝癌、自发性腹膜炎、肝肾综合征等是导致患者生存质量下降的严重因素, 严重降低了肝硬化患者的生活质量. 肝硬化患者的首要治疗目标是减轻肝功能和肝纤维化指标的异常, 减少其并发症的发生. 目前研究表明, 熊去氧胆酸(ursodeoxycholic acid, UDCA), 商品名为优思弗, 作为亲水性胆汁酸, 可以增加亲水性胆汁酸池, 拮抗疏水性胆汁酸的细胞不良反应, 保护肝细胞, 在肝硬化、脂肪肝、胆结石及一些胆道相关性疾病的治疗上有一定疗效[1-5]. 牛磺熊去氧胆酸(tauroursodeoxycholic acid, TUDCA), 商品名为滔罗特, 是一种天然的结合型胆汁酸, 广泛存在人和动物的胆汁中, 较UDCA多一个牛磺酸基团, 亲水性高而毒性低, 其在治疗原发性胆汁性肝硬化、慢性病毒性肝炎和胆固醇结石等肝脏疾病中的效果在国外已有不少报道[6], 目前其已经被证实是治疗原发性胆汁性肝硬化的安全有效的药物, 其能较快降低胆酶水平, 疗效可能优于UDCA[7]. 但是目前国内对TUDCA治疗其他病因引起的肝硬化临床统计的较少. 临床上, 对于肝硬化患者常伴有肝酶及胆酶的升高, 对症治疗可以使转氨酶下降, 但胆汁淤积指标碱性磷酸酶(alkaline phosphatase, ALP)、谷氨酰转移酶(γ-glutamyl transferase, GGT)却很难达到满意的水平. 为此, 我们对2011-06/2014-01服用两种不同药物(TUDCA、UDCA)的肝硬化患者治疗前后的生化指标、影像学及组织学及临床症状进行观察分析, 为临床医师对肝硬化患者用药提供依据及参考.
2011-6/2014-01于华中科技大学同济医学院协和医院及湖北省新华医院门诊或病房收集肝硬化患者48例, 按照数字随机分组法分成实验组(TUDCA组)及对照组(UDCA组). 入选标准: 年龄在18-75岁; 符合2000年中华医学会传染病与寄生虫病学分会、肝病学分会联合修订的诊断标准[8]. 排除肝功能衰竭及需考虑肝移植者及有严重并发症如上消化道出血、肝性脑病、肝肾综合征、严重的心、肾功能不良者. 退出条件: 对本药过敏; 发生严重不良事件、并发症或特殊生理变化不宜继续接受试验; 自行退出者. 退出者不能被替代. 两组病例入院时性别、年龄、血生化学检查、大小便常规及影像学检查、Child评分等方面比较差异均无统计学意义. TUDCA: 商品名: 滔罗特, 意大利贝斯迪大药厂生产, 250 mg/粒; UDCA: 商品名: 优思弗, 德国Dr.Falk药厂生产, 250 mg/粒.
1.2.1 研究设计: 本试验为随机、平行对照临床试验. 患者被随机以1:1的比例随机接受TUDCA或UDCA, 所有患者均在常规保肝、抗病毒及对症等基础上口服TUDAC或UDCA. 服药方法: 口服, 15 mg/(kg·d), 3次/d或2次/d, 服药3 mo时行肝功能检查, 服药6 mo时复查患者血常规、肝肾功能、电解质及影像学检查, 实验组及对照组各有4例患者进行经皮肝穿刺活检评估疾病进展, 组织学改变根据公认标准由病理医生判断. 以提供评价TUDCA治疗肝硬化的有效性和安全性的数据和资料.
1.2.2 药品分配: 患者经筛查后随机入组, 并按随机表接受相应药物治疗.
1.2.3 有效性及安全性评价: 主要终点是血清谷丙转氨酶(alkaline phosphatase, ALT)、谷草转氨酶(aspartate aminotransferase, AST)、ALP、GGT的下降幅度与基线水平相比较应不低于25%; 次要终点在血清肝纤维化指标方面有显著差异, 以及在肝组织学评定方面有显著性差异. 在试验第6月的28 d所有患者要进行临床症状及血液生化的检测以评估其安全性.
统计学处理 使用SPSS17.0进行统计分析. 数据以中位数与四分位间距或mean±SD表示, 正态分布的两样本计量资料的比较采用独立样本t检验或配对t检验, 非正态分布的两样本计量资料的比较用非参数检验, 计数资料的比较采用χ2检验, 所有的统计检验均采用双侧检验, P<0.05为差异有统计学意义.
共纳入48例肝硬化患者, 所有患者影像学均符合肝硬化期表现. 数字随机分组法随机把48例患者分为对照组和治疗组, 试验期间脱落或退出5例, 43例完成药物观察, 其中乙型肝炎肝硬化患者20例, 原发性胆汁淤积性肝硬化患者10例, 丙型肝炎肝硬化患者13例(Child A 16例、Child B 27例). 实验结束时实验组21例, 男10例, 女11例, 平均年龄51.55岁±10.66岁, 对照组22例, 男11例, 女11例, 平均年龄46.0岁±11.95岁; 其中实验组患者乙型肝炎肝硬化患者10例, 原发性胆汁性肝硬化5例, 丙型肝炎肝硬化患者6例, 对照组乙型肝炎肝硬化10例, 原发性胆汁淤积性肝硬化5例, 丙型肝炎肝硬化7例.
2组患者在入组时, 其性别、年龄、体质量指数、病因和Child-Pugh评分在两组之间没有明显差异, 具有可比性(表1). 两组间血常规、肝功能、肝纤维化、肾功能指标在治疗前的差异无统计学意义(表2). 所有患者的依从性良好, 无患者服药少于总剂量的95%.
| 特征 | TUDCA组 | UDCA组 | P值 |
| n | 21 | 22 | |
| 男/女 | 10/11 | 11/11 | >0.5 |
| 乙型肝炎肝硬化/PBC/丙型肝炎肝硬化 | 10/5/6 | 10/5/7 | >0.5 |
| 年龄(岁) | 53.0(40.5-60.5) | 50.0(37-53.5) | >0.5 |
| BMI(kg/m2) | 21.3(15.4-20.4) | 22.8(18.5-24.3) | >0.5 |
| Child-Pugh A/B | 8/13 | 8/14 | >0.5 |
| 分组 | n | WBC(×109/L) | RBC(×1012/L) | PLT(×109/L) | BUN(mmol/L) | Cr(μmol/L) | |
| A组 | 治疗前 | 21 | 4.49±1.86 | 3.80±0.78 | 113.33±81.35 | 5.78±2.13 | 73.80±21.30 |
| 治疗后 | 21 | 4.73±1.63 | 4.04±0.70 | 106.79±64.60 | 5.25±0.95 | 74.01±19.05 | |
| B组 | 治疗前 | 22 | 3.74±1.76 | 3.40±0.61 | 121.33±83.41 | 5.25±2.53 | 65.50±21.60 |
| 治疗后 | 22 | 4.53±1.39 | 3.88±0.59 | 229.11±178.78 | 4.59±1.87 | 62.00±22.30 |
2.2.1 生化学变化: 治疗前, 两组肝功能无明显差异, 治疗3 mo时, TUDCA组总胆红素、ALT、AST、GGT及ALP均值分别较服药前下降10.3%、43.4%、55.7%、50.7%、23.3%, 血清白蛋白均值较前上升18.2%, 其中血清ALT、AST、ALP、GGT及白蛋白较治疗前有明显改善, 均有统计学意义, UDCA组血清总胆红素、ALT、AST、GGT及ALP均值分别较服药前下降9.5%、5.3%、13.5%、27.8%、3.4%, 血清白蛋白均值较前上升10.5%, 其中血清AST及白蛋白较治疗前明显改善, 具有统计学意义; 在治疗6 mo后, TUDCA组血清总胆红素、ALT、AST、ALP和GGT的均值分别较服药前下降13.7%、42.8%、45.9%、38.4%和47.7%, 血清白蛋白的均值较服药前升高16.8%, 其中血清AST、ALP、GGT和白蛋白有明显改善, 治疗前后差异具有统计学意义(P<0.05); UDCA组治疗3 mo时, AST及白蛋白较治疗前有明显改善, 具有统计学意义; 治疗结束时血清总胆红素、ALT、AST、ALP和GGT的均值分别较服药前下降19.9%、24.7%、30.5%、8.6%和29.8%, 血清白蛋白的均值较服药前升高10.1%, 其中血清ALT、GGT和白蛋白水平有明显改善, 治疗前后差异具有统计学意义(P<0.05); 两组治疗结束后, TUDCA组ALP及AST下降较UDCA组明显, 具有明显统计学意义(P<0.05); 两组的血清胆红素在治疗后轻度降低, 但差异较服药前无统计学意义. 除在3 mo时两组间血清AST水平的差异有统计学意义(P<0.05), 两组间治疗前后无其他指标的差异有统计学意义(表3).
| 分组 | ALT(U/L) | AST(U/L) | ALP(U/L) | GGT(μmol/L) | 白蛋白(g/L) | |
| A组 | 治疗前 | 116.0(32.5, 237.5) | 85.0(55.5, 221.0) | 179.0(136.0, 296.0) | 242.0(131.0, 356.5) | 34.2(6.7, 20.3) |
| 治疗3 mo | 34.0(14.5, 51.0)a | 42.0(58.5, 27.0)b | 132.0(98.0, 164.0)a | 56.0(37.5, 87.0)a | 38.6(33.9, 46.2)a | |
| 治疗6 mo | 31.0(18.5, 62.5) | 39.0(29.5, 62.5)ac | 100.1(69.5, 127.0)bd | 50.0(30.5, 145.5)b | 44.9(38.4, 48.5)a | |
| B组 | 治疗前 | 57.0(26.0, 98.5) | 74.0(52.0, 97.0) | 291.0(104.0, 402.0) | 186.0(53.0, 353.5) | 35.5(32.6, 36.95) |
| 治疗3 mo | 32.0(26.0, 93.0) | 67.0(44.5, 100.0)a | 196.0(126.7, 329.0) | 88(40.5, 301.0) | 40.2(35.2, 40.9)a | |
| 治疗6 mo | 29.0(24.0, 49.5)a | 43.0(38.5, 84.0) | 171.0(121.5, 412.5) | 56.0(33.0, 336.0)a | 36.5(35.15, 42.55)a |
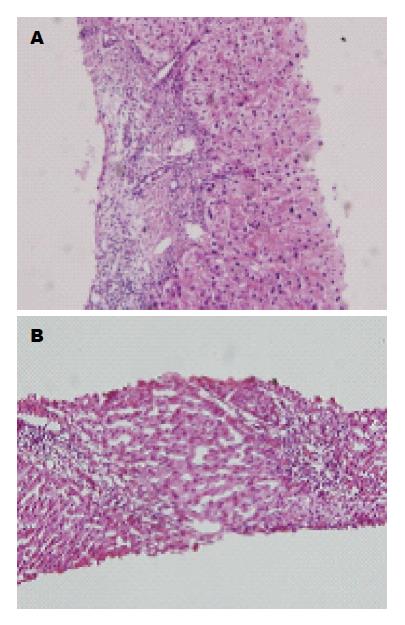
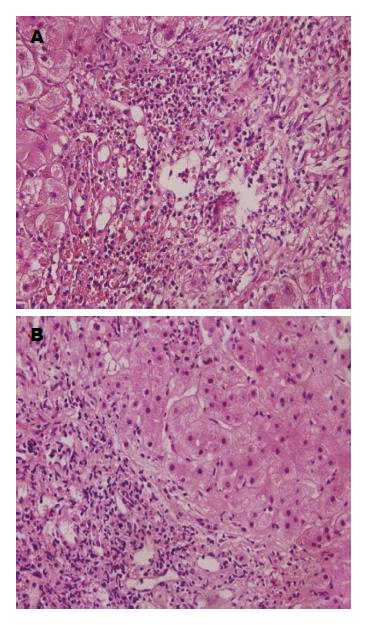
2.2.2 组织学变化: 有6例患者在治疗期间接受经皮肝穿刺活检, TUDCA组4例, UDCA组2例. 根据中国慢性肝炎炎症活动和肝纤维化计分方案[9], 治疗前患者肝脏病理改变均达G2-3及S2-4. 只有TUDCA组中的两例诊断为乙型肝炎肝硬化及原发性胆汁淤积性肝硬化患者的病理诊断从服药前的G2S3、G3S2转变为G2S1、G2S1(图1); 其他4例患者在组织学方面没有明显变化(图2).
两组药物均耐受性良好, 无不良反应报道. 患者的血常规、肾功能在服药前后均无明显变化(表2), 这表明两组药物在6 mo的治疗过程中15 mg/(kg·d)的治疗量是安全的.
UDCA有效成分为UDCA, 具有较强的亲水性, 长期服用可以改善患者肝功能, 目前已经被证实是治疗原发性胆汁性肝病的有效药物[10], 而TUDCA是一种与牛磺酸结合的亲水性胆汁酸, 广泛存在于人和动物的胆汁中, 是UDCA分泌在胆汁中的生理活性成分. 与UDCA相比, TUDCA以阴离子形式存在, 在不同pH值的环境下均为水溶性, 故更易在肠道吸收及被肝脏摄取[7]. 已有文献表明TUDCA在肠肝循环中生物利用度高, 肝脏摄取能力较强, 较UDCA更能促进胆汁排泄, 保护肝细胞、抑制肝细胞的凋亡[7], 口服TUDCA后肝内胆汁酸的组成和循环胆汁酸的成分和浓度与UDCA类似, 但生物利用度较高[11,12]. 因此, TUDCA表现出更有利于治疗肝脏疾病的代谢特性.
我们通过对TUDCA治疗肝硬化患者的疗效进行观察, 并与UDCA相比较, 评价其疗效. 结果表明, UDCA可以改善肝硬化患者肝功能, 这与文献报道的相符[13]. TUDCA作为牛磺酸与UDCA结合的一种天然的结合型胆汁酸, 治疗改善肝硬化患者的肝功能较UDCA明显, 这与Cagliaris等[14]的研究结果相近, 其研究对象是等待肝移植的肝硬化患者, 使用TUDCA治疗可改善胆汁淤积和细胞溶解的相关生化指标, 并有助于保持肝硬化患者临床症状和肝功能的稳定. TUDCA改善肝硬化患者血清生化指标的确切机制尚未完全阐明. 除了改善内源性胆盐的破坏作用, TUDCA还具有细胞保护作用, 通过直接调节死亡和生存的转录因子, TUDCA可保护线粒体和内质网膜, 从而改善内源和外源性凋亡途径以及内质网应激所致的肝细胞损伤[15-17]. 试验中两组血清白蛋白水平均有一定程度的升高. 其血清白蛋白升高, 可能与患者肝功能的改善有关.
这两种药物能否对肝硬化患者组织学改善仍有争论, TUDCA组虽有2例患者出现组织学改善, 但不足以表现出其明确的抗纤维化作用. 而在动物实验中, 研究发现TUDCA具有抗纤维化作用, 其可以通过降低转化生长因子β1的合成, 抑制肝星状细胞活化, 减少细胞外基质合成, 从而减轻CCl4诱导的大鼠肝纤维化[18]. UDCA被证明可以通过抑制胶原蛋白的表达和其他细胞外基质成分来抑制免疫介导的大鼠肝纤维化的发展[19]. Voumvouraki等[20]最近报道经过6 mo的UDCA治疗原发性胆汁性肝硬化后, 血清透明质酸、层黏连蛋白、Ⅳ型胶原蛋白无明显改善. 考虑到6 mo的疗程不足以避免肝硬化自然病程对结果的影响, 而且肝硬化患者的肝内组织学表现并不完全一致, 肝穿时可能会出现抽样误差, 因此, 更长时间的临床观察可能才能解释人类和动物研究之间的不一致.
对于除PBC的其他类型的肝硬化患者, UDCA对患者的远期疗效仍存在质疑, 有研究表明UDCA并不能改善此类患者的生存率[21]. TUDCA作为UDCA的衍生物, 我们研究表明其能改善患者肝功能, 并可能延缓肝硬化进展甚至逆转早期肝纤维化, 在改善肝功能生化异常方面较UDCA可能更为有效. 但由于我们样本量较少, 数据较离散, 观察周期较短, 其对肝硬化患者能否降低肝硬化并发症的发生率及能否改善肝硬化患者的生存率仍有待于大样本及更长时间的观察研究.
在这项研究中TUDCA治疗并未造成显著的不良反应如腹泻、恶心等, 没有患者因为药物不耐受而退出试验. 在研究期间, 两组患者治疗前后的血常规、肾功能的生化指标无显著变化, 这表明治疗量的TUDCA未影响这些生化指标. 因此, TUDCA与UDCA一样有良好的安全性. 此外, 6 mo治疗后TUDCA组血清肝功能改善程度较好的达到了主要治疗终点, 且下降幅度明显高于UDCA组; 且TUDCA组中两例患者治疗后达到组织学改善. 所以在肝硬化治疗中, TUDCA对改善肝功能不良方面可能比UDCA更为有效.
总之, TUDCA治疗肝硬化是安全的, 而且在改善肝功能生化异常方面较UDCA可能更为有效. 临床上, 其能否抗肝脏纤维化及能否影响患者的生存率, 需要我们行大样本及更长时间的试验来证实.
肝硬化是临床上常见的慢性进行性肝病, 是由一种或多种病因长期反复作用形成的弥漫性的慢性肝损害, 肝硬化晚期由于小胆道的阻塞引起胆汁排泄障碍以及回肠主动吸收肠腔内的胆汁酸, 使内源性疏水性胆汁酸在肝细胞内潴留, 进一步加重肝细胞的损伤, 使患者肝功能进一步恶化, 严重危害患者的生存质量.
刘占举, 教授, 同济大学附属上海市第十人民医院; 赵铁建, 教授, 广西中医药大学基础医学院生理学教研室; 杨家和, 教授, 中国人民解放军第二军医大学附属东方肝胆外科医院综合治疗三科
牛磺熊去氧胆酸(tauroursodeoxycholic acid, TUDCA)具有较强的亲水性, 长期服用可以改善患者肝功能, 目前已经被证实是治疗原发性胆汁性肝硬化的有效药物, 已有动物实验研究TUDCA可能通过抑制转化生长因子-β(transforming growth factor-β, TGF-β)表达来延缓肝硬化进程, 且各种病因所致的肝硬化患者均常常伴有不同程度的胆汁淤积, 会更进一步加重肝细胞的损害, 因此, 除针对病因治疗肝硬化外, 改善胆汁淤积延缓肝硬化进展亦显得尤为重要.
TUDCA在肠肝循环中生物利用度高, 肝脏摄取能力较强, 较熊去氧胆酸(ursodeoxycholic acid, UDCA)更能促进胆汁排泄, 保护肝细胞、抑制肝细胞的凋亡. 动物实验研究TUDCA可能通过抑制TGF-β1表达来延缓肝硬化进程. Cagliaris等对待肝移植的肝硬化患者口服TUDCA治疗可改善胆汁淤积和细胞溶解的相关生化指标, 并有助于保持肝硬化患者临床症状和肝功能的稳定.
与既往研究不同的是, 我们对随访40余例不同病因所致的肝硬化患者, 除观察其生化指标变化, 我们追加了两组患者的肝脏病理学治疗前后变化, 与报道的动物实验有相似结果, 即TUDCA可能会延缓或逆转肝硬化进展.
本文通过平行对照研究观察TUDCA治疗肝硬化的临床疗效, 对临床指导肝硬化尤其是伴有胆汁淤积的患者有一定的参考意义.
编辑: 郭鹏 电编: 闫晋利
| 1. | Kuiper EM, Hansen BE, Lesterhuis W, Robijn RJ, Thijs JC, Engels LG, Koek GH, Aparicio MN, Kerbert-Dreteler MJ, van Buuren HR. The long-term effect of ursodeoxycholic acid on laboratory liver parameters in biochemically non-advanced primary biliary cirrhosis. Clin Res Hepatol Gastroenterol. 2011;35:29-33. [PubMed] [DOI] |
| 2. | 王 晓艳, 沈 守荣, 李 楠, 李 予. 熊去氧胆酸治疗乙型肝炎肝硬化的临床疗效. 中南大学学报(医学版). 2010;35:171-175. |
| 3. | Fischer S, Müller I, Zündt BZ, Jüngst C, Meyer G, Jüngst D. Ursodeoxycholic acid decreases viscosity and sedimentable fractions of gallbladder bile in patients with cholesterol gallstones. Eur J Gastroenterol Hepatol. 2004;16:305-311. [PubMed] |
| 4. | Copaci I, Micu L, Iliescu L, Voiculescu M. New therapeutical indications of ursodeoxycholic acid. Rom J Gastroenterol. 2005;14:259-266. [PubMed] |
| 5. | Ratziu V, De Ledinghen V, Oberti F, Mathurin P, Wartelle-Bladou C, Renou C, Spnard J. A multi-centric, double-blind, randomized-controlled trial (RCT) of high dose ursodeoxycholic acid in patients with non-alcoholic steatohepatitis (NASH) [Abstract]. J Hepatol. 2009;50:S21. |
| 6. | Boatright JH, Nickerson JM, Moring AG, Pardue MT. Bile acids in treatment of ocular disease. J Ocul Biol Dis Infor. 2009;2:149-159. [PubMed] |
| 7. | Invernizzi P, Setchell KD, Crosignani A, Battezzati PM, Larghi A, O'Connell NC, Podda M. Differences in the metabolism and disposition of ursodeoxycholic acid and of its taurine-conjugated species in patients with primary biliary cirrhosis. Hepatology. 1999;29:320-327. [PubMed] |
| 10. | Lindor KD, Gershwin ME, Poupon R, Kaplan M, Bergasa NV, Heathcote EJ. Primary biliary cirrhosis. Hepatology. 2009;50:291-308. [PubMed] [DOI] |
| 11. | Setchell KD, Rodrigues CM, Podda M, Crosignani A. Metabolism of orally administered tauroursodeoxycholic acid in patients with primary biliary cirrhosis. Gut. 1996;38:439-446. [PubMed] |
| 12. | Crosignani A, Battezzati PM, Setchell KD, Invernizzi P, Covini G, Zuin M, Podda M. Tauroursodeoxycholic acid for treatment of primary biliary cirrhosis. A dose-response study. Dig Dis Sci. 1996;41:809-815. [PubMed] |
| 13. | Buongiorno G, Quaranta GM, Penna A, Guerra V, Misciagna G, Manghisi OG. [The effect of ursodeoxycholic acid in patients with liver cirrhosis and chronic hypertransaminasemia]. Minerva Gastroenterol Dietol. 1994;40:31-36. [PubMed] |
| 14. | Caglieris S, Giannini E, Dardano G, Mondello L, Valente U, Testa R. Tauroursodeoxycholic acid administration as adjuvant therapy in cirrhotic patients on transplantation waiting lists. Hepatogastroenterology. 2000;47:1045-1047. [PubMed] |
| 15. | Ben Mosbah I, Alfany-Fernández I, Martel C, Zaouali MA, Bintanel-Morcillo M, Rimola A, Rodés J, Brenner C, Roselló-Catafau J, Peralta C. Endoplasmic reticulum stress inhibition protects steatotic and non-steatotic livers in partial hepatectomy under ischemia-reperfusion. Cell Death Dis. 2010;1:e52. [PubMed] [DOI] |
| 16. | Rodrigues CM, Solá S, Sharpe JC, Moura JJ, Steer CJ. Tauroursodeoxycholic acid prevents Bax-induced membrane perturbation and cytochrome C release in isolated mitochondria. Biochemistry. 2003;42:3070-3080. [PubMed] |
| 17. | Schoemaker MH, Conde de la Rosa L, Buist-Homan M, Vrenken TE, Havinga R, Poelstra K, Haisma HJ, Jansen PL, Moshage H. Tauroursodeoxycholic acid protects rat hepatocytes from bile acid-induced apoptosis via activation of survival pathways. Hepatology. 2004;39:1563-1573. [PubMed] |
| 18. | 王 丹, 杨 玲, 黄 金明, 王 保永, 李 靓, 钱 伟, 叶 进, 侯 晓华. 牛磺熊去氧胆酸抑制四氯化碳诱导的大鼠肝纤维化. 世界华人消化杂志. 2010;18:1979-1984. [DOI] |
| 19. | Zhang LX, Liang TJ, Tan YR, Ren WH, Han GQ, Zhang J, Wang LC, Qin CY. Protective effects of ursodeoxycholic acid against immune-mediated liver fibrosis in rats. Hepatogastroenterology. 2010;57:1196-1202. [PubMed] |
| 20. | Voumvouraki A, Koulentaki M, Notas G, Sfakianaki O, Kouroumalis E. Serum surrogate markers of liver fibrosis in primary biliary cirrhosis. Eur J Intern Med. 2011;22:77-83. [PubMed] [DOI] |
| 21. | Papatheodoridis GV, Hadziyannis ES, Deutsch M, Hadziyannis SJ. Ursodeoxycholic acid for primary biliary cirrhosis: final results of a 12-year, prospective, randomized, controlled trial. Am J Gastroenterol. 2002;97:2063-2070. [PubMed] |