修回日期: 2014-08-04
接受日期: 2014-08-26
在线出版日期: 2014-10-08
目的: 通过测定酒精性脂肪肝(alcoholic fatty liver, AFL)大鼠模型肝组织内甘油三酯(triglyceride, TG)、8-羟基脱氧鸟苷酸(8-hydroxy-guanin, 8-OHdG)与硫代巴比妥酸反应产物(thiobarbituric acid reaction substances, TBARS)的含量及抗氧化剂维生素E(vitamin E, VE)的干预研究, 探讨氧化应激(oxidative stress, OS)及脂质过氧化反应(lipid peroxidation, LPO)在AFL发病中的作用.
方法: 将45只Wistar大鼠随机分为空白组(Control, n = 15)、模型组[(ethanol, ET), n = 15]及实验组(ET+VE, n = 15), 空白组给予蒸馏水灌胃; AFL模型组给予鱼油2.5 mL/kg+ET灌胃; 实验组采用鱼油+ET灌胃, 同时加用VE 400 mg/kg灌胃. 第8周取肝组织, 采用比色法测定肝脏TG沉积; 酶联免疫吸附实验(enzyme linked immunosorbent assay, ELISA)测定肝脏8-OHdG和肝脏TBARS含量.
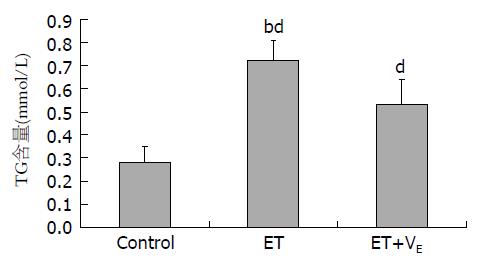
结果: 与对照组相比, AFL模型组大鼠肝脏TG沉积增加(0.72±0.09 vs 0.28±0.07, P<0.01), 肝8-OHdG(1.45±0.17 vs 0.52±0.21, P<0.01)及TBARS(65.2±9.7 vs 51.2±12.9, P<0.01)含量明显升高; 与模型组相比, 经VE干预后, 实验组大鼠肝内TG(0.53±0.11 vs 0.72±0.09, P<0.01)沉积减少, 8-OHdG(0.99±0.27 vs 1.45±0.17, P<0.01)及TBARS(55.6±12.6 vs 65.2±9.7, P<0.01)含量降低.
结论: AFL大鼠肝组织内TG沉积明显, 肝内8-OHdG和TBARS含量明显升高, 经抗氧化剂VE干预后, TG沉积减少, 肝内8-OHdG和TBARS含量降低. OS损伤及LPO损伤在AFL的发病过程中具有重要作用, 抗氧化剂VE可通过减轻OS及LPO损伤协同防治AFL.
核心提示: 本文通过检测酒精性脂肪肝(alcoholic fatty liver, AFL)模型大鼠肝内甘油三酯(triglyce-ride, TG)、8-羟基脱氧鸟苷酸(8-Hydroxy-Guanin)、硫代巴比妥酸反应产物(thiobarbituric acid reaction substances)的含量, 探讨AFL发病过程中TG沉积、氧化应激(oxidative stress)损伤及脂质过氧化反应(lipid peroxidation)的作用; 并通过维生素E(vitamin E, VE)的干预研究, 发现VE具有较明显的预防和治疗AFL的作用.
引文著录: 葛存锦, 郑世华, 仝巧云. 酒精性脂肪肝中8-OHdG与TBARS的表达及维生素E的干预实验. 世界华人消化杂志 2014; 22(28): 4312-4316
Revised: August 4, 2014
Accepted: August 26, 2014
Published online: October 8, 2014
AIM: To explore the role of oxidative stress (OS) and lipid peroxidation (LPO) in alcoholic fatty liver (AFL) in rats and to investigate the effect of vitamin E (VE) on AFL.
METHODS: Forty-five Wistar rats were randomly divided into three groups: a control group (n = 15), an ethanol group (ET, n= 15), and an ET + VE group (n = 15). The control group was given distilled water by gavage once a day for 8 wk. The ET group was given ET and fish oil by gavage. The ET + VE group was given additional VE compared with the ET group. Triglyceride (TG) in the liver was measured by colorimetric method. The contents of 8-hydroxy-deoxyguanosine (8-OHdG) and thiobarbituric acid reactive substances (TBARS) in the liver were measured by enzyme linked immunosorbent assay (ELISA).
RESULTS: The ET group had a significant increase in TG compared with the control group (0.72 ± 0.09 vs 0.28 ± 0.07, P < 0.01). After VE intervention, TG in the liver decreased. 8-OHdG (1.45 ± 0.17 vs 0.52 ± 0.21, P < 0.01) and TBARS (65.2 ± 9.7 vs 51.2 ± 12.9, P < 0.01) increased significantly in the ET group compared with the control group. 8-OHdG and TBARS decreased significantly in the ET + VE group compared with the ET group.
CONCLUSION: TG deposits obviously in the liver of AFL rats. OS and LPO play an important role in the pathogenesis of AFL. VE as an antioxidant can ameliorate AFL induced injury.
- Citation: Ge CJ, Zheng SH, Tong QY. Expression of 8-OHdG and TBARS in alcoholic fatty liver in rats: Implications for therapeutic effects of vitamin E. Shijie Huaren Xiaohua Zazhi 2014; 22(28): 4312-4316
- URL: https://www.wjgnet.com/1009-3079/full/v22/i28/4312.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i28.4312
酒精性肝病(alcoholic liver disease, ALD)是指长期过量饮酒导致的肝脏疾病, 包括酒精性脂肪肝(alcoholic fatty liver, AFL)、酒精性肝炎(alcoholic hepatitis, AH)、酒精性肝纤维化(alcoholic hepatic fibrosis, AHF)、酒精性肝硬化(alcoholic cirrhosis, AC)和肝细胞癌(hepatocellular carcinoma, HCC). ALD是世界范围内慢性肝病的最重要病因之一, 在我国, 随着生活水平的提高以及受"中国酒文化"的影响, ALD发病率呈逐渐上升的趋势, 已成为继病毒性肝炎之后导致肝损伤的第二大病因[1]. 据资料显示, 约90%-95%的饮酒者可发展为AFL, 但是只有30%-35%的饮酒者发展为较严重的ALD, 包括AH、AHF、AC和HCC, 说明除了酒精以外还有其他因素参与了ALD的发病机制[2,3]. 近年来, 氧化应激(oxidative stress, OS)和脂质过氧化损伤(lipid peroxidation, LPO)被认为是AFL形成和发展的重要因素, 8-羟基脱氧鸟苷酸(8-hydroxy-guanin, 8-OHdG)是敏感的DNA氧化损伤指标[4,5], 硫代巴比妥酸反应产物(thiobarbituric acid reaction substances, TBARS)涵盖了大部分氧化损伤产生的醛酮类物质, 是衡量脂质过氧化的一个敏感指标. 本文通过检测ALD大鼠肝脏8-OHdG和TBARS的含量, 并通过抗氧化剂维生素E(vitamin E, VE)的干预, 探讨OS和LPO在AFL发病中的作用.
选用健康♂Wistar大鼠60只, 体质量200 g±25 g, 随机分为3组: 空白组(Control)20只; 模型组(Ethanol, ET)20只; 实验组(ET+VE)20只. 给予普通维持级饲料, 自由进食水, 维持饲养环境温度在20 ℃-25 ℃. 所用甘油三酯(triglyceride, TG)试剂购自美国Abcam公司; 8-OHdG试剂盒购自美国Trevigen公司; TBARS试剂盒购自美国Cayman公司.
1.2.1 动物模型的制备: 空白组给予蒸馏水灌胃; AFL模型组给予鱼油2.5 mL/kg+ET灌胃, ET初始剂量为6 g/(kg·d), 2 wk内逐渐递增至8 g/(kg·d), 1次/d; 实验组采用鱼油+ET灌胃, 同时加用VE 400 mg/kg灌胃. 所有动物均于第8周麻醉取材, 留取肝组织, 并行肝脏病理检查确认ALD造模成功.
1.2.2 主要检测指标: 采用比色法测定肝脏TG沉积; 酶联免疫吸附实验(enzyme linked immunosorbent assay, ELISA)测定肝脏8-OHdG和肝脏TBARS含量.
统计学处理 采用SPSS19.0统计软件. 所测数据均采用mean±SD描述, 多组间变量采用单因素方差分析, P<0.05为差异有统计学意义.
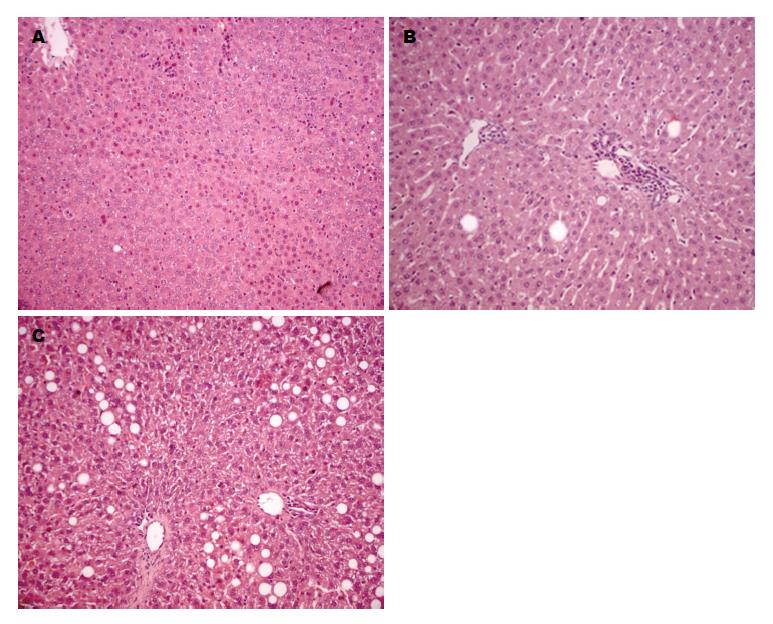
肉眼见空白组大鼠肝脏边缘光滑, 呈红褐色, 柔软而富有弹性; 模型组大鼠肝脏体积增大, 边缘厚钝, 表面及切面呈灰黄色, 有油腻感; 实验组大鼠肝脏形态介于空白组及模型组之间. 病理切片示AFL组模型大鼠肝细胞脂肪变性明显, 肝细胞充满大小不等的脂肪空泡; 空白对照组基本正常; VE干预组大鼠肝细胞内脂肪空泡较脂肪肝组少, 较空白对照组多(图1).
与空白组相比, 模型组大鼠肝脏内TG含量明显升高(P<0.01), 实验组大鼠肝内TG含量较模型组低(P<0.01), 但仍高于空白组(P<0.01)(图2).
鱼油含有丰富的多不饱和脂肪酸, 可促进酒精性肝损伤, 本实验中动物模型采用鱼油和乙醇制作ALD动物模型, 方法简便易行, 适合进行ALD发病机制的研究[4]. 关于AFL的发病机制复杂, 其包括ET代谢产物及OS所致的肝损伤、肠源性内毒素血症对肝脏产生的"二次打击"[6]、免疫反应产生的促炎因子对肝细胞的损伤、肝内脂肪沉积等机制, AFL是一个多因素、多途径、多层次的损伤, 并且各个因素之间相互关联共同促进AFL的发生和发展, 目前关于AFL的发病机制尚不完全清楚[7], 有学者认为细胞色素P450系统[主要为细胞色素P450 2E1(cytochrome P450 2E1, CYP2E1)]在酒精代谢过程中产生的氧自由基是造成AFL肝损伤的重要环节[8]. 本文就OS及LPO在AFL的发病过程中的作用加以研究.
人体摄入的酒精90%由肝脏代谢, 酒精代谢是造成ALD的主要原因. 在肝脏中, ET的氧化代谢通过3个酶系统催化完成, 即ADH、细胞色素P450系统(主要为CYP2E1)、过氧化氢酶系统. CYP2E1在酒精代谢过程中可产生乙醛和活性氧自由簇, 产生OS反应, 引起肝细胞损伤、炎症以及细胞外基质产生和纤维化的形成. 在正常情况下, 细胞内存在自由基清除剂, 如SOD、GSH、VE等, 但是长期饮酒可使CYP2E1活性增加, 导致自由基增加, 抗氧化物质被大量消耗, 体内的氧化-抗氧化机制失去平衡, 氧化产物相对过剩, 产生OS反应, 损伤肝细胞, 引起肝组织内大量TG沉积, 形成ALD[9-11].
AFL大鼠肝组织内TG沉积较多, 经抗氧化剂VE干预后, 肝组织内TG减少, 实验证明抗氧化剂VE可有效降低ALD大鼠肝组织内TG沉积, 可作为ALD的辅助治疗.
8-OHdG是DNA OS损伤的敏感标志物, 肝组织内8-OHdG含量可反映肝脏OS损伤程度. 本实验测量的TBARS涵盖了大部分氧化损伤产生的醛酮类物质, 因而目前认为TBARS可被作为衡量脂质过氧化损伤的敏感指标[12,13]. AFL组大鼠肝组织内8-OHdG明显升高, 反映AFL大鼠肝脏内DNA OS损伤程度较重, 经VE干预后, 8-OHdG水平有所下降. AFL大鼠因出现脂质过氧化损伤, 肝组织内TBARS含量升高, 经VE干预后, 抑制脂质过氧化反应, 减轻自由基损伤, 保护肝细胞, TBARS含量降低. VE是一种脂溶性抗氧化剂, 可将羟自由基转化为脂质过氧化物, 然后被谷胱甘肽过氧化酶4(glutathione peroxidase 4, GPX-4)代谢, 通过新的烷基自由基的形成来阻止自由基链的延伸, 清除活性氧, 抑制OS损伤[14,15].
本研究显示, ALD大鼠肝组织内TG沉积, 肝内8-OHdG和TBARS含量升高, 提示OS及LPO在ALD的发病过程中具有重要作用, 经抗氧化剂VE干预后, 肝内TG沉积减少, 8-OHdG和TBARS含量降低, 提示ALD大鼠肝经抗氧化剂干预, 可减轻肝脏OS及LPO, 抑制肝内TG沉积, 达到协同抗AFL的作用.
本文明确了在ALD的发病过程中, OS及LPO具有重要作用, 且AFL大鼠肝内TG沉积明显, 但关于TG在AFL肝内沉积的分子机制尚不完全清楚, 本实验组将就其机制进行后续研究.
随着现代生活方式的改变, 酒精性脂肪肝(alcoholic fatty liver, AFL)的发病率越来越高, 本文通过研究AFL的发病机制, 寻找预防和治疗AFL更有效的方法.
陈国凤, 主任医师, 中国人民解放军第302医院感染七科
国内外学者认为"二次打击"学说是AFL的重要发病机制, 氧化应激(oxidative stress, OS)损伤及脂质过氧化反应(lipid peroxidation, LPO)在AFL的发病过程中具有重要作用.
国内外很多学者研究认为AFL发病机制复杂, 是一个多因素、多途径、多层次的损伤, 并且各个因素之间相互关联共同促进AFL的发生和发展, 目前关于AFL的发病机制尚不完全清楚, 有学者认为细胞色素P450系统[主要为CYP2E1细胞色素P450 2E1(cytochrome P450 2E1)]在酒精代谢过程中产生的氧自由基是造成AFL肝损伤的重要环节.
本文采用检测OS损伤及LPO更为敏感的指标, 8-羟基脱氧鸟苷酸(8-hydroxy-guanin, 8-OHdG)和硫代巴比妥酸反应产物(thiobarbituric acid reaction substances, TBARS), 来评估AFL发病过程中的OS损伤及LPO, 灵敏度更高.
本文通过探讨AFL的发病机制, 研究维生素E(vitamin E, VE)在AFL中的防治作用, 为VE类药物对AFL的预防和治疗提供了理论基础.
8-OHdG: DNA OS损伤的敏感标志物, 肝组织内8-OHdG含量可反应肝脏OS损伤程度; TBARS: 涵盖了大部分氧化损伤产生的醛酮类物质, 目前认为TBARS可被作为衡量脂质过氧化损伤的敏感指标.
本文通过大鼠模型研究VE对AFL的保护作用, 思路清、结果好, 证明了AFL时大鼠肝内甘油三酯、8-OHdG和TBARS含量增高及VE的保护作用.
编辑: 郭鹏 电编: 闫晋利
| 1. | 任 燚, 肖 庆贵, 邬 吉伟, 陈 大吉. 酒精性肝病临床流调现状. 现代保健•医学创新研究. 2008;5:55-56. |
| 3. | Gao B, Bataller R. Alcoholic liver disease: pathogenesis and new therapeutic targets. Gastroenterology. 2011;141:1572-1585. [PubMed] [DOI] |
| 4. | Kawai D, Takaki A, Nakatsuka A, Wada J, Tamaki N, Yasunaka T, Koike K, Tsuzaki R, Matsumoto K, Miyake Y. Hydrogen-rich water prevents progression of nonalcoholic steatohepatitis and accompanying hepatocarcinogenesis in mice. Hepatology. 2012;56:912-921. [PubMed] [DOI] |
| 5. | McClain C, Barve S, Joshi-Barve S, Song Z, Deaciuc I, Chen T, Hill D. Dysregulated cytokine metabolism, altered hepatic methionine metabolism and proteasome dysfunction in alcoholic liver disease. Alcohol Clin Exp Res. 2005;29:180S-188S. [PubMed] |
| 6. | 贾 艳, 付 怡静, 刘 晓阳, 杨 国庆. 我国酒精性脂肪肝病的研究进展. 胃肠病学和肝病学杂志. 2014;23:376-379. |
| 7. | Mann RE, Smart RG, Govoni R. The epidemiology of alcoholic liver disease. Alcohol Res Health. 2003;27:209-219. [PubMed] |
| 9. | Morgan K, French SW, Morgan TR. Production of a cytochrome P450 2E1 transgenic mouse and initial evaluation of alcoholic liver damage. Hepatology. 2002;36:122-134. [PubMed] [DOI] |
| 10. | 王 一平, 谭 华炳, 王 记红, 任 永生, 高 玉玖, 胡 小林, 朱 德文. 非酒精性脂肪性肝病兔肝组织甘油三酯、丙二醛、超氧化物歧化酶与血浆内皮素的关系. 中华临床医师杂志. 2011;5:971-974. |
| 11. | Rao RK, Seth A, Sheth P. Recent Advances in Alcoholic Liver Disease I. Role of intestinal permeability and endotoxemia in alcoholic liver disease. Am J Physiol Gastrointest Liver Physiol. 2004;286:G881-G884. [PubMed] [DOI] |
| 12. | Arteel GE. Oxidants and antioxidants in alcohol-induced liver disease. Gastroenterology. 2003;124:778-790. [PubMed] [DOI] |
| 14. | Irie M, Sohda T, Iwata K, Kunimoto H, Fukunaga A, Kuno S, Yotsumoto K, Sakurai K, Iwashita H, Hirano G. Levels of the oxidative stress marker γ-glutamyltranspeptidase at different stages of nonalcoholic fatty liver disease. J Int Med Res. 2012;40:924-933. [PubMed] |
| 15. | Mantena SK, King AL, Andringa KK, Eccleston HB, Bailey SM. Mitochondrial dysfunction and oxidative stress in the pathogenesis of alcohol- and obesity-induced fatty liver diseases. Free Radic Biol Med. 2008;44:1259-1272. [PubMed] [DOI] |