修回日期: 2014-08-01
接受日期: 2014-08-17
在线出版日期: 2014-09-28
目的: 分别应用刀豆蛋白A(concanavalin A, ConA)及同种系肝抗原S-100建立自身免疫性肝炎(autoimmune hepatitis, AIH)的动物模型, 并比较分析两种模型之间的异同.
方法: 向♀Balb/C鼠尾静脉注射ConA溶液, 对照组注射生理盐水, 分别于6、12、24及48 h取血及肝脏组织; 向♀C57BL/6小鼠腹腔注射肝抗原S-100与等体积的弗氏完全佐剂(Freund's complete adjuvant, CFA)的乳化液, 对照组注射生理盐水与CFA的混合物, 4 wk后取血及肝脏组织. 检测血清丙氨酸氨基转移酶(alanine transaminase, ALT), 天门冬氨酸氨基转移酶(aspartate aminotransferase, AST)水平, 肝脏苏木素-伊红染液(HE)染色观察病理改变.
结果: 注射ConA后6 h ALT、AST水平均较正常对照组升高, 肝脏出现轻度充血, 少量淋巴细胞浸润, 肝细胞轻度变性, 12 h转氨酶升高达峰值(ALT: 1603.40 U/L±461.24 U/L vs 66.25 U/L±18.66 U/L, P = 0.000, AST: 1877.20 U/L±623.23 U/L vs 159.50 U/L±29.22 U/L, P = 0.000), 24 h肝细胞变性、坏死增多, 部分肝小叶结构消失, 炎性细胞浸润增加. 注射S-100后转氨酶水平较对照组显著增高(ALT: 156.80 U/L±50.86 U/L vs 29.90 U/L±8.43 U/L, AST: 317.80 U/L±105.80 U/L vs 146.40 U/L±30.61 U/L, P<0.01), 肝脏细胞形态结构紊乱, 局灶性细胞坏死伴肝小叶内大量炎细胞浸润.
结论: 两种模型均可作为AIH的动物模型, ConA模型呈急性病程, S-100模型呈慢性病程, 可根据实验要求选择模型.
核心提示: S-100与刀豆蛋白A模型均能作为自身免疫性肝炎(autoimmune hepatitis)的动物模型, 前者可应用于目前研究热点即固有免疫系统的研究, 后者可应用于药物疗效或细胞因子的研究.
引文著录: 伍银银, 许瑞蕊, 张洁, 周璐, 王邦茂. ConA与S-100分别诱导的自身免疫性肝炎动物模型的建立. 世界华人消化杂志 2014; 22(27): 4113-4118
Revised: August 1, 2014
Accepted: August 17, 2014
Published online: September 28, 2014
AIM: To establish two autoimmune hepatitis (AIH) mouse models by injection of concanavalin A (ConA) and syngeneic S-100, respectively, and to compare the two models.
METHODS: Female Balb/C mice received injection of ConA (15 mg/kg) through the tail vein, whereas control mice were injected with equal volume of sodium chloride. At 6, 12, 24 and 48 h after injection, blood and liver samples were taken. In addition, female C57BL/6 mice were given syngeneic S-100 emulsified with equal volume of Freund's complete adjuvant (CFA) by peritoneal injection at the 1st and 7th day, and the mixture of sodium chloride and CFA were given to control mice. Blood and liver samples were taken 4 wk later. Serum levels of alanine transaminase (ALT) and aspartate aminotransferase (AST) were tested using an automatic biochemistry analyzer. Liver pathological changes were observed after hematoxylin and eosin (HE) staining.
RESULTS: Serum levels of ALT and AST increased significantly 6 h after ConA injection and reached the peak at 12 h in comparison with the control group. The peak values of ALT and AST were significantly higher than those in the control group (ALT: 1603.40 U/L ± 461.24 U/L vs 66.25 U/L ± 18.66 U/L, AST: 1877.20 U/L ± 623.23 U/L vs 159.50 U/L ± 29.22 U/L, P < 0.01). Liver tissue showed mild congestion, infiltration of few inflammatory cells and hepatocyte degeneration 6 h after ConA injection. Degeneration and necrosis of hepatocytes and inflammatory cell infiltration became more significant and part of liver lobules disappeared at 24 h. Serum levels of ALT and AST in mice injected with syngeneic S-100 were significantly higher than those in the controls (ALT: 156.80 U/L ± 52.86 U/L vs 29.90 U/L ± 8.43 U/L; AST: 317.80 U/L ± 105.80 U/L vs 146.40 U/L ± 30.61 U/L, P < 0.01). The liver cells were arranged irregularly, and local necrosis and massive inflammatory cell infiltration were observed in model mice.
CONCLUSION: Animal models created with S-100 or ConA can be both used as AIH models. ConA model showed an acute course, while S-100 model showed a chronic course. They can be used in different experiments.
- Citation: Wu YY, Xu RR, Zhang J, Zhou L, Wang BM. Establishment of two mouse models of autoimmune hepatitis induced by concanavalin A and S-100. Shijie Huaren Xiaohua Zazhi 2014; 22(27): 4113-4118
- URL: https://www.wjgnet.com/1009-3079/full/v22/i27/4113.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i27.4113
自身免疫性肝炎(autoimmune hepatitis, AIH)是由免疫介导的慢性进展性肝脏疾病, 其特征是高丙种球蛋白血症、自身抗体阳性、肝组织学界面炎和免疫抑制剂治疗有效, 可进展为肝硬化甚至肝衰竭[1,2], 免疫抑制剂治疗有效. 该病以女性多见, 可以发生于儿童和不同年龄的成人并且影响不同的种族[1]. 尽管AIH的发病机制迄今为止尚未完全阐明, 但是多项研究表明, 遗传易感性、分子模拟学说及调节性T细胞缺陷参与了自身免疫性肝损伤. AIH的预后和诊断也不完善, 为了更好地研究AIH的发病机制和探索更有效的临床治疗方法, 急切需要一个理想的AIH动物模型. 本研究将目前广泛应用的刀豆蛋白A(concanavalin A, ConA)模型与较早出现的S-100模型进行对比, 以探讨两种模型的异同.
♀Balb/C小鼠, 8-10周龄, 体质量16-22 g; ♀C57BL/6小鼠, 4-6周龄, 体质量15-20 g之间, 由天津医科大学中心动物房提供, 清洁级, 正常饮食水. 适应性喂养3 d后将Balb/C小鼠随机分为两组, 即模型组(n = 24)及对照组(n = 6); C57BL/6小鼠随机分为2组, 即模型组和对照组(n = 10). Ⅳ型ConA购自美国Sigma公司, ConA事先用NS配成0.15%溶液(0.15 mg ConA溶于100 mL NS中), 微孔滤膜除菌, 现配现用. CFA购自北京中彬金桥公司. 普通光学显微镜全自动生化检测仪.
1.2.1 ConA模型的建立: 模型组小鼠予ConA 15 mg/kg尾静脉注射, 对照组注射等体积的生理盐水; 分别于造模后6、12、24和48 h对模型组及对照组小鼠摘除眼球取血, 并迅速取出肝脏组织.
1.2.2 S-100模型的建立: (1)S-100的提取: 取10只♀4-6周龄C57BL/6小鼠, 经0.2 mL 2%戊巴比妥腹腔注射麻醉, 待小鼠麻倒后用75 mL/L乙醇浸泡消毒5 min; 消毒后将小鼠放在解剖板上, 剥皮、剪掉胸骨, 暴露跳动的心脏和腹腔中的肝脏, 以预冷PBS缓冲液经心室腔灌注(扎入心尖), 直至肝脏颜色由深红变灰白; 分离取出灰白的肝脏, 将其剪成小块状, 以4 ℃枸橼酸-PBS液冲洗残留血液后, 加入等量枸橼酸-PBS液于匀浆器内匀浆, 之后放入离心管中; 将匀浆液于-80 ℃中反复冻融3次, 以达到破碎细胞的目的; 2000 r/min转速离心10 min, 取上清液100000 g超速离心1 h, 最终得到上清液(称为S-100), 调整S-100浓度, 使其终浓度为0.5-2 mg/mL; (2)建立模型: 将S-100肝抗原或生理盐水与完全氟氏佐剂(CFA)按1:1混合乳化, 分别制成试剂1和试剂2; 两组小鼠分别腹腔注射试剂1(S-100抗原+CFA)或试剂2(生理盐水+CFA) l mL/只, 注射试剂1组称为AIH模型组, 注射试剂2组称为对照组. 第1次免疫后第7天给予同等剂量注射; 第4周后, 取血及肝脏组织.
1.2.3 标本的处理: 将全血离心3000 r/min, 10 min, 取上清即为血清, 集齐标本送至天津医科大学总医院检验科行生化检测, 检测指标为谷丙转氨酶(alanine transaminase, ALT)和谷草转氨酶(aspartate aminotransferase, AST); 肝脏标本经HE染色及制片后于普通光学显微镜下行组织学观察.
统计学处理 实验数据采用mean±SD表示, 应用SPSS20.0统计软件进行处理. 经正态性和方差齐性检验, 用单因素方差分析进行多组间比较, 两组之间比较采用单样本t检验, P<0.05为差异有统计学意义.
ConA模型组的小鼠与对照组的小鼠相比, 皮毛、精神及活动状态无明显改变; S-100模型组小鼠皮毛晦暗、精神状态不佳、喜蹲卧、明显消瘦、活动欠佳、部分小鼠出现腹水.
ConA模型组6 h后小鼠ALT/AST升高, 12 h达峰值, 明显高于对照组(P = 0.000); 24 h后ALT较12 h逐渐减低, 但仍高于对照组(P = 0.018), AST较正常组高, 但差异不明显(P = 0.104); 48 h后, ALT/AST均减低至与正常对照组比较无明显差异(P>0.05)(表1). S-100模型组血清ALT/AST水平均显著高于对照组(ALT: 156.80 U/L±50.86 U/L vs 29.90 U/L±8.43 U/L, P = 0.000; AST: 317.80 U/L±105.80 U/L vs 146.40 U/L±30.61 U/L, P = 0.004).
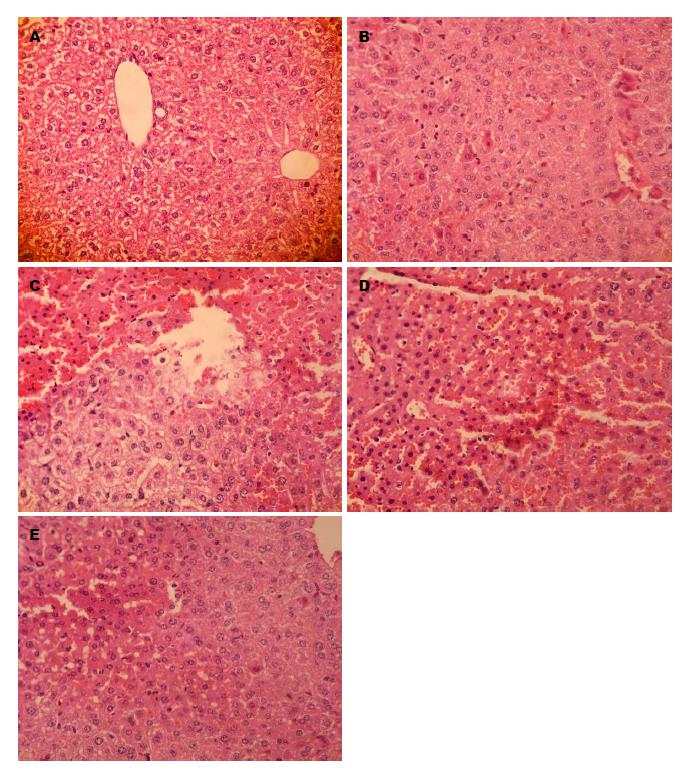
2.3.1 ConA模型: 对照组小鼠肝小叶结构正常, 肝索排列整齐(图1A); 6 h组小鼠出现轻度充血, 少量淋巴细胞浸润, 肝细胞轻度变性(图1B); 12 h组小鼠出现部分肝细胞变性、坏死, 肝小叶结构存在, 较多炎细胞浸润(图1C); 24 h组小鼠肝细胞变性、坏死增多, 部分肝小叶结构消失, 炎性细胞浸润较前增加(图1D); 48 h组小鼠肝细胞变性、坏死较前恢复, 可见少量炎性细胞浸润(图1E).
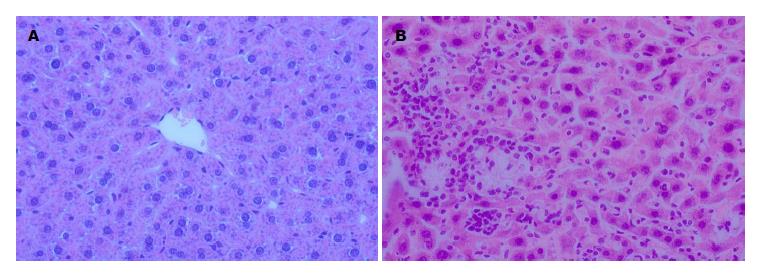
2.3.2 S-100模型: 对照组小鼠细胞形态正常, 肝小叶结构规则, 呈正常肝组织形态(图2A); 模型组小鼠肝脏中度损害, 细胞形态结构紊乱, 局灶性肝细胞坏死伴肝小叶内大量炎细胞浸润(图2B).
AIH一被提出, 即引起国内外广大医学研究者们的广泛关注, 当然, 研究一种新疾病的前提是有一个理想的动物模型, AIH模型的发展经历了从天然的肝脏同源类似物混合佐剂到如今的基因工程水平的漫长路程[3,4], 然而, 基因工程技术[5]虽然先进, 但是价格高昂, 在国内很难普及. 纵观国内外文献报道, 常被提及的AIH动物模型是ConA模型.
ConA是一种从刀豆中提取出来的植物凝集素[6], 是典型的T细胞丝裂原, ConA有特异性的糖结合位点, 可以与细胞膜的糖蛋白结合使细胞发生凝集[7]. 本实验中, 尾静脉注射ConA 6 h后转氨酶ALT、AST即出现升高, 肝脏病理出现少量淋巴细胞的浸润, 提示肝脏出现了损伤, 并且这种损伤是由淋巴细胞介导的, 这和人类AIH的肝脏病理相吻合. 12 h后转氨酶水平达峰值, 24 h后开始降低; 肝脏的病理学改变24 h最明显, 即部分肝小叶结构基本消失, 肝细胞变性、坏死, 伴大量炎细胞浸润, 48 h肝脏组织学改变较前好转, 这些变化表明此模型具有时效性, 随着时间的延长, 当小鼠体内毒素被清除, 病理过程即终止, 小鼠肝脏损伤即可恢复. 在实验过程中, 我们发现, 一旦ConA的浓度过大, 肝脏的损伤即不可逆, 小鼠在短期内即会死亡, 我们解剖死亡小鼠的肝脏发现与24 h的病理改变相似, 但程度更重, 由此可见, 这种模型是有剂量依赖性的, 这与国内报道[8]相一致, 即剂量越大, 转氨酶上升越快、越高, 对小鼠的肝脏损伤越急、越重. 由此可以推断, 如果长期小剂量注射ConA, 也会导致慢性肝脏损伤. 实验发现肝脏的病理学改变较血清转氨酶的变化迟, 提示血清转氨酶的变化对于肝脏的损伤较敏感, 因此通过转氨酶的检测能初步诊断肝脏的损伤. 研究发现, ConA模型的主要机制是以干扰素-γ(interferon-γ, IFN-γ)和肿瘤坏死因子-α(tumor necrosis factor α, TNF-α)为主的细胞因子"风暴"作用, 主要由CD4+ T淋巴细胞和巨噬细胞释放[9], 从而导致肝脏损伤, 这与人类AIH的发病机制相似, 因此ConA诱导的动物模型可以作为研究AIH的模型.
1967年, Scheiffarth等[10]使用同种系异基因小鼠的肝脏匀浆与CFA的乳化液连续腹腔注射, 首次成功建立AIH模型, 1975年, 他们用同基因小鼠的肝脏匀浆代替, 在门脉周围没有发现淋巴细胞浸润, 提示肝脏的免疫耐受很难被打破[11]. 1983年, Kuriki等[12]采用肺炎克雷白菌裂解液与同基因肝脏匀浆的混合物, 成功打破了肝脏免疫耐受, 导致AIH的发生, 证实肝脏免疫耐受的打破需要额外的外部信号. 1984年, Mori等[13]使用肝脏匀浆超速离心的上清(即S-100)与CFA的乳化液免疫不同种系的小鼠, 发现近交C57Bl/6J小鼠为易感小鼠, 且AIH可能是由T细胞介导的. 1990年, Lohse等[14]应用S-100与CFA的乳化液单次腹腔注射诱导了AIH, 证实C57Bl/6J小鼠为易感小鼠, 且T细胞介导了肝脏的损伤. 之后在2000年, 邱德凯等[15]国内学者以同种系肝抗原两次腹腔注射成功的建立了C57BL/6小鼠的AIH模型, 研究发现在首次注射后2 wk即可见到Ⅰ-Ⅱ级组织病变, 在汇管区和小叶中央可见多形核细胞(其中多数为淋巴细胞)浸润. 肝脏病变较重的小鼠的肌肉、肺脏、心脏、关节和胃肠道等肝外器官中未见明显病变. 本研究应用4-6 wk、易感的♀C57BL/6小鼠, 以S-100肝抗原与完全弗氏佐剂充分乳化后, 分别于第1天和第7天共2次腹腔注射, 建立动物模型. 造模后观察小鼠的一般状况, 与正常组小鼠相比, AIH模型组小鼠一般情况差, 即随着造模时间的延长, 出现反应迟钝, ¹背喜卧, 精神萎靡不振, 食欲减退, 毛色灰暗, 蓬松粗乱、脱落等病态表现. 取小鼠血清进行ALT、AST水平测定, 发现模型组明显高于正常对照组, 经统计学分析具有显著差异性(P<0.05). 实验组小鼠的肝脏组织学观察出现大量炎细胞的浸润及局灶性肝细胞坏死, 符合人类AIH的肝脏病理特征, 表明此模型能应用于AIH的研究. 另外, 在造模过程中, 有部分小鼠出现了腹水, 肝脏体积小, 质地较硬, 而且随时间的延长, 出现腹水的小鼠数目逐渐增多, 一方面体现了个体的差异, 另一方面也提示AIH不经过及时治疗会发展为肝硬化.
由AIH模型的发展史来看, S-100模型出现比ConA模型早, 从国内外发表的文献看, ConA模型基本上已经成为AIH的代表, S-100模型却很少被应用了, 但国内外没有明确文献解释这一现象的产生. 本研究分别建立了这两种模型, 在实验过程中, ConA模型的确具有很多优势: (1)时间短: S-100模型需要至少4 wk的时间, 相对于ConA模型短短的几个小时, S-100方法建立模型时间偏长而且较长时间造模的过程中, 动物的存活不好控制, 这应该也是ConA模型被更多应用的原因之一; (2)过程简单: S-100模型需要的抗原制备过程较繁杂, 且需要在第1天和第7天分别注射1次, 而ConA购买即可, 仅需注射1次; (3)转氨酶水平升高明显: 注射ConA 6 h转氨酶即升高, 12 h达峰值, 与对照组相比, ALT升高20倍以上, AST升高10倍以上; S-100模型中, ALT与AST均升高3倍左右, ConA模型转氨酶水平升高更明显. ConA模型用于以后的药物治疗效果的研究及细胞因子的研究, 更为方便、快捷. 然而, 本实验中依然可以看到S-100模型具有的优点: (1)发病过程呈慢性, 与人类AIH的发病过程更接近; ConA模型具有剂量依赖性, 病程是可控制的; (2)部分小鼠出现腹水: 先不论腹水的性质, 他的出现无疑是疾病恶化的警钟, 这也提示了如果AIH没有及时治疗的话, 会迅速的进展为肝硬化. 由此可见, S-100模型不仅体现了AIH的病程, 而且预示了AIH不接受治疗的结局. 固有免疫系统在AIH发病机制中扮演着什么样的角色正成为研究热点, 巨噬细胞是固有免疫重要成员之一, 2009年Martynova等[16]在ConA诱导的鼠肝损伤模型中发现腹腔巨噬细胞的吞噬功能下降, 我们的实验小组分别提取ConA和S-100模型小鼠的腹腔巨噬细胞, 其中S-100模型小鼠形成腹水, 结果发现双方巨噬细胞吞噬功能均降低, 腹水的形成似乎对实验结果未形成明显影响, 但是实验过程中发现S-100模型鼠的腹腔巨噬细胞更易提取, 这与腹水形成有无关联还需进一步的研究, 另外, 腹水对于巨噬细胞功能的影响也值得更深层次的探讨. 总体上来说, 这两种模型体现了AIH的研究历程及取得的进展, 各有优缺点, 我们可以根据不同的实验要求选择合适的模型.
本实验分别使用ConA与S-100建立了动物模型, 两者均能作为AIH模型. ConA模型呈急性病程, 造模时间短, 操作简单, 可重复性强, 可以用于以后的药物治疗效果及细胞因子的研究; S-100模型呈慢性病程, 可用于固有免疫系统的研究.
因为有人认为现在研究自身免疫性肝炎使用S-100模型不合适, 但国内外并没有明确的文献表示, 因此我们想借此实验证实一下这个模型的实用性.
王蒙, 副教授, 中国人民解放军第二军医大学附属东方肝胆外科医院肝外综合治疗一科; 麻勇, 副研究员, 哈尔滨医科大学附属第一医院肝脏外科
自身免疫性肝炎的发病机制目前的矛头指向了固有免疫, 我们想借此研究做一个抛砖引玉的作用, 后续相关实验将借S-100模型进行.
我们将应用S-100模型开展固有免疫系统在自身免疫性肝炎当中的作用的研究, 对于更深入了解自身免疫性肝炎的机制有着重大意义.
该文章研究的内容和思维还可以, 但研究的方法及手段有些简单.
编辑: 郭鹏 电编: 都珍珍
| 1. | Krawitt EL. Autoimmune hepatitis. N Engl J Med. 2006;354:54-66. [PubMed] [DOI] |
| 2. | Alvarez F, Berg PA, Bianchi FB, Bianchi L, Burroughs AK, Cancado EL, Chapman RW, Cooksley WG, Czaja AJ, Desmet VJ. International Autoimmune Hepatitis Group Report: review of criteria for diagnosis of autoimmune hepatitis. J Hepatol. 1999;31:929-938. [PubMed] [DOI] |
| 3. | Czaja AJ. Animal models of autoimmune hepatitis. Expert Rev Gastroenterol Hepatol. 2010;4:429-443. [PubMed] [DOI] |
| 4. | Büschenfelde KH, Kössling FK, Miescher PA. Experimental chronic active hepatitis in rabbits following immunization with human liver proteins. Clin Exp Immunol. 1972;11:99-108. [PubMed] |
| 5. | El Hefnawi MM, El Behaidy WH, Youssif AA, Ghalwash AZ, El Housseiny LA, Zada S. Natural genetic engineering of hepatitis C virus NS5A for immune system counterattack. Ann N Y Acad Sci. 2009;1178:173-185. [PubMed] [DOI] |
| 6. | Soares PA, Nascimento CO, Porto TS, Correia MT, Porto AL, Carneiro-da-Cunha MG. Purification of a lectin from Canavalia ensiformis using PEG-citrate aqueous two-phase system. J Chromatogr B Analyt Technol Biomed Life Sci. 2011;879:457-460. [PubMed] [DOI] |
| 7. | Kanellopoulos PN, Pavlou K, Perrakis A, Agianian B, Vorgias CE, Mavrommatis C, Soufi M, Tucker PA, Hamodrakas SJ. The crystal structure of the complexes of concanavalin A with 4'-nitrophenyl-alpha-D-mannopyranoside and 4'-nitrophenyl-alpha-D-glucopyranoside. J Struct Biol. 1996;116:345-355. [PubMed] [DOI] |
| 9. | Gantner F, Leist M, Küsters S, Vogt K, Volk HD, Tiegs G. T cell stimulus-induced crosstalk between lymphocytes and liver macrophages results in augmented cytokine release. Exp Cell Res. 1996;229:137-146. [PubMed] [DOI] |
| 10. | Scheiffarth F, Warnatz H, Mayer K. Studies concerning the importance of mononuclear cells in the development of experimental hepatitis. J Immunol. 1967;98:396-401. [PubMed] |
| 11. | Warnatz H, Scheiffarth F, Schmeissner R. Studies on the cytotoxic effect of in vivo and in vitro immunized lymphocytes on liver target cells. Clin Exp Immunol. 1975;21:250-258. [PubMed] |
| 12. | Kuriki J, Murakami H, Kakumu S, Sakamoto N, Yokochi T, Nakashima I, Kato N. Experimental autoimmune hepatitis in mice after immunization with syngeneic liver proteins together with the polysaccharide of Klebsiella pneumoniae. Gastroenterology. 1983;84:596-603. [PubMed] |
| 13. | Mori Y, Mori T, Yoshida H, Ueda S, Iesato K, Wakashin Y, Wakashin M, Okuda K. Study of cellular immunity in experimental autoimmune hepatitis in mice. Clin Exp Immunol. 1984;57:85-92. [PubMed] |
| 14. | Lohse AW, Manns M, Dienes HP, Meyer zum Büschenfelde KH, Cohen IR. Experimental autoimmune hepatitis: disease induction, time course and T-cell reactivity. Hepatology. 1990;11:24-30. [PubMed] [DOI] |