修回日期: 2014-07-22
接受日期: 2014-07-31
在线出版日期: 2014-09-18
目的: 对于低位直肠癌的患者, 在腹会阴联合直肠癌根治术(Miles手术)与经腹直肠癌切除术(Dixon手术)两种术式之间选择最适术式存在一个很大的争议. 本文旨在从循证医学角度为选择上述两种术式提供询证依据.
方法: 利用美国国立医学图书馆(Medline)、荷兰医学文摘(Embase)、医学生物中心(BioMed Central)、中国知网(CNKI)、万方数据(Wangfang)及中国生物医学文献数据库(CBM)等数据库搜索报道比较两种术式的5年生存率、局部复发率、CRM及术后并发症的发生率的文献, 从而比较两种术式的安全性、可行性及最优性.
结果: 共有11篇文献符合要求, 其中包括6544例手术. 分析显示Dixon术的5年生存率更高(pooled RR = 1.18, 95%CI: 1.08-1.30, P<0.00001 random-effect), Miles术却伴随着更高的局部复发率(pooled RR = 0.67, 95%CI: 0.57-0.78, P<0.00001 fixed-effect)、CRM(4 trials reported the data, pooled RR = 0.49, 95%CI: 0.38-0.62, P<0.00001 random-effect)及术后并发症(pooled RR = 0.60, 95%CI: 0.38-0.93, P = 0.02 random-effect).
结论: Miles术后的患者局部复发率、CRM及并发症高于Dixon术后的患者, 且行Miles术的患者肿瘤预后也不及选择Dixon术的患者. 因此对于低位直肠癌的患者, Dixon术应优先考虑.
核心提示: 本文结果提示Miles术后的肿瘤相关结局并不如Dixon术令人满意. 且Miles术并不能降低环周切缘肿瘤侵犯率(circumferential resection margin)阳性率、局部复发率及并发症的发生. 因此能够保留肛门功能、使患者免于背粪袋的Dixon手术应被低位直肠癌患者优先考虑.
引文著录: 李德钢, 孔凡彪, 刘春强, 庞黎明. Miles术与Dixon术治疗低位直肠癌的Meta分析. 世界华人消化杂志 2014; 22(26): 4027-4035
Revised: July 22, 2014
Accepted: July 31, 2014
Published online: September 18, 2014
AIM: To compare the oncological outcome of abdominoperineal resection (APR) and low anterior resection (LAR) for lower rectal cancer.
METHODS: Publications that compared 5-year survival, local recurrence, circumferential resection margin (CRM) involvement rate, and complications were identified by literature search. A meta-analysis was performed to clarify the safety and feasibility of the two procedures with regards to several types of outcome measures.
RESULTS: A total of 11 studies met the inclusion criteria, including 6544 cases. Analysis of these data showed that the LAR group was associated with a higher 5-year survival rate (pooled RR = 1.18, 95%CI: 1.08-1.30, P < 0.00001, random-effect). Local recurrence rate (pooled RR = 0.67, 95%CI: 0.57-0.78, P < 0.00001, fixed-effect) and CRM involvement rate (4 trials reported the data, pooled RR = 0.49, 95%CI: 0.38-0.62, P < 0.00001, random-effect) were significantly higher in the APR group than in the LAR group. Besides, the incidence of overall complications in the APR group was significantly higher than that in the LAR group (pooled RR = 0.60, 95%CI: 0.38-0.93, P = 0.02, random-effect).
CONCLUSION: Patients treated by APR have a higher rate of CRM involvement, higher local recurrence, and poorer prognosis than those by LAR. When performed with appropriate skill, LAR can be used safely with a better oncological outcome.
- Citation: Li DG, Kong FB, Liu CQ, Pang LM. Meta-analysis of oncological outcomes after abdominoperineal resection vs low anterior resection for lower rectal cancer. Shijie Huaren Xiaohua Zazhi 2014; 22(26): 4027-4035
- URL: https://www.wjgnet.com/1009-3079/full/v22/i26/4027.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i26.4027
结直肠癌已成为全球排名第4的恶性肿瘤, 目前对于低位直肠癌患者, 具有保肛优势的Dixon手术已成为其主要的手术治疗方式. 尽管选择Dixon术伴随着诸如大便失禁等术后高风险, 但低位直肠癌的患者更偏好于Dixon手术方式, 主要原因是因为此术式可以避免腹壁造瘘[1]. 因此, Miles术便成为了保肛术不适用之后的备选项, 或者只有当肿瘤侵犯肛门括约肌或者低于1 cm时, Miles术才成为一个无奈的选择[2]. 但是目前有文献[3,4]报道, 临床上采用Dixon手术治疗低位直肠癌的人数已达到采用Miles术的3-4倍, 这意味着这些术者基于种种原因[5]选择了保肛手术, 这些术者[6-9]坚持Dixon手术的预后优于Miles术的预后, 对于低位直肠癌患者的手术治疗方式应首先选择Dixon手术. 有文献[10-12]认为Miles术的局部复发率和环周切缘肿瘤侵犯率(circumferential resection margin, CRM)远远高于Dixon术, 相对于Dixon术而言, Miles术的预后效果并不理想. 当然也存在反对的声音, 有文献报道该术式与手术预后及局部复发无明显联系, 然而更多的报道却提示Miles术的肿瘤预后较Dixon差, 且局部复发率为后者的1.5-2.3倍[13-15]. 出现这种有趣现象的原因可能是这些研究的数据所收集到的病例数太少而并未充分到让人信服. 对于低位直肠癌适于手术治疗的患者, 到底应首先选择Miles术还是Dixon术仍存在较大争议, 本文对上述两种术式手术效果及预后进行比较, 旨在帮助临床医生更安全、更合理的选择术式治疗低位直肠癌.
分别利用美国国立医学图书馆(Medline)、荷兰医学文摘(Embase)、医学生物中心(BioMed Central)、中国知网(CNKI)、万方数据(Wangfang)及中国生物医学文献数据库(CBM)等著名数据库进行系统搜索, 收集所有比较Dixon术式及Miles术式治疗低位直肠癌的文献, 搜索条件限制在"人类", "动物"实验将被剔除; 发表日期不受限制; 由两位作者分别通过评估标题及摘要进行初筛, 剔除不相关的文献, 收集可能满足条件的文献全文及其他相关数据; 具体评估标准参考下文入选标准. 搜索关键词为: " Miles术"或者"腹会阴联合直肠癌根治术"; "Dixon术"或者"经腹直肠癌切除术"; "结肠"或者"直肠"; "肿瘤"或者"癌"或者"瘤". 为了将检索的偏倚减到最小, 我们同时也利用谷歌学术搜索、科学文献索引、考克兰图书馆以及本专业内高影响因子的杂志网站进行了手动搜索, 根据文章的引用率及专家意见选择了合适的文章纳入本研究. 我们联系了所有潜在纳入文章的通讯作者或者第一作者, 获得了相关必要的原始数据, 对所有文献全文及部分原始数据进行了系统复习, 对相关信息如表1, 2所示.
| 纳入文献 | 研究地点 | 病例总数 | 年龄(范围) | 男女比例(男:女) | |||
| Dixon组 | Miles组 | Dixon组 | Miles组 | Dixon组 | Miles组 | ||
| Chambers等[8]2010 | 英国 | 93 | 70 | 67.1(38.4-86.4) | 63.5(32-83.4) | 69:24 | 39:31 |
| Chuwa等[11]2006 | 新加坡 | 677 | 93 | 65.0(22-89) | 64.0(33-93) | 392:285 | 52:41 |
| 何炜杰等[18]2002 | 中国 | 128 | 356 | 41.6(27-61) | 58.0(35-84) | 72:56 | 214:142 |
| Heald等[16]1997 | 英国 | 105 | 31 | 62.7(27-97) | 62.7(27-97) | 未提及 | 未提及 |
| Kim等[12]2013 | 韩国 | 402 | 402 | 54.0(45-63) | 54.0(44-64) | 238:164 | 237:165 |
| Law等[17]2001 | 中国香港 | 123 | 57 | 63.6(25-83) | 65.0(26-86) | 71:52 | 36:21 |
| 李辰生等[6]2006 | 中国 | 244 | 355 | 未提及 | 未提及 | 125:119 | 197:158 |
| 李长华[19]2009 | 中国 | 53 | 25 | 61.0(35-79) | 65.0(43-75) | 31:26 | 19:9 |
| Marr等[9]2005 | 英国 | 355 | 181 | 未提及 | 未提及 | 未提及 | 未提及 |
| Nagtegaal等[5]2005 | 英国 | 205 | 453 | 63.9(27-85) | 64.6(25-87) | 97:108 | 254:199 |
| Wibe等[15]2004 | 挪威 | 1315 | 821 | 未提及 | 未提及 | 859:456 | 478:343 |
| 纳入文献 | 合适随机方法 | 新辅助化疗 | 佐药疗法 | 分配隐藏 | 盲法 | 结果数据完整性 | 自由选择报告偏倚 | 无其他偏倚来源 |
| Chambers等[8]2010 | 是 | 是1 | 是1 | 是 | 不了解 | 是 | 是 | 是 |
| Chuwa等[11]2006 | 是 | 否 | 否 | 是 | 不了解 | 是 | 是 | 是 |
| 何炜杰等[18]2002 | 是 | 否 | 否 | 是 | 不了解 | 是 | 是 | 不了解 |
| Heald等[16]1997 | 是 | 否 | 否 | 不了解 | 是 | 是 | 不了解 | 是 |
| Kim等[12]2013 | 是 | 否 | 是 | 不了解 | 不了解 | 是 | 是 | 是 |
| Law等[17]2001 | 不了解 | 否 | 否 | 是 | 不了解 | 是 | 是 | 是 |
| 李辰生等[6]2006 | 是 | 否 | 否 | 是 | 不了解 | 是 | 不了解 | 是 |
| 李长华[19]2009 | 不了解 | 否 | 否 | 是 | 是 | 是 | 不了解 | 是 |
| Marr等[9]2005 | 是 | 否 | 是 | 是 | 不了解 | 是 | 是 | 不了解 |
| Nagtegaal等[5]2005 | 是 | 否 | 否 | 不了解 | 不了解 | 是 | 是 | 是 |
| Wibe等[15]2004 | 是 | 否 | 是 | 是 | 不了解 | 是 | 是 | 不了解 |
1.2.1 入选标准: 列入本研究的文献必须满足如下条件: (1)该文献必须以中文或者英文全文发表于正规杂志上, 不包括会议记录等载体; (2)该文献必须包含Miles术和Dixon术对于肿瘤位于距离肛缘6 cm以内的低位直肠癌患者术后结果的比较数据; (3)可以从文中或通讯作者处获得所有病例的全部基本资料(如年龄、性别、肿瘤分级、TNM分期、化疗及新辅助化疗及边缘侵犯等信息); (4)如果同一研究机构或者作者发表了数篇相关文章, 只纳入最近发表的或者最高水平杂志刊登的文章.
1.2.2 排除标准: 下列类型的文献被排除: (1)研究样本太小, 病例数少于50例; (2)未包含原始数据, 或未能获得原始数据; (3)仅仅对Miles术后或者Dixon术后单独研究而未比较两种术式的文献; (4)手术方式为非开腹的譬如腹腔镜等其他手术方式; (5)其他非原创文章, 如综述、信件、评论和个例报道等.
1.2.3 数据析取: 由两位作者分别独立提取全文中的数据, 其中不统一的部分及分歧通过讨论统一意见, 必要时邀请第三名作者参与讨论, 提取的数据主要包括: (1)第一作者及文章发表年份; (2)文献研究的病例数、纳入标准、排除标准、匹配标准及研究机构、研究国度、研究类型、性别比例、年龄分布、肿瘤分期、是否行新辅助化疗等基本特征; (3)预后数据如5年生存率、局部复发、CRM及并发症发生率等.
统计学处理 采用Review Manager 5.2软件进行Meta分析, 对各文献结果进行异质性检验; 如果文献同质(P≥0.05), 采用固定效应模型(PetoMantel-Haenszel法)进行Meta分析, 如果存在异质性(P<0.05), 则采用随机模型(DerSimonian-Laird法)进行分析. 计算各观察数据的危险比(RR值)及其95%可信区间, P<0.05为差异有统计学意义.
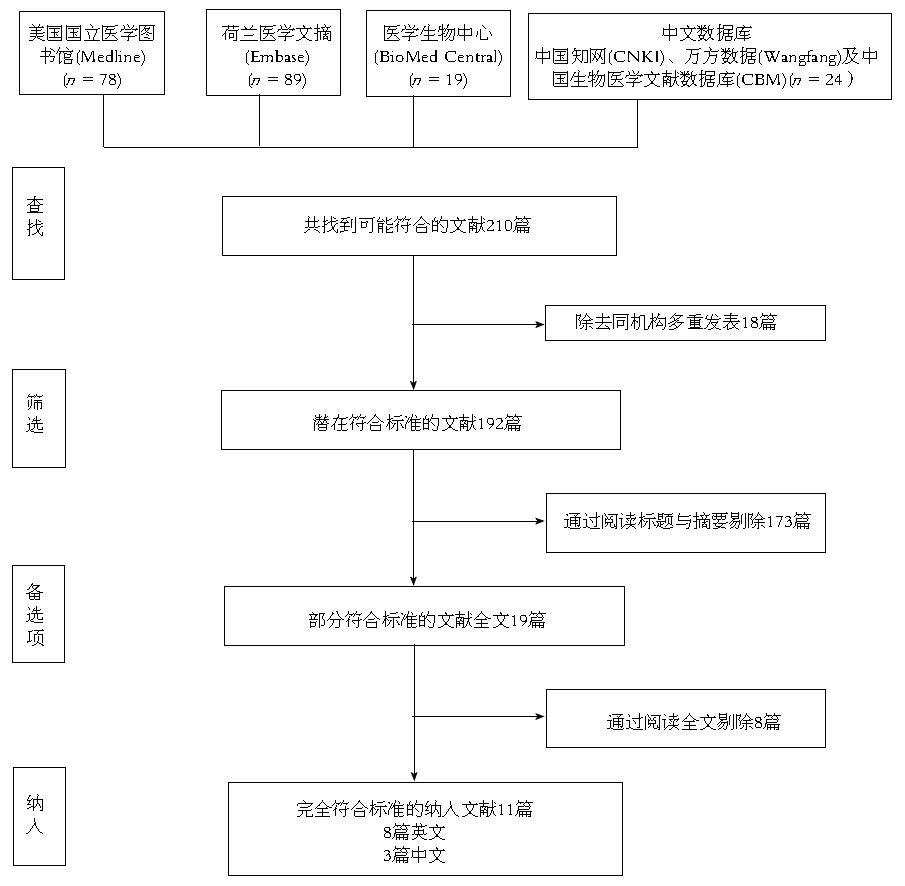
利用上述搜索策略获得全部潜在符合标准的文献, 排除重复发表的文献, 得到192篇文献; 通过系统复习文献标题及摘要排除了173篇不符合标准的文献; 获得剩下19篇文献的全文, 通过仔细阅读全文排除了其中7篇文献; 由此我们通过文献搜索共获得了12篇符合上述纳入标准的文献(图1), 这些文献比较了Miles术和Dixon术治疗低位直肠癌患者的预后; 不幸的是其中有一篇文献未能提供必要且适当的数据而被排除, 所以共纳入11篇符合纳入标准及排除标准的文献进入本研究(表1, 表2). 此11篇文献组成的数据库得到了本文作者的一致认可, 共包含6544例行首次进行手术治疗低位直肠癌的病例数, 其中有3700例(56.54%)行Dixon术, 2844例(43.46%)选择了Miles术. 其中有2篇文献的年龄及性别已得到匹配, 另10篇文献匹配了的年龄、性别、其他疾病、身体物理状态及肿瘤分期等指标.
如图2所示, 11篇文献比较了Miles术及Dixon术两种术式的5年生存率[5,6,8,9,11,12,15-19]. 数据显示Dixon术后患者的5年生存率要明显高于Miles术后的患者(pooled RR = 1.18, 95%CI: 1.08-1.30, P<0.00001 random-effect)(χ2 = 51.59, df = 10, P<0.00001, I2 = 81%)(图2). 只有Nagtegaal[5](57.6% vs 38.5%; P = 0.008)认为Miles术后患者的5年生存率要优于Dixon术后.
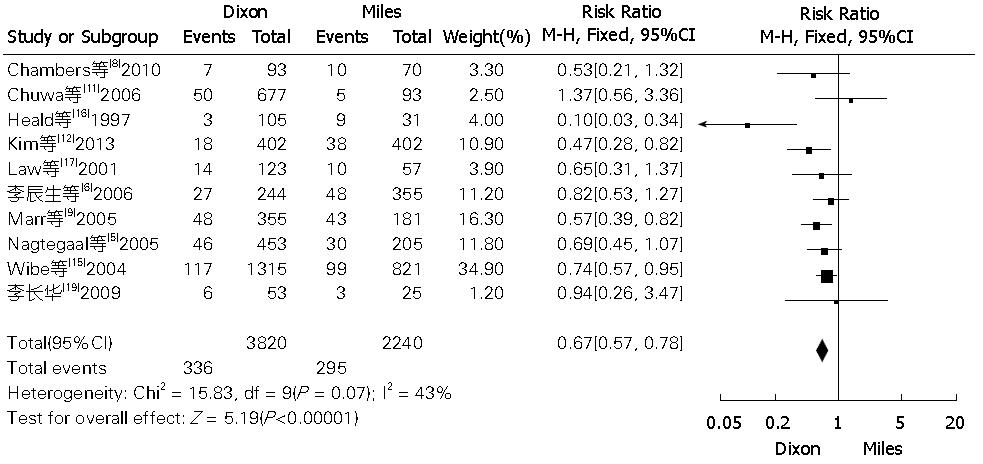
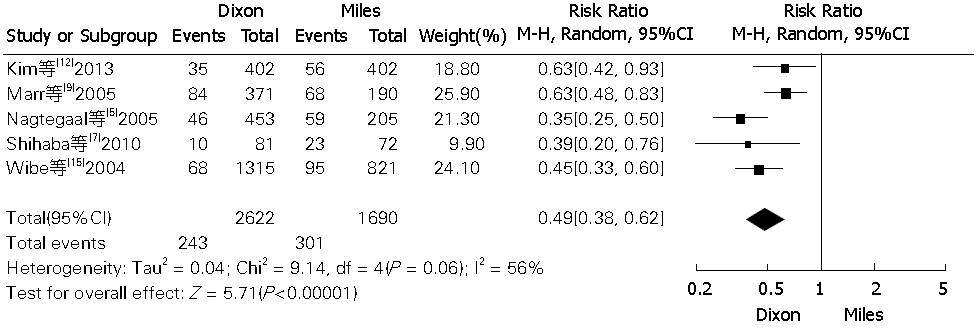
10篇文献比较了两种术式术后的局部复发率[5,6,8,9,11,12,15-17,19]. 结果显示选择Miles术的患者其局部复发率要高于选择Dixon术的(pooled RR = 0.67, 95%CI: 0.57-0.78, P<0.00001 fixed-effect). 同质性检验显示χ2 = 15.83, df = 9, P = 0.07, I2 = 43%. 低位直肠癌术后CRM在Miles术组也明显高于Dixon术组. 共有5篇文献[5,7,9,12,15]比较了两组术后CRM(pooled RR = 0.49, 95%CI: 0.38-0.62, P<0.00001 random-effect) (χ2 = 9.14, df = 4, P = 0.06, I2 = 56%)(图3, 图4).
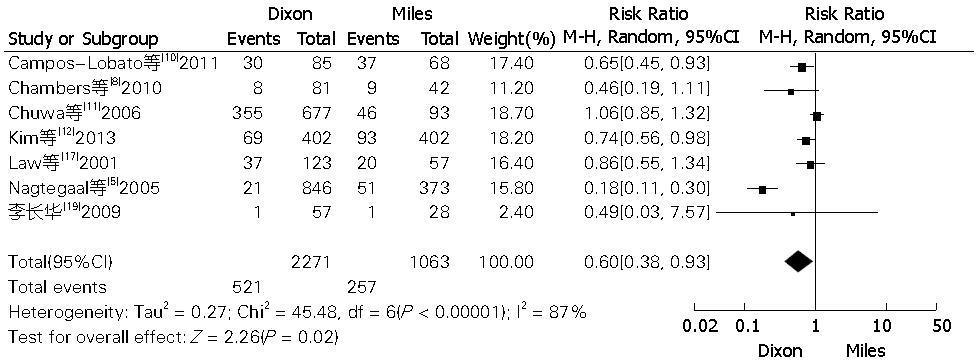
虽然本文并未收集到部分并发症, 如尿潴留的相关数据, 对于术后并发尿潴留的报道, 只有Campos-Lobato等[10]和Kim等[12]分别在2011及2013年发表的文献中进行了比较, 阐明了两种术式对术后尿潴留及性功能障碍的影响. 但本文讨论了一些更为常见的术后并发症, 如出血、尿管损伤、膀胱损伤及吻合口瘘等, 本文共纳入7篇文献比较了上述并发症[5,8,10-12,17,19], 该结果存在重大的差异性(χ2 = 45.48, df = 6, P<0.00001, I2 = 87%), 并适合运用随机效应模式来分析, 结果显示Miles术组的总并发症发生率要高于Dixon术组(pooled RR = 0.60, 95%CI: 0.38-0.93, P = 0.02 random-effect)(图5). 遗憾的是本文收集的文献数据并不能提供充足的证据比较两种术式对术后尿潴留及性功能障碍的影响.
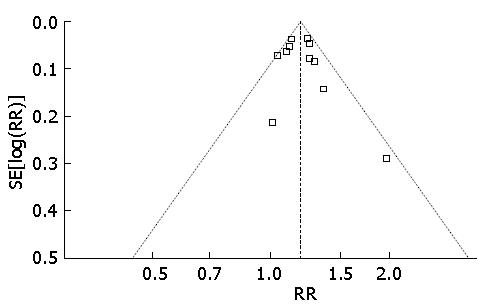
本文的漏斗图并未显示任何非对称图案(图6), 提示大部分资料对应的点位于95%CI内, 说明并无发表偏倚存在; 另外, 影响性分析被用来评估单篇文献所致的偏倚, 及单篇文献的缺失对整体数据的影响. 结果显示本文的得出的结果并不被任何单篇文献左右, 一次移除任意单篇文献并不影响整体数据的趋势.
Miles术由欧内斯特在1908年的一篇文献中第一次公开介绍给全球医务工作者[20], 一个世纪以来, 对于低位直肠癌, 尤其是超低位或者是体积巨大的直肠癌, Miles术一直被当作一种金标准的治疗方式推荐给直肠癌患者; 然而, 随着人们生活质量的提高, 也有越来越多的患者不再认同Miles术伴随而来的永久性结肠造口术. 结肠造口无可避免地给直肠癌Miles术后患者带来身体上的不利及心理上的创伤, 面临这些压力, 不少手术者开始尝试完善一种可以保肛的手术方式; 随着全直肠系膜切除术(total mesorectal excision, TME)概念的成熟及订合器等手术器械的发展, 低位直肠癌的保肛手术方式也得到了越来越多的推荐, 即Dixon术. 尽管对于距离肛缘8 cm之内的肿瘤, Miles术仍被认为是标准疗法, 但Miles术的这一权威性正受到越来越多的压力与挑战, 更多的低位及超低位直肠癌患者选择了保肛手术治疗-Dixon术. 随着订合器和吻合技术的发展, 结肠肛管吻合术得到了更广泛的认可, 选择Miles术治疗低位直肠癌的患者比例下降了50%.
对于一个适用于手术切除治疗的低位直肠癌患者, 到底是采取Miles术还是Dixon术更好仍然未能得到统一意见. 在一项涉及608例直肠癌患者的研究[9]中提示Miles术后的局部复发率较Dixon术后更高, 且Miles术后的5年生存率更低; 同时另有报道[5,9]称, Miles术后的CRM阳性率是Dixon术后的3倍多; 为了降低CRM边缘阳性率, Holm等[21]推荐了一种扩张式改良的Miles术, 该术式切除了与肛门及低位直肠连接的全部的肛提肌. 然而, 另有研究[11]称Miles术后的肿瘤相关预后并不比那些行Dixon术后的患者差. Kim等[12]也认为当使用适当的手术技巧做到R0根治后, Miles术后的肿瘤预后及手术安全性并未下降. 这些看似相互矛盾的研究结果可能归因于诸如其研究规模较小及参与的小样本病例数的限制.
本文研究的结果提示Miles术后的肿瘤相关结局并不如Dixon术令人满意. 换言之, Miles术后的5年生存率不如Dixon术理想, 且Miles术并不能降低局部并发症的发生, 这与其他相关文献[16]结论一致.
尽管本文中涉及的两组病例在年龄、肿瘤分期及其他辅助治疗上都就具有可比较性, 但是Miles组的肿瘤位置更低更大也是不可否认的事实; 两组病例的肿瘤分期并无统计学差异, 但是由于在遇到超低位肿瘤以及肿瘤体积较大等情况时, 手术者一般不会选择尝试保留肛门括约肌, 所以不可避免地使得肿瘤更大的患者更易选择Miles术, 而导致了一定的偏倚. 由此可以看出肿瘤本身的分期并不会影响到CRM阳性率、局部复发率以及5年生存率.
局部复发率是一项衡量直肠手术成功与否的重要的指标. 尽管在过去几十年里, 手术技术及围手术期的管理取得了巨大的进步, 低位直肠癌术后的患者仍不可避免的遭历着手术并发症. Miles术后的主要并发症则表现在会阴切口的愈合时间延长[8], 而随着越来越低水平位置的结肠肛门吻合以及来自患者越来越高的保留肛管括约肌的要求, 与Dixon术相伴而行的超低位直肠肛管吻合及对肛管括约肌的损伤风险增加都可能导致诸如吻合口漏、出血等并发症成为了Dixon术后的主要并发症[22]; Jorge等[23]也报道称其直肠癌术后吻合口瘘的发生率已达11%-12%. 另外, 我们的研究结果提示诸如盆腔脓肿、排便困难等并发症在Miles组中的发生率相对于Dixon组而言更高. 并且, 在Miles组中仅有20.9%的患者术后对于永久性的造瘘口表示满意[12], 余下的患者都认为永久性造瘘口对其生活及社交活动造成了一定程度上的影响[24]. 在对Miles术后的患者进行生活质量(quality of life, QOL)调查时发现, Miles术永久性造瘘袋在充气后造成的形体异常严重干扰了其社交活动, 从而限制了其生活上的各种便利[25]. 本文结果提示Miles术后的并发症要低于Dixon组, 这与其他的文献[26]报道结论一致. Miles术后并发症高发的原因可能是因为以下一些因素的作用. 尽管有足够充足的证据[27]证明TME能将术后的局部复发率降低1%-6%, 但还可能存在另外一种淋巴转移方式, 使得这些转移的淋巴结并不被包含在TME的"切除包"里. 不能充分切除肿瘤组织也能导致较高的术后并发症, 并且不充分的切除应承担主要的责任. 但看起来切除更彻底的Miles术式并未能提高目前高局部复发率及低生存率的现状.
CRM阳性是局部复发的一项强有力的预后指标. 本文中选择行Miles术的病例组的CRM阳性率更高, 而CRM阳性率与局部复发及术后生存率密切相关. 这与其他文献[16]结论一致, 认为Miles术后的CRM阳性率高于选择Dixon术的病例组. CRM阳性率是一项广为接受的高复发及低生存率的替代指标, CRM阳性多提示肿瘤的位置偏低[28], 行Miles术后检测CRM阳性率可以预测局部复发率以及术后生存率; 这说明CRM阳性率对患者预后具有重要的预测作用. 同时, Miles术后糟糕的生存率可能跟其居高不下的CRM阳性率有关, 造成这一现象的原因可能是Miles术本身使得肿瘤未能充分切除, 也有可能是在低位直肠癌中, 存在淋巴结转移所致. 另外, 低位直肠癌的位置也决定了TME的难度增加, 从而降低了低位直肠癌的肿瘤预后效果, 正如Chuwa等[11]所言, 在肿瘤距离肛缘5 cm以内的低位直肠癌患者中, 只有37%的患者进行了TME. 并且在低位直肠癌中, 因为低位直肠癌的特殊位置, 使得在骨盆深处进行一项完美的直肠周围系膜全切除术非常困难. 并且Miles术后的CRM阳性率也并不因为加做了TME而减少; 而与是否在肿瘤平面剔除一定的组织有关[9]. 所以, Miles术后的不良预后可能跟当前的外科技术及手术层面有关, 而手术层面的选择导致了不同的CRM阳性率.
随着人们生活水平的提高, 保肛手术必须被作为一项安全有效的首选项. 本文结果提示Dixon术能够在不影响其生存率的情况下作为一项更能被人们接受的术式, 安全地被应用于临床. 但是, Miles术在低位和超级低位直肠癌或者进展期直肠癌中的地位仍不能被替代.
与大多数Meta分析一样, 本文也存在不得不指出的一些缺陷. 首先, 本文的数据攫取于回顾性分析的文章, 所以尽管我们考虑了所有可能影响比较结果的变量因素, 仍然可能存在一些混杂因素及变量对结果造成一定的偏差. 在本文涉及的研究领域缺乏大型的前瞻性随机试验(randomized controlled trial, RCT), 这有待将来进一步研究; 其次, 我们尽量使标准最优化, 但也同样地各文献之间对低位直肠癌存在一些定义上的细微差别, 为了克服这一定义上的问题, 本文收集的文献都必须能够提供病例的具体资料, 通过查阅详细资料, 本文将纳入的低位直肠癌都规定在距离肛缘6 cm以内; 另外本文所纳入的各文献对术后结果的评估方式也不尽相同, 我们选取了其中评价术后最常用的几项标准, 以期减少误差, 但同时也造成了评估不够全面、彻底的窘局.
随着人们生活质量的提高, 越来越多的患者不再认同Miles术伴随而来的永久性结肠造口术. 低位直肠癌的保肛手术方式(Dixon)也得到了越来越多的推荐.
许剑民, 教授, 上海市复旦大学附属中山医院普外科
本文通过系统回顾已公开发表的文献, 首次比较了Miles术及Dixon术在治疗低位直肠癌的技术可行性、有效性及安全性. 在本文涉及的研究领域缺乏大型的前瞻性随机试验(randomized controlled trial, RCT), 这有待将来进一步研究.
李长华等的研究提示两种手术方式患者预后差异无统计学差异, 因此在既要求根除肿瘤, 又要保留肛门控制排便功能的条件下, 保肛术式为首选, 应摒弃以往以肿瘤在直肠的位置、距离肛缘的长度为唯一参考指标.
目前尚无临床试验比较低位直肠癌的Miles术和Dixon术的差异, 本文纳入了3773例手术患者, 着重比较了术后5年生存率、局部复发率、CRM及手术并发症等指标, 为手术方式的选择提供了一定的依据.
随着人们生活水平的提高, 保肛手术必须被作为一项安全有效的首选项. 本文结果提示Dixon术能够在不影响其生存率的情况下作为一项更能被人们接受的术式, 安全地被应用于临床. 基于此理, 会大大减少结肠造瘘给患者带来的身心损害.
Dixon手术: 即直肠低位前切除术(low anterior resection, LAR), 此手术损伤小, 且能保留原有肛门功能, 对患者生活及社交影响较小. 原则上应用于腹膜返折以上的直肠癌, 目前已降低此要求, 超低位直肠癌也有大量应用该术式, 但也有学者认为该方式切除并不彻底.
目前尚无临床试验比较低位直肠癌的Miles术和Dixon术的差异, 该研究具有一定的创新性.
编辑: 郭鹏 电编:闫晋利
| 1. | Varpe P, Huhtinen H, Rantala A, Salminen P, Rautava P, Hurme S, Grönroos J. Quality of life after surgery for rectal cancer with special reference to pelvic floor dysfunction. Colorectal Dis. 2011;13:399-405. [PubMed] [DOI] |
| 2. | Bujko K, Rutkowski A, Chang GJ, Michalski W, Chmielik E, Kusnierz J. Is the 1-cm Rule of Distal Bowel Resection Margin in Rectal Cancer Based on Clinical Evidence? A Systematic Review. Indian J Surg Oncol. 2012;3:139-146. [PubMed] [DOI] |
| 3. | Schoetz DJ. Evolving practice patterns in colon and rectal surgery. J Am Coll Surg. 2006;203:322-327. [PubMed] [DOI] |
| 4. | Perry WB, Connaughton JC. Abdominoperineal resection: how is it done and what are the results? Clin Colon Rectal Surg. 2007;20:213-220. [PubMed] [DOI] |
| 5. | Nagtegaal ID, van de Velde CJ, Marijnen CA, van Krieken JH, Quirke P. Low rectal cancer: a call for a change of approach in abdominoperineal resection. J Clin Oncol. 2005;23:9257-9264. [PubMed] [DOI] |
| 6. | 李 辰生, 万 德森, 潘 志忠, 周 志伟, 陈 功, 伍 小军, 李 力人, 卢 震海, 丁 培荣, 李 勇. 影响中下段直肠癌患者根治术后生存的多因素分析. 癌症. 2006;25:587-590. |
| 7. | Shihab OC, Brown G, Daniels IR, Heald RJ, Quirke P, Moran BJ. Patients with low rectal cancer treated by abdominoperineal excision have worse tumors and higher involved margin rates compared with patients treated by anterior resection. Dis Colon Rectum. 2010;53:53-56. [PubMed] [DOI] |
| 8. | Chambers W, Khan A, Waters R, Lindsey I, George B, Mortensen N, Cunningham C. Examination of outcome following abdominoperineal resection for adenocarcinoma in Oxford. Colorectal Dis. 2010;12:1192-1197. [PubMed] [DOI] |
| 9. | Marr R, Birbeck K, Garvican J, Macklin CP, Tiffin NJ, Parsons WJ, Dixon MF, Mapstone NP, Sebag-Montefiore D, Scott N. The modern abdominoperineal excision: the next challenge after total mesorectal excision. Ann Surg. 2005;242:74-82. [PubMed] [DOI] |
| 10. | Campos-Lobato LF, Alves-Ferreira PC, Lavery IC, Kiran RP. Abdominoperineal resection does not decrease quality of life in patients with low rectal cancer. Clinics (Sao Paulo). 2011;66:1035-1040. [PubMed] [DOI] |
| 11. | Chuwa EW, Seow-Choen F. Outcomes for abdominoperineal resections are not worse than those of anterior resections. Dis Colon Rectum. 2006;49:41-49. [PubMed] [DOI] |
| 12. | Kim JC, Yu CS, Lim SB, Kim CW, Kim JH, Kim TW. Abdominoperineal resection and low anterior resection: comparison of long-term oncologic outcome in matched patients with lower rectal cancer. Int J Colorectal Dis. 2013;28:493-501. [PubMed] [DOI] |
| 13. | Grumann MM, Noack EM, Hoffmann IA, Schlag PM. Comparison of quality of life in patients undergoing abdominoperineal extirpation or anterior resection for rectal cancer. Ann Surg. 2001;233:149-156. [PubMed] [DOI] |
| 14. | Keating JP. Sexual function after rectal excision. ANZ J Surg. 2004;74:248-259. [PubMed] [DOI] |
| 15. | Wibe A, Syse A, Andersen E, Tretli S, Myrvold HE, Søreide O. Oncological outcomes after total mesorectal excision for cure for cancer of the lower rectum: anterior vs. abdominoperineal resection. Dis Colon Rectum. 2004;47:48-58. [PubMed] [DOI] |
| 16. | Heald RJ, Smedh RK, Kald A, Sexton R, Moran BJ. Abdominoperineal excision of the rectum--an endangered operation. Norman Nigro Lectureship. Dis Colon Rectum. 1997;40:747-751. [PubMed] [DOI] |
| 17. | Law WL, Chu KW. Impact of total mesorectal excision on the results of surgery of distal rectal cancer. Br J Surg. 2001;88:1607-1612. [PubMed] [DOI] |
| 20. | Zolfaghari S, Williams LJ, Moloo H, Boushey RP. Rectal cancer: current surgical management. Minerva Chir. 2010;65:197-211. [PubMed] |
| 21. | Holm T, Ljung A, Häggmark T, Jurell G, Lagergren J. Extended abdominoperineal resection with gluteus maximus flap reconstruction of the pelvic floor for rectal cancer. Br J Surg. 2007;94:232-238. [PubMed] [DOI] |
| 22. | Brown SR, Seow-Choen F. Preservation of rectal function after low anterior resection with formation of a neorectum. Semin Surg Oncol. 2000;19:376-385. [PubMed] [DOI] |
| 23. | Jorge JM, Wexner SD. Etiology and management of fecal incontinence. Dis Colon Rectum. 1993;36:77-97. [PubMed] [DOI] |
| 24. | Bossema E, Stiggelbout A, Baas-Thijssen M, van de Velde C, Marijnen C. Patients' preferences for low rectal cancer surgery. Eur J Surg Oncol. 2008;34:42-48. [PubMed] [DOI] |
| 25. | Zolciak A, Bujko K, Kepka L, Oledzki J, Rutkowski A, Nowacki MP. Abdominoperineal resection or anterior resection for rectal cancer: patient preferences before and after treatment. Colorectal Dis. 2006;8:575-580. [PubMed] [DOI] |
| 26. | Glynne-Jones R, Mawdsley S, Pearce T, Buyse M. Alternative clinical end points in rectal cancer--are we getting closer? Ann Oncol. 2006;17:1239-1248. [PubMed] [DOI] |
| 27. | den Dulk M, Marijnen CA, Putter H, Rutten HJ, Beets GL, Wiggers T, Nagtegaal ID, van de Velde CJ. Risk factors for adverse outcome in patients with rectal cancer treated with an abdominoperineal resection in the total mesorectal excision trial. Ann Surg. 2007;246:83-90. [PubMed] [DOI] |
| 28. | Nagtegaal ID, Marijnen CA, Kranenbarg EK, van de Velde CJ, van Krieken JH. Circumferential margin involvement is still an important predictor of local recurrence in rectal carcinoma: not one millimeter but two millimeters is the limit. Am J Surg Pathol. 2002;26:350-357. [PubMed] [DOI] |