修回日期: 2014-07-21
接受日期: 2014-07-31
在线出版日期: 2014-09-18
目的: 研究蒙脱石散、美沙拉秦及美沙拉秦联合蒙脱石散对2,4,6-三硝基苯磺酸(2,4,6-trinitrobenzene sulfonic acid, TNBS)诱导的溃疡性结肠炎(ulcerative colitis, UC)大鼠肠上皮细胞凋亡的影响.
方法: 82只♂SD大鼠, 随机分为正常组、模型组、干预组, 干预组包括蒙脱石散组、美沙拉秦组, 美沙拉秦联合蒙脱石散组. 采用TNBS/乙醇法建立大鼠UC模型. 确认模型建立后, 模型组每天经口灌入生理盐水, 干预组分别每天经口灌入蒙脱石散、美沙拉秦、美沙拉秦联合蒙脱石散. 分别于灌胃满5 d和12 d时处死大鼠, 剖取结肠标本采用原位末端标记法(terminal-deoxynucleoitidyl transferase mediated nick end labeling, TUNEL)测定细胞凋亡情况.
结果: (1)模型建立成功: 造模满24 h后大鼠出现腹泻、血便、体质量下降. 结肠组织行光镜和电镜观察可见黏膜溃疡形成, 并伴有中性粒细胞浸润、腺体结构破坏和杯状细胞减少; (2)肠组织细胞凋亡的检测结果: 治疗5 d及12 d的模型组、干预组与正常组相比, 肠上皮细胞凋亡率明显增加(H5 = 439.78, H12 = 84.03, P = 0.000); 给药治疗5 d的3个干预组分别与治疗5 d的模型组比较, 肠上皮细胞凋亡率明显降低(P = 0.000); 3个干预组间两两比较, 美沙拉秦联合蒙脱石散组的凋亡率明显低于蒙脱石散组和美沙拉秦组(P = 0.000); 给药治疗12 d的3个干预组分别与治疗12 d的模型组比较, 肠上皮细胞凋亡率明显降低(P = 0.000); 3个干预组间两两比较, 美沙拉秦联合蒙脱石散组的凋亡率明显低于美沙拉秦组, 美沙拉秦组明显低于蒙脱石散组(P = 0.000); 各干预组治疗12 d的凋亡率与本组治疗5 d的凋亡率相比明显减少(P = 0.000).
结论: 研究表明肠上皮细胞凋亡参与了UC的发病过程, 蒙脱石散与美沙拉秦联合治疗能抑制细胞凋亡, 蒙脱石散能辅助美沙拉秦降低肠黏膜通透性, 联合使用效果优于单独使用美沙拉秦的效果. 单独药物或联合药物治疗12 d的效果均优于治疗5 d的效果.
核心提示: 实验表明肠上皮细胞凋亡参与了溃疡性结肠炎(ulcerative colitis)的发病过程, 蒙脱石散与美沙拉秦联合治疗能抑制细胞凋亡, 蒙脱石散能辅助美沙拉秦降低肠黏膜通透性, 效果优于单独使用美沙拉秦, 单独药物或联合药物治疗12 d的效果均优于治疗5 d的效果.
引文著录: 远孟梦, 熊晶晶, 赵川, 胡红卫, 刘梅, 赵亚玲, 丁臻博, 黄永坤. 蒙脱石散与美沙拉秦对溃疡性结肠炎大鼠肠上皮细胞凋亡的影响. 世界华人消化杂志 2014; 22(26): 3911-3917
Revised: July 21, 2014
Accepted: July 31, 2014
Published online: September 18, 2014
AIM: To assess the effect of montmorillonite powder (Smecta) and mesalazine, alone or in combination, on intestinal epithelial cell apoptosis in rats with 2,4,6-trinitrobenzene sulfonic acid (TNBS) induced colitis.
METHODS: Eighty-two male SD rats were randomly divided into a normal group, a model group and three intervention groups including Smecta group, mesalazine group, and mesalazine plus Smecta group. Ulcerative colitis (UC) was induced in rats by the TNBS/ethanol method. The model group was daily treated with normal saline, and the intervention groups were intragastrically treated with Smecta, mesalazine, mesalazine plus Smecta, respectively. Rats were killed on days 5 and 12 after treatment to collect colon specimens. Terminal-deoxynucleoitidyl transferase mediated nick end labeling (TUNEL) method was used to assay intestinal cell apoptosis rate.
RESULTS: The rats treated with TNBS/ethanol had diarrhea with bloody stools and weight loss 24 h after model creation. Light and electronic microscopic analyses showed large mucosal ulceration area accompanied by neutrophil infiltration, damaged gland structural and decreased goblet cells. Compared with the normal group, intestinal epithelial cell apoptosis rates in the model group and three intervention groups were significantly increased on days 5 and 12 (H5 = 439.78, H12 = 84.03, P = 0.000). Compared with the model group, intestinal epithelial cell apoptosis rates in the three intervention groups were significantly lower on days 5 and 12 (P = 0.000). The apoptosis rates in the combination group were more significantly lower than those in the two monotherapy groups (P = 0.000). The apoptosis rates in the three intervention groups on day 12 were more significantly lower than those on day 5 (P = 0.000).
CONCLUSION: Intestinal epithelial cell apoptosis is involved in the pathogenesis of UC. Montmorillonite powder combined with mesalazine therapy has a synergistic inhibitory effect on apoptosis. The inhibitory effect on apoptosis is better on day 12 than on day 5.
- Citation: Yuan MM, Xiong JJ, Zhao C, Hu HW, Liu M, Zhao YL, Ding ZB, Huang YK. Effect of montmorillonite powder and mesalazine on intestinal epithelial cell apoptosis in rats with ulcerative colitis. Shijie Huaren Xiaohua Zazhi 2014; 22(26): 3911-3917
- URL: https://www.wjgnet.com/1009-3079/full/v22/i26/3911.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i26.3911
溃疡性结肠炎(ulcerative colitis, UC)是一种累及直肠和结肠的慢性非特异性炎症疾病. 持续或反复发作的腹泻、黏液脓血便、腹痛及里急后重等症状是UC的主要临床表现[1]. UC病程迁延不愈, 儿童患者还会合并生长发育迟缓、营养不良等情况[2], 以其慢性、复发性的特点, 严重影响患儿的生活质量、生长发育和远期预后[3]. UC的发病机制尚不明确, 近年来的研究显示细胞凋亡在UC的发生和发展中起了重要作用[4]. 美沙拉秦作为新型替代型5-氨基水杨酸制剂, 在一定程度上可以缓解并控制症状. 但他只能单纯控制炎症, 不能有效保护肠黏膜屏障. 蒙脱石散是一种黏膜保护和修复剂, 可覆盖在消化系黏膜表面, 加强黏膜防御屏障, 减少肠腔内抗原物质的吸收, 恢复受损肠上皮细胞的吸收和分泌功能, 保持其完整性及重建肠腔表面膜的能力. 本研究致力于联合使用美沙拉秦、蒙脱石散后观察UC大鼠肠上皮细胞凋亡的改变, 评估对大鼠肠黏膜屏障损伤的影响, 从而为临床干预提供依据.
由昆明医科大学动物实验中心提供SPF级清洁健康♂适龄(6-8 wk)SD大鼠82只, 体质量160-200 g, 动物生产许可证号: SYXK(滇)2011-0004. 5%TNBS溶液(p2297-10 mL): 美国Sigma公司; 无水乙醇、10%水合氯醛、40 g/L甲醛、去离子水(天根生化, RT120-01); RNase-Free ddH2O、in situ cell death detection kit(美国Roche公司, 11684809910); 枸橼酸抗原修复液、蛋白酶K(Sigma公司); 美沙拉秦肠溶片(莎尔福): 德国Losan Pharma.GmbH公司, 生产批号: 13A31318L; 蒙脱石散(思密达): 博福-益普生(天津)制药有限公司, 生产批号: F10752. 外科手术器械; 1 mL注射器若干, 聚炳烯管(直径约2 mm); 电子天平(200 g, JY5002)(上海杭平天平有限公司); 大鼠灌胃器、BME显微镜(德国Leica公司); BX50显微成像系统(日本OLYMPUS公司).
1.2.1 分组及造模: 参照文献[5]将82只清洁级SD♂大鼠称体质量后编号, 按照随机数字表分为正常组(n = 10)、模型组(n = 18)、美沙拉秦组(n = 18)、蒙脱石散组(n = 18)、美沙拉秦联合蒙脱石散组(n = 18). 统一饲养在动物实验中心不锈钢铁丝笼中, 用标准柱状饲料饲养, 自由饮用实验中心提供的灭菌水, 空气温度20 ℃-29 ℃, 空气湿度50%-70%, 通风较好. 适应性喂养3 d, 除正常组外, 其余各组均禁食不禁水36 h予10%水合氯醛2 mL/kg麻醉后将聚丙烯管插入肛门上段8 cm, 一次性注入5%TNBS 100 mg/kg(2 mL/kg)、50%乙醇等体积混合液, 并注入0.5 mL空气, 捏闭肛门倒立5 min后将大鼠平躺由其自然清醒, 常规饲养.
造模满24 h大鼠精神变差, 皮毛无光泽, 体质量下降, 腹泻, 黏液血便. 造模24 h后各组随机抽取2只大鼠通过大鼠尾静脉同步注射99TcmN(NFXDTC)2同位素显像剂[6]约1 mL, 对比正常大鼠与造模24 h后大鼠的显影, 后处死大鼠, 解剖取结肠组织HE染色光镜和电镜下观察病理改变, 对比显影效果. 模型组予NS 2 mL/d灌服, 治疗组予美沙拉秦[0.2 g/(kg·d)]联合蒙脱石散[0.8 g/(kg·d)]灌胃治疗.
治疗组在灌胃治疗满12 d后, 与正常组、模型组大鼠再次同步注射99TcmN(NFXDTC)2同位素显像剂约1 mL监测治疗后显影效果, 后再次处死大鼠, 取结肠组织HE染色光镜和电镜下观察病理改变, 并再次与显像效果比较.
1.2.2 治疗: 根据人和大鼠体表面积折算公式计算出大鼠给药剂量[7]. 模型组给予0.9%生理盐水2 mL, 蒙脱石散组[0.81 g/(kg·d)]、美沙拉秦组[0.2 g/(kg·d)]、美沙拉秦联合蒙脱石散组分别给予相应的药物剂量, 两药灌服时间间隔2 h. 各组均定量给食, 充足给水.
1.2.3 标本的采集及处理: 各治疗组在治疗满5 d后, 取本组一半的大鼠, 在3 mL/kg水合氯醛腹腔注射的麻醉下, 仰卧位固定, 严格无菌操作, 手术剪自腹正中线打开腹部, 暴露腹腔组织, 用镊子小心分离肠系膜后取远端结肠约10 cm, 沿肠系膜纵轴剪开肠管, 用冰生理盐水冲洗后, 取病变最明显的肠段, 甲醛固定, 石蜡包埋, 连续切片. 剩余大鼠于治疗满12 d后标本采集同前. 石蜡切片按原位末端细胞凋亡检测试剂盒说明书进行操作, 每张切片选择5个染色典型的不重叠的高倍视野, 计数凋亡的细胞数和细胞总数, 计算其中凋亡细胞所占百分比.
统计学处理 用SPSS17.0版统计软件包处理数据. 计量资料以mean±SD表示, 多组数据间用单因素方差分析. 两组数据间比较用t检验. 以P<0.05为差异有统计学意义.
正常组大鼠每天进食正常, 活动如常, 反应机警, 皮毛有光泽, 生长发育良好, 体质量增加; 模型组及治疗组大鼠造模24 h后就相继出现精神萎靡, 皮毛无光泽, 喜蜷缩扎堆而卧, 饮食量减少, 体质量下降, 并出现稀便、血便. 各治疗组给予治疗的大鼠一般情况随给药时间延长逐渐好转, 饮食量增加, 体质量增加, 肉眼血便消失. 联合用药组一般情况改善尤为明显.
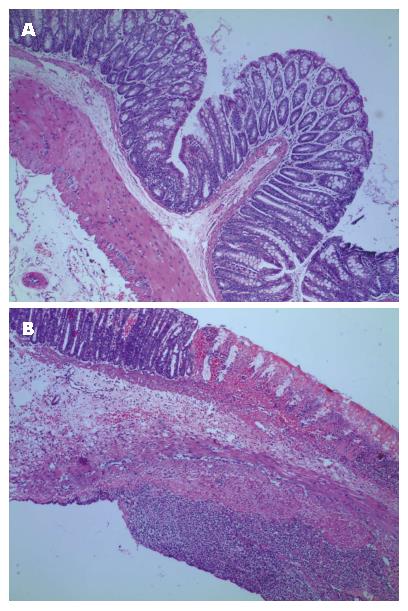
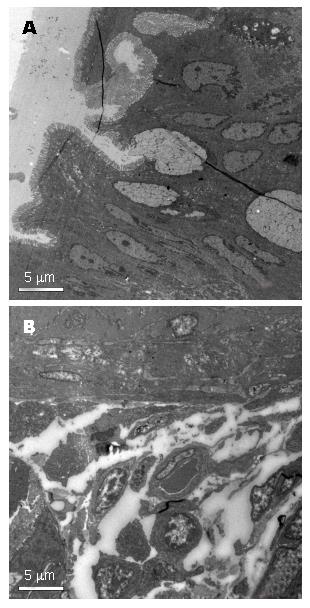
正常组大鼠肠组织腺体排列整齐规则, 隐窝正常, 杯状细胞无明显减少, 仅个别有轻度黏膜层炎性细胞浸润, 无溃疡及糜烂, 肌层无异常. 造模24 h后的大鼠肠壁全层大量炎细胞浸润, 可见典型溃疡形成, 黏膜层出血、坏死, 尚未脱落, 黏膜下层疏松、水肿, 血管扩张充血、出血, 肌层散在中性粒细胞, 集中一块坏死黏膜正对浆膜面可见片状炎性细胞聚集, 以中性粒细胞为主, 腺体结构紊乱, 杯状细胞减少(图1, 图2). 参照文献[8]同位素全身显像, 模型大鼠尾静脉注射核素显像剂20 min后在腹腔炎症处聚集, 出现显影. 以上为模型建立成功的表现.
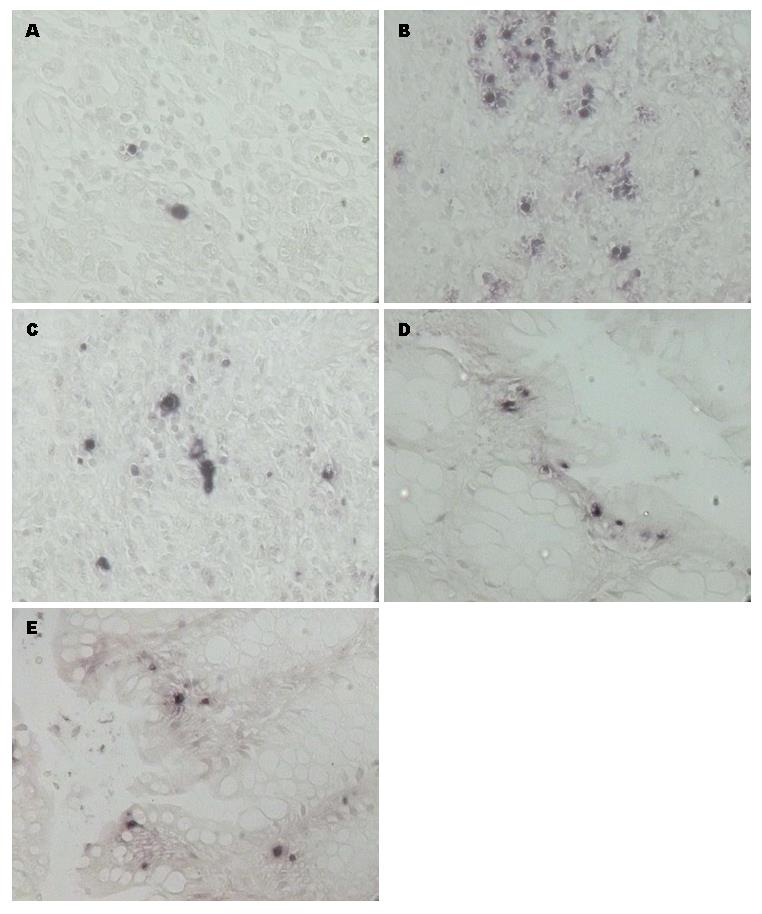
治疗5 d及12 d的模型组、干预组与正常组相比, 肠上皮细胞凋亡率明显增加(H5 = 439.78, H12 = 84.03, P = 0.000); 给药治疗5 d的3个干预组分别与治疗5 d的模型组比较, 肠上皮细胞凋亡率明显降低(P = 0.000); 3个干预组间两两比较, 美沙拉秦联合蒙脱石散组的凋亡率明显低于蒙脱石散组和美沙拉秦组(P = 0.000), 蒙脱石散组与美沙拉秦组相比无差异(P = 0.347); 给药治疗12 d的3个干预组分别与治疗12 d的模型组比较, 肠上皮细胞凋亡率明显降低(P = 0.000); 3个干预组间两两比较, 美沙拉秦联合蒙脱石散组的凋亡率明显低于美沙拉秦组, 美沙拉秦组明显低于蒙脱石散组(P = 0.000); 各干预组治疗12 d的凋亡率与本组治疗5 d的凋亡率相比明显减少(P = 0.000)(表1, 图3).
综合近几年的研究结果, 目前大多数学者认为肠黏膜屏障功能的障碍在UC的疾病发展过程中有着重要意义[9], 主要的危险因素很可能与免疫、遗传、感染、精神因素有关. UC发病时, 肠黏膜屏障遭到破坏, 细胞大量凋亡, 一些原本不能通过肠黏膜屏障的有害物质会进入黏膜, 引发机体对其产生异常免疫, 异常的免疫反应产生炎症, 引起肠黏膜上皮细胞凋亡, 导致肠黏膜上皮缺失, 影响上皮细胞连接的完整性, 肠黏膜屏障遭到破坏, 组织对炎症等破坏因素的抵抗能力降低, 增加了发病和复发的可能, 形成恶性循环, 使病情迁延. UC发病过程中, 肠黏膜屏障受损既是表现又是原因.
正常肠黏膜屏障由机械屏障、化学屏障、免疫屏障、生物屏障共同构成, 在抗感染、防损伤、免疫防御等方面起着重要作用[10]. 机械屏障也就是肠道上皮细胞黏膜屏障是肠道最重要的一道防线, 由完整的肠黏膜上皮细胞和黏膜表面黏液层组成, 并调控着水和溶质的跨上皮转运[11], 能有效将肠腔内细菌、抗原等物质与肠黏膜固有层免疫细胞隔离开. 肠上皮细胞为单层柱状上皮细胞, 是抵抗病毒、细菌侵袭及食物抗原侵入的首道防线, 维持其完整性至关重要. 在正常的生理情况下, 新生的上皮细胞从隐窝基底部沿隐窝绒毛轴向上移行, 从未分化细胞、活跃增殖的细胞, 到成熟的绒毛上皮细胞, 逐渐分化成熟, 然后在机体调控下发生细胞凋亡[12].
细胞凋亡在维持肠黏膜上皮细胞稳态中起着重要的作用[13]. 一旦细胞凋亡的正常规律被打破, 异常的细胞凋亡将引起一系列的疾病, 包括癌症、感染性疾病、自身免疫性疾病等. 目前, 许多研究证实, 细胞凋亡参与胃肠道疾病的发生, 例如幽门螺旋杆菌感染可诱导胃黏膜上皮细胞的凋亡和增殖异常, 使细胞增殖和凋亡的正常区带发生改变, 同时参与消化道肿瘤的发生[14]. UC的发病机制尚不明确, 近年来的研究显示细胞凋亡在UC的发生和发展中起了重要作用[15]. 肠道功能的正常依赖于肠黏膜结构的完整和功能的正常, 能保护机体免受外来细菌、病毒等有害物的侵袭, 避免黏膜异常免疫反应的发生[16]. 有研究表明[17], 结肠炎患者病灶多发生于与细菌接触最多的区域, 炎症最常见的部位也是人体肠道细菌浓度最高的解剖部位(远端回肠与结肠).
正常情况下机体肠腔内含有大量细菌和内毒素, 当肠黏膜屏障功能障碍时, 内毒素穿过肠黏膜, 引起细胞线粒体结构的改变及细胞能量代谢障碍, 介导细胞凋亡[18]. Iwamoto等[19]的研究表明, 正常的结肠细胞凋亡主要发生在肠腔上皮细胞, 而活动期溃疡性结肠炎除肠腔上皮细胞外, 病变处及邻近的非病变处隐窝上皮细胞凋亡增加, 从而使由上皮细胞构成的黏膜屏障破坏, 导致结肠黏膜的损伤和溃疡. 肠上皮细胞在正常情况下仅存在少量的凋亡现象, 发生UC时, 肠黏膜细胞凋亡的数目增多, 可能是UC发病的重要机制之一[20]. 2007年李莉等[21]取36例UC患者肠组织与正常人肠组织作对比, UC组及对照组肠细胞凋亡率分别为15.31%±1.49%和5.46%±1.01%, UC组及对照组细胞增殖率分别为15.76%±1.83%和5.52%±1.16%, 两者的凋亡和增殖差异均有统计学意义. UC时肠道上皮细胞凋亡速率增加, 同时伴随隐窝细胞过度增殖. 2014年袁柏思等[22]用右旋葡聚硫酸钠溶液诱导建立UC大鼠模型, 8 d后处死大鼠取结肠标本进行肠细胞凋亡检测并收集尿液分析大鼠尿液中三氯蔗糖及甘露醇排泄量, 评估结肠通透性. 结果表明, UC组大鼠结肠上皮细胞凋亡数量明显高于正常组, UC组大鼠尿液中三氯蔗糖及甘露醇排泄量均高于正常组, 凋亡的增加引起肠黏膜的损伤, 肠道通透性的增加和结肠上皮细胞凋亡数量呈正相关. 亦有研究表明, 活动期UC患者结肠黏膜上皮细胞凋亡数是对照组的32倍[23], 局部大量上皮细胞的凋亡会导致黏膜屏障的破坏, 使局部炎性细胞浸润增多, 进一步加重黏膜损伤[24].
本实验中我们也得出了相同的实验结果, 与正常对照组相比, 模型组大鼠肠道上皮细胞凋亡率明显增高, 模型组与正常组肠细胞凋亡率分别为89.67%±2.16%和4.5%±0.84%, 正常组与5 d及12 d模型组细胞凋亡率的比较均有统计学意义(P = 0.000), 表明了肠道细胞凋亡参与了UC的发病过程. 过度的凋亡不利于肠上皮的再生与修复, 引起肠黏膜屏障功能障碍. UC的发病机制主要有感染、免疫、遗传、精神等学说, 这些学说都有一定的临床或实验的验证或者统计学资料的支持, 但是肠道黏膜屏障的损伤或黏膜屏障功能的低下是UC发病的基础, 无论哪种诱因导致的UC发病, 必先引起肠道功能的紊乱, 黏膜受损, 导致肠道通透性增加, 有害物质的入侵诱发UC的发生, 而肠上皮细胞的凋亡增多直接导致的后果就是黏膜功能紊乱, 肠黏膜屏障功能异常[25]. 肠黏膜屏障在预防微生物及毒素侵入机体方面发挥着重要作用, 因此阻止细胞凋亡, 改善肠黏膜屏障功能, 缓解和促进UC受损肠黏膜屏障修复是治疗UC的有效途径之一. 有报道[26]蒙脱石散可通过自身与肠黏液分子间的互相作用, 增加黏液内聚力、存在时间和弹性, 从而保护肠细胞顶端和细胞间桥免受损伤, 促进上皮细胞再生和修复. 梁若玲[27]和王进海等[28]通过研究发现, 蒙脱石散可覆盖在消化系黏膜表面, 加强黏膜防御屏障, 减少肠腔内抗原物质的吸收, 恢复肠上皮细胞的正常吸收、分泌功能, 降低结肠的敏感性, 改善症状, 吸附毒素、细菌和病毒, 还能修复黏膜, 保持其完整性及重建肠腔表面膜的能力. 江学良等[29,30]研究蒙脱石散可以直接修复损伤肠黏膜, 与美沙拉秦联合治疗能更快修复损伤肠黏膜屏障, 使线粒体肿胀减轻, 微绒毛和杯状细胞恢复正常, 凋亡细胞显著减少, 细胞连接恢复正常. 以上研究与本实验研究结论一致, 在蒙脱石散干预后肠道损伤减轻, 凋亡率较模型组明显下降, 与模型组细胞凋亡率的比较有统计学意义(P = 0.000), 说明蒙脱石散可能在肠道形成保护层, 减轻肠黏膜受损, 并修复已受损伤肠黏膜, 抑制细胞凋亡, 促进溃疡愈合, 有效地保护肠道屏障. 蒙脱石散与美沙拉秦联合治疗, 凋亡率明显下降, 与模型组比较有统计学意义(P = 0.000), 治疗5 d及12 d的美沙拉秦组与治疗5 d及12 d的美沙拉秦联合蒙脱石散组凋亡率的比较均有统计学意义(P5 d = 0.000, P12 d = 0.029), 效果优于单独使用美沙拉秦, 说明蒙脱石散能辅助美沙拉秦增强肠黏膜屏障功能, 抑制细胞凋亡, 改善肠黏膜屏障功能.
本实验中蒙脱石散组、美沙拉秦组、美沙拉秦联合蒙脱石散组各组治疗12 d的细胞凋亡率较治疗5 d的明显降低, 各组治疗5 d与治疗12 d细胞凋亡率的比较均具有统计学意义(P = 0.000), 说明单独药物或联合药物治疗12 d的效果均优于治疗5 d的效果. 蒙脱石散联合美沙拉秦治疗UC, 美沙拉秦通过控制或减轻肠黏膜炎症和免疫反应以减轻肠黏膜屏障的损伤, 蒙脱石散通过修复肠黏膜屏障以控制或减轻肠黏膜炎症和免疫反应. 联合用药不仅抑制肠黏膜炎症反应, 还有效地调节、改善肠黏膜屏障功能, 达到迅速缓解症状和修复肠黏膜屏障的作用. 因此阻止细胞凋亡的发生是治疗UC有效的途径之一.
炎症性肠病(inflammatory bowel disease, IBD)是一类以反复复发和缓解为临床特征的疾病,包括溃疡性结肠炎(ulcerative colitis, UC)和克罗恩病(Chron's diseases, CD). UC是一种主要累及直肠和结肠的慢性非特异性炎症疾病. 主要表现为反复发作的腹痛、腹泻、黏液脓血便等. 以其慢性、复发性的特点, 严重影响患儿的生活质量、生长发育和远期预后.
江学良, 教授, 主任医师, 中国人民解放军济南军区总医院消化科
UC发生机制目前尚不完全清楚, 但大多数学者认为肠黏膜屏障功能的障碍与UC的发展有着密切的关系. 美沙拉秦控制或减轻肠黏膜免疫反应和炎症有助于减轻黏膜屏障损伤, 蒙脱石散修复黏膜损伤有助于控制或减轻肠黏膜免疫反应和炎症, 因此我们认为蒙脱石散、美沙拉秦或联合用药可能具有缓解和促进受损肠黏膜屏障修复的作用.
2007年李莉等研究表明UC患儿肠组织细胞凋亡率较正常对照组明显增高. 2013年袁柏思等用右旋葡聚硫酸钠溶液诱导建立UC大鼠模型, 取结肠标本进行肠细胞凋亡检测发现UC组大鼠结肠上皮细胞凋亡数量明显高于正常组, 凋亡的增加引起肠黏膜的损伤, 肠道通透性的增加和结肠上皮细胞凋亡数量呈正相关. 2003年Kojima等研究发现活动期UC患者结肠黏膜上皮细胞凋亡数是对照组的32倍.
采用2,4,6-三硝基苯磺酸(2,4,6-trinitrobenzene sulfonic acid, TNBS)/乙醇法建立大鼠溃疡性结肠炎模型, 确认模型建立后, 使用美沙拉秦、蒙脱石散及美沙拉秦联合蒙脱石散进行干预治疗, 研究其对溃疡性结肠炎大鼠肠上皮细胞凋亡的影响.
本实验中我们发现模型组大鼠肠道上皮细胞凋亡率明显增高, 表明了肠道细胞凋亡参与了UC的发病过程. 过度的凋亡不利于肠上皮的再生与修复, 引起肠黏膜屏障功能障碍. 蒙脱石散能辅助美沙拉秦减轻肠黏膜屏障损伤, 抑制细胞凋亡, 改善肠黏膜屏障功能, 为联合用药修复肠黏膜屏障提供了实验资料.
溃疡性结肠炎(UC): 一种累及直肠和结肠的慢性非特异性炎症疾病. 主要临床表现为持续或反复发作的腹泻、黏液脓血便、腹痛及里急后重等; 细胞凋亡: 由一系列基因控制的细胞自主性死亡的过程, 是为了调控机体发育和维护内环境稳定, 保证机体正常的生理功能.
本文报道肠上皮细胞凋亡参与了溃疡性结肠炎的发病过程, 蒙脱石散与美沙拉秦联合治疗能抑制细胞凋亡, 降低肠黏膜通透性, 为联合用药修复肠黏膜屏障提供了实验资料. 论文设计合理, 具有一定科学性和实用性.
编辑: 郭鹏 电编:闫晋利
| 2. | Wong SC, Smyth A, McNeill E, Galloway PJ, Hassan K, McGrogan P, Ahmed SF. The growth hormone insulin-like growth factor 1 axis in children and adolescents with inflammatory bowel disease and growth retardation. Clin Endocrinol (Oxf). 2010;73:220-228. [PubMed] |
| 3. | Hofley PM, Piccoli DA. Inflammatory bowel disease in children. Med Clin North Am. 1994;78:1281-1302. [PubMed] |
| 4. | Xavier RJ, Podolsky DK. Unravelling the pathogenesis of inflammatory bowel disease. Nature. 2007;448:427-434. [PubMed] [DOI] |
| 5. | 张 涛, 谢 建群. 大鼠溃疡性结肠炎模型的实验研究. 中国中西医结合消化杂志. 2006;14:240-242. |
| 6. | 张 仕坚, 王 跃, 张 俊波, 王 学斌. 新型炎症显像剂99TcN-诺氟沙星氨荒酸盐配合物的研究. 中国核科学技术进展报告-中国核学会2009年学术年会论文集(第一卷·第4册). 2009;. |
| 12. | Verstege MI, te Velde AA, Hommes DW. Apoptosis as a therapeutic paradigm in inflammatory bowel diseases. Acta Gastroenterol Belg. 2006;69:406-412. [PubMed] |
| 13. | Grossmann J, Walther K, Artinger M, Rümmele P, Woenckhaus M, Schölmerich J. Induction of apoptosis before shedding of human intestinal epithelial cells. Am J Gastroenterol. 2002;97:1421-1428. [PubMed] [DOI] |
| 14. | 彭 黎明, 王 曾礼. 细胞凋亡的基础与临床. 北京: 人民卫生出版社 2000; 13-15. |
| 16. | Shen L, Su L, Turner JR. Mechanisms and functional implications of intestinal barrier defects. Dig Dis. 2009;27:443-449. [PubMed] [DOI] |
| 17. | Campieri M, Gionchetti P. Probiotics in inflammatory bowel disease: new insight to pathogenesis or a possible therapeutic alternative? Gastroenterology. 1999;116:1246-1249. [PubMed] [DOI] |
| 19. | Iwamoto M, Koji T, Makiyama K, Kobayashi N, Nakane PK. Apoptosis of crypt epithelial cells in ulcerative colitis. J Pathol. 1996;180:152-159. [PubMed] [DOI] |
| 20. | Rábago LR, Castro JL, Joya D, Montes C, Gea F, Mora P, Blesa C. [Treatment of inoperable malignant gastric stenosis with self-expanding prosthesis]. Gastroenterol Hepatol. 1999;22:510-513. [PubMed] |
| 23. | Kojima M, Iwakiri R, Wu B, Fujise T, Watanabe K, Lin T, Amemori S, Sakata H, Shimoda R, Oguzu T. Effects of antioxidative agents on apoptosis induced by ischaemia-reperfusion in rat intestinal mucosa. Aliment Pharmacol Ther. 2003;18 Suppl 1:139-145. [PubMed] [DOI] |
| 24. | Heller F, Fromm A, Gitter AH, Mankertz J, Schulzke JD. Epithelial apoptosis is a prominent feature of the epithelial barrier disturbance in intestinal inflammation: effect of pro-inflammatory interleukin-13 on epithelial cell function. Mucosal Immunol. 2008;1 Suppl 1:S58-S61. [PubMed] [DOI] |
| 27. | 梁 若玲. 思密达治疗肠易激综合征疗效观察. 胃肠病学和肝病学杂志. 2001;10:117. |
| 29. | 江 学良, 权 启镇, 孙 自勤. 蒙脱石散剂联合美沙拉嗪治疗溃疡性结肠炎腹泻 的疗效. 中华消化病与影像杂志. 2011;1:39-42. |