修回日期: 2014-07-08
接受日期: 2014-07-28
在线出版日期: 2014-09-18
目的: 探讨Lin28A/B亚型对肝癌细胞凋亡的影响, 揭示其在肝癌发生发展过程中的作用.
方法: Real-time PCR和Western blot分别检测Lin28A/B亚型在肝癌细胞系中的表达变化; Real-time PCR和Western blot检测siRNA分别干扰Lin28A/B亚型后二者在肝细胞癌中的表达; MTT法分别Lin28A/B siRNA转染肝癌细胞48、72 h后对肝癌细胞增殖的影响, FACS检测二者对肝癌细胞凋亡的作用.
结果: Lin28A和Lin28B在肝癌细胞中的表达明显上调(P<0.05; P<0.01), 其中Lin28B在肝癌细胞中表达增加更加明显; siRNA可降低Lin28A/B在肝癌细胞中的表达(P<0.05); Lin28A/B siRNA均可抑制肝癌细胞的增殖, 诱导肝癌细胞凋亡率显著增加, 且随着转染时间的延长而进一步增加(P<0.05; P<0.01); 其中Lin28B siRNA对肝癌细胞的作用优于Lin28A siRNA(P<0.05).
结论: Lin28A/B两种亚型均参与肝癌细胞的发生、发展, 其中Lin28B亚型在诱导肝癌细胞凋亡中起主要作用, 而Lin28A可能起到协同作用.
核心提示: Lin28A/B在肝癌细胞中的表达明显高于正常肝细胞, 通过RNA干扰的方法降低Lin28A/B 的表达均可抑制肝癌细胞增殖、诱导肝癌细胞凋亡. Lin28B亚型在诱导肝癌细胞凋亡中起主要作用, 而Lin28A可能起到协同作用.
引文著录: 盛金丹, 雷蕾, 王爱平. Lin28A/B不同亚型诱导肝癌细胞凋亡的作用. 世界华人消化杂志 2014; 22(26): 3891-3897
Revised: July 8, 2014
Accepted: July 28, 2014
Published online: September 18, 2014
AIM: To explore the role of Lin28A/B subtypes in apoptosis of hepatocellular carcinoma (HCC) cells, and to analyze the mechanism of action of Lin28A/B in tumorigenesis of HCC.
METHODS: The mRNA and protein expression of Lin28A/B in HCC cells was detected by real-time PCR and Western blot. After siRNAs targeting Lin28A/B were transfected into HCC cells, the expression of Lin28A/B was detected by real-time PCR and Western blot, cell proliferation was assessed by MTT assay, and cell apoptosis was analyzed by FACS.
RESULTS: Real-time PCR showed that the expression of Lin28A/B mRNAs was up-regulated in HCC cells (P < 0.05; P < 0.01), and the up-regulation of Lin28B was more significant than that of Lin28A. Transfection of Lin28A/B siRNAs decreased the expression of Lin28A/B in HCC cells (P < 0.05). MTT assay revealed that Lin28A and Lin28B siRNAs significantly inhibited HCC cell proliferation (P < 0.05; P < 0.01) and promoted cell apoptosis (P < 0.05; P < 0.01). The effect of Lin28B siRNA on cell proliferation and apoptosis was stronger than that of Lin28A siRNA (P < 0.05).
CONCLUSION: Both Lin28A/B take part in the tumorigenesis of HCC. Lin28B may play a major role in HCC tumorigenesis, while Lin28A may play a subordinate role.
- Citation: Sheng JD, Lei L, Wang AP. Role of Lin28A/B subtypes in apoptosis of hepatocellular carcinoma cells. Shijie Huaren Xiaohua Zazhi 2014; 22(26): 3891-3897
- URL: https://www.wjgnet.com/1009-3079/full/v22/i26/3891.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i26.3891
Lin28属于RNA结合蛋白(RNA binding protein, RBP)家族的成员, 具有高度保守性和独特的RNA联结模体, 最早研究起始于Lin28在线虫中的表达, 随后证实Lin28在其他高等物种中也有表达, 且表达方式各自不同, 调节机制各异[1,2]. 在哺乳动物中, 该基因家族目前发现Lin28A和Lin28B两个同型体(亚型)成员[3,4]. Lin28以多种类型集中表达在人类未分化的细胞中, 从而使分化细胞中相关mRNA的翻译和稳定性受到影响[5-7]. 近期研究显示, Lin28基因是诱导多能干细胞(induced pluripotent stem cells, iPS)的关键调节因子之一, 因此成为研究热点. Lin28通过调节iPS可以参与干细胞的分化调控, 包括分化为神经细胞、生殖细胞等, 从而促进机体代谢, 组织生长发育, 细胞的更新等[8-10]. 然而, 令Lin28更加引人关注的是其与Let-7 miRNA家族的相互作用. RNA结合蛋白Lin28A/B可负向调控Let-7 miRNA家族的生物合成, 促进肿瘤的发生、发展和恶化[2,11]. 研究表明, Lin28高表达可见于横纹肌肉瘤、前列腺癌、乳腺癌等多种恶性肿瘤[7]. Lin28的表达增加虽在肝癌中也有研究报道[8], 但两个亚型Lin28A和Lin28B在肝癌发生、发展中的具体作用报道少见, 因此本研究通过siRNA分析Lin28A和Lin28B在对肝癌细胞增殖及诱导肝癌细胞凋亡中的作用, 揭示二者在肝癌发生过程中的作用机制, 为临床确定肝癌潜在治疗靶点提供理论依据.
正常肝细胞株IMH和肝癌细胞株Huh7购自美国ATCC细胞库; 高糖DMEM培养基、胎牛血清(fetal bovine serum, FBS)、青链霉素、二甲基亚砜、MTT粉购自Gibco公司; 胰酶-EDTA消化液购自Sigma公司; RNA提取试剂TRIzol、逆转录试剂盒、SYBR荧光定量试剂购自Invitrogen公司; Lin28A、Lin28B及内参引物合成由上海英骏生物技术公司合成; siRNA Lin28A(100 μmol/L)(cat no. s36195)、Lipofectamine® RNAiMAX及其他转染试剂购自Life Technologies公司; siRNA Lin28B(100 μmol/L)(cat no. s52477)购自Ambion公司; 其他常用试剂购自大连宝生物公司; 酶标仪购自Bio-rad公司; 实时定量PCR仪购自ABI公司; 流式细胞仪购自BD公司; 超净工作台购自苏州苏泰净化设备工程有限公司.
1.2.1 细胞培养: IMH和Huh7细胞分别置于培养皿中培养, 培养液包括10%胎牛血清, 90%高糖DMEM培养基(含100 U/mL青霉素, 100 μg/mL链霉素), 37 ℃、5%CO2培养箱培养. 隔天换液, 每2-3天传代.
1.2.2 Real-time PCR检测: 采用TRIzol试剂提取IMH和Huh7细胞mRNA, 利用PCR特异引物设计合成cDNA. Lin28A: 上游引物: 5'-CACGCACGCGACTCTGTAAG-3'; 下游引物: 5'-GGATCACCTGGCTCTGTAATA-3'; Lin28B: 上游引物: 5'-AATGCGATGAGCTCTGTATC-3'; 下游引物: 5'-CTAAGTTATGGCTCTGCTTTG-3'; GAPDH: 上游引物: 5'-AGTACCAGTCTGTTGCTGG-3'; 下游引物: 5'-TAATAGACCCGGATGTCTGGT-3'. 对目的基因进行Real-time PCR检测. 反应条件: 50 ℃ 1 min, 95 ℃ 30 s, 56 ℃-60 ℃ 50 s, 72 ℃ 35 s, 共35个循环. GAPDH为参照, 数据收集主要由荧光定量PCR反应仪软件计算出所有标准品和样品的起始循环数(Ct), 并且根据标准品Ct值绘制出标准曲线, 再根据2-△△Ct法进行定量分析.
1.2.3 细胞转染: 转染试剂使用Lipofectamine RNAiMAX Reagent, 根据转染体系说明进行Lin28A siRNA和Lin28B siRNA转染. 接种Huh7细胞于6孔板, 至60%-80%融合开始转染, Lin28A siRNA和Lin28B siRNA和转染试剂分别用Opti-MEM稀释, 并室温孵育5 min, 将配制好的转染体系(siRNA-Reagent复合物)100 μL加入孔板中, 使siRNA终浓度达到5 nmol/L.
1.2.4 Western blot检测: 裂解全细胞, 将处理好的细胞裂解液加入蛋白上样缓冲液, 95 ℃加热5 min, 10%SDS-PAGE蛋白电泳分离样品, 并转移至硝酸纤维膜, 5%脱脂奶粉室温封2 h, 以去除非特异性背景, 4 ℃一抗孵育过夜, PBST洗涤, 加入相应兔二抗, 室温避光孵育30 min, PBST洗涤, ECL显色, X片曝光成像.
1.2.5 MTT检测细胞增殖率: 将Huh7细胞Lin28A siRNA和Lin28B siRNA转染48、72 h后及对照组细胞消化、计数, 以3000个/孔接种于96孔板, 同时每孔加入MTT溶液(5 g/L)20 μL, 温箱内培养4 h, 弃培养液, 加入DMSO 150 μL/孔, 摇床振荡10 min, 至紫色结晶充分溶解后, 置酶标仪于492 nm波长处测定其吸光度(A)值, 计算细胞增殖率(%) = (A实验组/A溶剂对照组-1)×100%. 每组均设5个复孔, 实验重复3次.
1.2.6 流式细胞仪检测细胞凋亡: 取Huh7细胞Lin28A siRNA和Lin28B siRNA转染72 h后, 用0.25%胰酶收集所有细胞, 用4 ℃预冷的PBS(0.1 mol/L, pH 7.4)洗涤1次, 计数细胞并调整细胞数约为1×106/mL. 根据Annexin V-FITC细胞凋亡检测试剂盒提供的方法进行处理细胞: 加入500 μL的Binding Buffer悬浮细胞; 加入5 μL Annexin V-FITC混匀; 再加入5 μL PI, 轻轻混匀; 避光, 室温放置15 min. 1 h内用流式细胞仪检测细胞凋亡, 激发波长为488 nm, 发射波长为530 nm. 所得数据用FCSExpress3.0软件进行分析.
统计学处理 所有数据均以mean±SD表示. 数据统计分析及处理均用SPSS16.0软件. 多组样本均数的比较应用单因素方差分析, 两样本均数的比较选择t检验. P<0.05为差异有统计学意义.
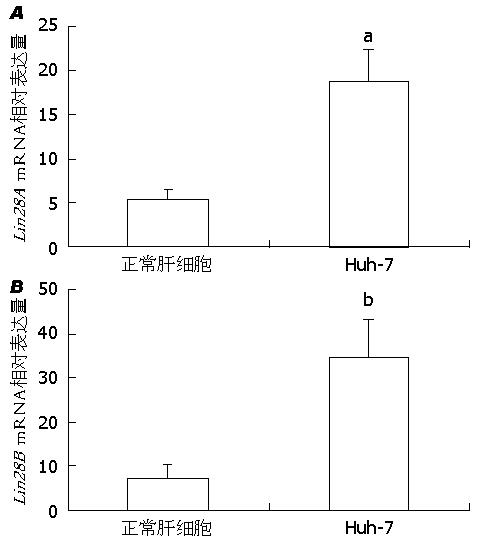
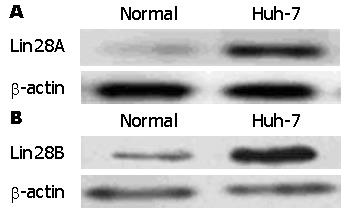
2.1 Lin28A和Lin28B在肝癌细胞中的表达应用Real-time PCR检测Lin28A和Lin28B两个基因在肝癌细胞中的表达变化. 与正常肝细胞比较, Lin28A在肝癌细胞中表达明显增加, 表达增加近3倍, 差异具有统计学意义(P<0.05)(图1A). 而Lin28B在肝癌细胞中表达亦显著增加, 与正常对照组比较, 表达增加近5倍, 差异具有统计学意义(P<0.01)(图1B). 利用Western blot检测Lin28A和Lin28B蛋白在肝癌细胞中的表达变化. 与基因表达相似, Lin28A在肝癌细胞中表达明显增加, 而Lin28B在肝癌细胞中表达亦显著增加(图2).
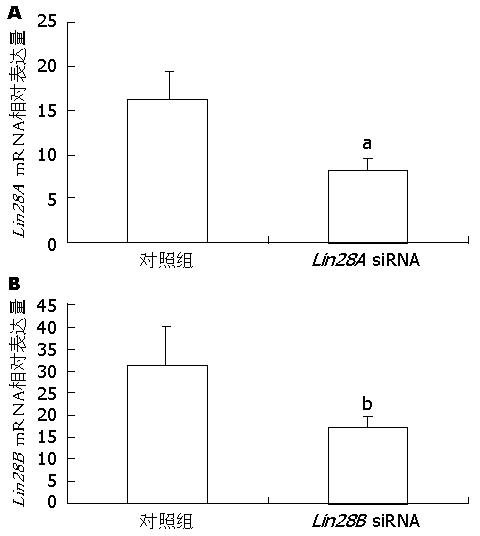
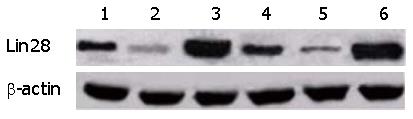
应用Real-time PCR检测分别用Lin28A siRNA和Lin28B siRNA转染Huh7细胞24 h后, Lin28A和Lin28B基因在肝癌细胞中的表达变化. 结果证实siRNA转染后, 可显著降低Lin28A和Lin28B在肝癌细胞中表达, 差异具有统计学意义(P<0.05)(图3). 进一步, 用Western blot检测Lin28A siRNA和Lin28B siRNA转染Huh7细胞24 h后, Lin28A和Lin28B在肝癌细胞中的表达. 结果可见分别siRNA转染后, 可显著降低Lin28A和Lin28B在Huh7细胞中的表达, 说明Lin28A siRNA和Lin28B siRNA可以成功干扰二者在肝癌细胞系中的表达(图4).
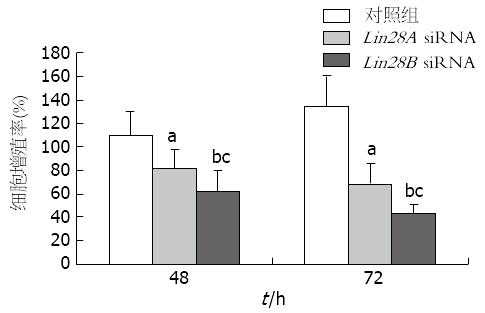
利用siRNA技术分别干扰Lin28A和Lin28B在肝癌细胞中的表达, MTT检测转染入肝癌细胞48、72 h后, 二者对肝癌细胞增殖的影响. Lin28A siRNA转染入肝癌细胞48 h后, 肝癌细胞增殖受到明显影响, 与肝癌细胞对照组比较差异具有统计学意义, 且随着转染时间的增长, 对肝癌细胞增殖抑制的作用更加显著(P<0.05). 肝癌细胞转染Lin28B siRNA后, 与肝癌细胞对照组比较, 肝癌细胞的增殖活性受到明显抑制, 具有显著统计学意义, 同样随着转染时间的增加而进一步影响肝癌细胞的增殖(P<0.01). 值得注意的是, 与Lin28A siRNA转染组比较, Lin28B siRNA转染组对肝癌细胞增殖的影响更加明显(P<0.05)(图5).
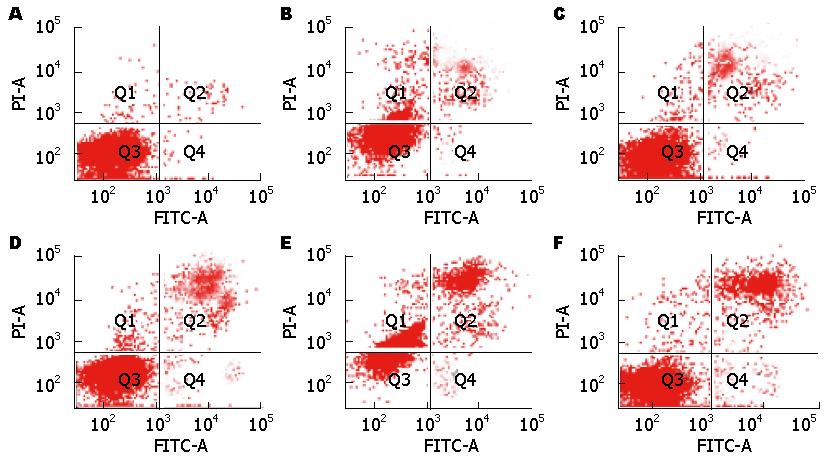
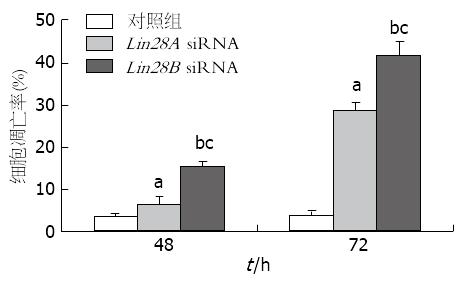
流式细胞仪检测细胞凋亡率结果显示, Lin28A siRNA和Lin28B siRNA转染Huh-7细胞48、72 h后, 细胞早期凋亡率逐渐上升, Lin28A siRNA和Lin28B siRNA转染后与对照组比较, 凋亡率显著增加, 差异有统计学意义(P<0.05); 且随着转移时间的延长, 凋亡率增加更加明显; 而且在不同时间点检测结果可见, 与Lin28A siRNA转染组比较, Lin28B siRNA转染组对凋亡的影响更加明显(图6, 图7).
肝细胞癌(hepatocellular carcinoma, HCC)是世界常见的肿瘤之一, 是肿瘤的主要死因之一, 发病率一直居高不下. 找到与肝癌发生密切相关的分子靶点一直以来是预防、诊断、治疗肝癌的新的研究热点[12-14]. 研究发现, 肝癌的发生与细胞周期、细胞分化等密切相关[15,16]. RBP作为能够调控细胞增殖、分化及生长的调节因子, 通过调节RNA剪接、转运、编辑等, 维持RNA细胞内稳定、定位及翻译等正常功能[17-19].
作为RBP家族的重要成员, Lin28蛋白类似于"翻译增强子", 在各细胞以及组织中可通过将RNA和多核糖体的连接, 增强起始复合物的翻译, 提高蛋白的合成[20,21]. 目前, 在包括乳腺癌、肝癌等多种肿瘤细胞中发现Lin28发挥调控细胞分化及细胞周期的作用. 肿瘤细胞中Lin28通过结合众多细胞调节相关基因, 促进细胞周期蛋白如CDK2的翻译, 调控细胞的生长和存活, 从而达到对肿瘤细胞增殖的正反馈作用[22-25]. Lin28可通过转录后抑制Let-7 miRNA的生物合成, 负向调控并阻断Let-7的作用, 促进癌基因的表达. 研究表明Let-7又可将Lin28作为靶点, 通过结合Lin28的转录子, 抑制其表达, 因此Lin28和Let-7相互影响, 构成双向负反馈环路[26,27]. 上述调节机制有利于正常细胞的生长、增殖、发育以及组织内环境的稳定, 如该机制异常则导致炎症, 甚至肿瘤的发生[28-30]. 在近期研究中分别证实了Lin28A/B的两个亚型Lin28A和Lin28B在肝癌细胞中存在过表达[31,32].
本研究表明, 与正常肝细胞比较, Lin28A和Lin28B在肝癌细胞中表达明显上调, 该结果与以往研究报道相似. 值得注意的是, 本研究结果证实Lin28B在肝癌细胞中表达增加较Lin28A更为显著. 进一步通过siRNA分别敲减Lin28A和Lin28B在肝癌细胞中的表达, 证实二者表达减少均可影响肝癌细胞的增殖, 并诱导肝癌细胞的凋亡增加, 尤其在Lin28B siRNA转染肝癌细胞后, 可更加显著地影响肝癌细胞. 上述结果提示Lin28A/B两种亚型均参与肝癌细胞的发生、发展, 是肝癌进展的关键因子, 其中Lin28B亚型与肝癌细胞的增殖关系更为密切, 在肝癌发生中可能起主要作用, 而Lin28A在促进肝癌增殖中可能起到协同作用. 由于Lin28A/B两种亚型在肿瘤细胞中的作用机制和特点各自不同, 因此二者在肝癌中的具体分子机制有待进一步研究.
Lin28是RNA结合蛋白家族的重要成员. 通过对干细胞分化的调控, 尤其是对Let-7 miRNA家族的调控, Lin28不仅调节着机体的发育、生长、代谢, 而且在结肠癌、前列腺癌、乳腺癌等多种恶性肿瘤的发生、发展中同样发挥着重要作用.
魏继福, 研究员, 江苏省人民医院
Lin28在各种肿瘤中的表达、功能、作用机制是当前肿瘤研究领域的重要热点之一. 但Lin28在肝细胞癌中的表达和功能仍未有详细报道.
越来越多的研究表明, Lin28可发挥癌基因的功能, 促进了卵巢癌、结肠癌、食管癌、乳腺癌等一系列肿瘤的发生、发展, 是重要的肿瘤患者预后判断标志物和靶向治疗靶点. 在肝细胞癌中, 新近研究同样表明Lin28的表达与肝癌细胞系Hep3B的耐药相关.
本研究首次发现Lin28A和Lin28B在肝癌细胞中的表达明显高于正常肝细胞, 并进一步发现通过RNAi的方法降低Lin28A/B 的表达均可抑制肝癌细胞增殖、诱导肝癌细胞凋亡. 更为重要的是, 本研究初步表明Lin28B亚型在诱导肝癌细胞凋亡中起主要作用, 而Lin28A可能起到协同作用.
Lin28A/B在肝癌的发生、发展中发挥重要作用. 一方面, Lin28A/B有可能作为肝癌患者预后判断的分子标志物; 另一方面, Lin28A/B也有可能成为肝癌靶向治疗的分子靶点.
本研究致力于Lin28A/B亚型对肝癌细胞凋亡的影响, 从而揭示其在肝癌发生发展过程中的作用.
编辑: 郭鹏 电编:闫晋利
| 1. | Wang LX, Wang J, Qu TT, Zhang Y, Shen YF. Reversible acetylation of Lin28 mediated by PCAF and SIRT1. Biochim Biophys Acta. 2014;1843:1188-1195. [PubMed] [DOI] |
| 2. | Stratoulias V, Heino TI, Michon F. Lin-28 regulates oogenesis and muscle formation in Drosophila melanogaster. PLoS One. 2014;9:e101141. [PubMed] [DOI] |
| 3. | Xie R, Wang Y, Nie W, Huang W, Song W, Wang Z, Guan X. Lin28B expression correlates with aggressive clinicopathological characteristics in breast invasive ductal carcinoma. Cancer Biother Radiopharm. 2014;29:215-220. [PubMed] [DOI] |
| 4. | Tan SM, Altschuler G, Zhao TY, Ang HS, Yang H, Lim B, Vardy L, Hide W, Thomson AM, Lareu RR. Divergent Lin28-mRNA associations result in translational suppression upon the initiation of differentiation. Nucleic Acids Res. 2014;42:7997-8007. [PubMed] [DOI] |
| 5. | Lozoya T, Domínguez F, Romero-Ruiz A, Steffani L, Martínez S, Monterde M, Ferri B, Núñez MJ, AinhoaRomero-Espinós O, Gurrea M. The Lin28/Let-7 system in early human embryonic tissue and ectopic pregnancy. PLoS One. 2014;9:e87698. [PubMed] [DOI] |
| 6. | Desjardins A, Bouvette J, Legault P. Stepwise assembly of multiple Lin28 proteins on the terminal loop of let-7 miRNA precursors. Nucleic Acids Res. 2014;42:4615-4628. [PubMed] [DOI] |
| 7. | Balzer E, Moss EG. Localization of the developmental timing regulator Lin28 to mRNP complexes, P-bodies and stress granules. RNA Biol. 2007;4:16-25. [PubMed] |
| 8. | West JA, Viswanathan SR, Yabuuchi A, Cunniff K, Takeuchi A, Park IH, Sero JE, Zhu H, Perez-Atayde A, Frazier AL. A role for Lin28 in primordial germ-cell development and germ-cell malignancy. Nature. 2009;460:909-913. [PubMed] [DOI] |
| 9. | Ouchi Y, Yamamoto J, Iwamoto T. The heterochronic genes lin-28a and lin-28b play an essential and evolutionarily conserved role in early zebrafish development. PLoS One. 2014;9:e88086. [PubMed] [DOI] |
| 10. | Viswanathan SR, Powers JT, Einhorn W, Hoshida Y, Ng TL, Toffanin S, O'Sullivan M, Lu J, Phillips LA, Lockhart VL. Lin28 promotes transformation and is associated with advanced human malignancies. Nat Genet. 2009;41:843-848. [PubMed] [DOI] |
| 11. | Mo X, Li N, Wu S. Generation and characterization of bat-induced pluripotent stem cells. Theriogenology. 2014;82:283-293. [PubMed] [DOI] |
| 12. | Zheng YW, Nie YZ, Taniguchi H. Cellular reprogramming and hepatocellular carcinoma development. World J Gastroenterol. 2013;19:8850-8860. [PubMed] [DOI] |
| 13. | Yin X, Li YW, Jin JJ, Zhou Y, Ren ZG, Qiu SJ, Zhang BH. The clinical and prognostic implications of pluripotent stem cell gene expression in hepatocellular carcinoma. Oncol Lett. 2013;5:1155-1162. [PubMed] |
| 14. | Oishi N, Wang XW. Novel therapeutic strategies for targeting liver cancer stem cells. Int J Biol Sci. 2011;7:517-535. [PubMed] |
| 15. | Ali N, Allam H, May R, Sureban SM, Bronze MS, Bader T, Umar S, Anant S, Houchen CW. Hepatitis C virus-induced cancer stem cell-like signatures in cell culture and murine tumor xenografts. J Virol. 2011;85:12292-12303. [PubMed] [DOI] |
| 16. | Mäkelä JA, Toppari J, Rivero-Müller A, Ventelä S. Reconstruction of mouse testicular cellular microenvironments in long-term seminiferous tubule culture. PLoS One. 2014;9:e90088. [PubMed] [DOI] |
| 17. | Grimmer J, Rödiger A, Hoehenwarter W, Helm S, Baginsky S. The RNA-binding protein RNP29 is an unusual Toc159 transport substrate. Front Plant Sci. 2014;5:258. [PubMed] [DOI] |
| 18. | Dai Q, Luan G, Deng L, Lei T, Kang H, Song X, Zhang Y, Xiao ZX, Li Q. Primordial dwarfism gene maintains Lin28 expression to safeguard embryonic stem cells from premature differentiation. Cell Rep. 2014;7:735-746. [PubMed] [DOI] |
| 19. | Culig Z. Words of wisdom: Re: Lin28 promotes growth of prostate cancer cells and activates the androgen receptor. Eur Urol. 2014;65:1013. [PubMed] |
| 20. | Gérard C, Gonze D, Lemaigre F, Novák B. A model for the epigenetic switch linking inflammation to cell transformation: deterministic and stochastic approaches. PLoS Comput Biol. 2014;10:e1003455. [PubMed] [DOI] |
| 21. | Mayr F, Heinemann U. Mechanisms of Lin28-mediated miRNA and mRNA regulation--a structural and functional perspective. Int J Mol Sci. 2013;14:16532-16553. [PubMed] [DOI] |
| 22. | Chakraborty C, S Roy S, J Hsu M, Agoramoorthy G. Network analysis of transcription factors for nuclear reprogramming into induced pluripotent stem cell using bioinformatics. Cell J. 2014;15:332-339. [PubMed] |
| 23. | Wan Y, Sun G, Wang Z, Guo J, Shi L. miR-125b promotes cell proliferation by directly targeting Lin28 in glioblastoma stem cells with low expression levels of miR-125b. Neuroreport. 2014;25:289-296. [PubMed] [DOI] |
| 24. | Li Y, Liu H, Lai C, Du X, Su Z, Gao S. The Lin28/let-7a/c-Myc pathway plays a role in non-muscle invasive bladder cancer. Cell Tissue Res. 2013;354:533-541. [PubMed] [DOI] |
| 25. | Shyh-Chang N, Zhu H, Yvanka de Soysa T, Shinoda G, Seligson MT, Tsanov KM, Nguyen L, Asara JM, Cantley LC, Daley GQ. Lin28 enhances tissue repair by reprogramming cellular metabolism. Cell. 2013;155:778-792. [PubMed] [DOI] |
| 26. | Teng RY, Zhou JC, Jiang ZN, Xu CY, Li ZD, Wang QC, Xu CP, Guo JF, Shen JG, Wang LB. The relationship between Lin28 and the chemotherapy response of gastric cancer. Onco Targets Ther. 2013;6:1341-1345. [PubMed] [DOI] |
| 27. | Wang L, Yuan C, Lv K, Xie S, Fu P, Liu X, Chen Y, Qin C, Deng W, Hu W. Lin28 mediates radiation resistance of breast cancer cells via regulation of caspase, H2A.X and Let-7 signaling. PLoS One. 2013;8:e67373. [PubMed] [DOI] |
| 28. | Qin R, Zhou J, Chen C, Xu T, Yan Y, Ma Y, Zheng Z, Shen Y, Lu Y, Fu D. Lin28 is involved in glioma carcinogenesis and predicts outcomes of glioblastoma multiforme patients. PLoS One. 2014;9:e86446. [PubMed] [DOI] |
| 29. | Liu Y, Li H, Feng J, Cui X, Huang W, Li Y, Su F, Liu Q, Zhu J, Lv X. Lin28 induces epithelial-to-mesenchymal transition and stemness via downregulation of let-7a in breast cancer cells. PLoS One. 2013;8:e83083. [PubMed] [DOI] |
| 30. | Guo Y, Chen Y, Ito H, Watanabe A, Ge X, Kodama T, Aburatani H. Identification and characterization of lin-28 homolog B (Lin28B) in human hepatocellular carcinoma. Gene. 2006;384:51-61. [PubMed] |
| 31. | Qiu JL, Huang PZ, You JH, Zou RH, Wang L, Hong J, Li BK, Zhou K, Yuan YF. Lin28 expression and prognostic value in hepatocellular carcinoma patients who meet the Milan criteria and undergo hepatectomy. Chin J Cancer. 2012;31:223-232. [PubMed] [DOI] |