修回日期: 2014-07-10
接受日期: 2014-07-31
在线出版日期: 2014-08-28
目的: 了解肝源性糖尿病(hepatic diabetes, HD)与2型糖尿病(type 2 diabetes mellitus, T2DM)的临床特点, 探讨HD和T2DM患者临床和预后情况的差异, 及临床护理干预前后的血糖控制情况.
方法: HD患者30例和T2DM患者30例入组本研究. 分为HD组(30例)和糖尿病无肝硬化组(30例). 两组均进行糖耐量试验及胰岛素释放试验. 监测空腹血糖和糖化血红蛋白. 同时给予内科治疗、降糖治疗及内科护理干预, 比较临床护理干预前后的血糖控制情况.
结果: (1)HD组空腹血糖(7.8 mmol/L±2.4 mmol/L)和糖化血红蛋白水平(0.065±0.017)显著低于T2DM组(9.6 mmol/L±3.2 mmol/L)和(0.083±0.027), 差异均有统计学意义(t = 1.017、0.976, P = 0.002、0.004). HD组葡萄糖耐量试验各时间点(0、30、60、120、180 min)的血糖水平均显著低于T2DM组, 差异均有统计学意义(均P<0.05); (2)胰岛素释放试验各时间点(0、30、60、120、180 min)的胰岛素水平及C肽水平均显著高于T2DM组, 差异均有统计学意义(均P<0.05); (3)所有入组患者给予内科治疗、降糖治疗及内科护理干预后, HD组与T2DM组空腹血糖及糖化血红蛋白较前明显下降, 差异有统计学意义(t = 2. 076、1.872、2.301、1.874, P = 0.003、0.004、0.002、0.004).
结论: HD患者存在高胰岛素血症, 血糖水平控制好于T2DM患者. 对于HD与T2DM患者, 除给予内科治疗治疗外, 实施有效的综合护理干预, 能够改善血糖控制情况, 值得临床进一步推广使用.
核心提示: 本研究通过对比30例肝源性糖尿病(hepatic diabetes, HD)患者与30例2型糖尿病(type 2 diabetes mellitus, T2DM)患者的临床资料, 发现: 空腹血糖、糖化血红蛋白、糖耐量试验(oral glucose tolerance test)中血糖情况对比, HD组均低于T2DM患者组, 提示HD患者高血糖症状不典型, 易被慢性肝病所掩盖, 其原因可能是HD患者由于肝脏疾病原因, 掩盖高血糖症状, 同时HD患者在治疗过程中肝功能得到回复, 从而血糖也可得到控制.
引文著录: 王少萍, 吴玉萍, 林小洁. 肝源性糖尿病与2型糖尿病患者临床和预后情况的差异及相关护理. 世界华人消化杂志 2014; 22(24): 3722-3726
Revised: July 10, 2014
Accepted: July 31, 2014
Published online: August 28, 2014
AIM: To compare the clinical characteristics, prognosis and nursing intervention between patients with hepatogenic diabetes (HD) and those with type 2 diabetes (T2DM).
METHODS: Sixty patients with hyperglycaemia were divided into two groups: an HD group (n = 30) and a T2DM group (n = 30). Oral glucose tolerance test (OGTT) and glucose-stimulated insulin release test were performed in all patients. The levels of fasting blood glucose (FBG) and glycosylated hemoglobin (HbAlc) were determined. All patients were given medical management, hypoglycemic therapy and comprehensive nursing intervention. BSL were compared between before and after nursing intervention.
RESULTS: FBG and HbAlc in the HD group were significantly lower than those in the T2DM group (7.8 mmol/L ± 2.4 mmol/L vs 9.6 mmol/L ± 3.2 mmol/L, 0.065 ± 0.017 vs 0.083 ± 0.027, t = 1.017, 0.976; P = 0.002, 0.004). BSL in the HD group at different time points (0, 30, 60, 120, 180 min) were all significantly lower than those in the T2DM group (P < 0.05). Insulin and peptide C levels in the HD group at different time points (0, 30, 60, 120, 180 min) were all significantly higher than those in the T2DM group (P < 0.05). All patients were given medical management, hypoglycemic therapy and comprehensive nursing intervention. BSL in both the HD group and T2DM group were significantly lower after intervention than before intervention (t = 2. 076, 1.872, 2.301, 1.874; P = 0.003, 0.004, 0.002, 0.004).
CONCLUSION: Hyperinsulinemia is more obvious and BSL is controlled better in HD patients. Comprehensive nursing intervention is conducive to controlling BSL in both HD and T2DM patients.
- Citation: Wang SP, Wu YP, Lin XJ. Clinical characteristics, prognosis and nursing intervention in hepatogenic diabetes and type 2 diabetes mellitus. Shijie Huaren Xiaohua Zazhi 2014; 22(24): 3722-3726
- URL: https://www.wjgnet.com/1009-3079/full/v22/i24/3722.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i24.3722
肝源性糖尿病(hepatogenous diabetes, HD)是由肝硬化继发的糖尿病, 因各种原因导致肝实质细胞损害时, 临床可表现为HD[1]. HD以高血糖及葡萄糖耐量减低为特征, 其发生机制、临床表现及治疗均不同于原发性糖尿病, 目前为止其发病机制与内科治疗后血糖控制情况也不明确. 对于严重肝病导致的高血糖患者, 血糖水平与肝功能密切相关[2], 因此此类患者良好的血糖控制显得尤为重要. 高血糖状态不利于患者肝脏疾病的治疗与恢复, 同时部分降糖药也通过肝脏代谢, 加重了已经本不堪重负的肝脏系统的负担. 2型糖尿病(type 2 diabetes mellitus, T2DM)占糖尿病总人群的95%以上, 早期症状不明显. 研究显示[3-5], 代表β细胞功能的静脉葡萄糖耐量试验中β细胞第一时相胰岛素分泌受损和缺失是发病早期和晚期重要的生理变化. 因此, 充分了解HD患者的临床表现, 并明确HD患者与原发糖尿病患者的差别是十分必要的. 本研究分析30例HD与30例T2DM患者的临床资料, 了解HD和T2DM的临床特点, 分析HD和T2DM临床表现和预后的差异, 及加强临床护理对两者的血糖情况的影响.
随机选取2013-05/2014-05在海南省人民医院住院治疗的HD、T2DM患者各30例, HD组入选标准: (1)有慢性肝病史, 肝病发生在糖尿病之前或同时发生; (2)无糖尿病史和家族史; (3)有肝病临床表现和生化学检查异常或影像学检查证据; (4)糖尿病的诊断符合1999年世界卫生组织(World Health Organization, WHO)及国际糖尿病联盟公布的标准; (5)排除垂体、肾上腺、甲状腺等疾病所引起的继发性糖尿病及原发性糖尿病. T2DM组入选标准: 均符合WHO发布的DM诊断标准.
1.2.1 临床资料收集: 所有入选者均签署诊疗知情同意书. 记录患者人口学资料、基础疾病史、临床表现、辅助检查结果.
1.2.2 血糖、糖耐量试验(oral glucose tolerance test, OGTT)和胰岛素释放试验: 所有患者入院时均进行OGTT、胰岛素释放试验. 检测两组患者血糖、胰岛素和C肽.
1.2.3 临床护理干预: 患者住院期间给予: (1)心理干预: 给予患者健康宣教, 包括HD和T2DM的相关知识, 介绍如何预防出血、感染、低血糖等. 加强病友间经验交流, 使患者建立良好的心境, 积极配合治疗; (2)糖尿病饮食护理: 指导糖尿病饮食要点, 控制总热量, 搭配合理, 定时定量进餐, 饮食与胰岛素的治疗相配合. 随时监督患者饮食, 纠正患者错误进食; (3)用药护理: 护理人员监督患者按医生医嘱用药; 若患者使用胰岛素降血糖, 将患者血糖变化及时告知医生, 调整胰岛素用量, 避免发生低血糖反应; (4)运动指导: 建议患者进行适量运动, 运动以有氧运动为主, 以提高患者的生活质量; (5)预防感染: 给予患者修剪指甲, 防止抓破皮肤, 保持患者皮肤清洁干燥, 经常更换体位, 加强皮肤及足部护理, 必要时使用气垫床减压防压疮; 加强口腔护理; 使用胰岛素治疗的患者, 应定期更换注射部位, 严格消毒. 患者出院后延伸护理: 出院后进行电话随访, 第1-2月随访1次; 第3个月以后每月随访1次. 随访内容为患者饮食情况; 是否规律及精确用药; 是否进行运动; 提醒患者每1周门诊随访空腹血糖. 每2-3 mo随访糖化血红蛋白.
1.2.4 临床研究起点、终点: 将入院时间作为起点, 将死亡时间或2014-05-31作为临床研究终点.
统计学处理 应用SPSS16.0软件进行统计分析. 计量资料以mean±SD表示. 两组间均数的比较采用Student t检验. P<0.05为差异有统计学意义.
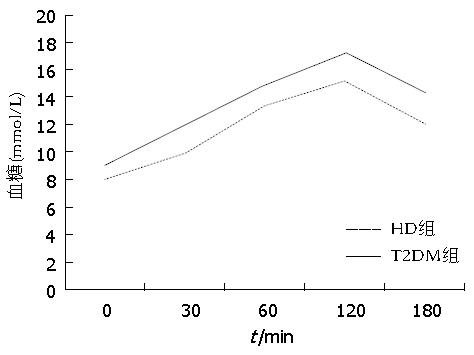
HD组空腹血糖(7.8 mmol/L±2.4 mmol/L)和糖化血红蛋白水平(0.065±0.017)均显著低于T2DM组(9.6 mmol/L±3.2 mmol/L)和(0.083±0.027), 差异均有统计学意义(t = 1.017、0.976, P = 0.002、0.004). HD组OGTT各时间点(0、30、60、120、180 min)的血糖水平均显著低于T2DM组, 差异均有统计学意义(t = 3.163、2. 224、3.407、3.112、3.231, P = 0.004、0.025、0.002、0.004、0.001)(图1).
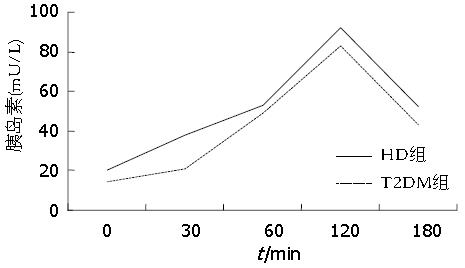
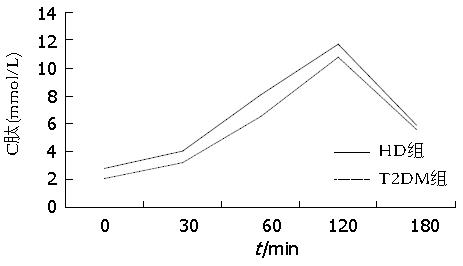
HD组各时间点(0、30、60、120、180 min)的胰岛素水平均显著高于T2DM组, 差异均有统计学意义(t = 2.581、3.081、2.776、3.454、2.760, P = 0.006、0.002、0.004、0.00l、0.005)(图2), HD组存在明显高胰岛素血症. HD组各时间点(0、30、60、120、180 min)的C肽水平均显著高于T2DM组, 差异均有统计学意义(t = 3.543、3.760、3.580、4.632、4.643, P = 0.002、0.002、0.002、0.001、0.001)(图3).
加强护理干预后, HD组和T2DM组空腹血糖和糖化血红蛋白水平较治疗前显著减低, 差异均有统计学意义(表1).
| 分组 | 出院前 | 加强护理干预后 | t值 | P值 | |
| HD组 | 空腹血糖(mmol/L) | 7.800±2.400 | 5.000±2.50 | 2.076 | 0.003 |
| 糖化血红蛋白 | 0.065±0.017 | 0.059±0.012 | 1.872 | 0.004 | |
| T2DM组 | 空腹血糖(mmol/L) | 9.600±3.200 | 7.200±3.11 | 2.301 | 0.002 |
| 糖化血红蛋白 | 0.083±0.027 | 0.071±0.021 | 1.874 | 0.004 |
肝脏是调节体内糖代谢的重要器官[2-7], 是多种激素分解代谢的主要场所, 也是多种激素作用的主要靶位[8,9]. 肝硬化患者常并发糖代谢紊乱[10-14]. 这种继发于慢性肝实质损害的糖尿病统称为HD. 临床表现以高血糖, 葡萄糖耐量减低为特征.
本研究通过对比30例HD患者与30例T2DM患者的临床资料, 发现: (1)空腹血糖、糖化血红蛋白、OGTT实验中血糖情况对比, HD组均低于T2DM组, 提示HD患者高血糖症状不典型, 易被慢性肝病所掩盖, 其原因可能是HD患者由于肝脏疾病原因, 掩盖高血糖症状[10], 同时HD患者在治疗过程中肝功能得到恢复, 从而血糖也可得到控制; (2)HD组的胰岛素及C肽水平均高于T2DM组, 可能是胰岛素大多通过肝脏代谢, 慢性肝病患者因肝细胞数目减少、肝脏功能受损和肝脏失代偿时建立侧枝循环, 导致胰岛素的灭活和摄取减少, 使外周血胰岛素增高, 出现高胰岛素血症[10]. 胰岛素水平的增加可引起外周组织胰岛素受体数目的减少和与胰岛素的亲和力降低. 肝脏摄取胰岛素异常者, 会出现高胰岛素血症[12,15-17]. 而血清中C肽和胰岛素水平常呈同步变化, 故同时检测胰岛素与C肽可能对HD的诊断具有一定的提示意义. 胰岛素抵抗、胰岛素分泌与代谢异常是HD的主要原因; (3)加强临床护理干预后, HD组与T2DM组血糖均明显低于进行护理干预前, 提示坚持按照糖尿病饮食要求进食、进行相应的运动锻炼、坚持并准确使用口服降糖药物和/或胰岛素来进行降糖治疗, 及实施有效的出院指导以及出院后定期随访等综合护理措施[18,19], 可以促进患者提高对疾病的认识度, 学会自我分析疾病、监测疾病, 做到自我管理, 在治疗过程中积极配合, 提高其依从性, 从而达到提高患者临床治疗效果的目的.
总之, HD是在肝病的基础上出现胰岛素抵抗及胰岛素代谢与分泌异常, 同时检测胰岛素与C肽有助于临床诊断. 对于HD及T2DM患者, 除给予内科治疗及降糖治疗, 实施有效的综合护理干预, 能够改善血糖控制情况, 值得临床进一步推广使用.
肝脏是调节体内糖代谢的重要器官, 是多种激素分解代谢的主要场所, 也是多种激素作用的主要靶位. 肝硬化患者常并发糖代谢紊乱. 这种继发于慢性肝实质损害的糖尿病统称为肝源性糖尿病. 临床表现以高血糖, 葡萄糖耐量减低为特征.
徐健, 副主任医师, 深圳市慢性病防治中心
肝源性糖尿病(hepatic diabetes, HD)以高血糖及葡萄糖耐量减低为特征, 其发生机制、临床表现及治疗均不同于原发性糖尿病, 目前为止其发病机制与内科治疗后血糖控制情况也不明确.
HD是在肝病的基础上出现胰岛素抵抗及胰岛素代谢与分泌异常, 同时检测胰岛素与C肽有助于临床诊断. 对于HD及2型糖尿病患者, 除给予内科治疗及降糖治疗, 实施有效的综合护理干预, 能够改善血糖控制情况, 值得临床进一步推广使用.
本研究选题实用, 设计科学, 逻辑清晰, 具有很好的可读性.
编辑: 郭鹏 电编:闫晋利
| 1. | Sibley SD, Palmer JP, Hirsch IB, Brunzell JD. Visceral obesity, hepatic lipase activity, and dyslipidemia in type 1 diabetes. J Clin Endocrinol Metab. 2003;88:3379-3384. [PubMed] [DOI] |
| 2. | da Rocha AF, Liboni TF, Kurauti MA, de Souza CO, Miksza DR, Moreira CC, Borba-Murad GR, Bazotte RB, de Souza HM. Tumor necrosis factor alpha abolished the suppressive effect of insulin on hepatic glucose production and glycogenolysis stimulated by cAMP. Pharmacol Rep. 2014;66:380-385. [PubMed] [DOI] |
| 3. | García-Compeán D, Jáquez-Quintana JO, González-González JA, Lavalle-González FJ, Villarreal-Pérez JZ, Maldonado-Garza HJ. [Diabetes in liver cirrhosis]. Gastroenterol Hepatol. 2013;36:473-482. [PubMed] [DOI] |
| 4. | Tu S, Shao A, Ye Z, Yao D. [Advances in understanding the pathogenesis of hepatogenic diabetes]. Zhonghua Ganzangbing Zazhi. 2014;22:78-80. [PubMed] |
| 5. | Picardi A, D'Avola D, Gentilucci UV, Galati G, Fiori E, Spataro S, Afeltra A. Diabetes in chronic liver disease: from old concepts to new evidence. Diabetes. Metab Res Rev. 2006;22:274-283. [PubMed] [DOI] |
| 6. | Roden M, Bernroider E. Hepatic glucose metabolism in humans--its role in health and disease. Best Pract Res Clin Endocrinol Metab. 2003;17:365-383. [PubMed] [DOI] |
| 7. | Rui L. Energy metabolism in the liver. Compr Physiol. 2014;4:177-197. [PubMed] [DOI] |
| 8. | Wang C, Dai J, Yang M, Deng G, Xu S, Jia Y, Boden G, Ma ZA, Yang G, Li L. Silencing of FGF-21 expression promotes hepatic gluconeogenesis and glycogenolysis by regulation of the STAT3-SOCS3 signal. FEBS J. 2014;281:2136-2147. [PubMed] [DOI] |
| 9. | Mitchell J. Regulation of hepatic glucose production by Gq-coupled receptors: potential new targets for treatment of type 2 diabetes. Endocrinology. 2013;154:3495-3497. [PubMed] [DOI] |
| 10. | García-Compean D, Jaquez-Quintana JO, Maldonado-Garza H. Hepatogenous diabetes. Current views of an ancient problem. Ann Hepatol. 2009;8:13-20. [PubMed] |
| 11. | Jeon HK, Kim MY, Baik SK, Park HJ, Choi H, Park SY, Kim BR, Hong JH, Jo KW, Shin SY. Hepatogenous diabetes in cirrhosis is related to portal pressure and variceal hemorrhage. Dig Dis Sci. 2013;58:3335-3341. [PubMed] [DOI] |
| 12. | Kim MG, Choi WC. [Differential diagnosis of diabetes mellitus caused by liver cirrhosis and other type 2 diabetes mellitus]. Korean J Hepatol. 2006;12:524-529. [PubMed] |
| 13. | Gundling F, Seidl H, Löffler N, Strassen I, Schepp W. [Metabolic disturbances in liver cirrhosis (part 2), hepatogenous diabetes: diagnostic aspects and treatment]. Dtsch Med Wochenschr. 2010;135:22-24. [PubMed] [DOI] |
| 14. | Gundling F, Schumm-Draeger PM, Schepp W. [Hepatogenous diabetes - diagnostics and treatment]. Z Gastroenterol. 2009;47:436-445. [PubMed] [DOI] |
| 15. | Holstein A, Hinze S, Thiessen E, Plaschke A, Egberts EH. Clinical implications of hepatogenous diabetes in liver cirrhosis. J Gastroenterol Hepatol. 2002;17:677-681. [PubMed] [DOI] |
| 16. | Garcia-Compean D, Jaquez-Quintana JO, Gonzalez-Gonzalez JA, Maldonado-Garza H. Liver cirrhosis and diabetes: risk factors, pathophysiology, clinical implications and management. World J Gastroenterol. 2009;15:280-288. [PubMed] [DOI] |