修回日期: 2014-06-25
接受日期: 2014-07-15
在线出版日期: 2014-08-28
目的: 探讨溃疡性结肠炎(ulcerative colitis, UC)患者CD4+CD29+辅助性T细胞及其表面标志和相关细胞因子的表达, 并进一步探讨体外黄芩苷干预的作用.
方法: 选取33例UC患者, 30例腹泻型肠易激综合征(irritable bowel syndrome, IBS-D)组, 30例健康组, 应用流式细胞仪检测UC患者CD4+CD29+的表达, Q-PCR的检测其GATA-3、FOXP3、T-bet、RORC的表达, Western blot检测其核因子κB(nuclear factor-kappa B, NF-κB) p65和phospho-NF-κB p65、STAT4和phospho-STAT4、STAT6和phospho-STAT6的表达, 用ELISA法检测血清γ-干扰素(interferon γ, IFN-γ)、白介素(interleukin, IL)-4、IL-5、IL-6、IL-10、肿瘤生长因子β(tumor specific growth factor-β, TGF-β)的水平及体外黄芩苷干预的作用.
结果: UC患者外周血中CD4+CD29+ T细胞与健康对照组和IBS-D组相比, CD4+和CD4+CD29+明显增高, 差异有统计学意义(P<0.01); IFN-γ、IL-4、IL-5、IL-10和TGF-β1与IBS-D组和健康对照组均有不同程度的升高, IL-6较IBS-D组和健康对照组稍降低; 外周血单个核细胞RORC和FOXP3 mRNA与健康对照组和IBS-D组相比, RORC和FOXP3 mRNA明显增高, 差异有统计学意义(P<0.05); 外周血T细胞转录因子T-bet基因的表达水平明显高于健康对照组, GATA-3基因的表达低于健康对照组, T-bet/GATA-3的比值明显高于健康对照组(P<0.05); 40 μmol/L和20 μmol/L浓度黄芩苷的干预下CD4+CD29+较未干预前明显增高, 明显降低IFN-γ、IL-5、IL-6, 而升高IL-4和IL-10; RORC和FOXP3均明显下降, 可明显降低T-bet, 可稍降低GATA3, 使T-bet/GATA-3的比值较干预前降低; p-STAT4/STAT4较未干预前明显下降, p-STAT6/STAT6明显增高, p-NF-κB/NF-κB明显下降.
结论: 黄芩苷可能通过促CD4+CD29+增殖作用及多方面的免疫抑制调节免疫平衡而缓解溃疡性结肠的炎症反应, 为深入研究UC的发病机制及新药开发提供理论基础.
核心提示: 本研究通过检测外周血单个核细胞核因子κB(nuclear factor-kappa B, NF-κB)及磷酸化NF-κB在溃疡性结肠炎(ulcerative colitis)中的表达, 发现与健康对照组和腹泻型肠易激综合征(irritable bowel syndrome, IBS-D)组相比较, p-NF-κB明显增高, NF-κB明显下降, p-NF-κB/NF-κB明显增高, 差异有统计学意义(P<0.05). 体外黄芩苷干预, 40 μmol/L浓度干预下p-NF-κB/NF-κB下降, 差异有统计学意义(P<0.05). 从而说明黄芩苷可能抑制p-NF-κB/NF-κB, 调节免疫平衡而缓解溃疡性结肠的炎症反应. 我们同时通过ELISA检测血清中细胞因子, 发现γ-干扰素(interferon γ)、白介素-4(interleukin, IL-4)、IL-5、IL-10和肿瘤生长因子β(tumor specific growth factor-β)与炎症性肠病(inflammatory bowed disease)组和健康对照组均有不同程度的升高, IL-6较IBS-D组和健康对照组稍降低.
引文著录: 于丰彦, 黄绍刚, 张海燕, 叶华, 迟宏罡, 邹颖, 吕汝西, 郑学宝. CD4+CD29+ T细胞亚群与溃疡性结肠炎的相关性及黄芩苷的干预作用. 世界华人消化杂志 2014; 22(24): 3710-3717
Revised: June 25, 2014
Accepted: July 15, 2014
Published online: August 28, 2014
AIM: To evaluate the mechanisms underlying the therapeutic effect of baicalin on ulcerative colitis (UC) in terms of its effect on CD4+CD29+ T helper cells, surface markers and serum inflammatory cytokines.
METHODS: Flow cytometry was used to detect the percentage of CD4+CD29+ cells in patients with UC. Real-time polymerase chain reaction (PCR) was used to detect the expression of GATA-3, forkhead box P3 (FOXP3), T-box expressed in T cells (T-bet), and retinoic acid-related orphan nuclear hormone receptor C (RORC). Western blot was used to analyze the expression of nuclear factor-kappa B (NF-κB) p65, p-NF-κB p65, STAT4, p-STAT4, STAT6, and p-STAT6. The concentrations of interferon γ (IFN-γ), interleukin (IL)-4, IL-5, IL-6, IL-10, and tumor growth factor-β (TGF-β) in serum were determined by ELISA assay.
RESULTS: The percentages of CD4+CD29+ T cells were significantly lower in cells treated with 40 and 20 μmol/L baicalin than in untreated cells. Treatment with 40 or 20 μmol/L baicalin significantly upregulated the expression of IL-4, TGF-β1 and IL-10, increased the p-STAT6/STAT6 ratio, but downregulated the expression of IFN-γ, IL-5, IL-6, RORC, FOXP3, and T-bet, and decreased the ratios of T-bet/GATA-3, p-STAT4/STAT4, and p-NF-κB/NF-κB compared to those in untreated cells.
CONCLUSION: Baicalin regulates immune balance and relieves UC induced inflammation response possibly by promoting the proliferation of CD4+CD29+ cells and modulating immunosuppressive pathways.
- Citation: Yu FY, Huang SG, Zhang HY, Ye H, Chi HG, Zou Y, Lv RX, Zheng XB. Baicalin modulates immuno-inflammatory response in patients with ulcerative colitis. Shijie Huaren Xiaohua Zazhi 2014; 22(24): 3710-3717
- URL: https://www.wjgnet.com/1009-3079/full/v22/i24/3710.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i24.3710
溃疡性结肠炎(ulcerative colitis, UC)是一种原因不明的肠道慢性非特异炎症性疾病, 属炎症性肠病(inflammatory bowed disease, IBD)的一种. 虽然其发病机制尚未完全明确, 但UC的发生与免疫、遗传、环境及感染因素有关已经得到认可[1]. 在与UC发病密切相关的免疫因素中, T细胞起到了非常关键作用[2]. CD29和CD4的共同表达可作为鉴别CD4+辅助性细胞亚群的标志, CD4+CD29+细胞主要辅助B细胞产生抗体和诱导CD8+细胞介导的淋巴细胞溶解作用, 其升高可造成B细胞高度活化而发生免疫异常, 作为UC的重要免疫学监测指标. 近年来的研究发现, Th17/Treg转化平衡是维持肠道免疫稳态的重要因素. 维A酸相关核孤儿受体γt(retinoid acid related orphan receptor gamma t, RORγt)是Th17所特有的转录因子. Treg主要分泌白介素-4(interleukin, IL-4)、IL-10和肿瘤生长因子β(tumor specific growth factor-β, TGF-β)等细胞因子, 与多种免疫性疾病的发病机制密切相关, 叉头蛋白P3(forkhead box P3, FOXP3)是Treg细胞的特性核转录因子, 在调控其分化、发育和功能上起关键作用. 黄芩苷(baicalin)是黄芩汤中黄芩的主要有效成分之一[3], 具有清热燥湿、泻火解毒功效. 本研究观察黄芩苷对UC患者CD4+CD29+ T细胞的增殖作用, 为深入研究UC的发病机制及新药开发提供理论基础.
选取2010-06/2011-01南方医科大学南方医院及广东省中医院大学城分院就诊的UC患者和腹泻型肠易激综合征(irritable bowel syndrome, IBS-D)患者. 33例UC患者中, 男18例, 女15例; 年龄22-56岁, 平均年龄39岁±17岁. 30例IBS患者中男16例, 女14例; 年龄18-60岁, 平均年龄39岁±21岁; 30例健康对照组, 女15例, 男15例; 年龄23-62岁, 平均年龄42.5岁±19.5岁.
1.2.1 外周血单个核细胞的制备: 采用Ficoll密度梯度离心法提取受检者静脉血淋巴细胞, 计数淋巴细胞, 稀释细胞浓度至1×106/mL, 取1 mL细胞悬液置于试管中, 放入冰箱备用.
1.2.2 流式检测: 取上述细胞悬液, 加入1×PBS溶液2 mL离心, 1500 r/min×10 min共洗涤2遍; 弃上清, 加入PBS溶液配成100 μL细胞悬液; 每管分别加入人或大鼠的CD4抗体、CD29抗体及其各自同型对照抗体(均约1.25 μg), 避光, 4 ℃孵育30 min. 加PBS溶液2 mL离心; 1500 r/min×10 min, 共洗涤2次. 加入流式细胞缓冲液后, 检测CD4+及CD29+ T细胞的表达.
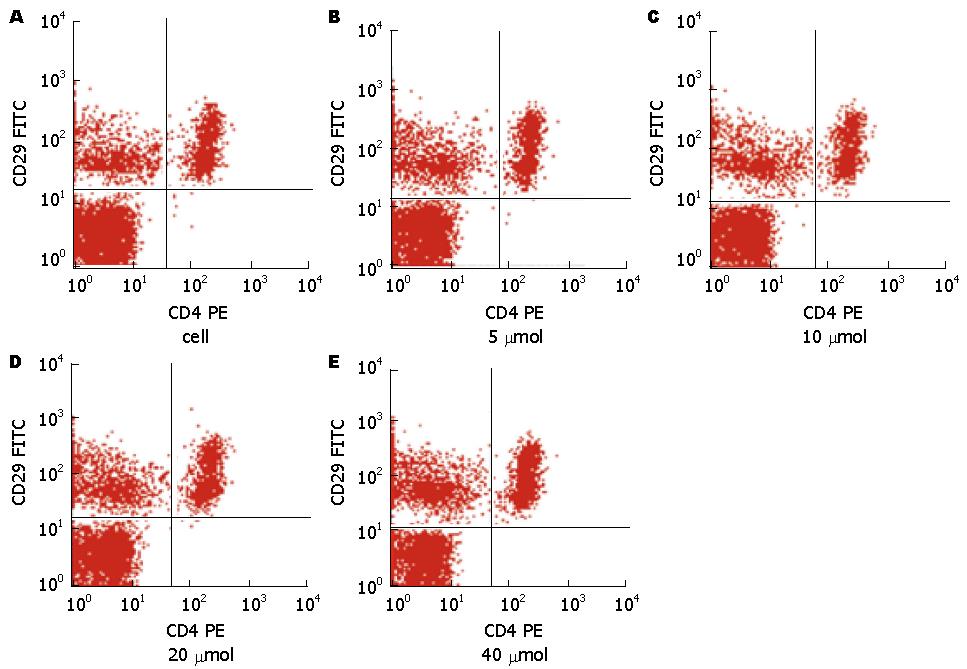
1.2.3 UC淋巴细胞接受药物处理: 采用台盼蓝拒染法检测细胞的存活率. UC实验分共分为6组, 第1组为未干预组(cell); 第2组为阴性对照组, 即以添加DMSO; 第3组为以5 μmol/L黄芩苷浓度干预; 第4组为以10 μmol/L黄芩苷浓度干预; 第5组为以20 μmol/L黄芩苷干预; 第6组为以40 μmol/L黄芩苷干预.
1.2.4 MTS法检测细胞增殖: (1)取各组细胞进行下面实验; (2)消化细胞后吹打散细胞, 计数, 调整细胞浓度为1×105个/mL, 分到96孔板, 每孔100 μL, 即每孔细胞为1×104个; (3)贴壁细胞需待细胞贴壁后, 再收集各时间点细胞进行检测; (4)收集各个时间点的细胞(0, 24, 48, 72 h)加入MTS, 比例为1:10. 即100 μL培养液加入10 μL检测液; (5)在孵育4 h后, 酶标仪读板, MTS检测读取A490数据.
1.2.5 Q-PCR的检测: 取外周静脉血各1 mL, 用人淋巴细胞分离液分离外周血单个核细胞. TRIzol一步法提取PBMC总mRNA, 用琼脂糖凝胶电泳检测RNA完整性, 紫外分光光度计测定RNA浓度和纯度. cDNA合成按照试剂盒说明书操作, 相关引物如表1, 反应条件: 50 ℃ 2 min, 95 ℃ 2 min, 95 ℃ 15 s, 60 ℃ 32 s读板, 40个循环; 融解曲线分析: 温度60 ℃-95 ℃. 每个样重复3次. 收集荧光信号, 得到Ct值. 循环结束应用系统软件绘制扩增曲线、融解曲线. 由软件得出RQ值, 即是所检测目的基因的相对表达量.
| 名称 | 序列 |
| GATA3 | F: 5'-AGTTGGCCTAAGGTGGTTG-3' |
| R: 5'-CACGCTGGTAGCTCATACAC-3' | |
| FOXP3 | F: 5'-CAGGATCTGAGGTCCCAACA-3' |
| R: 5'-TTTGGCAAGGCAGTGTGTGT-3' | |
| T-bet | F: 5'-CTGCATATCGTTGAGGTGAA-3' |
| R: 5'-GTAGGCAGTCACGGCAATGA-3' | |
| RORC | F: 5'-CAAGACTCATCGCCAAAGCA-3' |
| R: 5'-CAGTGCTGAAGAGCTCCTTG-3' | |
| 18S | F: 5'-CCTGGATACCGCAGCTAGGA-3' |
| R: 5'-GCGGCGCAATACGAATGCCCC-3' |
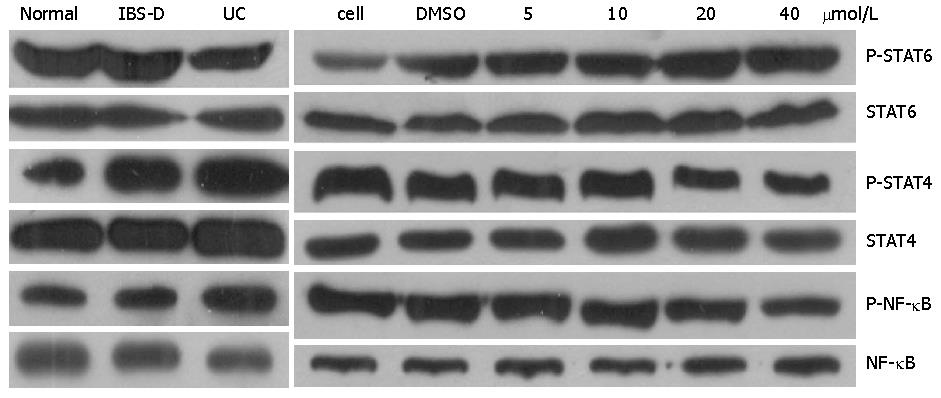
1.2.6 Western blot蛋白水平检测: 提取并检测培养细胞蛋白, 采用裂解缓冲液经匀浆裂解提取蛋白. 根据总蛋白测定试剂盒说明书测定样本中的总蛋白含量及电泳上样量. 电泳、转膜、染色、去离子水震荡去除浮色, 5%脱脂奶粉封闭, 4 ℃过夜, 分别加入NF-κB p65和phospho-NF-κB p65, STAT4、phospho-STAT4和STAT6、phospho-STAT6单克隆抗体孵育, 洗涤后加入二抗孵育, 洗涤后加入底物孵育, 取出NC膜并用蒸馏水漂洗后晾干, 将胶片进行扫描或拍照, 用凝胶图像处理系统分析目标带的分子量和净光密度值.
1.2.7 血清IFN-γ、IL- 4、IL-5、IL-6、IL-10、TGF-β水平的检测: 应用ELISA法检测, 按试剂盒说明书操作. 使用酶标仪在450 nm处测定A值, 转化为浓度. 试剂盒购自深圳晶美生物工程有限公司.
统计学处理 统计学分析采用SPSS13.0统计分析软件, 计量数据用mean±SD表示, 采用方差分析后再进行q检验, P<0.05表示差异有统计学意义.
与健康对照组和IBS-D组相比, UC组CD4+和CD4+CD29+细胞明显增高, 差异有统计学意义(41.56±3.6 vs 19.37±4.1, 20.12±3.4; 8.33±1.25 vs 1.91±2.35, 2.42±1.12, P<0.01); IBS-D组与健康对照组相比较CD4+和CD4+CD29+细胞均增高, 但差异无统计学意义(P>0.05)(图1).
UC患者外周血T细胞转录因子T-bet和GATA-3基因的表达结果显示, UC患者外周血T细胞转录因子T-bet基因的表达水平明显高于健康对照组, GATA-3基因的表达低于健康对照组, T-bet/GATA-3的比值明显高于健康对照组(P<0.05). 体外黄芩苷干预下, 40 μmol/L浓度干预比干预前、DMSO干预、5 μmol/L干预、10 μmol/L干预和20 μmol/L的GATA3和FOXP3明显升高而T-bet、RORC明显下降, 与未干预前、DMSO干预、5 μmol/L干预、10 μmol/L干预和20 μmol/L之间有差异有统计学意义(P<0.05); 未干预前、DMSO干预、5 μmol/L干预、10 μmol/L干预和20 μmol/L干预的RORC之间比较差异无统计学意义(P>0.05).
与健康对照组和IBS-D组相比较, p-STAT6明显下降, STAT6较增高, p-STAT6/STAT6明显下降, 差异有统计学意义(P<0.05); IBS-D组和健康对照组之间差异无统计学意义(P>0.05). 体外黄芩苷干预下, 在40 μmol/L和20 μmol/L浓度干预下p-STAT6/STAT6较未干预前、DMSO干预、5 μmol/L干预和10 μmol/L浓度干预明显增高, 之间差异有统计学意义(P<0.05); 与健康对照组和IBS-D组相比较, p-STAT4明显增高, STAT4也增高, p-STAT4/STAT4明显增高, 差异有统计学意义(P<0.05); IBS-D组和健康对照组之间差异无统计学意义(P>0.05). 体外黄芩苷干预下, 在40 μmol/L和20 μmol/L浓度干预下p-STAT4/STAT4较未干预前、DMSO干预、5 μmol/L干预和10 μmol/L浓度干预之间比较明显下降, 差异有统计学意义(P<0.05); 40 μmol/L和20 μmol/L浓度干预下p-STAT4/STAT4相比较差异无统计学意义(P>0.05). 干预前、DMSO干预、5 μmol/L干预、10 μmol/L和20 μmol/L浓度干预之间p-STAT4/STAT4差异无统计学意义(P>0.05).
与健康对照组和IBS-D组相比较, NF-κB磷酸化水平明显增高, NF-κB明显下降, 差异有统计学意义(P<0.05); IBS-D组和健康对照组之间差异无统计学意义(P>0.05).
体外黄芩苷干预下, 在40 μmol/L浓度干预下p-NF-κB/NF-κB较未干预前、DMSO干预、5 μmol/L干预、10 μmol/L和20 μmol/L浓度干预之间差异有统计学意义(P<0.05); 干预前、DMSO干预、5 μmol/L干预、10 μmol/L和20 μmol/L浓度干预的p-NF-κB/NF-κB之间差异无统计学意义(P>0.05)(图2).
较健康对照组和IBS-D组, UC组IFN-γ、IL-5浓度明显增高, 差异有统计学意义(P<0.01); IBS-D组与健康对照组之间亦差异有统计学意义(P<0.05).
体外黄芩苷干预下, 在40 μmol/L和20 μmol/L浓度干预下IFN-γ、IL-5较未干预前明显下降, 与DMSO干预、5 μmol/L干预和10 μmol/L干预之间差异有统计学意义(P<0.05); 40 μmol/L和20 μmol/L浓度干预下IFN-γ、IL-5之间差异无统计学意义(P>0.05), 未干预前、DMSO干预、5 μmol/L干预和10 μmol/L干预之间IFN-γ、IL-5差异无统计学意义(P>0.05).
健康对照组较IBS-D组和UC组IL-5浓度明显增高, 与健康对照组相比, 差异有统计学意义(P<0.01); IBS-D组与健康对照组之间亦差异有统计学意义(P<0.05).
体外黄芩苷干预下, 在40 μmol/L、20 μmol/L浓度干预下IL-6较未干预前、DMSO干预下的IL-6明显下降, 与未干预前、DMSO干预、5 μmol/L干预和10 μmol/L干预之间差异有统计学意义(P<0.05); 40 μmol/L和20 μmol/L浓度干预下IL-5之间差异无统计学意义(P>0.05), 未干预前、DMSO干预、5 μmol/L干预和10 μmol/L干预之间IL-5差异无统计学意义(P>0.05).
健康对照组和IBS-D组IL-4、IL-10浓度均低于UC组, 差异有统计学意义(P<0.05); 体外黄芩苷干预下, 在40 μmol/L和20 μmol/L浓度干预下IL-4、IL-10较未干预前明显增高, 与DMSO干预、5 μmol/L干预和10 μmol/L干预之间差异有统计学意义(P<0.05); 40 μmol/L和20 μmol/L浓度干预下IL-4、IL-10之间差异无统计学意义(P>0.05), 未干预前、DMSO干预、5 μmol/L干预和10 μmol/L干预之间IL-4、IL-10差异无统计学意义(P>0.05).
体外黄芩苷干预下, 在40 μmol/L、20 μmol/L浓度干预下TGF-β1较未干预前、DMSO干预下的TGF-β1差异无统计学意义(P>0.05), 5 μmol/L干预下TGF-β1较未干预前、DMSO干预、10 μmol/L干预、20 μmol/L干预和40 μmol/L干预的TGF-β1明显下降, 差异有统计学意义(P<0.05); 未干预前、DMSO干预、10 μmol/L干预、20 μmol/L干预和40 μmol/L干预的TGF-β1之间差异无统计学意义(P>0.05).
UC是一种原因不明的反复发作的肠道慢性非特异炎症性疾病. 已知机体免疫调节异常是导致免疫紊乱进而引发肠道炎症的重要原因[4-8]. T细胞是一类重要的免疫活性细胞, 直接介导细胞免疫功能, 对机体免疫应答的调节起关键作用. CD4+ T细胞在控制T细胞对自身和外来抗原的免疫应答中扮演着重要的角色, 在溃疡性结肠炎的发展和持续中起重要作用[9,10]. CD4+CD29+ T细胞属于辅助性T细胞, 参与自身免疫性疾病的发病已有报道, 并且发现CD4+CD29+ T细胞能促进甲状腺功能亢进患者的B细胞生长因子增多[11,12], 还发现妊娠糖尿病[13]、过敏性鼻炎[14]患者、急性丙型肝炎患者的外周血CD29+ T细胞均高于对照组[15]. 但有关黄芩汤从T细胞亚群的角度综合调控T细胞活性的机制研究未见报道. 我们前期的研究已经发现CD4+CD29+ T细胞在湿热型UC患者和大鼠中表达均显著升高, 可能参与了湿热型UC的发病. 我们在前期研究的基础上体外培养UC患者外周血中CD4+CD29+ T细胞发现与健康对照组和IBS-D组相比, CD4+和CD4+CD29+明显增高, 差异有统计学意义(P<0.01); 体外黄芩苷干预下, CD4+和CD4+CD29+增殖明显. 说明了黄芩苷作为黄芩汤的重要组成成分之一, 可能通过促CD4+CD29+增殖作用而调节免疫功能而治疗溃疡性结肠炎.
近年来的研究发现, Th17与Treg在分化的过程中有着密切的联系, 二者存在相互转化的关系, 两者在机体免疫反应中起着独立统一的关系, 他们之间的平衡关系若被打破, 则可能成为多种疾病发生的关键因素. 研究发现, IL-23极其受体IL-23R以及RORC在Th17的分化和维持中起到了关键的作用, 并与UC的发病密切相关[16,17]. 另有文献报道, 两种新的转录因子T-bet和GATA-3的平衡对调控Th1/Th2分化至关重要, T-bet与GATA-3均可形成自我激活的反馈调节环路, 针对自身和其他亚群特异性转录因子, 构成一个动态调节网络[18], T-bet自身可通过与GATA-3的直接结合来干扰GATA-3所介导的Th2反应[19].
我们前期的实验证实, 通过调节转录因子FOXP3、RORγt以及细胞因子IL-17、IL-6、IL-10和TGF-β的表达, 黄芩汤能够调节Th17/Treg的平衡而缓解湿热型溃疡性结肠炎大鼠的炎症反应, 这也许是黄芩汤治疗湿热型溃疡性结肠炎的免疫调节机制之一. 在前期研究的基础上通过ELISA检测血清中细胞因子, 发现IFN-γ、IL-4、IL-5、IL-10和TGF-β1与IBS-D组和健康对照组均有不同程度的升高, IL-6较IBS-D组和健康对照组稍降低. 体外不同溶度的黄芩苷可引起IFN-γ、IL-5、IL-6明显降低, IL-4和IL-10升高, 以20 μmol/L和40 μmol/L浓度更明显. 通过Q-PCR检测外周血单个核细胞RORC和FOXP3 mRNA, 与健康对照组和IBS-D组相比较, RORC和FOXP3 mRNA明显增高, 差异有统计学意义(P<0.05). 较高浓度黄芩苷干预对FOXP3下降的作用更明显, 使RORγt/FOXP3比值降低, 间接调节了Th17/Treg分化的平衡. Q-PCR检测外周血T细胞转录因子T-bet的表达水平明显高于健康对照组, GATA-3基因的表达低于健康对照组, T-bet/GATA-3的比值明显高于健康对照组(P<0.05), T-bet水平升高, 可促使Th1细胞的分化和细胞因子的水平升高, 而GATA-3水平下降, 不能促进Th0细胞向Th2细胞分化, 而最后导致机体呈Th1优势表达, 与国外相关报道一致[20]. 40 μmol/L浓度黄芩苷干预可明显降低T-bet, 可稍降低GATA3, 使T-bet/GATA-3的比值较干预前降低. 从上述研究中我们发现, 较高浓度的黄芩苷均能够抑制T-bet、GATA3的表达及IFN-γ、IL-4、IL-5、IL-10等细胞因子, 可以使IL-4、IL-10升高. 我们认为黄芩苷可能具有把Th0细胞向Th1/Th2细胞分化这个环节作为治疗UC的新靶点, 将Th1状态逆转为Th2状态. 同时说明了黄芩苷也可能通过调节T-bet与GATA-3表达, 可能纠正Th1/Th2细胞分化失衡.
STAT6和STAT4属于STAT家族, 他们分别参与调节Th细胞向Thl和Th2亚群的分化过程[21]. STAT4被认为是调节Th1分化的转录因子, 因而STAT4的活化具有致炎作用. 有研究发现UC和CD患者以及作为对照组的肠易激综合征患者, 其结肠黏膜组织中磷酸化的STAT4的表达均增高, 但UC患者的STAT4升高得较显著[21]. 有研究结果显示磷酸化的STAT4存在于UC组织中, 并明显高于对照组[22]. 因为磷酸化的STAT4代表活化状态的STAT4, 说明STAT4在UC的发病中起作用, STAT4的表达增高可能导致了UC的炎症过程. STAT6是介导Th2的关键转录因子之一, 因而STAT6的活化有抗炎作用. 有研究显示溃疡性结肠炎结肠黏膜STAT6较健康对照组无明显变化, 但经复方中药干预下结肠黏膜的STAT6较治疗前明显下降, 通过抑制STAT6调节免疫而达到改善临床症状. 我们应用Western blot蛋白水平检测外周血单个核细胞STAT4和STAT6、磷酸化STAT4和STAT6及相关细胞因子在UC中的表达, 发现与健康对照组和IBS-D组相比较, p-STAT4/STAT4明显增高, p-STAT6/STAT6明显下降, 差异有统计学意义(P<0.05). 体外黄芩苷干预下, 在40 μmol/L和20 μmol/L浓度干预下p-STAT4/STAT4较未干预前、DMSO干预、5 μmol/L干预和10 μmol/L浓度干预之间比较明显下降, p-STAT6/STAT6较未干预前、DMSO干预、5 μmol/L干预和10 μmol/L浓度干预明显增高, 差异有统计学意义(P<0.05).
目前多数研究认为免疫功能紊乱在IBD发病中起关键作用[23]. Neurath等[22]第一次在TNBS诱发的IBD动物模型中证实了炎性肠组织中存在NF-κB的活化以来, Schreiber等[23]的研究也证实NF-κB在正常人肠上皮无活性, 而在UC和CD人肠上皮中高度活跃, 从而表明NF-κB对UC的发生、发展起着重要作用. 有研究[24]证实黄芩苷处理重症胰腺炎大鼠, 能减少血液中内毒素和TNF-α的含量, 减轻肠黏膜损伤, 降低细胞因子NF-κB的产生, 抑制炎症反应, 从而保护肠黏膜. 本研究通过检测外周血单个核细胞NF-κB及磷酸化NF-κB(p-NF-κB)在UC中的表达, 发现与健康对照组和IBS-D组相比较, p-NF-κB明显增高, NF-κB明显下降, p-NF-κB/NF-κB明显增高, 差异有统计学意义(P<0.05). 体外黄芩苷干预, 40 μmol/L浓度干预下p-NF-κB/NF-κB下降, 差异有统计学意义(P<0.05). 从而说明黄芩苷可能抑制p-NF-κB/NF-κB, 调节免疫平衡而缓解溃疡性结肠的炎症反应. 我们同时通过ELISA检测血清中细胞因子, 发现IFN-γ、IL-4、IL-5、IL-10和TGF-β1与IBS-D组和健康对照组均有不同程度的升高, IL-6较IBS-D组和健康对照组稍降低. 体外不同溶度的黄芩苷可引起IFN-γ、IL-5、IL-6明显降低, IL-4和IL-10升高, 以20 μmol/L和40 μmol/L浓度更明显. 从上述研究中我们发现黄芩苷作为黄芩汤的重要组成成分之一, 可能是一种潜在的免疫抑制, 可能抑制p-STAT4/STAT4, 调节p-STAT6/STAT6、p-NF-κB/NF-κB及相关细胞因子, 可能通过多方面的免疫抑制调节免疫平衡而缓解溃疡性结肠的炎症反应.
从上述研究中我们发现, 黄芩苷可能是一种潜在的免疫抑制剂, 可能通过多方面的免疫抑制调节免疫平衡而缓解溃疡性结肠的炎症反应, 为深入研究UC的发病机制及新药开发提供理论基础, 为包括UC在内其他Th细胞免疫紊乱的相关疾病提供新思路.
在与溃疡性结肠炎(ulcerative colitis, UC)发病密切相关的免疫因素中, T细胞起到了非常关键作用. CD29和CD4的共同表达可作为鉴别CD4+辅助性细胞亚群的标志, CD4+CD29+细胞主要辅助B细胞产生抗体和诱导CD8+细胞介导的淋巴细胞溶解作用, 其升高可造成B细胞高度活化而发生免疫异常, 作为UC的重要免疫学监测指标. 黄芩苷(baicalin)是黄芩汤中黄芩的主要有效成分之一, 具有清热燥湿、泻火解毒功效.
刘杰民, 副主任医师, 贵州省人民医院消化内镜科; 杜群, 副研究员, 广州中医药大学脾胃研究所药理室
UC是一种原因不明的反复发作的肠道慢性非特异炎症性疾病. 已知机体免疫调节异常是导致免疫紊乱进而引发肠道炎症的重要原因. T细胞是一类重要的免疫活性细胞, 直接介导细胞免疫功能, 对机体免疫应答的调节起关键作用.
有文献报道, 两种新的转录因子T-bet和GATA-3的平衡对调控Th1/Th2分化至关重要, T-bet与GATA-3均可形成自我激活的反馈调节环路, 针对自身和其他亚群特异性转录因子, 构成一个动态调节网络, T-bet自身可通过与GATA-3的直接结合来干扰GATA-3所介导的Th2反应.
黄芩苷可能是一种潜在的免疫抑制剂, 可能通过多方面的免疫抑制调节免疫平衡而缓解溃疡性结肠的炎症反应, 为深入研究UC的发病机制及新药开发提供理论基础, 为包括UC在内其他Th细胞免疫紊乱的相关疾病提供新思路.
本文有很好的科学性, 设计合理, 方法可靠, 有较好的学术价值.
编辑: 郭鹏 电编:闫晋利
| 1. | Fiocchi C. Inflammatory bowel disease: etiology and pathogenesis. Gastroenterology. 1998;115:182-205. [PubMed] |
| 2. | Yamaji O, Nagaishi T, Totsuka T, Onizawa M, Suzuki M, Tsuge N, Hasegawa A, Okamoto R, Tsuchiya K, Nakamura T. The development of colitogenic CD4(+) T cells is regulated by IL-7 in collaboration with NK cell function in a murine model of colitis. J Immunol. 2012;188:2524-2536. [PubMed] [DOI] |
| 3. | Mosmann TR, Cherwinski H, Bond MW, Giedlin MA, Coffman RL. Two types of murine helper T cell clone. I. Definition according to profiles of lymphokine activities and secreted proteins. 1986. J Immunol. 2005;175:5-14. [PubMed] |
| 4. | Bai A, Lu N, Zeng H, Li Z, Zhou X, Chen J, Liu P, Peng Z, Guo Y. All-trans retinoic acid ameliorates trinitrobenzene sulfonic acid-induced colitis by shifting Th1 to Th2 profile. J Interferon Cytokine Res. 2010;30:399-406. [PubMed] [DOI] |
| 5. | Xu J, Yang Y, Qiu G, Lal G, Yin N, Wu Z, Bromberg JS, Ding Y. Stat4 is critical for the balance between Th17 cells and regulatory T cells in colitis. J Immunol. 2011;186:6597-6606. [PubMed] [DOI] |
| 6. | Chen Z, Lin F, Gao Y, Li Z, Zhang J, Xing Y, Deng Z, Yao Z, Tsun A, Li B. FOXP3 and RORγt: transcriptional regulation of Treg and Th17. Int Immunopharmacol. 2011;11:536-542. [PubMed] [DOI] |
| 7. | Mudter J, Weigmann B, Bartsch B, Kiesslich R, Strand D, Galle PR, Lehr HA, Schmidt J, Neurath MF. Activation pattern of signal transducers and activators of transcription (STAT) factors in inflammatory bowel diseases. Am J Gastroenterol. 2005;100:64-72. [PubMed] |
| 8. | Lai MY, Hsiu SL, Tsai SY, Hou YC, Chao PD. Comparison of metabolic pharmacokinetics of baicalin and baicalein in rats. J Pharm Pharmacol. 2003;55:205-209. [PubMed] [DOI] |
| 9. | Shen YC, Chiou WF, Chou YC, Chen CF. Mechanisms in mediating the anti-inflammatory effects of baicalin and baicalein in human leukocytes. Eur J Pharmacol. 2003;465:171-181. [PubMed] [DOI] |
| 10. | Chao K, Zhong BH, Zhang SH, Gong XR, Yao JY, Chen MH. [Imbalance of CD4(+) T cell subgroups in ulcerative colitis]. Zhonghua Yixue Zazhi. 2011;91:1605-1608. [PubMed] |
| 11. | Grundmann O, Yoon SL. Irritable bowel syndrome: epidemiology, diagnosis and treatment: an update for health-care practitioners. J Gastroenterol Hepatol. 2010;25:691-699. [PubMed] [DOI] |
| 12. | Xu D, Liu H, Komai-Koma M, Campbell C, McSharry C, Alexander J, Liew FY. CD4+CD25+ regulatory T cells suppress differentiation and functions of Th1 and Th2 cells, Leishmania major infection, and colitis in mice. J Immunol. 2003;170:394-399. [PubMed] [DOI] |
| 13. | Kanai T, Nemoto Y, Kamada N, Totsuka T, Hisamatsu T, Watanabe M, Hibi T. Homeostatic (IL-7) and effector (IL-17) cytokines as distinct but complementary target for an optimal therapeutic strategy in inflammatory bowel disease. Curr Opin Gastroenterol. 2009;25:306-313. [PubMed] [DOI] |
| 14. | Mahmoud F, Arifhodzic N, Haines D, Novotney L. Levocetirizine modulates lymphocyte activation in patients with allergic rhinitis. J Pharmacol Sci. 2008;108:149-156. [PubMed] [DOI] |
| 15. | Boykinova OB, Stoilova YD, Tsvetkova TZ, Baltadjiev IG. Epidemiological, immunological and clinical characteristics of acute hepatitis C. Folia Med (Plovdiv). 2009;51:61-69. [PubMed] |
| 16. | Kitani A, Xu L. Regulatory T cells and the induction of IL-17. Mucosal Immunol. 2008;1 Suppl 1:S43-S46. [PubMed] [DOI] |
| 17. | Ogino H, Nakamura K, Ihara E, Akiho H, Takayanagi R. CD4+CD25+ regulatory T cells suppress Th17-responses in an experimental colitis model. Dig Dis Sci. 2011;56:376-386. [PubMed] [DOI] |
| 18. | Rengarajan J, Szabo SJ, Glimcher LH. Transcriptional regulation of Th1/Th2 polarization. Immunol Today. 2000;21:479-483. [PubMed] |
| 19. | Hwang ES, Szabo SJ, Schwartzberg PL, Glimcher LH. T helper cell fate specified by kinase-mediated interaction of T-bet with GATA-3. Science. 2005;307:430-433. [PubMed] |
| 20. | Müller B, Gimsa U, Mitchison NA, Radbruch A, Sieper J, Yin Z. Modulating the Th1/Th2 balance in inflammatory arthritis. Springer Semin Immunopathol. 1998;20:181-196. [PubMed] |
| 21. | Fan H, Zhao J, Shen L. Effect of compound Sophorae Flavescentis Jiechangrong capsule on expression of NF-κB p65 and STAT6 in the intestinal mucosa of patients with ulcerative colitis. Front Med China. 2009;3:480-484. [DOI] |
| 22. | Neurath MF, Pettersson S. Predominant role of NF-kappa B p65 in the pathogenesis of chronic intestinal inflammation. Immunobiology. 1997;198:91-98. [PubMed] |
| 23. | Schreiber S, Nikolaus S, Hampe J. Activation of nuclear factor kappa B inflammatory bowel disease. Gut. 1998;42:477-484. [PubMed] |
| 24. | Zhang XP, Zhang L, He JX, Zhang RP, Cheng QH, Zhou YF, Lu B. Experimental study of therapeutic efficacy of Baicalin in rats with severe acute pancreatitis. World J Gastroenterol. 2007;13:717-724. [PubMed] |