修回日期: 2014-07-07
接受日期: 2014-07-24
在线出版日期: 2014-08-28
目的: 观察四株胃癌细胞上雌激素受体(ERα和ERβ)的表达情况及雌激素对胃癌细胞株细胞增殖和丝氨酸蛋白酶抑制蛋白9(serine proteinase inhibitor 9, PI9)表达的影响.
方法: 对前期筛选出的PI9阳性表达胃癌细胞株(MNK45、SGC7901)和阴性表达胃癌细胞株(MNK28、BGC823), 采用免疫荧光化学法检测ERα和ERβ的表达情况, CCK8法检测雌激素干预后胃癌细胞株的增殖情况, 逆转录聚合酶链式反应(reverse transcription polymerase chain reaction, RT-PCR)检测雌激素干预后PI9表达的变化.
结果: ERα在MNK45和SGC7901的细胞核上均有表达, ERβ在BGC823的细胞核上呈弱阳性表达, MNK28上未见表达; 雌激素在1-100 nmol/L时可明显促进MNK45、SGC7901的细胞增殖, 与阴性对照组相比差异有统计学意义(P<0.05), 在10-100 nmol/L时亦促进BGC823的细胞增殖, 与阴性对照组相比差异有统计学意义(P<0.05), 在10 nmol/L时促进MNK28的细胞增殖; 雌激素干预后SGC-7901和MNK45的PI9 mRNA表达均增强, 其中, MNK45的PI9 mRNA的相对灰度值(0.7158±0.0734)较对照组(0.5401±0.0653)明显升高, 差异有统计学意义(P = 0.014).
结论: 雌激素与胃癌细胞上雌激素受体结合后能明显促进胃癌细胞株的增殖活性, 其促增殖作用与其诱导PI9的表达密切相关.
核心提示: 胃癌细胞能内源性表达PI9, 进而通过PI9介导其免疫逃逸, 雌激素是PI9表达的重要诱导剂, 雌激素能促进某些胃癌的发生发展, 其作用机制与诱导PI9表达有关吗? 本文将初步探讨雌激素与胃癌细胞PI9表达及细胞增殖的关系.
引文著录: 陈海霞, 周业江, 王璐璐, 李华, 熊玉霞. 雌激素对人胃癌细胞株PI9表达和细胞增殖的影响. 世界华人消化杂志 2014; 22(24): 3613-3618
Revised: July 7, 2014
Accepted: July 24, 2014
Published online: August 28, 2014
AIM: To detect the expression of estrogen receptors (ER alpha and ER beta) in four gastric cancer cell lines and evaluate the effect of estrogen on cell proliferation and expression of serine proteinase inhibitor 9 (PI9) in gastric cancer cells.
METHODS: Gastric cancer cell lines with PI9 positive expression (MNK45 and SGC7901) and those with negative expression (MNK28 and BGC823) were used. The expression of ER was detected by immunofluorescence. Cell proliferation was tested by CCK8 assay, and expression of PI9 was detected by reverse transcription-polymerase chain reaction (RT-PCR).
RESULTS: ER-α protein expression was noted in MNK45 and SGC7901 cells, ER-β expression was noted in BGC823 cells, and ER-α and ER-β were undetectable in MNK28 cells. Compared with the negative control group, estrogen could significantly promote the proliferation of MNK45 and SGC7901 cells at concentrations of 1-100 nmol/L, of BGC823 cells at concentrations of 10-100 nmol/L, and of MNK28 at a concentration of 10 nmol/L (P < 0.05). The expression of PI9 mRNA in SGC-7901 and MNK45 cells was enhanced after intervention with estrogen, and the relative grey value of PI9 mRNA in MNK45 cells (0.7158 ± 0.0734) increased significantly compared with the control group (0.5401 ± 0.0653, P = 0.014).
CONCLUSION: Estrogen could significantly promote the proliferation of gastric cancer cells by binding to ER, possibly via inducing the expression of PI9.
- Citation: Chen HX, Zhou YJ, Wang LL, Li H, Xiong YX. Effect of estrogen on expression of PI9 and cell proliferation in human gastric cancer cell lines. Shijie Huaren Xiaohua Zazhi 2014; 22(24): 3613-3618
- URL: https://www.wjgnet.com/1009-3079/full/v22/i24/3613.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i24.3613
PI9[1-3]是具有抑制颗粒酶B(granzyme B, GrB)功能作用的抑制蛋白, 能阻断GrB所致的DNA降解, 从而具有抑制GrB诱导的细胞凋亡作用. PI9表达于人体正常的细胞毒T淋巴细胞、成熟的树突状细胞、NK细胞及人体为数不多的具有免疫豁免的部位, 如眼、睾丸和胎盘等组织, 保护这些细胞不被GrB介导的细胞毒攻击而自相残杀. 换言之, 上述细胞可通过表达PI9抑制GrB介导的凋亡而获得自身保护, 即内源性免疫逃逸机制. 我们的前期研究发现胃癌细胞能内源性表达PI9, 进而通过PI9抑制PFP/GrB途径介导的细胞凋亡而获得自身保护, 从而造成胃癌的免疫逃逸[4,5]. PI9的表达受多种因素的调控, 雌激素(estradiol, E2)是诱导PI9表达的一个重要因素[6], 雌激素能促进某些胃癌的发生发展, 其作用机制与PI9有关吗? 本研究将首先观察PI9阳性和阴性胃癌细胞上雌激素受体的表达情况, 接着观察雌激素干预后各细胞的增殖情况, 并进一步观察雌激素对胃癌细胞PI9 表达的影响, 探讨雌激素与胃癌细胞PI9表达间的关系, 雌激素是否具有诱导PI9表达进而促进胃癌细胞增殖的作用.
人胃癌细胞株MNK45、SGC7901、MNK28和BGC823购自北京北纳创联生物技术研究院; DMEM培养基、胎牛血清购自HyClone公司; Cell Counting Kit-8购自碧云天生物技术研究所; Tamoxifen购自Adamas Reagent公司; BioBBRK RT-PCR Kit、一抗ERβ兔抗人多克隆抗体和ERα鼠抗人单抗购自美国Bioworld公司; 二抗罗丹明标记山羊抗兔IgG、FITC标记山羊抗小鼠IgG购自中杉金桥.
1.2.1 细胞培养: MNK45、SGC7901、MNK28和BGC823人胃癌细胞株, 于37 ℃、5%CO2条件下, 培养于含10%胎牛血清、1%双抗贮存液的DMEM培养基中, 每2-3 d传代1次, 取对数生长期细胞进行实验.
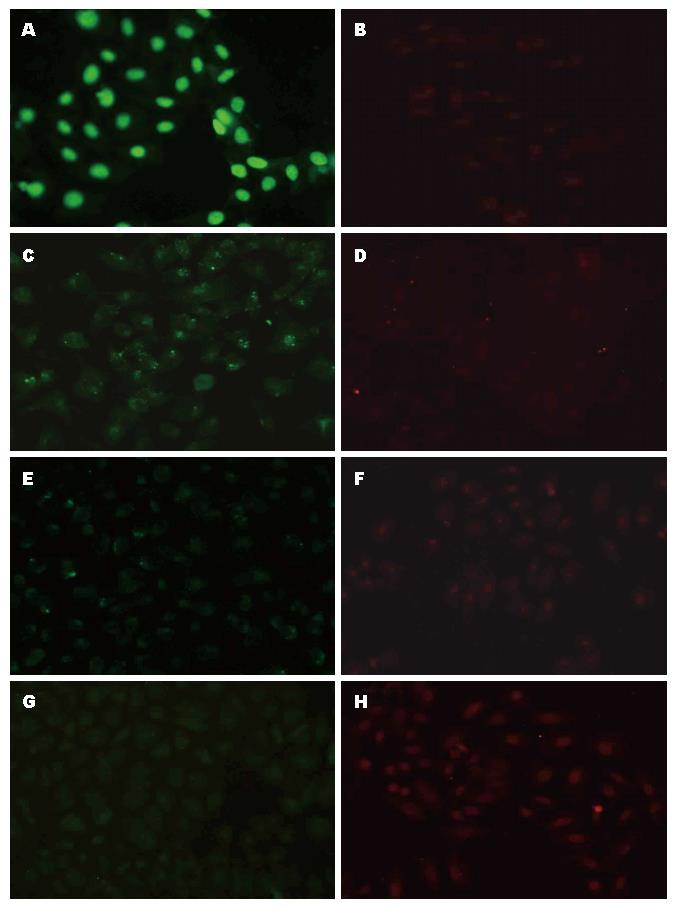
1.2.2 免疫荧光法检测细胞株ERα和ERβ的表达: 取对数生长期细胞, 0.25%胰蛋白酶消化, 调整细胞悬液1×l05/mL, 接种到预先置有盖玻片的12孔板中, 待细胞接近长成单层后用PBS洗涤, 4%预冷的多聚甲醛室温下固定, 预冷甲醇-20 ℃进行细胞通透, 使用与二抗相同宿主10%胎牛血清封闭, 分别加入浓度1:200鼠抗人ERα和1:50兔抗人ERβ稀释液50 μL, 湿盒环境中4 ℃过夜, 等量10%胎牛血清替代一抗作为阴性对照, 加入浓度1:200 FITC标记羊抗小鼠IgG、1:50罗丹明标记山羊抗兔IgG稀释液50 μL, 37 ℃避光孵育30 min, 封片并荧光显微镜下拍照观察. 以激发波长为535-450 nm, 观察四株细胞中ERα、ERβ抗原表达的定位情况及荧光信号的强弱, FITC荧光标记显绿色, 罗丹明荧光标记显红色, 以明确的荧光为阳性, 仅发浅荧光且与周围背景区别不明显则判为阴性或弱阳性.
1.2.3 CCK-8法检测药物对肿瘤细胞增殖的影响: 取对数生长期的细胞, 0.25%胰蛋白酶消化, 活细胞计数>95%, 调整人胃癌细胞MNK45、SGC7901、MNK28和BGC823细胞悬液密度为 2×105/mL, 接种于96孔培养板, 每孔90 μL, 置37 ℃、5%CO2培养箱中培养, 24 h后分别加入终浓度为1000、100、10、1、0.1 nmol/L的苯甲酸雌二醇溶液各10 μL, 阴性对照组加DMEM 10 μL, 空白对照组加无血清DMEM 100 μL, 同时设溶媒对照组加1%甲醇10 μL, 设3个复孔. 24 h后, 向每孔加入10 μL CCK溶液, 继续孵育4 h, 测定450 nm处的吸光度. 细胞增殖能力大小以吸光度(A)值分析, 按公式计算细胞增殖率 = (A给药组-A阴性对照组)/A阴性对照组×100%, 实验重复3次.
1.2.4 半定量RT-PCR法检测PI9 mRNA表达: MN45、SGC-7901细胞经1 μmol/L E2作用24 h后, 对照组设相同体积的1%甲醇, 按照RNAsimple Total RNA Kit说明书操作提取总RNA, 紫外分光光度计测定RNA浓度和纯度后, 用ReverTra Ace逆转录酶合成cDNA, -20 ℃保存备用. 根据GenBank数据库设计引物: PI9 F: 5'-TTCATCGGGCTTTCCAGT-3', R: 5'-TTTGAGACCCAGGTGTTG-3', 引物大小217 bp; GAPDH F: 5'-ACCACAGTCCATGCCATCAC-3', R: 5'-TCCACCACCCTGTTGCT GTA-3', 引物大小450 bp. PCR反应条件为94 ℃预变性5 min, 94 ℃ 30 s, 57 ℃ 30 s, 72 ℃ 1 min, 共35个循环, 72 ℃延伸5 min. 2%琼脂糖凝胶电泳, Bio-Rad凝胶成像采集系统成像.
统计学处理 用SPSS13.0进行统计学分析, 计量资料采用mean±SD表示, 组间比较采用单因素方差分析, 假定方差齐性采用LSD法检验, 未假定方差齐性采用Dunnett's T3法检验, P<0.05为差异有统计学意义.
ERα和ERβ表达定位于细胞核, ERα呈清晰的绿色颗粒, ERβ为红色颗粒. 人胃癌细胞MNK45的ERα呈强阳性表达, 而ERβ为阴性表达, SGC-7901细胞的ERα呈弱阳性表达, ERβ为阴性表达, MNK28细胞ERα和ERβ均未见表达, BGC-823的ERα未见表达, 而ERβ表达则呈弱阳性(图1).
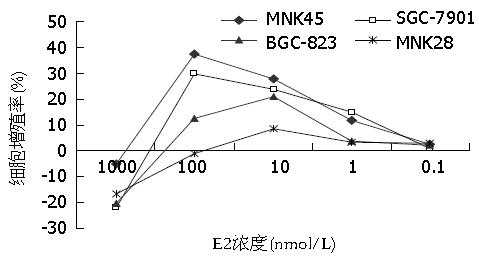
不同浓度的E2作用于MNK45、SGC-7901、MNK28及BGC-823胃癌细胞株24 h后, 采用CCK8法测定细胞增殖活性, 检测结果(表1)显示: 四株人胃癌细胞的生长均受到E2不同程度的影响, E2在0.1-100.0 nmol/L的浓度范围对四株胃癌细胞均具有促增殖活性, 而高浓度E2(1000 nmol/L)则对四株细胞均显示出抑制增殖的作用, 可能是由于雌激素浓度过高, 超出正常的生理浓度, 使渗透压和酸碱平衡紊乱, 其外环境不适合细胞的生长, 细胞动力学参数改变所致. MNK45和SGC-7901在E2 1-100 nmol/L范围内随药物浓度增高吸光度值逐渐增高, 与阴性对照组比较差异均有统计学意义(P<0.05), 尤其在100 nmol/L浓度时促进增殖作用最明显, MNK45和SGC-7901的增殖率分别为37.34%±4.24%和23.70%±2.84%. BGC-823和MNK28的促增殖高峰浓度为10 nmol/L, 其增殖率分别为20.98%±3.12%和8.46%±0.94%, 而1 nmol/L E2的促增殖活性与阴性对照组比较差异无显著性(P = 0.214, P = 0.117). E2对PI9阳性表达细胞的促增殖活性强于PI9阴性表达细胞(图2).
| 分组 | MNK45 | SGC-7901 | BGC-823 | MNK28 |
| 阴性对照组 | 0.656±0.023 | 0.633±0.024 | 0.510±0.034 | 0.614±0.022 |
| E2组(nmol/L) | ||||
| 1000 | 0.623±0.014a | 0.495±0.034a | 0.407±0.027a | 0.511±0.017a |
| 100 | 0.901±0.025a | 0.822±0.026a | 0.574±0.019a | 0.608±0.013 |
| 10 | 0.840±0.017a | 0.783±0.013a | 0.617±0.014a | 0.666±0.019a |
| 1 | 0.733±0.013a | 0.728±0.015a | 0.530±0.014 | 0.635±0.013 |
| 0.1 | 0.672±0.018 | 0.638±0.021 | 0.521±0.019 | 0.633±0.014 |
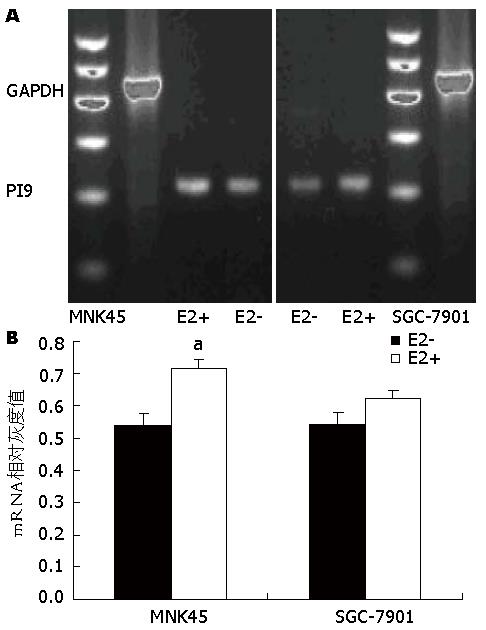
E2处理24 h后, RT-PCR产物电泳结果显示: BGC-823和MNK28仍然未见PI9表达, 而MNK45、SGC-7901细胞的PI9及GAPDH泳道中均出现阳性条带, PI9约在217 bp处产生阳性条带, GAPDH约在450 bp处出现阳性条带, 均与预计扩增产物大小相一致. MNK45经E2作用后PI9 mRNA的相对灰度值(0.7158±0.0734)较对照组(0.5401±0.0653)明显升高(P = 0.014), SGC-7901经E2作用后PI9 mRNA的相对灰度值(0.6216±0.0465)较对照组(0.5445±0.0387, P = 0.086)升高, 但差异无统计学意义(图3).
雌激素能促进某些胃癌的发生发展, 但其确切机制仍不清楚. 20世纪80年代, 日本学者[7]首先发现胃癌组织中有雌激素受体的表达, 而正常胃癌粘膜中则未见表达, 此后国内外学者[8-10]应用不同的方法证实胃癌细胞ER表达的事实, 作为非激素靶器官, ER阳性胃癌也被推测可能是雌激素依赖性肿瘤. 目前多数研究[11-13]提示ER 阳性胃癌的恶性程度高, 生物学行为不良, 患者预后较差. 本研究也发现在四株胃癌细胞株中, 低分化胃癌细胞MNK45的ERα呈强阳性表达, 中分化胃癌细胞SGC-7901ERα为弱阳性表达, 另一株低分化胃癌细胞BGC-823的ERβ呈弱阳性表达, 而高分化胃癌细胞MNK28的ERα和ERβ均未见表达. 雌激素能促进四株胃癌细胞的增殖活性, 且对ER阳性的MNK45、SGC-7901和BGC-823胃癌细胞的促增殖活性强于ER阴性的MNK28, 结果提示雌激素很可能通过与ER结合, 传递细胞生长的信号, 对胃癌的发生发展产生影响.
雌激素是诱导PI9表达的一个最重要因素. 在雌激素α受体阳性的肝癌HepG2ER7细胞株发现雌激素能显著诱导PI9基因转录, 且雌激素的诱导作用不受其他激素调节因子的影响[14]; Jiang等[15,16]在乳腺癌研究中进一步证实雌激素能促进PI9的表达, 在一定浓度范围内随着雌激素浓度的增加PI9表达也增加. 进一步研究发现[2], PI9基因上独特的雌激素反应单元(estrogen response unit, ERU)是雌激素调控PI9表达的关键部位. 美国伊利诺州大学的研究者[6,17]首次发现雌激素诱导的PI9大量合成能显著增加乳腺癌细胞对免疫细胞的耐受性, 阻止免疫细胞对乳腺癌细胞的杀伤作用. 研究也发现雌激素拮抗剂他莫昔芬(tamoxifen, TAM)[16]能抑制雌激素诱导的乳腺癌细胞中PI9的合成, 进而改善PI9介导的免疫耐受.
雌激素能促进某些胃癌的发生发展, 雌激素及其受体的作用机制与PI9有关吗? 目前还未见相关报道. 本研究发现前期筛选出的PI9阳性表达细胞(MNK45和SGC-7901)均为ERα阳性表达细胞, 在E2作用后MNK45和SGC-7901的PI9表达进一步增强, 且E2作用后MNK45和SGC-7901细胞增殖活性亦明显增强, 实验结果提示雌激素与胃癌细胞上ER结合后能明显促进胃癌细胞株的增殖活性, 其促增殖作用与其诱导PI9的表达密切相关. 本课题通过探讨雌激素及其受体与胃癌细胞PI9表达的关系, 初步揭示了雌激素促肿瘤作用的可能机制, 雌激素可能通过与肿瘤细胞上ER结合后诱导PI9 mRNA的表达, 进而抑制PFP/GrB途径而介导免疫逃逸, 即雌激素间接导致了胃癌细胞的免疫耐受, 其作用及其机制还有待进一步的证实.
雌激素能促进某些胃癌的发生发展, 但其确切机制仍不清楚. 某些胃癌组织中有ER表达, 且ER阳性胃癌的恶性程度高、生物学行为不良. 雌激素是诱导PI9表达的重要因素, 雌激素促胃癌机制可能与其诱导胃癌细胞中内源性PI9的表达而导致了胃癌细胞的免疫耐受有关.
欧希龙, 副教授, 东南大学中大医院消化科
某些肿瘤细胞通过内源性表达PI9获得自身保护机制而具有逃逸免疫清除的功能, 肿瘤细胞的这种内源性免疫逃逸机制, 可能与肿瘤的形成和发展中自身获得免疫耐受有关. 因此, PI9极有可能是介导肿瘤免疫逃逸的重要机制和肿瘤免疫治疗的重要障碍.
乳腺癌研究中已证实雌激素能促进PI9的表达, PI9能显著增加乳腺癌细胞对免疫细胞的耐受性, 阻止免疫细胞对乳腺癌细胞的杀伤作用. 研究也发现雌激素拮抗剂他莫昔芬能抑制雌激素诱导的乳腺癌细胞中PI9的合成, 进而改善PI9介导的免疫耐受.
本课题通过探讨雌激素及其受体与胃癌细胞PI9表达的关系, 揭示雌激素促肿瘤作用的可能机制, 即雌激素诱导胃癌细胞中内源性PI9的表达进而间接导致了胃癌细胞的免疫耐受. 此外, 研究成果对其他上皮肿瘤的研究也有一定的借鉴意义, 对更深入认识上皮肿瘤的本质和特性开拓新的视野.
研究结果提示以雌激素为纽带将胃癌的内分泌机制和免疫耐受机制联系起来, 研究成果不仅为雌激素受体拮抗剂的临床应用提供有力的证据, 同时也为其他PI9抑制剂的开发提供参考.
本文内容新颖, 设计科学, 具有一定指导意义.
编辑: 田滢 电编:闫晋利
| 1. | Bird CH, Sutton VR, Sun J, Hirst CE, Novak A, Kumar S, Trapani JA, Bird PI. Selective regulation of apoptosis: the cytotoxic lymphocyte serpin proteinase inhibitor 9 protects against granzyme B-mediated apoptosis without perturbing the Fas cell death pathway. Mol Cell Biol. 1998;18:6387-6398. [PubMed] |
| 2. | Krieg AJ, Krieg SA, Ahn BS, Shapiro DJ. Interplay between estrogen response element sequence and ligands controls in vivo binding of estrogen receptor to regulated genes. J Biol Chem. 2004;279:5025-5034. [PubMed] |
| 3. | Bots M, VAN Bostelen L, Rademaker MT, Offringa R, Medema JP. Serpins prevent granzyme-induced death in a species-specific manner. Immunol Cell Biol. 2006;84:79-86. [PubMed] |
| 4. | 熊 玉霞, 周 业江. P19和GrB在胃癌细胞表达的生物学意义. 中国生理学会2011心血管生理学术会议论文集. 2012;106. |
| 6. | Jiang X, Ellison SJ, Alarid ET, Shapiro DJ. Interplay between the levels of estrogen and estrogen receptor controls the level of the granzyme inhibitor, proteinase inhibitor 9 and susceptibility to immune surveillance by natural killer cells. Oncogene. 2007;26:4106-4114. [PubMed] |
| 7. | Tokunaga A, Kojima N, Andoh T, Matsukura N, Yoshiyasu M, Tanaka N, Ohkawa K, Shirota A, Asano G, Hayashi K. Hormone receptors in gastric cancer. Eur J Cancer Clin Oncol. 1983;19:687-689. [PubMed] |
| 8. | Ryu WS, Kim JH, Jang YJ, Park SS, Um JW, Park SH, Kim SJ, Mok YJ, Kim CS. Expression of estrogen receptors in gastric cancer and their clinical significance. J Surg Oncol. 2012;106:456-461. [PubMed] [DOI] |
| 9. | Chandanos E, Rubio CA, Lindblad M, Jia C, Tsolakis AV, Warner M, Gustafsson JA, Lagergren J. Endogenous estrogen exposure in relation to distribution of histological type and estrogen receptors in gastric adenocarcinoma. Gastric Cancer. 2008;11:168-174. [PubMed] [DOI] |
| 10. | Motohashi M, Wakui S, Muto T, Suzuki Y, Shirai M, Takahashi H, Hano H. Cyclin D1/cdk4, estrogen receptors α and β, in N-methyl-N'-nitro-N-nitrosoguanidine-induced rat gastric carcinogenesis: immunohistochemical study. J Toxicol Sci. 2011;36:373-378. [PubMed] |
| 12. | Kim MJ, Cho SI, Lee KO, Han HJ, Song TJ, Park SH. Effects of 17β-estradiol and estrogen receptor antagonists on the proliferation of gastric cancer cell lines. J Gastric Cancer. 2013;13:172-178. [PubMed] [DOI] |
| 13. | Kretzer NM, Cherian MT, Mao C, Aninye IO, Reynolds PD, Schiff R, Hergenrother PJ, Nordeen SK, Wilson EM, Shapiro DJ. A noncompetitive small molecule inhibitor of estrogen-regulated gene expression and breast cancer cell growth that enhances proteasome-dependent degradation of estrogen receptor {alpha}. J Biol Chem. 2010;285:41863-41873. [PubMed] [DOI] |
| 14. | Kannan-Thulasiraman P, Shapiro DJ. Modulators of inflammation use nuclear factor-kappa B and activator protein-1 sites to induce the caspase-1 and granzyme B inhibitor, proteinase inhibitor 9. J Biol Chem. 2002;277:41230-41239. [PubMed] |
| 15. | Jiang X, Orr BA, Kranz DM, Shapiro DJ. Estrogen induction of the granzyme B inhibitor, proteinase inhibitor 9, protects cells against apoptosis mediated by cytotoxic T lymphocytes and natural killer cells. Endocrinology. 2006;147:1419-1426. [PubMed] |
| 16. | Jiang X, Patterson NM, Ling Y, Xie J, Helferich WG, Shapiro DJ. Low concentrations of the soy phytoestrogen genistein induce proteinase inhibitor 9 and block killing of breast cancer cells by immune cells. Endocrinology. 2008;149:5366-5373. [PubMed] [DOI] |
| 17. | Cunningham TD, Jiang X, Shapiro DJ. Expression of high levels of human proteinase inhibitor 9 blocks both perforin/granzyme and Fas/Fas ligand-mediated cytotoxicity. Cell Immunol. 2007;245:32-41. [PubMed] |