修回日期: 2014-06-19
接受日期: 2014-07-01
在线出版日期: 2014-08-28
目的: 探讨血管内皮生长因子受体3(vascular endothelial growth factor receptor-3, VEGFR-3)siRNA腺病毒载体对结肠癌细胞增殖、迁移、黏附和侵袭能力的影响.
方法: 将VEGFR-3 siRNA腺病毒转染结肠癌LoVo细胞, 以qRT-PCR和Western blot分别检测VEGFR-3 mRNA和蛋白的表达, 通过MTT比色法、划痕实验、Transwell实验、黏附实验检测LoVo细胞的增殖、迁移、侵袭和黏附能力.
结果: 与空白对照组和阴性对照组相比, 实验组VEGFR-3 mRNA和蛋白的表达水平明显降低(P<0.05). 与空白对照组和阴性对照组相比, 实验组细胞增殖明显抑制(P<0.05), 迁移能力减弱(P<0.05), 实验组的穿膜细胞数明显减少(P<0.05), 黏附能力减弱(P<0.001).
结论: 腺病毒介导的VEGFR-3 siRNA可以通过下调结肠癌细胞VEGFR-3的表达从而抑制结肠癌细胞的增殖、黏附、侵袭和迁移能力.
核心提示: 本研究通过靶向血管内皮生长因子受体3(vascular endothelial growth factor receptor-3, VEGFR-3)小干扰RNA腺病毒转染结肠癌LoVo细胞, 检测到VEGFR-3 mRNA和蛋白的表达受到抑制, 细胞增殖减缓、迁移和侵袭能力明显减弱. 说明VEGFR-3小干扰RNA腺病毒载体可以作为结肠癌靶向治疗的一种途径, 为结肠癌靶向治疗提供新的理论依据和临床治疗手段.
引文著录: 苏芝兰, 高峰, 吕志诚, 张鑫. VEGFR-3 siRNA腺病毒载体对结肠癌细胞生长和运动能力的影响. 世界华人消化杂志 2014; 22(24): 3573-3579
Revised: June 19, 2014
Accepted: July 1, 2014
Published online: August 28, 2014
AIM: To investigate the effect of transfection with an adenovirus vector expressing short interfering RNA (siRNA) targeting vascular endothelial growth factor receptor-3 (VEGFR-3) on cell proliferation, adhesion and migration in colorectal cancer cell line LoVo.
METHODS: An adenovirus vector expressing siRNA targeting VEGFR-3 was constructed and transfected into LoVo cells. The expression of VEGFR-3 was detected by RT-PCR and Western blot. Cell proliferation and migration were detected by MTT assay and Transwell assay, respectively.
RESULTS: The expression of VEGFR-3 mRNA and protein was significantly decreased after transfection with the recombinant adenovirus (P < 0.05), compared with the blank control group and negative control group. The proliferation, adhesion and migration of LoVo cells were significantly decreased after transfection with the recombinant adenovirus (P < 0.05).
CONCLUSION: SiRNA-mediated silencing of VEGFR-3 inhibits the proliferation, adhesion and migration of LoVo cells.
- Citation: Su ZL, Gao F, Lv ZC, Zhang X. SiRNA-mediated silencing of VEGFR-3 reduces proliferation, adhesion and migration of colorectal cancer cells. Shijie Huaren Xiaohua Zazhi 2014; 22(24): 3573-3579
- URL: https://www.wjgnet.com/1009-3079/full/v22/i24/3573.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i24.3573
血管内皮生长因子受体3(vascular endothelial growth factor receptor-3, VEGFR-3)是血管内皮细胞的酪氨酸受体之一, 主要介导淋巴管的生成. 在多种肿瘤的增殖和迁移中起着重要作用[1,2]. 结肠癌和其他恶性肿瘤一样, 侵袭和转移是其主要特征[3-5]. 大多数结肠癌患者发现时已为晚期, 已发生远处转移和局部周围器官的侵犯, 给治疗带来一定难度, 也是致死的主要原因之一[6,7].
本研究在原有研究的基础上, 通过腺病毒介导的VEGFR-3小干扰RNA(small interfering, siRNA)感染结肠癌细胞, 了解能否抑制结肠癌细胞的生长和运动能力, 为结肠癌的靶向治疗提供新的依据.
人结肠癌LoVo细胞系购自中科院上海生物研究所; 包含有靶向VEGFR-3的pGenesil- siRNA由晶赛公司合成; pAdTrack、pAdEasy-1质粒, DH5α、BJ5183菌种, HEK293细胞由中国人民解放军兰州军区兰州总医院实验室提供; PCR试剂盒、T4 DNA连接酶及限制性内切酶SalⅠ、HindⅢ、EcoRⅠ购自日本Takara公司; PacⅠ购自美国NEB公司; 质粒小量抽提试剂盒与胶回收试剂盒购自Omega公司; 脂质体LitrofactomineTM2000购自Invitrogen公司; Transwell小室(Millopore 8 μm)购自Corning公司; Matrigel基质胶购自BD公司.
1.2.1 VEGFR-3 siRNA腺病毒载体pAd-VEGFR3-siRNA的构建及病毒感染: VEGFR3 siRNA腺病毒载体pAd-VEGFR-3-siRNA的构建见文献[8]. 复苏后的结肠癌LoVo细胞在37 ℃、5%CO2饱和湿度条件下、用含10%胎牛血清的1640培养液培养. 在生长倍数期时, 用胰酶消化, 分为3组: 接种6孔板, 未接种病毒的LoVo细胞为空白对照组; 接种空病毒载体pAd-siRNA为阴性对照组; 接种pAd-VEGFR-3-siRNA为实验组. 按50 MOI的量接种病毒, 培养箱中感染3 h; 然后弃尽培养上清, 加入新鲜培养液继续培养24 h. 荧光显微镜下观察感染效率, 收集细胞.
1.2.2 实时荧光定量PCR(RT-PCR)法检测: 病毒转染48 h后, 提取总RNA, 采用Primer5.0引物设计软件设计引物, VEGFR-3特异性PCR上游引物: 5'-GACCAGACCATGCTTCAGTGAGA-3'; 下游引物: 5'-GTTGCATGGCTGTTCACAGGA-3', 扩增产物为151 bp. 内参β-actin引物序列上游引物为: 5'-TCATGAAGTGTGACGTTGCATCCGT-3'; 下游引物为: 5'-CCTAGAAGCA、TTTGCGGTGCCGATG-3', 扩增产物片段长100 bp. 荧光定量PCR的扩增条件: 95 ℃变性3 min, 95 ℃ 30 s, 60 ℃ 30 s, 72 ℃ 30 s, 扩增45个循环. 每个样品设3个复孔. 通过顺序检测系统观察各扩增曲线融解曲线, 标准曲线的线形回归系数R值, 统计软件自动进行各样本的mRNA拷贝数的计算. 以VEGFR-3 mRNA与β-actin mRNA拷贝数之比对结果进行标准化.
1.2.3 Western blot: 提取细胞总蛋白, 进行Western blot检测. 将总蛋白变性后, 进行SDS-PAGE凝胶电泳与转膜, VEGFR-3(1:500)、β-actin抗体(1:1000)孵育, 4 ℃过夜, TBST洗2次×10 min, 分别加入碱性磷酸酶标记山羊抗兔IgG(1:2000) 室温孵育2 h, 超敏ECL化学发光、显影、定影. 软件分析条带的吸光度(A)值, 以VEGFR-3 A值与β-actin A值之比进行半定量分析. 实验重复3次.
1.2.4 MTT法检测: 上述3组细胞接种于96孔培养板中, 以只加1640培养液为空白对照, 每组设3个重复孔, 分别于病毒感染前及感染后第2、4、6、8天, 加入MTT(5 mg/mL)溶液20 μL/孔, 置于37 ℃、饱和湿度CO2培养箱中孵育4 h后; 吸弃上清液, 加入200 μL/孔DMSO, 振荡10 min, 在酶联免疫检测仪上测定各孔在490 nm波长处的光密度A值, 计算各组平均值, 以培养时间为横坐标, A值为纵坐标, 绘制细胞生长曲线. 实验重复3次.
1.2.5 黏附实验: 将Matrigel胶与无血清培养基按1:1比例混匀后加入96孔板中, 每孔加Matrigel胶2 μg, 置超净台中过夜风干. 收集对数生长期的实验组、阴性对照组和空白对照组细胞, 稀释后每孔加各稀释细胞数2×105个, 设3个复孔. 37 ℃、5%的CO2培养2 h, PBS洗去未经黏附的细胞, 每孔加入MTT(5 mg/mL)溶液20 μL/孔, 37 ℃、5%CO2培养箱中孵育4 h后吸弃MTT, 每孔加入200 μL/孔DMSO, 振荡10 min, 用酶标仪测490波长A值. 实验重复3次. 细胞黏附抑制率 = (未处理组平均A值-实验组平均A值)/未处理组平均A值×100%.
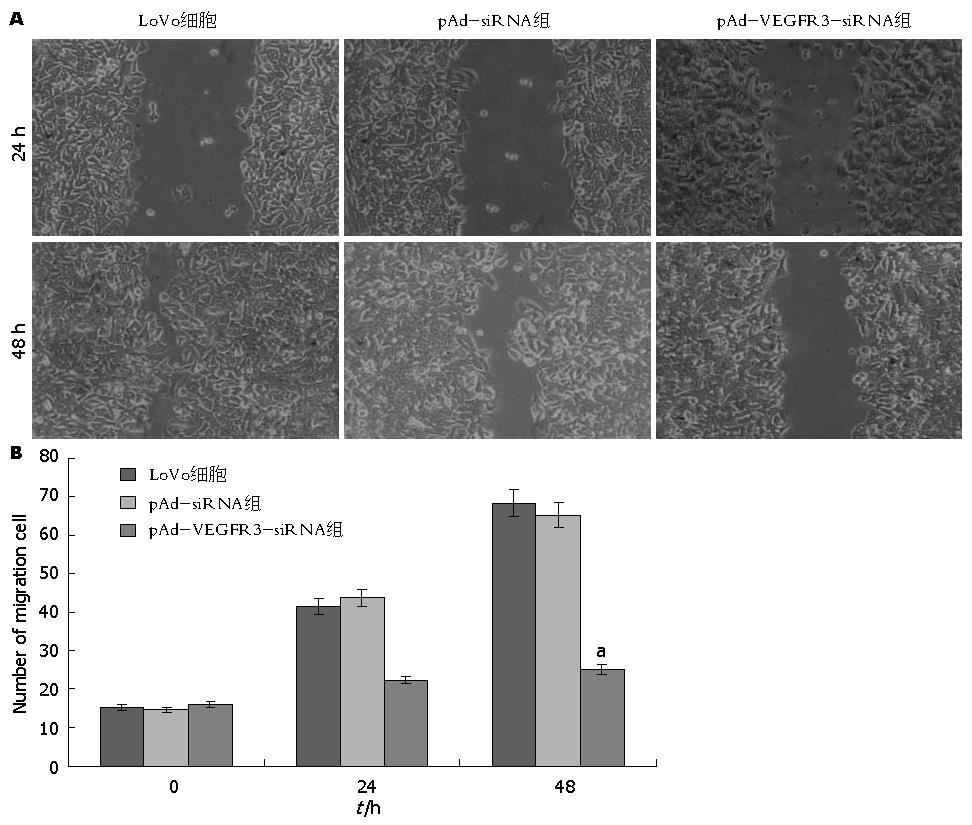
1.2.6 划痕实验: 将上述各组细胞以4×104/mL 密度接种于6孔板, 37 ℃、5%CO2培养24 h. 待细胞铺满板底, 在孔板中央用1000 μL移液器枪头垂直划痕, PBS轻洗2次, 除去细胞碎片, 继续培养24 h, 在倒置显微镜下观察划痕处细胞的迁移情况. 每孔等距离取3个点作为测量点, 测量后取均数, 按下面公式计算细胞的相对迁移率: 计算划痕愈合程度 = (初始宽度-测量宽度)/初始宽度×100%.
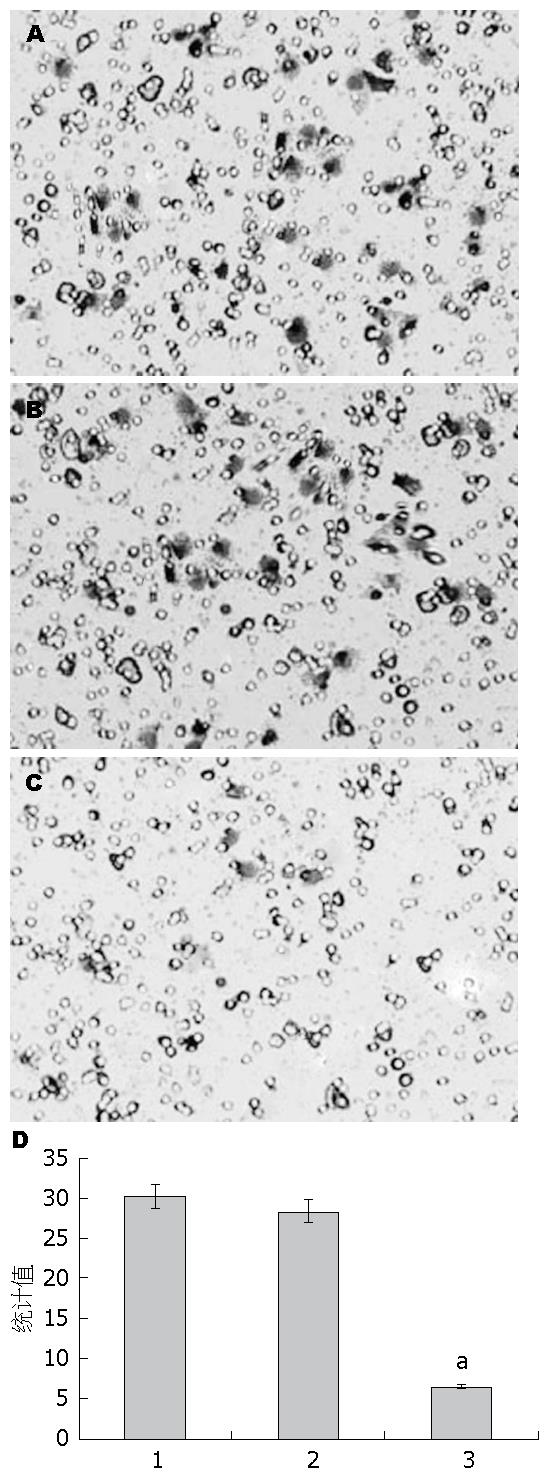
1.2.7 细胞侵袭能力检测: 上述各组细胞在对数生长期时, 用0.25%胰蛋白酶消化, 收集细胞并稀释至2×105个/L. Transwell上室(Matrigel胶与无血清培养基按1:1比例混匀封闭, 聚碳酸酯膜孔径8 μmol/L)中加入200 μL的细胞悬液, 含30%胎牛血清的培养液500 μL加入下室, 每组设3个复孔, 置37 ℃恒温、5%CO2培养箱中培养24 h后, 4%多聚甲醛固定15 min, HE染色. 高倍镜下计数膜背面的细胞数并进行分析.
统计学处理 所有数据均经SPSS13.0软件进行统计分析, 计量资料值以mean±SD表示, 全部数据经方差齐性分析, 组间比较采用单因素方差分析(One-way ANOVA), 组间的比较若方差齐用LSD-t检验, 方差不齐时采用Dunnett法检验. P<0.05为差异有统计学意义.
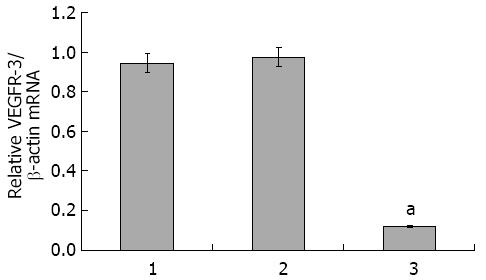
病毒转染48 h后, 提取总RNA, 经qRT-PCR显示, 与空白对照(0.94±0.12)和阴性对照(0.97±0.14)相比, 实验组(0.13±0.19)VEGFR-3 mRNA表达水平均显著性降低(P<0.001). 和空白对照和阴性对照组相比VEGFR-3 mRNA表达抑制率分别达86.17%和86.46%, 而空白对照和阴性对照VEGFR-3 mRNA表达水平差异无统计学意义(P>0.05)(图1).
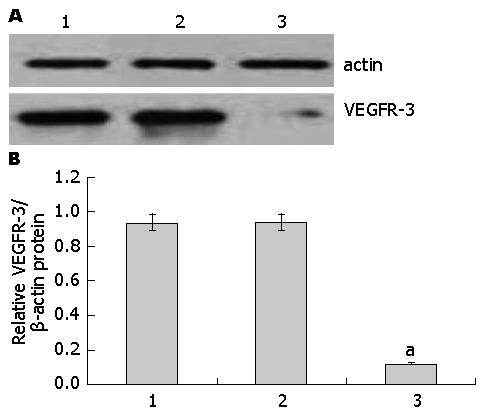
蛋白印迹法检测表明, 实验组(0.12±0.14)与空白对照组(0.94±0.15)和阴性对照组(0.97±0.16)比较, 实验组的蛋白水平明显下降(P<0.001). 空白对照组和阴性对照组相比较蛋白水平无差异(P>0.05)(图2).
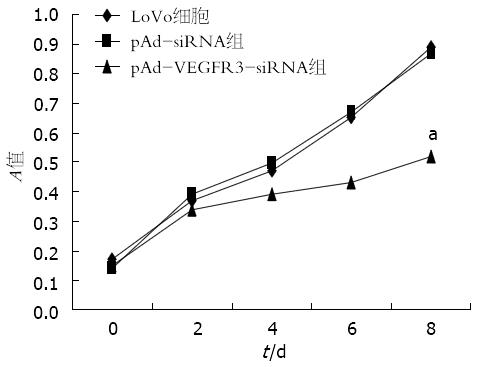
病毒感染前及感染后第2、4、6、8天进行细胞检测, 空白对照组和阴性对照组之间没有差异(P>0.05). 实验组细胞和对照组细胞比较增殖活力在4 d后开始降低, 出现明显差异(P<0.05), 第8天的抑制率达到41.6%(图3).
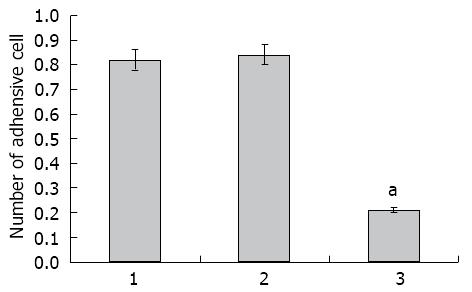
实验组LoVo细胞黏附能力(0.21±0.08)较空白对照组(0.82±0.07)和阴性对照组(0.84±0.06)有明显降低(P<0.001)(图4).
应用单层细胞划痕实验分别观察转染24、48 h后结肠癌LoVo细胞的迁移情况. 结果(图5). 可见, 24 h后, 与空白对照组和阴性对照组相比, 实验组结肠癌LoVo细胞迁移能力明显减弱(P<0.05), 而空白对照组和阴性对照组没有差异(P>0.05).
与空白对照组(30.21±2.45)相比, 实验组细胞侵袭的个数为7.33±2.41, 显著减少(P<0.05), 阴性对照组细胞发生侵袭的个数为28.37±2.39, 无明显变化(P>0.05)(图6).
结直肠癌是最常见的恶性肿瘤之一, 全世界每年新发病例超过一百万, 其中1/3的患者因此而死亡. 生活习惯严重影响该疾病的发生[4,9]. 随着我国经济发展和城市化进程的加快, 居民饮食结构和生活习惯的改变, 我国的结直肠癌发病和死亡率均呈上升趋势. 其中, 结肠癌的发病率上升尤为显著, 大多数患者发现时已属于中晚期[10,11]. 侵袭和转移是恶性肿瘤与良性肿瘤区别的基本特征, 绝大多数恶性肿瘤最终会发生远处转移[12,13]. 转移是一个连续渐进的多因素、多步骤参与的动态过程. 是肿瘤细胞和周围环境相互作用的结果, 有许多细胞因子和信号通路参与其中, 这些因子和信号通路相互作用、相互影响最终导致肿瘤的侵袭和转移[14-16].
淋巴转移是恶性肿瘤判断分期和预后的很重要因素, 为综合治疗决策提供重要依据[17,18]. 血管内皮生长因子家族成员及其受体是目前认为较为重要的调控肿瘤血管淋巴管生成的信号传导通路. VEGFR-3是一个高度糖基化的FNS样酪氨酸激酶, 是淋巴管特异性标志物, 在胚胎发育、伤口愈合以及肿瘤的发生、发展、侵袭及转移中起着非常重要的调控作用. 在许多恶性肿瘤中均有表达, 参与诱导肿瘤淋巴管的生成, 促进肿瘤淋巴转移[19,20].
研究表明, VEGFR-3在非小细胞肺癌、大肠癌、子宫内膜癌、卵巢癌、乳腺癌、前列腺癌、胃癌中VEGFR-3表达与患者的生存时间有相关性, 且认为VEGFR-3的是一个独立的预后因素; VEGFR-3的高表达与淋巴管浸润、淋巴结转移及不良生存预后相关[21-27]. Jayasinghe等[28]认为VEGFR-3是淋巴管生成信号通路的主要诱导物, 通过组织淋巴管内皮细胞的凋亡和刺激淋巴管内皮细胞的迁移、增殖和细胞存活而起作用. VEGFR-3通过维持新生内皮细胞完整性和控制血管萌芽和血管网形成而达到血管生成的目的. 同时在恶性肿瘤细胞以及淋巴结和远处转移病灶的肿瘤细胞中均检测到VEGFR-3的表达[29]. Martins等[23]通过研究结肠癌肿瘤切片和癌旁组织切片分析VEGFR-3的表达发现高表达的VEGFR-3有较差的预后和更短的生存期, VEGFR-3有表达的组织更容易发生肝转移. 然而, 肿瘤细胞VEGFR-3/VEGF-C自分泌系统在肿瘤细胞的增殖、生长、侵袭和转移的功能方面起着重要作用[30,31].
本研究通过腺病毒介导的VEGFR-3 siRNA抑制结肠癌细胞系中VEGFR-3 mRNA及蛋白的表达, 从而阻断VEGF-C/VEGFR-3信号通路, 用MTT法显示和对照组相比, 抑制VEGFR-3表达后结肠癌细胞生长减慢, 活性降低, 4 d后开始明显降低, 第8天的抑制率达到41.6%. 通过划痕实验也证实了下调VEGFR-3的表达后可以显著抑制结肠癌细胞的迁移, 黏附实验和侵袭实验也表明抑制VEGFR-3的表达后, 结肠癌细胞的黏附和侵袭均受到明显影响. 但这种抑制是否与肿瘤细胞的自分泌和其他分子机制有关, 还有待进一步研究.
本研究显示, 通过腺病毒介导的VEGFR-3 siRNA可以通过下调结肠癌细胞VEGFR-3的表达而抑制结肠癌细胞的增殖、迁移、黏附和侵袭, 可以为进一步靶向VEGFR-3基因治疗研究提供理论依据.
结直肠癌是常见的恶性肿瘤之一, 近年来, 我国的结直肠癌发病率和死亡率呈上升趋势, 尤其结肠癌的发病率上升尤为显著. 淋巴转移是结肠癌主要的转移途径, 血管内皮生长因子受体(vascular endothelial growth factor receptor, VEGFR)家族成员及其受体是目前认为较为重要的调控肿瘤血管淋巴管生成的信号传导通路.
郭俊明, 教授, 宁波大学医学院生物化学与分子生物学研究所; 潘兴华, 副主任医师, 中国人民解放军成都军区昆明总医院干细胞与组织器官工程研究中心
VEGFR-3参与了肿瘤的发生、发展、侵袭和转移. 针对此受体的研究在结肠癌靶向治疗方面具有重要意义. VEGFR-3的表达与结肠癌的生存时间相关, 是一个独立的预后因素. 期望为结肠癌的临床治疗开辟一条新的途径.
Jayasinghe等认为VEGFR-3是淋巴管生成信号通路的主要诱导物, 通过组织淋巴管内皮细胞的凋亡和刺激淋巴管内皮细胞的迁移、增殖和细胞存活而起作用. Martins等通过研究结肠癌肿瘤切片和癌旁组织切片分析VEGFR-3的表达发现高表达的VEGFR-3有较差的预后和更短的生存期, VEGFR-3有表达的组织更容易发生肝转移.
本研究通过靶向VEGFR-3小干扰RNA腺病毒抑制结肠癌LoVo细胞的增殖、迁移和侵袭能力. 说明VEGFR-3小干扰RNA腺病毒载体可以作为结肠癌靶向治疗的一种途径. 具有一定的创新性.
本研究采用VEGFR-3小干扰RNA腺病毒可以抑制结肠癌增殖、迁移和侵袭, 具有一定的理论和临床应用价值.
本文设计合理, 方法得当, 结论科学, 为肿瘤基因治疗体内研究提供了新的途径.
编辑: 田滢 电编:闫晋利
| 1. | Alitalo A, Detmar M. Interaction of tumor cells and lymphatic vessels in cancer progression. Oncogene. 2012;31:4499-4508. [PubMed] [DOI] |
| 2. | Swiderska M, Choromańska B, Dąbrowska E, Konarzewska-Duchnowska E, Choromańska K, Szczurko G, Myśliwiec P, Dadan J, Ladny JR, Zwierz K. The diagnostics of colorectal cancer. Contemp Oncol (Pozn). 2014;18:1-6. [PubMed] |
| 3. | Chan KM, Wu TH, Cheng CH, Lee WC, Chiang JM, Chen JS, Wang JY. Prognostic significance of the number of tumors and aggressive surgical approach in colorectal cancer hepatic metastasis. World J Surg Oncol. 2014;12:155. [PubMed] [DOI] |
| 4. | Akgül Ö, Çetinkaya E, Ersöz Ş, Tez M. Role of surgery in colorectal cancer liver metastases. World J Gastroenterol. 2014;20:6113-6122. [PubMed] [DOI] |
| 5. | Lupinacci RM, Mello ES, Coelho FF, Kruger JA, Perini MV, Pinheiro RS, Fonseca GM, Cecconello I, Herman P. Prognostic implication of mucinous histology in resected colorectal cancer liver metastases. Surgery. 2014;155:1062-1068. [PubMed] [DOI] |
| 7. | Brenner H, Stock C, Hoffmeister M. Effect of screening sigmoidoscopy and screening colonoscopy on colorectal cancer incidence and mortality: systematic review and meta-analysis of randomised controlled trials and observational studies. BMJ. 2014;348:g2467. [PubMed] [DOI] |
| 9. | Przybyla AG, Crockett JA, Rex JC, Culumovic PJ. Current screening guidelines overlook a significant number of patients treated for colorectal cancer. Am Surg. 2014;80:539-543. [PubMed] |
| 10. | Zhong X, Fang YJ, Pan ZZ, Lu MS, Zheng MC, Chen YM, Zhang CX. Dietary fiber and fiber fraction intakes and colorectal cancer risk in Chinese adults. Nutr Cancer. 2014;66:351-361. [PubMed] [DOI] |
| 11. | Yusup A, Wang HJ, Rahmutula A, Sayim P, Zhao ZL, Zhang GQ. Clinical features and prognosis in colorectal cancer patients with different ethnicities in Northwest China. World J Gastroenterol. 2013;19:7183-7188. [PubMed] [DOI] |
| 12. | Landskron G, De la Fuente M, Thuwajit P, Thuwajit C, Hermoso MA. Chronic inflammation and cytokines in the tumor microenvironment. J Immunol Res. 2014;2014:149185. [PubMed] [DOI] |
| 13. | Sehdev A, Catenacci DV. Gastroesophageal cancer: focus on epidemiology, classification, and staging. Discov Med. 2013;16:103-111. [PubMed] |
| 14. | Choudhari SK, Chaudhary M, Bagde S, Gadbail AR, Joshi V. Nitric oxide and cancer: a review. World J Surg Oncol. 2013;11:118. [PubMed] |
| 15. | Paschos KA, Majeed AW, Bird NC. Natural history of hepatic metastases from colorectal cancer--pathobiological pathways with clinical significance. World J Gastroenterol. 2014;20:3719-3737. [PubMed] [DOI] |
| 16. | Spolverato G, Ejaz A, Azad N, Pawlik TM. Surgery for colorectal liver metastases: The evolution of determining prognosis. World J Gastrointest Oncol. 2013;5:207-221. [PubMed] [DOI] |
| 17. | Aino H, Sumie S, Niizeki T, Kuromatsu R, Tajiri N, Nakano M, Satani M, Yamada S, Okamura S, Shimose S. Clinical characteristics and prognostic factors for advanced hepatocellular carcinoma with extrahepatic metastasis. Mol Clin Oncol. 2014;2:393-398. [PubMed] [DOI] |
| 18. | Paik KY, Lee IK, Lee YS, Sung NY, Kwon TS. Clinical implications of systemic inflammatory response markers as independent prognostic factors in colorectal cancer patients. Cancer Res Treat. 2014;46:65-73. [PubMed] [DOI] |
| 19. | Woollard DJ, Opeskin K, Coso S, Wu D, Baldwin ME, Williams ED. Differential expression of VEGF ligands and receptors in prostate cancer. Prostate. 2013;73:563-572. [PubMed] [DOI] |
| 20. | Godfraind C, Calicchio ML, Kozakewich H. Pyogenic granuloma, an impaired wound healing process, linked to vascular growth driven by FLT4 and the nitric oxide pathway. Mod Pathol. 2013;26:247-255. [PubMed] [DOI] |
| 21. | Welti J, Loges S, Dimmeler S, Carmeliet P. Recent molecular discoveries in angiogenesis and antiangiogenic therapies in cancer. J Clin Invest. 2013;123:3190-3200. [PubMed] [DOI] |
| 22. | Subramanian J, Morgensztern D, Govindan R. Vascular endothelial growth factor receptor tyrosine kinase inhibitors in non-small-cell lung cancer. Clin Lung Cancer. 2010;11:311-319. [PubMed] [DOI] |
| 23. | Martins SF, Garcia EA, Luz MA, Pardal F, Rodrigues M, Filho AL. Clinicopathological correlation and prognostic significance of VEGF-A, VEGF-C, VEGFR-2 and VEGFR-3 expression in colorectal cancer. Cancer Genomics Proteomics. 2013;10:55-67. [PubMed] |
| 24. | Takahashi K, Mizukami H, Saga Y, Takei Y, Urabe M, Kume A, Machida S, Fujiwara H, Suzuki M, Ozawa K. Suppression of lymph node and lung metastases of endometrial cancer by muscle-mediated expression of soluble vascular endothelial growth factor receptor-3. Cancer Sci. 2013;104:1107-1111. [PubMed] [DOI] |
| 25. | Tuppurainen L, Sallinen H, Kokki E, Koponen J, Anttila M, Pulkkinen K, Heikura T, Toivanen P, Hämäläinen K, Kosma VM. Preclinical safety, toxicology, and biodistribution study of adenoviral gene therapy with sVEGFR-2 and sVEGFR-3 combined with chemotherapy for ovarian cancer. Hum Gene Ther Clin Dev. 2013;24:29-37. [PubMed] [DOI] |
| 26. | Matsumoto M, Roufail S, Inder R, Caesar C, Karnezis T, Shayan R, Farnsworth RH, Sato T, Achen MG, Mann GB. Signaling for lymphangiogenesis via VEGFR-3 is required for the early events of metastasis. Clin Exp Metastasis. 2013;30:819-832. [PubMed] [DOI] |
| 27. | Kim JY, Jeon TJ, Bae BN, Kwon JE, Kim HJ, Park K, Shin E. The prognostic significance of growth factors and growth factor receptors in gastric adenocarcinoma. APMIS. 2013;121:95-104. [PubMed] [DOI] |
| 28. | Jayasinghe C, Simiantonaki N, Michel-Schmidt R, Kirkpatrick CJ. Endothelial VEGFR-3 expression in colorectal carcinomas is associated with hematogenous metastasis. Oncol Rep. 2009;22:1093-1100. [PubMed] [DOI] |
| 29. | Achen MG, Stacker SA. Vascular endothelial growth factor-D: signaling mechanisms, biology, and clinical relevance. Growth Factors. 2012;30:283-296. [PubMed] [DOI] |
| 30. | Klasa-Mazurkiewicz D, Jarząb M, Milczek T, Lipińska B, Emerich J. Clinical significance of VEGFR-2 and VEGFR-3 expression in ovarian cancer patients. Pol J Pathol. 2011;62:31-40. [PubMed] |
| 31. | Matsuura M, Onimaru M, Yonemitsu Y, Suzuki H, Nakano T, Ishibashi H, Shirasuna K, Sueishi K. Autocrine loop between vascular endothelial growth factor (VEGF)-C and VEGF receptor-3 positively regulates tumor-associated lymphangiogenesis in oral squamoid cancer cells. Am J Pathol. 2009;175:1709-1721. [PubMed] [DOI] |