修回日期: 2014-07-07
接受日期: 2014-07-28
在线出版日期: 2014-08-28
目的: 构建靶向信号接头蛋白Crk的短发夹RNA(short hairpin RNA, shRNA)的真核表达载体质粒, 研究其对肝星状细胞株LX-2功能的影响.
方法: 根据Crk mRNA序列进行设计并合成shRNA寡核苷酸片段, 退火形成双链并连接入plko载体. 包装Crk慢病毒, 感染人肝星状细胞株LX-2. 研究其对LX-2细胞增殖、迁移和活化功能的影响.
结果: 定量PCR和Western blot检测结果提示成功构建了针对Crk特异性shRNA真核表达质粒, shCrk组的Crk表达明显低于对照组. 干扰Crk基因后, LX-2细胞的活化、迁移能力减弱; 而细胞增殖没有受到影响.
结论: LX-2中成功构建Crk基因的shRNA真核表达载体; 下调Crk基因后能够抑制LX-2细胞的活化和迁移.
核心提示: 利用Crk的慢病毒载体感染肝星状细胞, 稳定持续的抑制Crk的表达. 当Crk的表达被抑制后, 肝星状细胞的活化指标一型胶原和平滑肌肌动蛋白的表达减少, 肝星状细胞的迁移能力也出现了下降, 提示通过抑制Crk能够影响肝纤维化的进程.
引文著录: 胡江峰, 陈超, 齐峰, 刘婷婷, 刘保海, 朱樑. Crk基因shRNA质粒的构建及其在肝纤维化中的作用. 世界华人消化杂志 2014; 22(24): 3565-3572
Revised: July 7, 2014
Accepted: July 28, 2014
Published online: August 28, 2014
AIM: To construct a short-hairpin RNA (shRNA) eukaryotic expression vector targeting the v-Crk avian sarcoma virus CT10 oncogene homolog gene (Crk) and to study the potential role of Crk in liver fibrosis.
METHODS: The shRNA oligonucleotide fragments were designed and synthesized based on the sequence of Crk mRNA. Double strands were then formed after annealing and inserted into the plko vector. Recombinant lentiviral vector was transfected into 293T cells to package lentivirus. LX-2 cells were then infected with the recombinant lentivirus and the function of Crk was studied after infection.
RESULTS: RT-PCR and Western bolt analyses indicated that after successful infection, both mRNA and protein expression was dramatically down-regulated, compared with the control group. Knockdown of Crk decreased the expression of collagen type 1 (Col1), α-smooth muscle actin (α-SMA) and the capacity of cell migration, but had no effect on cell proliferation.
CONCLUSION: We have successfully constructed an shRNA eukaryotic expression vector targeting the Crk gene. Knockdown of Crk can inhibit liver fibrosis possibly by suppressing the activation and migration of LX-2 cells.
- Citation: Hu JF, Chen C, Qi F, Liu TT, Liu BH, Zhu L. Construction of an shRNA expression vector targeting the Crk gene: Potential role of Crk in liver fibrosis. Shijie Huaren Xiaohua Zazhi 2014; 22(24): 3565-3572
- URL: https://www.wjgnet.com/1009-3079/full/v22/i24/3565.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i24.3565
信号接头蛋白Crk(v-Crk avian sarcoma virus CT10 oncogene homolog, Crk)被认为参与了细胞内受体整合蛋白和酪氨酸激酶等多种网络信号分子的信号转导过程[1,2]. 近几年, 越来越多的研究发现Crk在肿瘤疾病及炎症的进展中起到了重要的作用[3-8]. 最近研究发现microRNA-126(miR-126)通过抑制肝星状细胞的功能从而抑制肝纤维化, 并发现了一个新的靶基因: Crk. 众所周知, miRNA主要通过在转录后水平抑制靶基因的表达行使其功能, 但一个miRNA常常有几个靶基因, 所以miR-126是否直接通过靶向抑制Crk对肝星状细胞的功能进行调控尚缺乏直接证据. 因此, 通过构建靶向抑制Crk的shRNA真核表达质粒, 用以研究Crk对肝星状细胞的功能影响, 对于深入了解肝纤维化的分子调控机制有着重要意义.
RNA干扰(RNA interference, RNAi)是大部分生物体存在的一种普遍的细胞生物学现象, 在转录水平调控基因表达[9-14]. 近年来RNAi已经发展成为一种新型的基因阻断技术, 广泛应用于特异抑制基因的表达及其功能研究. 慢病毒载体可携带外源双链shRNA进入细胞, 整合到细胞的基因组中, 进而高效、稳定、特异地抑制目的基因表达.
肝星状细胞的活化被认为是肝纤维化进程中的关键环节. 当肝脏受到各种病理因素的刺激后, 由静止状态开始逐渐活化, 伴随着增殖、迁移、活化能力的提升, 并分泌大量的胶原蛋白[15-21]. 本文通过构建Crk基因shRNA慢病毒表达载体并感染肝星状细胞系LX-2[22], 形成Crk基因沉默细胞, 进一步研究了Crk在肝星状细胞中的作用机制.
实验大鼠购自中国人民解放军第二军医大学实验动物中心, SPF级♂SD大鼠, 体质量180-200 g. CCl4、橄榄油(国产分析纯, 上海国药); 大肠杆菌DH5α自行制备; 真核表达载体plko.1购自Addgene; 限制性内切酶AgeⅠ、EcorⅠ及T4 DNA连接酶购自大连宝生生物; 小量质粒提取试剂盒购自捷瑞生物; Tublin抗体(巴傲德); Ⅰ型胶原(collagen typeⅠ, Col1)抗体(Abcam); 平滑肌肌动蛋白(α-smooth muscle actin, α-SMA)抗体(Sigma); Crk抗体(Epitomics); Hochest 33342(Sigma); CCK-8试剂盒(Dojindo); Transwell小室(Corning).
1.2.1 靶向Crk基因的shRNA序列的设计: 根据Genbank中Crk基因的mRNA序列(Genbank accession no. NM_001008365.1→NP_001008366.1), 采用Ambion公司的网上设计软件, 并参考shRNA的设计原则, 设计两段靶向Crk mRNA的shRNA序列, 并通过BLAST对所选择的靶序列进行同源分析, 排除shRNA非特异性抑制其他基因片段的可能, 最终确定shRNA序列. 设计的具有发夹结构的靶向Crk基因的shRNA干扰片段序列及用于对照的序列片段如表1. 以上DNA寡核苷酸单链均由上海捷瑞生物公司合成. 将合成好的两条互补的单链稀释至100 pmol/L, 等量混合放置于95 ℃水浴, 5 min关闭开关待自然冷却后即形成双链. 各取5 μL过夜产物分别加入50 μL感受态细胞DH5α中混匀, 冰浴静置20 min, 42 ℃水浴热激90 s, 迅速冰浴冷却5 min, 再向其中加入750 μL LB培养基, 37 ℃摇床温育50 min, 使大肠杆菌复苏并表达质粒的氨苄抗性标记基因. 将菌液均匀涂于含氨苄的LB平板上, 倒置放在37 ℃恒温箱培养过夜. 第2天从LB平板上挑取3个单克隆菌落接种于5 mL含氨苄抗性的LB培养基中, 37 ℃恒温摇床250 r/min培养过夜. 第2天取出按照质粒小量抽提说明书抽提质粒, 并测其浓度.
| shCrk | 序列及结构 |
| shCrk-1 | 5'-CCGGCGCCTCAGTATCGGCTCTGATCTCGAGATCAGAGCCGATACTGAGGCGTTTTT-3' |
| shCrk-2 | 5'-CCGGGCTTTACTGGAATTCTACAAACTCGAGTTTGTAGAATTCCAGTAAAGCTTTTT-3' |
| Control | 5'-CCGGTGCTTCGACATTTAACCAATTTCAAGAGAATTGGTTAAATGTCGAAGCTTTTTT-3' |
1.2.2 干扰效果的检测: 测序正确的PLKO.1/Crk-shRNA质粒, 与VSVG、PAX2按4:2:3的比例混合, 利用Lipofectamine 2000转染包装细胞(293T细胞). 48 h后收集病毒上清, 使用0.45 μm滤器过滤, 短时间使用则置于4 ℃冰箱, 长时间保存至于-80 ℃冰箱. 当细胞汇合度约30%时, 加入病毒感染LX-2细胞, 8 h换液, 72 h后收集细胞. RT-PCR法检测Crk mRNA表达水平. Western blot法检测蛋白表达水平. 内参抗体Tublin(1:1500)、Crk(1:1500). 采用化学发光法进行显色反应.
1.2.3 细胞增殖检测: 将感染对照病毒的LX-2细胞和shCrk的LX-2细胞按照3000/孔的密度接种于96孔板中, 选取24、48、72 h为3个观察时间点, 加入CCK-8试剂, 置于培养箱内孵育2 h, 取出放置于酶标仪下检测450 nm波长的吸光度(A)值.
1.2.4 细胞迁移检测: 将感染对照病毒的LX-2细胞和shCrk的LX-2细胞按照4×105/well的密度接种于Transwell小室, 上室加入100 μL无血清培养基, 下室加入600 μL含有10%FBS的培养基. 孵育16-20 h后取出, 去除原培养基, 加入PBS洗涤细胞2遍. 加入4%PFA固定细胞5 min. 避光加入Honchest33342进行染核. 荧光显微镜下随机选取3个高倍镜视野, 计算3个视野的细胞平均数.
1.2.5 RT-PCR法检测Col1、α-SMA、Crk mRNA水平: 使用TRIzolTM试剂盒(Takara)和RT-PCR试剂盒(Takara). 在6孔板中每个孔加入1 mL TRIzol试剂, 提取细胞总RNA. 提取后使用分光光度计检测RNA质量和浓度. A260/280均在1.80以上. 10 μL体系中加入500 ng的RNA进行反转录. 反转录的程序为: 37 ℃ 15 min, 85 ℃ 5 s, 随后置于冰上. 定量PCR引物序列如表2.
| 名称 | 引物序列 | 大小(bp) |
| GAPDH | 5'-GAAGGCTGGGGCTCATTTG-3' | 258 |
| 5'-AGGGGCCATCCACAGTCTTCPF-3' | ||
| Col1 | 5'-GAGGGCCAAGACGAAGACATC-3' | |
| 5'-CAGATCACGTCATCGCACAAC-3' | 140 | |
| α-SMA | 5'-AAAAGACAGCTACGTGGGTGA-3' | |
| 5'-GCCATGTTCTATCGGGTACTTC-3' | 76 | |
| Crk | 5'-CGCTCCGCCTGGTATATGG-3' | |
| 5'-GGACACCGACAGCACATAGTC-3' | 129 |
1.2.6 Western blot检测相关蛋白: 1×SDS裂解蛋白, 每孔加样20 μg. 分别加入1:1500稀释的Tublin、Col1、α-SMA和Crk抗体. 1:3000稀释的兔二抗, 常规曝光、显色.
1.2.7 大鼠肝纤维化模型的建立及肝组织形态学观察: 采用CCl4腹腔注射的方法复制肝纤维化大鼠模型. 将大鼠分为两组: 肝纤维化组腹腔注射40%CCl4的橄榄油溶液, 2 mL/kg, 首剂加倍, 2次/wk, 共8 wk. 对照组注射橄榄油溶液, 剂量及注射时间、次数与肝纤维化造模组保持一致. 造模结束后, 取大鼠肝左叶, 以4%PFA固定, 石蜡包埋组织制作切片, 行HE染色观察肝纤维化分期, 分期标准参照《病毒性肝炎防治方案》[23].
统计学处理 应用SPSS统计软件, 实验数据以mean±SD表示, 两两比较采用t检验, P<0.05为差异有统计学意义.
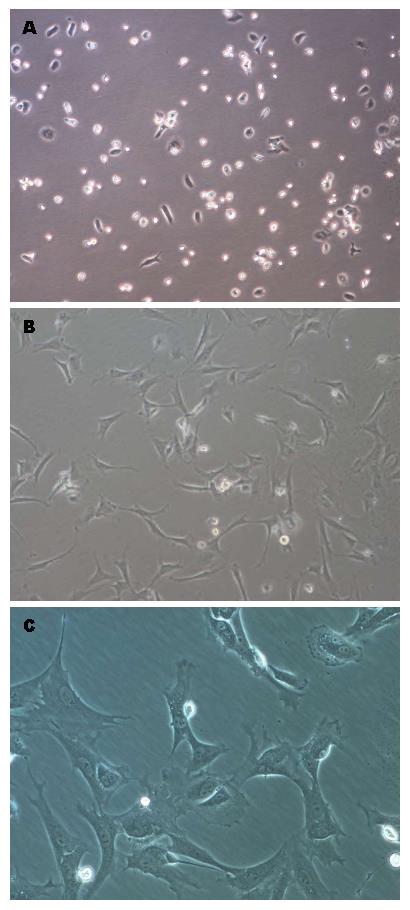
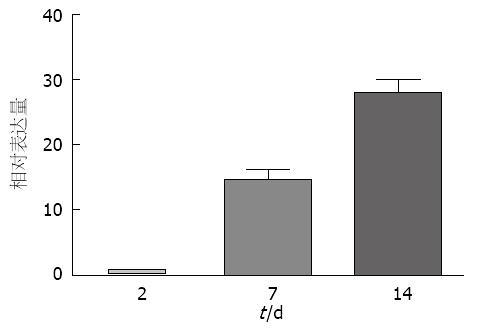
利用原位灌注胶原酶消化法分离大鼠的原代肝星状细胞[24,25]. 培养2 d的肝星状细胞保持静止状态, 培养7 d的肝星状细胞为半活化状态, 培养14 d的肝星状细胞为完全活化的状态. 在肝星状细胞逐渐活化的过程中, 肝星状细胞的形态由静止状态的圆球形逐渐向外伸出触角呈星形, 细胞体积明显增大(图1). 分别收集大鼠和人的静止状态、半活化状态和完全活化状态的肝星状细胞, 提取RNA检测Crk的表达水平, 以2 d的Crk表达量为1, 随着肝星状细胞逐渐活化, Crk的表达逐渐升高(P<0.01), 差异有统计学意义(图2).
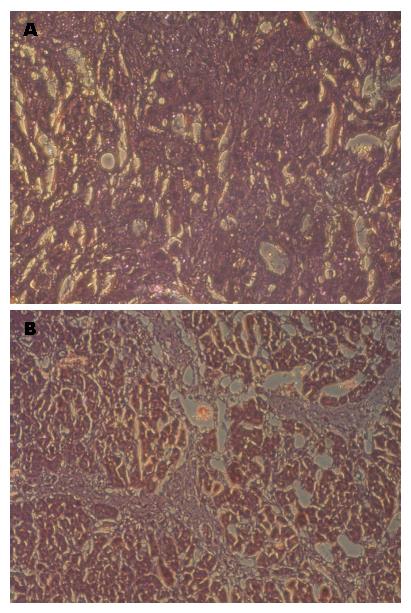
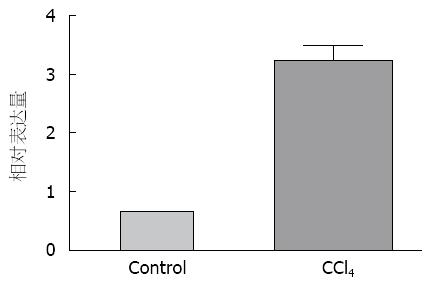
大鼠CCl4造模8 wk后, 取部分肝组织, HE染色结果显示造模后的大鼠肝脏的纤维组织大量增生, 并包绕增生的肝细胞团形成假小叶(图3). 提取肝组织的总RNA, 检测Crk基因的表达. 以对照组Crk表达量为1, CCl4造模8 wk后, 肝脏中Crk的表达量明显高于对照组(P<0.01), 差异有统计学意义(图4).
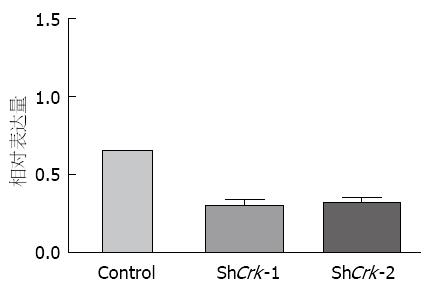
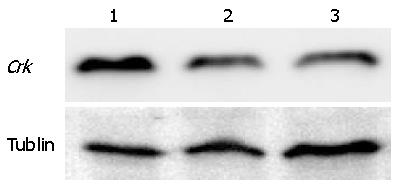
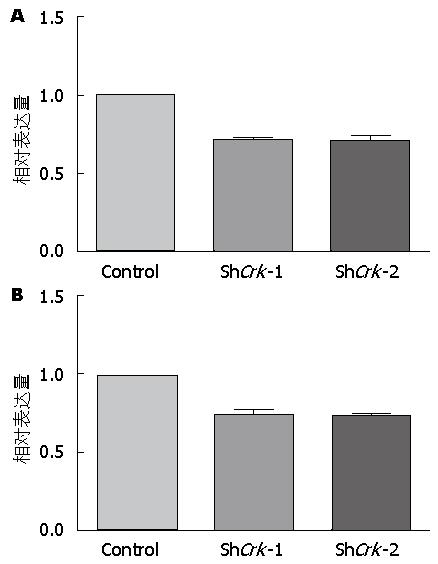
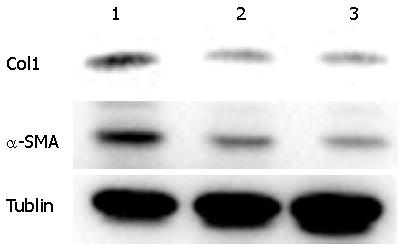
测序正确的质粒转染293T细胞进行慢病毒的包装, 感染LX-2细胞72 h后, 收集细胞, 提取RNA和蛋白. 荧光定量PCR结果显示, 相比较于感染对照病毒组, 感染了shCrk慢病毒组中Crk基因的mRNA表达水平明显下调. 并且两条设计序列构建的质粒均有较好的干扰效果, 差异有统计学意义(P<0.01)(图5). Western blot检测结果在蛋白表达水平上也提示在感染了shCrk慢病毒组中, Crk基因的表达被明显抑制(图6).
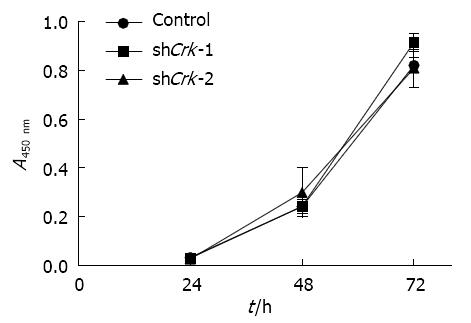
CCK-8法检测Control组、shCrk-1组、shCrk-2组的LX-2细胞增殖能力. LX-2细胞感染对照病毒和shCrk慢病毒3 d后, 收集细胞, 重新接种于96孔板中. 分别收集接种后24、48、72 h的细胞, 加入CCK-8试剂. 结果显示, 当下调Crk的表达以后, LX-2细胞的增殖能力并未出现明显的变化, 提示Crk可能并不影响LX-2细胞的增殖(图7).
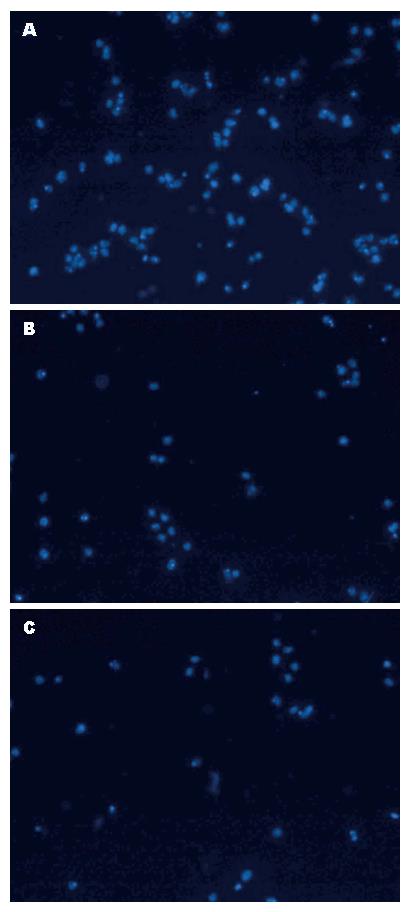
利用Transwell小室检测LX-2细胞在抑制Crk基因后的细胞迁移能力. 由于血清梯度的趋化作用, 细胞由上室穿到下室. 当抑制Crk的表达后, LX-2细胞的迁移能力出现了明显的下调, shCrk-1和shCrk-2组的细胞迁移数量都明显少与对照组, 两两比较均有统计学意义(均P<0.01)(表3, 图8).
LX-2细胞感染相应的慢病毒, 72 h后收集细胞, 检测Col1和α-SMA的基因表达水平. 结果显示, 当抑制了Crk后, Col1和α-SMA的表达也受到了抑制(P<0.01)(图9), 差异有统计学意义. Western blot结果同样提示, 抑制Crk后, Col1和α-SMA的蛋白水平也出现了明显的减少(图10). 结果提示抑制Crk可能会影响LX-2细胞的活化能力.
肝纤维化是多种病因引起的慢性肝脏损伤所导致的病理改变, 主要表现为细胞外间质成分过度沉积, 肝脏功能受损的状态, 是慢性肝病发展到肝硬化、肝癌的必经阶段. 目前研究观点认为肝纤维化病变阶段能够逆转至正常, 而肝硬化则无法发生逆转. 因此早期发现、早期治疗肝纤维化是目前临床和科研的重点.
肝星状细胞位于Disse间隙内, 紧临着肝细胞和肝窦内皮细胞. 各种致纤维化因素均把肝星状细胞作为其作用的最终靶细胞. 正常状态下该细胞处于静止状态, 当受到炎症或者机械等刺激时, 肝星状细胞开始被激活. 主要表现为激活后的肝星状细胞增殖、活化、迁移能力的增强, 并且分泌大量细胞外基质, 参与肝内结构的重建.
肝纤维化的治疗策略中, 很重要的一条就是抑制肝星状细胞的活化. 目前有报道的抗肝纤维化有效药物, 例如霉酚酸、转化生长因子-β(transforming growth factor beta, TGF-β)拮抗剂、5-羟色胺拮抗剂、维生素E、α干扰素和肝细胞生长因子等都是通过作用于肝星状细胞, 抑制其活化功能, 从而达到治疗肝纤维化的目的[26-29].
Crk是近年来发现的一种细胞内信号接头蛋白, 为原癌基因c-Crk的表达产物, 参与了细胞内受体整合蛋白和酪氨酸激酶等多种信号分子的信号转导过程. Crk在正常组织中表达较低, 但Crk在恶性肿瘤例如肺癌, 表达显著高于正常组织. 且研究发现其与肿瘤细胞的增殖、侵袭、凋亡等功能紧密相关. Crk作为一种接头蛋白, 通过与多种信号分子相联系, 广泛参与肿瘤细胞的增殖、迁移、凋亡的信号转导.
最近, 有研究者发现过表达miR-126能够明显抑制大鼠肝星状细胞的活化和迁移, 并发现了一个miR-126的新的靶基因: Crk[30]. 但Crk在肝纤维化中的作用尚不清楚. 因此, 对Crk的功能进行研究显得尤为必要. 我们利用RNA干扰技术, 设计并构建了两个靶向Crk基因的shRNA真核表达载体. 利用包被的慢病毒感染LX-2细胞, 具备了高效性、稳定性、特异性等优势, 并且将目的基因整合到宿主细胞的染色体中, 在子代中稳定表达. 通过RT-PCR和Western blot实验验证了干扰效果, 得到了两个较为有效的干扰质粒载体shCrk1、shCrk2. 随后分别对细胞的增殖, 活化以及迁移的功能进行检测. 我们发现, 干预了shCrk后, LX-2细胞的增殖能力并未受到影响, 但其迁移能力明显被抑制, 细胞活化的相关指标Col1和α-SMA也出现了明显的下调. 这一结果提示Crk在调控LX-2细胞的功能起到了重要的作用, 抑制Crk能够阻减少肝星状细胞分泌合成细胞外基质, 抑制肝星状细胞向损伤部位迁移. 提示Crk可能作为潜在的治疗肝纤维化的靶点.
总之, 本研究成功设计并构建了2条靶向Crk的shRNA质粒. 在细胞水平上发现干扰Crk基因能够抑制肝星状细胞的活化和迁移. 为后续进一步的体内外功能研究提供了理论基础.
信号接头蛋白Crk被认为参与了细胞内受体整合蛋白和酪氨酸激酶等多种网络信号分子的信号转导过程. 近几年, 越来越多的研究发现Crk在肿瘤疾病及炎症的进展中起到了重要的作用.
赵铁建, 教授, 广西中医药大学基础医学院生理学教研室
目前对肝纤维化的研究集中在肝星状细胞的表观遗传学上, 例如非编码RNA对肝星状细胞的调控以及寻找非编码RNA相应的靶基因. 但由于非编码RNA的靶基因并不局限于一个, 因此寻找并验证对肝星状细胞调控的非编码RNA的靶基因是当前研究的一个难点.
Crk基因在多种肿瘤疾病与非肿瘤疾病中都扮演了重要的角色, 例如影响肿瘤细胞的侵袭和迁移能力, 但在肝纤维化中的作用尚不清楚.
与同类文章有所区别的是, 本研究利用慢病毒感染肝星状细胞, 可以使得目的基因在肝星状细胞中稳定持续的抑制. 保证了实验结果的稳定性. 此外, 本研究还首次发现了Crk基因在肝星状细胞中的重要作用.
利用慢病毒稳定持续的感染肝星状细胞, 干预Crk在肝星状细胞中的表达, 为后期注射到动物体内, 进行体内干预实验, 奠定了基础.
shRNA: short hairpin RNA的缩写, 翻译为: "短发夹RNA", shRNA包括两个短反向的重复序列, 随后再连上5-6个T作为RNA聚合酶Ⅲ的转录终止子.
本实验选题, 设计合理, 实验结果客观可信, 具有一定的应用价值.
编辑: 郭鹏 电编:闫晋利
| 1. | Feller SM. Crk family adaptors-signalling complex formation and biological roles. Oncogene. 2001;20:6348-6371. [PubMed] [DOI] |
| 2. | Nishihara H, Tanaka S, Tsuda M, Oikawa S, Maeda M, Shimizu M, Shinomiya H, Tanigami A, Sawa H, Nagashima K. Molecular and immunohistochemical analysis of signaling adaptor protein Crk in human cancers. Cancer Lett. 2002;180:55-61. [PubMed] [DOI] |
| 3. | Mortazavi F, Dubinett S, Rettig M. c-Crk proto-oncogene contributes to transcriptional repression of p120-catenin in non-small cell lung cancer cells. Clin Exp Metastasis. 2011;28:391-404. [PubMed] [DOI] |
| 4. | Kumar S, Fajardo JE, Birge RB, Sriram G. Crk at the quarter century mark: perspectives in signaling and cancer. J Cell Biochem. 2014;115:819-825. [PubMed] [DOI] |
| 5. | Linghu H, Tsuda M, Makino Y, Sakai M, Watanabe T, Ichihara S, Sawa H, Nagashima K, Mochizuki N, Tanaka S. Involvement of adaptor protein Crk in malignant feature of human ovarian cancer cell line MCAS. Oncogene. 2006;25:3547-3556. [PubMed] |
| 6. | Fathers KE, Bell ES, Rajadurai CV, Cory S, Zhao H, Mourskaia A, Zuo D, Madore J, Monast A, Mes-Masson AM. Crk adaptor proteins act as key signaling integrators for breast tumorigenesis. Breast Cancer Res. 2012;14:R74. [PubMed] |
| 7. | Tsuda M, Tanaka S. Roles for crk in cancer metastasis and invasion. Genes Cancer. 2012;3:334-340. [PubMed] [DOI] |
| 8. | Lewis BP, Burge CB, Bartel DP. Conserved seed pairing, often flanked by adenosines, indicates that thousands of human genes are microRNA targets. Cell. 2005;120:15-20. [PubMed] |
| 9. | Elbashir SM, Harborth J, Lendeckel W, Yalcin A, Weber K, Tuschl T. Duplexes of 21-nucleotide RNAs mediate RNA interference in cultured mammalian cells. Nature. 2001;411:494-498. [PubMed] |
| 10. | Shen T, Liu K, Miao D, Cao R, Zhou B, Chen P. Lentivirus-mediated RNA interference against Japanese encephalitis virus infection in vitro and in vivo. Antiviral Res. 2014;108:56-64. [PubMed] [DOI] |
| 11. | Chen S, Feng J, Ma L, Liu Z, Yuan W. RNA interference technology for anti-VEGF treatment. Expert Opin Drug Deliv. 2014; Jun 5. [Epub ahead of print]. [PubMed] |
| 12. | Shum D, Djaballah H. Plasmid-Based shRNA Lentiviral Particle Production for RNAi Applications. J Biomol Screen. 2014; Jun 17. [Epub ahead of print]. [PubMed] |
| 13. | van Cleef KW, van Mierlo JT, Miesen P, Overheul GJ, Fros JJ, Schuster S, Marklewitz M, Pijlman GP, Junglen S, van Rij RP. Mosquito and Drosophila entomobirnaviruses suppress dsRNA- and siRNA-induced RNAi. Nucleic Acids Res. 2014;42:8732-8744. [PubMed] |
| 14. | Beard PM, Griffiths SJ, Gonzalez O, Haga IR, Pechenick Jowers T, Reynolds DK, Wildenhain J, Tekotte H, Auer M, Tyers M. A loss of function analysis of host factors influencing Vaccinia virus replication by RNA interference. PLoS One. 2014;9:e98431. [PubMed] |
| 15. | Safadi R, Friedman SL. Hepatic fibrosis--role of hepatic stellate cell activation. MedGenMed. 2002;4:27. [PubMed] |
| 16. | Venugopal SK, Jiang J, Kim TH, Li Y, Wang SS, Torok NJ, Wu J, Zern MA. Liver fibrosis causes downregulation of miRNA-150 and miRNA-194 in hepatic stellate cells, and their overexpression causes decreased stellate cell activation. Am J Physiol Gastrointest Liver Physiol. 2010;298:G101-G106. [PubMed] [DOI] |
| 17. | Lo YT, Tsai YH, Wu SJ, Chen JR, Chao JC. Ginsenoside Rb1 inhibits cell activation and liver fibrosis in rat hepatic stellate cells. J Med Food. 2011;14:1135-1143. [PubMed] [DOI] |
| 18. | Rosenberg P, Sjöström M, Söderberg C, Kinnman N, Stål P, Hultcrantz R. Attenuated liver fibrosis after bile duct ligation and defective hepatic stellate cell activation in neural cell adhesion molecule knockout mice. Liver Int. 2011;31:630-641. [PubMed] [DOI] |
| 19. | Marcos LA, Terashima A, Yi P, Andrade R, Cubero FJ, Albanis E, Gotuzzo E, Espinoza JR, Friedman SL. Mechanisms of liver fibrosis associated with experimental Fasciola hepatica infection: roles of Fas2 proteinase and hepatic stellate cell activation. J Parasitol. 2011;97:82-87. [PubMed] [DOI] |
| 20. | Ping J, Gao AM, Qin HQ, Wei XN, Bai J, Liu L, Li XH, Li RW, Ao Y, Wang H. Indole-3-carbinol enhances the resolution of rat liver fibrosis and stimulates hepatic stellate cell apoptosis by blocking the inhibitor of κB kinase α/inhibitor of κB-α/nuclear factor-κB pathway. J Pharmacol Exp Ther. 2011;339:694-703. [PubMed] [DOI] |
| 21. | Ghatak S, Biswas A, Dhali GK, Chowdhury A, Boyer JL, Santra A. Oxidative stress and hepatic stellate cell activation are key events in arsenic induced liver fibrosis in mice. Toxicol Appl Pharmacol. 2011;251:59-69. [PubMed] [DOI] |
| 22. | Xu L, Hui AY, Albanis E, Arthur MJ, O'Byrne SM, Blaner WS, Mukherjee P, Friedman SL, Eng FJ. Human hepatic stellate cell lines, LX-1 and LX-2: new tools for analysis of hepatic fibrosis. Gut. 2005;54:142-151. [PubMed] |
| 24. | Ramm GA. Isolation and culture of rat hepatic stellate cells. J Gastroenterol Hepatol. 1998;13:846-851. [PubMed] |
| 25. | Chang W, Yang M, Song L, Shen K, Wang H, Gao X, Li M, Niu W, Qin X. Isolation and culture of hepatic stellate cells from mouse liver. Acta Biochim Biophys Sin (Shanghai). 2014;46:291-298. [PubMed] [DOI] |
| 26. | Harrison SA, Torgerson S, Hayashi P, Ward J, Schenker S. Vitamin E and vitamin C treatment improves fibrosis in patients with nonalcoholic steatohepatitis. Am J Gastroenterol. 2003;98:2485-2490. [PubMed] |
| 27. | Li Q, Yan Z, Li F, Lu W, Wang J, Guo C. The improving effects on hepatic fibrosis of interferon-γ liposomes targeted to hepatic stellate cells. Nanotechnology. 2012;23:265101. [PubMed] [DOI] |
| 28. | Manzia TM, Angelico R, Toti L, Bellini MI, Sforza D, Palmieri G, Orlando G, Tariciotti L, Angelico M, Tisone G. Long-term, maintenance MMF monotherapy improves the fibrosis progression in liver transplant recipients with recurrent hepatitis C. Transpl Int. 2011;24:461-468. [PubMed] [DOI] |
| 29. | Germani G, Tsochatzis E, Burroughs AK. Does MMF really slow down fibrosis of HCV recurrence in liver transplant recipients? Transpl Int. 2011;24:e77-e78. [PubMed] [DOI] |
| 30. | Gong XH, Chen C, Hou P, Zhu SC, Wu CQ, Song CL, Ni W, Hu JF, Yao DK, Kang JH. Overexpression of miR-126 Inhibits the Activation and Migration of HSCs through Targeting CRK. Cell Physiol Biochem. 2014;33:97-106. [PubMed] [DOI] |