修回日期: 2014-06-09
接受日期: 2014-06-19
在线出版日期: 2014-08-18
目的: 探讨原发性肝癌(primary hepatocellular carcinoma, PHC)患者血清及血清高密度脂蛋白(high-density lipoprotein, HDL)和低密度脂蛋白(low-density lipoprotein, LDL)的氧化和对硫酸铜诱导的氧化抵抗及小柴胡汤的抗氧化作用.
方法: 采用PHC患者、正常体检者、2型糖尿病(diabetes mellitus type 2, T2DM)患者血清和硫酸铜诱导的血清氧化体系, 采用硫代巴比妥酸比色法测定血清脂质过氧化产物丙二醛(malondialdehyde, MDA)水平, 并采用紫外分光光度法对测定血清共轭二烯氢过氧化物(conjugated diene hydroperoxide, CD)、过氧亚硝基阴离子(peroxynitrite, ONOO-)水平, 通过琼脂糖凝胶电泳法分离血清HDL和LDL, 分析HDL和LDL条带特征、电泳迁移率、MDA和CD, 分析原发性肝癌患者血清HDL和LDL的氧化和对硫酸铜诱导的氧化抵抗及小柴胡汤的抗氧化作用.
结果: PHC组血清总MDA和总CD略高于正常组和T2DM组, 加入氧化剂CuSO4后, 3组血清总MDA和总CD均显著升高(P<0.01), 小柴胡汤作用后3组血清总MDA和总CD均显著降低(P<0.01); 3组血清ONOO-无显著差异, 加入CuSO4后3组血清总ONOO-均显著升高(P<0.01), 小柴胡汤作用后, 仅T2DM组升高(P<0.05). PHC组血清HDL和LDL的MDA和CD与正常组和T2DM组比较, 无显著差别, 加入CuSO4后, HDL和LDL的MDA略有升高, HDL和LDL的CD显著升高, 小柴胡汤作用后, 均略有降低; PHC组、正常组和T2DM组HDL和LDL条带整齐、致密和颜色深, 加入CuSO4后, HDL和LDL的致密度和颜色强度均显著降低, 小柴胡汤作用后均显著改善. PHC组血清HDL和LDL迁移率均略高于正常组和T2DM组, 加入CuSO4后, 3组血清HDL和LDL迁移率略有升高, 小柴胡汤作用后, PHC组和T2DM组HDL和LDL迁移率降低, 正常组血清HDL和LDL迁移率变化不明显.
结论: PHC患者血清总氧化显著升高, HDL、LDL氧化略升高, 总氧化抵抗显著降低, HDL、LDL氧化抵抗略降低, 小柴胡汤通过显著升高PHC患者血清总氧化抵抗, 调节整体血清氧化还原微环境, 改善血清HDL和LDL氧化抵抗.
核心提示: 高密度脂蛋白(high-density lipoprotein, HDL)和低密度脂蛋白(low-density lipoprotein, LDL)是人体中重要的两类脂蛋白, 两者可因疾病、环境及精神等多种因素而发生氧化应激损伤, 已发现多种疾病如肝病、糖尿病、冠心病等均导致HDL、LDL氧化损伤, 另一方面发现HDL、LDL氧化与糖尿病、肝损伤、肝炎、肝硬化和癌症等多种疾病的发生发展密切相关, 小柴胡汤是中医临床常用方剂, 广泛用于治疗与预防多种疾病, 主要包括肝炎、肝硬化、肝癌和糖尿病等, 并发现与其有明确的抗氧化作用机制有关, 但目前尚未有小柴胡汤抗蛋白氧化方面的研究. 本研究发现原发性肝癌(primary hepatocellular carcinoma, PHC)患者血清总氧化显著升高, HDL、LDL氧化略升高, 总氧化抵抗显著降低, HDL、LDL氧化抵抗略降低, 小柴胡汤通过显著升高PHC患者血清总氧化抵抗, 调节整体血清氧化还原微环境, 改善血清HDL和LDL氧化抵抗.
引文著录: 曾晓英, 朱海龙, 刘晓秋, 徐红星. 原发性肝癌患者血清及血清高密度脂蛋白、血清低密度脂蛋白的氧化和氧化抵抗及小柴胡汤的作用. 世界华人消化杂志 2014; 22(23): 3499-3504
Revised: June 9, 2014
Accepted: June 19, 2014
Published online: August 18, 2014
AIM: To investigate the oxidation and oxidation resistance of serum and serum high-density lipoprotein (HDL) and low-density lipoprotein (LDL) in patients with primary hepatocellular carcinoma (PHC), and the anti-oxidation effect of Xiaochaihu decoction.
METHODS: Serum samples from PHC patients, normal controls and diabetes mellitus type 2 (T2DM) patients, and the copper sulfate-induced serum oxidation system were used. Thiobarbituric acid colorimetric method was used to determine malondialdehyde (MDA) level of lipid peroxidation products. Ultraviolet spectrophotometry was used for the determination of conjugated diene hydroperoxide (CD) and peroxynitrite anion (ONOO-). Agarose gel electrophoresis was used to separate HDL and LDL in serum, analyze band density and migration rate, and MDA and CD levels of HDL and LDL. The oxidation and oxidation resistance of serum and serum HDL and LDL and the antioxidant effect of Xiaochaihu decoction were than analyzed.
RESULTS: Serum levels of MDA and CD in the PHC group were slightly higher than those in the normal group and T2DM group. After CuSO4 was added, serum levels of MDA and CD in the three groups increased significantly (P < 0.01). After Xiaochaihu decoction was added, serum levels of MDA and CD in the three groups became lower significantly (P < 0.01). There was no significant difference of the serum ONOO- level of three groups, after CuSO4 were added, the serum ONOO- level of three groups increased significantly (P < 0.01), and after Xiaochaihu decoction were added there were no significant change but the level of the T2DM group increased (P < 0.05). There were no significant differences in the levels of MDA and CD of both HDL and LDL in the three groups. After CuSO4 was added, the levels of MDA of HDL and LDL rose slightly, but the levels of CD of HDL and LDL increased significantly. After Xiaochaihu decoction was added, all these were reduced slightly. The electrophoretic bands of HDL and LDL of the three groups were neat, dense regular and dark colored. After CuSO4 was added, the electrophoretic bands became significantly lower in density and color intensity. After Xiaochaihu decoction was added, all these were significantly improved. The mobility of serum HDL and LDL in the PHC group was slightly higher than that in the other two groups. After CuSO4 was added, the migration rate became higher slightly. After Xiaochaihu decoction was added, the HDL and LDL mobility in the PHC group and T2DM group was reduced, and the HDL and LDL mobility in the normal group did not change obviously.
CONCLUSION: Serum total oxidation increases significantly, HDL and LDL oxidation is elevated slightly, serum total oxidation resistance decreases significantly, and HDL and LDL oxidation resistance becomes lower slightly in PHC patients. Xiaochaihu decoction significantly increases serum total oxidation resistance, modulates the serum total oxidation-reduction environment, and improves the serum HDL and LDL oxidation resistance in PHC patients.
- Citation: Zeng XY, Zhu HL, Liu XQ, Xu HX. Oxidation and oxidation resistance of serum and serum HDL and LDL in patients with primary hepatocellular carcinoma: Anti-oxidation effect of Xiaochaihu decoction. Shijie Huaren Xiaohua Zazhi 2014; 22(23): 3499-3504
- URL: https://www.wjgnet.com/1009-3079/full/v22/i23/3499.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i23.3499
高密度脂蛋白(high-density lipoprotein, HDL)和低密度脂蛋白(low-density lipoprotein, LDL)是人体中重要的两类脂蛋白, 两者可因疾病、环境及精神等多种因素而发生氧化应激损伤, 已发现多种疾病如肝病、糖尿病、冠心病等均导致HDL、LDL氧化损伤, 另一方面发现HDL、LDL氧化与糖尿病[1,2]、肝损伤[3]、肝炎[4,5]、肝硬化[6]和癌症[7-9]等多种疾病的发生发展密切相关, 小柴胡汤是中医临床常用方剂, 广泛用于治疗与预防多种疾病, 主要包括肝炎[10]、肝硬化[11,12]、肝癌[13,14]和糖尿病[15]等, 并发现与其有明确的抗氧化作用机制[16-18]有关, 但目前尚未有小柴胡汤抗蛋白氧化方面的研究. 故本文重点研究原发性肝癌(primary hepatocellular carcinoma, PHC)患者血清总氧化、HDL和LDL氧化及CuSO4诱导的血清总氧化抵抗和HDL和LDL氧化抵抗状况, 以及小柴胡汤的抗氧化作用.
人原发性肝癌血清、2型糖尿病(diabetes mellitus type 2, T2DM)患者血清、正常健康体检者血清各13例, 由广州中医药大学第一附属医院检验科提供. 柴胡、黄芩、党参、清半夏、干姜、甘草、大枣购自广州中医药大学门诊部中药房. 3-羟甲基氨基甲烷购自广州展晨生物科技有限公司; 硼酸购自广州化学试剂厂; EDTA购自汕头市化学试剂厂; 巴比妥钠购自广州化学试剂厂; 琼脂粉购自广州威佳科技有限公司; 苏丹黑B购自广州浩玛生物科技有限公司; 二甲基亚砜购自广州威佳科技有限公司; 磷酸氢二钠购自广州化学试剂厂; 磷酸二氢钠购自广州化学试剂厂; 2-硫代巴比妥酸购自上海远帆助剂厂. 不锈钢电热蒸馏水器购自杭州蓝天化验仪器厂; 数显式电子恒温水箱购自北京医疗设备厂; 电子天平购自上海天平仪器厂; UV-754分光光度计购自上海第三分析仪器厂; 漩涡混合器购自上海精科实验有限公司; DYY-7C型电泳仪购自北京市六一仪器厂; 电泳槽由北京鼎国生物技术发展中心制; 芬兰可调式移液器(Y38302, KZ21517); 数码相机(a Canon Eos 350D digital camera).
1.2.1 小柴胡汤药剂制备: 柴胡20 g、黄芩10 g、党参10 g、清半夏10 g、甘草5 g、生姜9片、大枣6枚, 加300 mL水, 水煮, 煮沸再煎15 min, 6层纱布过滤药液; 加300 mL水再煎, 煮沸后再煎15 min, 6层纱布过滤药液, 将两次所得药液合并, 置于蒸发皿中蒸发干燥, 收集所得药粉. 称取上述中药药粉0.2 g, 加入1 mL PBS溶液, 配制成200 mg/mL的小柴胡汤药液.
1.2.2 血清和硫酸铜诱导的血清氧化体系: 将人原发性肝癌患者血清、T2DM患者血清、正常体检者血清在标号为1-3号的1.5 mL塑料管中分别注入150 μL血清, 再按以下要求添加试剂: (1)血清组: 150 μL血清+12 μL PBS; (2)血清+CuSO4组: 150 μL血清+6 μL CuSO4+6 μL PBS(CuSO4浓度为4 mmol/L); (3)血清+CuSO4+小柴胡汤组: 150 μL血清+6 μL CuSO4+6 μL小柴胡汤液(CuSO4浓度为4 mmol/L、小柴胡汤液浓度为8 mg/mL). 上述溶液混匀后, 室温下静置24 h, 然后进行一下步骤.
1.2.3 共轭二烯氢过氧化物(conjugated diene hydroperoxide, CD)、过氧亚硝基阴离子(peroxynitrite, ONOO-)检测: 参照文献[5,6]方法, 在紫外分光光度计中测量A234、A302, 分别计算CD、ONOO-数值.
1.2.4 丙二醛(malondialdehyde, MDA)检测: 按硫代巴比妥酸比色[7]方法用分光光度计测量535 nm的MDA值.
1.2.5 电泳分析: 参照文献[8]方法将步骤1.2.2的血清分别吸取, 加入10 μL EDTA, 4 ℃条件下静置24 h, 然后加入10 μL PBS, 4 ℃条件下再静置24 h, 分别加入5 μL苏丹黑B染料预染血清, 点样电泳, 测量所得胶板中高密度脂蛋白与低密度脂蛋白的条带特征和迁移率; 将3组条带中的高密度脂蛋白条带及低密度脂蛋白条带分别切下, 浸泡于4 mL 900 mL/L乙醇中24 h, 取上清液在紫外分光光度计中测量A234、A302, 分别计算高密度脂蛋白及低密度脂蛋白的CD及ONOO-值.
统计学处理 所有数据分析用SPSS12.0统计软件. 各组实验数据以mean±SD表示, 统计学显著性通过非配对Student t检验进行计算, 计算相关系数. P<0.05为差异具有统计学意义.
3组血清颜色均呈淡黄色, 无明显差别, 加入氧化剂CuSO4后, 3组血清颜色分别转变为淡绿色, 小柴胡汤作用后3组血清颜色转变为深黄色.
PHC组血清总MDA和总CD略高于正常组和T2DM组, 加入氧化剂CuSO4后, 3组血清总MDA和总CD均显著升高(P<0.01), 小柴胡汤作用后3组血清总MDA和总CD均显著降低(P<0.01); 3组血清ONOO-无显著差异, 加入CuSO4后, 3组血清总ONOO-均显著升高(P<0.01), 小柴胡汤作用后, PHC组及正常组无明显改变, T2DM组升高(P<0.05)(表1).
| MDA[nmol/(mg蛋白•mL)] | CD[OD/(mg蛋白•mL)] | ONOO-[nmol/(mg蛋白•mL)] | |
| PHC组 | |||
| 血清组 | 0.69±0.34b | 8.88±0.47b | 0.102±0.004b |
| 血清+CuSO4组 | 2.01±0.74 | 9.60±0.71 | 0.088±0.007 |
| 血清+CuSO4+小柴胡汤组 | 1.17±0.74b | 7.43±0.51b | 0.088±0.007 |
| 正常组 | |||
| 血清组 | 0.55±0.27b | 8.71±0.38b | 0.103±0.002b |
| 血清+CuSO4组 | 2.06±0.79 | 9.73±0.63 | 0.087±0.007 |
| 血清+CuSO4+小柴胡汤组 | 0.85±0.24b | 7.34±0.35b | 0.088±0.005 |
| 2型糖尿病组 | |||
| 血清组 | 0.53±0.29b | 8.35±1.30a | 0.100±0.004b |
| 血清+CuSO4组 | 2.21±0.78 | 9.45±1.86 | 0.082±0.005 |
| 血清+CuSO4+小柴胡汤组 | 0.86±0.296b | 7.12±0.96b | 0.086±0.005a |
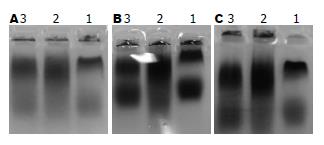
PHC组血清HDL和LDL的MDA和CD与正常组和T2DM组比较, 无显著差别, 加入CuSO4后, HDL和LDL的MDA略有升高, HDL和LDL的CD显著升高, 小柴胡汤作用后, 均略有降低; PHC组、正常组和T2DM组HDL和LDL条带整齐、致密和颜色深, 加入CuSO4后, HDL和LDL的致密度和颜色强度均显著降低, 小柴胡汤作用后均显著改善. PHC组血清HDL和LDL迁移率均略高于正常组和T2DM组, 加入CuSO4后, 3组血清HDL和LDL迁移率略有升高, 小柴胡汤作用后, PHC组和T2DM组HDL和LDL迁移率降低, 正常组血清HDL和LDL迁移率变化不明显(表2, 图1).
| MDA[nmol/(mg蛋白•mL)] | CD[OD/(mg蛋白•mL)] | 迁移率(%) | ||||
| HDL | LDL | HDL | LDL | HDL | LDL | |
| PHC组 | ||||||
| 血清组 | 0.89±1.75 | 0.43±0.32 | 0.013±0.004a | 0.005±0.006 | 20.50±5.75 | 8.83±3.66a |
| 血清+CuSO4组 | 0.56±0.35 | 0.46±0.17 | 0.016±0.004 | 0.019±0.005 | 22.33±5.61 | 14.50±5.89 |
| 血清+CuSO4+小柴胡汤组 | 0.78±0.92 | 0.45±0.21 | 0.016±0.004 | 0.019±0.006 | 21.67±6.53 | 12.00±5.55 |
| 正常组 | ||||||
| 血清组 | 0.34±0.36 | 0.44±0.10 | 0.019±0.017 | 0.014±0.012 | 20.20±2.95 | 8.00±1.41a |
| 血清+CuSO4组 | 0.48±0.15 | 0.51±0.15 | 0.019±0.014 | 0.017±0.011 | 22.60±3.13 | 14.80±3.42 |
| 血清+CuSO4+小柴胡汤组 | 0.41±0.21 | 0.49±0.27 | 0.018±0.017 | 0.017±0.012 | 22.80±4.15 | 12.40±3.36 |
| 2型糖尿病组 | ||||||
| 血清组 | 0.47±0.19 | 0.34±0.16 | 0.017±0.005c | 0.014±0.008 | 19.00±4.76 | 8.71±2.21a |
| 血清+CuSO4组 | 0.55±0.14 | 0.34±0.11 | 0.018±0.002 | 0.016±0.011 | 21.86±4.67 | 14.71±4.15 |
| 血清+CuSO4+小柴胡汤组 | 0.42±0.19 | 0.34±0.14 | 0.017±0.007 | 0.016±0.012 | 21.43±4.93 | 14.29±3.90 |
HDL和LDL均由肝脏合成, 前者主要功能是将外周组织的胆固醇运至肝脏进行代谢并排除体外, 后者由VLDL代谢转变生成, 运输内源性甘油三脂和胆固醇至肝外组织毛细血管内皮细胞和网状内皮系统代谢, 两者相互作用、相互依赖, 共同维持脂类代谢的稳态. HDL和LDL是仅次于白蛋白的血液主要蛋白成分, HDL和LDL亦是氧化损伤高敏感靶点. 正常状态下, HDL和LDL相互作用、相互依赖共同抵抗氧化, 现已明确HDL有较高的抗氧化活性, 能保护LDL抵抗氧化. 已有大量研究证实糖尿病和肝癌能导致HDL和LDL氧化[2,8], 另一方面HDL和LDL氧化亦促进糖尿病[1]和肝癌[7]的发生发展.
本实验发现, 3组血清颜色均呈淡黄色, 无明显差别, 加入氧化剂CuSO4后, 3组血清颜色分别转变为淡绿色, 小柴胡汤作用后3组血清颜色转变为深黄色.
PHC组血清总MDA和总CD略高于正常组和T2DM组, 加入氧化剂CuSO4后, 3组血清总MDA和总CD均显著升高(P<0.01), 小柴胡汤作用后3组血清总MDA和总CD均显著降低(P<0.01); 3组血清ONOO-无显著差异, 加入CuSO4后3组血清总ONOO-均显著升高(P<0.01), 小柴胡汤作用后, 仅T2DM组升高(P<0.05).
PHC组血清HDL和LDL的MDA和CD与正常组和T2DM组比较, 无显著差别, 加入CuSO4后, HDL和LDL的MDA略有升高, HDL和LDL的CD显著升高, 小柴胡汤作用后, 均略有降低; PHC组、正常组和T2DM组HDL和LDL条带整齐、致密和颜色深, 加入CuSO4后, HDL和LDL的致密度和颜色强度均显著降低, 小柴胡汤作用后均显著改善. PHC组血清HDL和LDL迁移率均略高于正常组和T2DM组, 加入CuSO4后, 3组血清HDL和LDL迁移率略有升高, 小柴胡汤作用后, PHC组与T2DM组HDL和LDL迁移率降低, 正常组血清HDL和LDL迁移率变化不明显.
CuSO4诱导的血清氧化体系是常用的药物抗氧化研究体系, 由于血清为复杂体系, 含有大量小分子抗氧化物分子如胆红素及生物大分子抗氧化物分子如白蛋白能抵抗氧化, 本实验Cu2+诱导的血清颜色变化是由抗氧化剂胆红素氧化还原变化导致的, 表明由Cu2+诱导的血清氧化抗氧化剂胆红素也参与其中. 因此, 由Cu2+诱导的血清HDL和LDL氧化及中药抗总血清氧化不明显, 但CuSO4诱导的总血清氧化及中药抗总血清氧化明显. 表明CuSO4主要诱导的总血清氧化, 而小柴胡汤主要通过抗血清整体的氧化, 调节整体血清氧化还原微环境, 改善血清HDL和LDL氧化抵抗, 其中的机制有待进一步研究.
高密度脂蛋白(high-density lipoprotein, HDL)和低密度脂蛋白(low-density lipoprotein, LDL)是人体中重要的两类脂蛋白, 两者可因多因素而发生氧化应激损伤, 已发现多种疾病可致HDL和LDL氧化损伤, 另一方面发现HDL、LDL氧化与多种疾病的发生发展密切相关; 小柴胡汤有明确的抗氧化作用.
傅晓辉, 副教授, 副主任医师, 东方肝胆外科医院.
中草药的疗效与其抗氧化作用密切相关. 中药的抗氧化作用是重要的研究方向. 小柴胡汤是预防和治疗肝病的重要方剂, 现代药理研究亦显示, 该方剂有抗氧化作用, 然而小柴胡汤对蛋白氧化的作用及机制尚未见报道.
研究显示小柴胡汤是中医临床常用方剂, 广泛用于治疗与预防多种疾病, 主要包括肝炎、肝硬化、肝癌和糖尿病等, 这与其明确的抗氧化作用机制有关.
原发性肝癌(primary hepatocellular carcinoma, PHC)患者血清氧化已改变, 小柴胡汤有抗氧化作用. 本论文重点研究PHC患者血清总氧化、HDL和LDL氧化及CuSO4诱导的血清总氧化抵抗和HDL和LDL氧化抵抗状况, 以及小柴胡汤的抗氧化作用.
蛋白质是生命活动的直接执行者, 蛋白质尤其血清蛋白对氧化损伤高度敏感, 蛋白质氧化损伤占总分子氧化的68%, 远多于脂质和核酸, 此外蛋白氧化尚能引起继发性长寿蛋白自由基的产生, 进一步加重氧化损伤, 导致氧化损伤的恶性循环. 蛋白质氧化损伤与疾病的关系受到越来越广泛的关注, 已成为临床医学和临床药理学的重要领域. 在这一领域进行中医药机制的研究有重要实际应用价值.
该文设计合理, 数据翔实可信, 为探索小柴胡汤的作用机制提供了新的临床研究资料.
编辑 田滢 电编 都珍珍
| 1. | Lopes-Virella MF, Baker NL, Hunt KJ, Lyons TJ, Jenkins AJ, Virella G. High concentrations of AGE-LDL and oxidized LDL in circulating immune complexes are associated with progression of retinopathy in type 1 diabetes. Diabetes Care. 2012;35:1333-1340. [PubMed] [DOI] |
| 2. | Ergüder IB, Karagenç N, Karaca L. Reduced antioxidant potential & sensitivity to oxidation in plasma low density lipoprotein fraction in type 2 diabetes mellitus patients. Indian J Med Res. 2006;124:207-210. [PubMed] |
| 3. | Hammad MA, Abdel-Bakky MS, Walker LA, Ashfaq MK. Oxidized low-density lipoprotein and tissue factor are involved in monocrotaline/lipopolysaccharide-induced hepatotoxicity. Arch Toxicol. 2011;85:1079-1089. [PubMed] [DOI] |
| 4. | Bieghs V, van Gorp PJ, Walenbergh SM, Gijbels MJ, Verheyen F, Buurman WA, Briles DE, Hofker MH, Binder CJ, Shiri-Sverdlov R. Specific immunization strategies against oxidized low-density lipoprotein: a novel way to reduce nonalcoholic steatohepatitis in mice. Hepatology. 2012;56:894-903. [PubMed] [DOI] |
| 5. | Yimin H, Matsuoka S, Sakurai T, Kohanawa M, Zhao S, Kuge Y, Tamaki N, Chiba H. A novel murine model for non-alcoholic steatohepatitis developed by combination of a high-fat diet and oxidized low-density lipoprotein. Lab Invest. 2012;92:265-281. [PubMed] [DOI] |
| 6. | Karadeniz G, Acikgoz S, Tekin IO, Tascýlar O, Gun BD, Cömert M. Oxidized low-density-lipoprotein accumulation is associated with liver fibrosis in experimental cholestasis. Clinics (Sao Paulo). 2008;63:531-540. [PubMed] |
| 7. | Lu J, Mitra S, Wang X, Khaidakov M, Mehta JL. Oxidative stress and lectin-like ox-LDL-receptor LOX-1 in atherogenesis and tumorigenesis. Antioxid Redox Signal. 2011;15:2301-2333. [PubMed] [DOI] |
| 8. | Fernández-Irigoyen J, Santamaría E, Sesma L, Muñoz J, Riezu JI, Caballería J, Lu SC, Prieto J, Mato JM, Avila MA. Oxidation of specific methionine and tryptophan residues of apolipoprotein A-I in hepatocarcinogenesis. Proteomics. 2005;5:4964-4972. [PubMed] |
| 9. | Motta M, Pistone G, Franzone AM, Romeo MA, Di Mauro S, Giugno I, Ruello P, Malaguarnera M. Antibodies against ox-LDL serum levels in patients with hepatocellular carcinoma. Panminerva Med. 2003;45:69-73. [PubMed] |
| 10. | Zheng N, Dai J, Cao H, Sun S, Fang J, Li Q, Su S, Zhang Y, Qiu M, Huang S. Current understanding on antihepatocarcinoma effects of xiao chai hu tang and its constituents. Evid Based Complement Alternat Med. 2013;2013:529458. [PubMed] [DOI] |
| 11. | Lee JK, Kim JH, Shin HK. Therapeutic effects of the oriental herbal medicine Sho-saiko-to on liver cirrhosis and carcinoma. Hepatol Res. 2011;41:825-837. [PubMed] [DOI] |
| 12. | Lin CC, Lin LT, Yen MH, Cheng JT, Hsing CH, Yeh CH. Renal protective effect of xiao-chai-hu-tang on diabetic nephropathy of type 1-diabetic mice. Evid Based Complement Alternat Med. 2012;2012:984024. [PubMed] [DOI] |
| 13. | Shiota G, Maeta Y, Mukoyama T, Yanagidani A, Udagawa A, Oyama K, Yashima K, Kishimoto Y, Nakai Y, Miura T. Effects of Sho-Saiko-to on hepatocarcinogenesis and 8-hydroxy-2'-deoxyguanosine formation. Hepatology. 2002;35:1125-1133. [PubMed] |
| 14. | Kitade Y, Watanabe S, Masaki T, Nishioka M, Nishino H. Inhibition of liver fibrosis in LEC rats by a carotenoid, lycopene, or a herbal medicine, Sho-saiko-to. Hepatol Res. 2002;22:196-205. [PubMed] |
| 15. | Shimizu I. Sho-saiko-to: Japanese herbal medicine for protection against hepatic fibrosis and carcinoma. J Gastroenterol Hepatol. 2000;15 Suppl:D84-D90. [PubMed] |
| 16. | Miyahara M, Tatsumi Y. [Suppression of lipid peroxidation by sho-saiko-to and its components in rat liver subcellular membranes]. Yakugaku Zasshi. 1990;110:407-413. [PubMed] |
| 17. | Sakaguchi S, Tsutsumi E, Yokota K. Preventive effects of a traditional Chinese medicine (sho-saiko-to) against oxygen toxicity and membrane damage during endotoxemia. Biol Pharm Bull. 1993;16:782-786. [PubMed] |
| 18. | Liu XQ, Hu XJ, Xu HX, Zeng XY. Xiaochaihu Decoction attenuates the vicious circle between the oxidative stress and the ALP inactivation through LPS-catecholamines interactions in gut, liver and brain during CCI4+ethanol-induced mouse HCC. BMC Complement Altern Med. 2013;13:375. [PubMed] [DOI] |