修回日期: 2014-06-04
接受日期: 2014-06-11
在线出版日期: 2014-08-08
目的: 探讨粪便中Wnt拮抗基因启动子甲基化在早期筛查大肠癌(colorectal cancer, CRC)中的意义.
方法: 采用甲基特异性PCR技术检测83例大肠肿瘤患者粪便中分泌型卷曲相关蛋白(secreted frizzled-related protein, SFRPs)和Wnt抑制因子1(Wnt inhibitory factor-1, WIF-1)基因甲基化状况.
结果: 粪便中SFRP1、SFRP2、SFRP5和WIF-1基因在大肠癌中甲基化率分别为68.8% (33/48)、56.3%(27/48)、45.8%(22/48)和60.4%(29/48); 腺瘤中分别为57.1%(20/35)、51.4%(18/35)、37.1%(13/35)和45.7%(16/35); 增生性息肉中分别为21.9%(7/32)、12.5% (4/32)、9.4%(3/32)和18.8%(6/32). 联合四种粪便基因甲基化对大肠癌和腺瘤的检测率分别为81.3%(39/48)和65.7%(23/35), 同时联合检测Dukes A期CRC和进展期腺瘤的敏感性高达81.8%(18/22), 特异性为93.3%(28/30). SFRPs和WIF-1基因甲基化与大肠癌的临床病理特征无相关性(均P>0.05). 对于Ducks A大肠癌和进展期腺瘤的检测阳性率, 组合四种Wnt拮抗基因甲基化(81.8%)明显优于粪便潜血试验(31.8%), 两者差异有统计学意义(P<0.001).
结论: 粪便中Wnt拮抗基因(SFRP1、SFRP2、SFRP5和WIF-1)甲基化有望成为早期筛查大肠癌的一种非侵入性的生物学标志物.
核心提示: 目前大肠癌(colorectal cancer, CRC)的筛查方式由于各自的缺陷均不能成为理想的筛查方式, 限制了在早期筛查CRC和腺瘤中的应用. Wnt途径异常激活是CRC的早期事件. 粪便中Wnt拮抗基因甲基化有可能成为早期筛查的一种非侵入性检测标志物, 在早期筛查和诊断中具有潜在的应用价值.
引文著录: 张虎, 朱尤庆, 吴亚琼, 张平, 江军, 袁林, 李静, 齐健. 人粪便DNA甲基化对大肠癌的早期诊断价值. 世界华人消化杂志 2014; 22(22): 3201-3207
Revised: June 4, 2014
Accepted: June 11, 2014
Published online: August 8, 2014
AIM: To investigate the role of promoter hypermethylation of Wnt-antagonist genes in fecal DNA as non-invasive biomarkers for early screening of colorectal cancer (CRC).
METHODS: The methylation-specific PCR assay (MSP) was performed to analyze the methylation status of secreted frizzled-related protein (SFRPs) and Wnt inhibitory factor-1 (WIF-1) gene promoters in fecal samples from 83 subjects with colorectal tumors.
RESULTS: Hypermethylation of SFRP1, SFRP2, SFRP5 and WIF-1 in fecal samples was detected in 68.8% (33/48), 56.3% (27/48), 45.8% (22/48) and 60.4% (29/48) of 48 CRCs; 57.1% (20/35), 51.4% (18/35), 37.1% (13/35) and 45.7% (16/35) of adenomas; 21.9% (7/32), 12.5% (4/32), 9.4% (3/32) and 18.8% (6/32) of hyperplastic polyps. The sensitivity and specificity of combined detection of promoter hypermethylation of the four genes for detection of Ducks A stage of CRCs and advanced adenomas were 81.8% (18/22) and 93.3% (28/30), respectively. The promoter hypermethylation status of SFRP1, 2, 5 and WIF-1 in fecal samples had no significant correlation with clinicopathological characteristics (P > 0.05 for all). Compared with fecal occult blood test (FOBT), with a detection rate of 31.8%, hypermethylated Wnt-antagonist genes were detected in 81.8% of Ducks A stage of CRCs and advanced adenomas (P < 0.001).
CONCLUSION: Hypermethylated of SFRP1, SFRP2, SFRP5 and WIF-1 genes in fecal samples are likely to be biomarkers for early detection of colorectal tumors.
- Citation: Zhang H, Zhu YQ, Wu YQ, Zhang P, Jiang J, Yuan L, Li J, Qi J. Value of fecal DNA methylation analysis in early diagnosis of colorectal cancer. Shijie Huaren Xiaohua Zazhi 2014; 22(22): 3201-3207
- URL: https://www.wjgnet.com/1009-3079/full/v22/i22/3201.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i22.3201
大肠癌(colorectal cancer, CRC)为消化系的常见恶性肿瘤. 在世界范围内, 其死亡率已位于恶性肿瘤第3位, 在美国已位于第2位[1], 我国也已上升至第5位[2]. 在美国, 过去15年内, 由于筛查的普及CRC发生率每年下降2%-3%[3], 表明适当的筛查方式可以有效地降低CRC的发生率, 但尽管如此, 早期大肠癌的发现率仍然不足5%, 探索早期大肠癌的筛查方法仍然是全世界肿瘤研究者共同努力的方向. 近年来研究发现, Wnt信号通路在调控细胞生长、运动和分化的关键途径以及肿瘤增生、细胞凋亡等生命过程中发挥重要作用[4]. Wnt途径异常激活与人类多种肿瘤发生密切相关, 如头颈部肿瘤、乳腺癌、膀胱癌、间皮瘤等, 大肠癌尤其常见[5-11]. 分泌型卷曲相关蛋白家族(secreted frizzled-related protein, SFRPs)和Wnt抑制因子-1(Wnt inhibitory factor-1, WIF-1)是Wnt途径的细胞外拮抗物, 直接与Wnt反应, 从而抑制Wnt信号传导. Wnt途径异常激活与其拮抗物失活密切相关. 我们的前期研究显示, 大肠肿瘤组织中SFRPs和WIF-1基因甲基化是大肠肿瘤发生中常见的早期事件, 在大肠肿瘤中存在高频率甲基化[12]. 因此, 本研究通过检测大肠癌和大肠良性病变患者粪便中Wnt拮抗基因甲基化的状况, 探讨粪便中Wnt拮抗基因异常甲基化作为大肠癌筛选标志物的可行性.
粪便样本取自武汉大学中南医院2012-03/2013-03外科手术和结肠镜检测者. 大肠癌48例, 男24例, 女24例, 年龄范围为19-86岁; 大肠良性病变67例(包括腺瘤35例, 增生性息肉32例), 男40例, 女27例, 年龄范围为25-79岁. 30例对照为全结肠镜检查均为阴性者, 男11例, 女19例, 年龄范围为21-82岁. 所有临床标本诊断均得到病理证实. 所有病例均无肠道及其他部位肿瘤病史; 大肠癌患者均未行术前放疗或化疗. 粪便样本排出后立即置入-80 ℃冰箱冰冻保存. 按照国际抗癌联盟的TNM系统进行肿瘤分期. 进展期腺瘤包括腺瘤大小>10 mm, 或腺瘤中含有高级别不典型增生或绒毛成分. 本研究定义早期大肠肿瘤为Dukes A期CRC或进展期腺瘤[13]. 粪便样本均检测粪便潜血试验(fecal occult blood test, FOBT). 所有样本均取得受检者的知情同意, 并被武汉大学伦理委员会批准.
1.2.1 粪便DNA提取: 按QIAamp粪便DNA提取试剂盒说明书提取粪便标本中人类基因组DNA, 并对提取的DNA扩增β肌动蛋白基因(β-actin), 引物序列为上游: 5'-TGGTGATGGAGGAGGCTCAGCAAGT-3', 下游: 5'-AGCCAATGGGACCTGCTCCTCCCTTGA-3', 扩增产物长度为133 bp, 由上海生工生物工程公司合成.
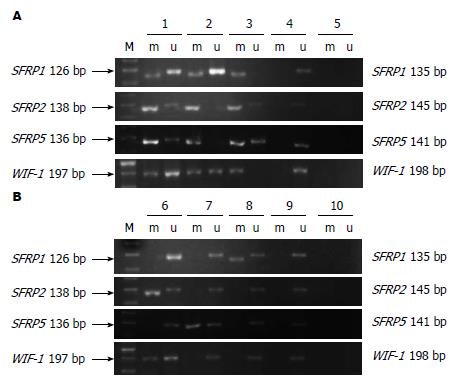
1.2.2 甲基化特异性PCR(methylation specific PCR, MSP): 原理是提取的DNA经亚硫酸氢盐处理后, DNA序列中的未发生甲基化的胞嘧啶转变为尿嘧啶, 而发生甲基化的胞嘧啶则保持不变, 然后以处理后的DNA产物作为模板, 加入甲基化特异性的引物或非甲基化特异性的引物, 随后进行特异性的PCR扩增, 只有结合完全的片段最终才能扩增出产物. DNA的亚硫酸氢钠修饰及纯化回收主要根据Herman等[14]报道的方法, 并加以改进. 修饰后DNA分别用各基因的甲基化、非甲基化引物扩增, 各基因引物序列参照前期研究[12]. 3%琼脂糖凝胶电泳检测, 凝胶成像系统(SynGene GGM, UK)摄片, 配套软件(SynGene GeneTools, UK)分析结果.
1.2.3 粪便隐血试验: 所有粪便标本行粪便隐血试验(胶体金法, 万华普曼生物工程有限公司生产). 其原理为双抗体夹心法, 试剂中含有被预先固定于膜上测试区的抗血红蛋白单克隆抗体和控制区的相应抗体.
统计学处理 采用SPSS17.0软件进行统计分析, 数据比较采用χ2检验, P<0.05为差异有统计学意义.
不同粪便标本中SFRP1、SFRP2、SFRP5和WIF-1基因启动子甲基化情况如图1和表1. CRC和腺瘤间SFRP1、SFRP2、SFRP5和WIF-1的甲基化率差异均无统计学意义(均P>0.05); 腺癌、腺瘤与正常对照及增生性息肉比较, 差异均有统计学意义(均P<0.05); 比较增生性息肉和正常对照, 其中SFRP1和SFRP2甲基化率差异有统计学意义(P<0.05), 而SFRP5和WIF-1差异无统计学意义(P>0.05). 39例CRC和23例腺瘤患者粪便中至少有一个基因可以检测到高甲基化.
| 分组 | n | SFRP1 | SFRP2 | SFRP5 | WIF-1 | 合计1 |
| CRC | 48 | 68.8 | 56.3 | 45.8 | 60.4 | 81.3 |
| Dukes A-B期 | 27 | 66.7 | 55.6 | 44.4 | 66.7 | 81.5 |
| Dukes A期 | 7 | 57.1 | 71.4 | 42.9 | 57.1 | 85.7 |
| Dukes B期 | 20 | 70.0 | 50.0 | 45.0 | 70.0 | 80.0 |
| Dukes C-D期 | 21 | 71.4 | 57.1 | 47.6 | 52.4 | 81.0 |
| Dukes C期 | 14 | 71.4 | 57.1 | 50.0 | 50.0 | 71.4 |
| Dukes D期 | 7 | 71.4 | 57.1 | 42.9 | 57.1 | 100 |
| 腺瘤 | 35 | 57.1 | 51.4 | 37.1 | 45.7 | 65.7 |
| 进展期 | 15 | 66.7 | 60.0 | 46.7 | 53.3 | 80.0 |
| 非进展期 | 20 | 45.0 | 40.0 | 25.0 | 35.0 | 55.0 |
| 增生性息肉 | 32 | 21.9 | 12.5 | 9.4 | 18.8 | 34.4 |
| 正常对照 | 30 | 3.3 | 0.0 | 0.0 | 3.3 | 6.7 |
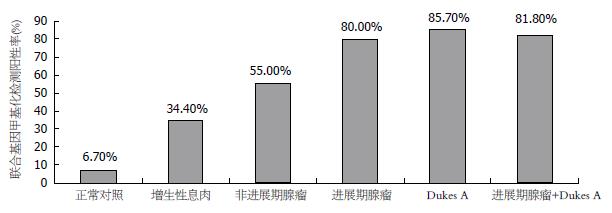
联合4种粪便基因甲基化对大肠癌检测率为81.3%(39/48), 其中, 检测Dukes A期CRC的阳性率达到了85.7%(6/7), 而Dukes B-D期CRC的阳性率为80.5%(33/41); 对大肠腺瘤的检测率为65.7%(23/35), 其中, 对非进展期腺瘤的检测阳性率为55%(11/20), 而检测进展期腺瘤的阳性率达到80.0%(12/15). 联合检测Dukes A期CRC和进展期腺瘤的阳性率高达81.8%(图2). Dukes A期CRC和进展期腺瘤、非进展期腺瘤和增生性息肉间比较, 联合4种粪便基因的甲基化率差异均无统计学意义(均P>0.05); Dukes A期CRC、进展期腺瘤与正常对照、增生性息肉, 以及增生性息肉和正常对照间比较, 差异均有统计学意义(均P<0.05).
大肠癌粪便DNA中SFRP1、SFRP2、SFRP5和WIF-1基因启动子甲基化与大肠癌患者的性别、年龄、肿瘤部位、Duke分期及远处转移均无明显相关性(均P>0.05)(表2).
| 临床特征 | n | 甲基化状况 | |||||||
| SFRP1 | SFRP2 | SFRP5 | WIF-1 | ||||||
| M | U | M | U | M | U | M | U | ||
| 性别 | |||||||||
| 男 | 24 | 17 | 7 | 14 | 10 | 12 | 12 | 17 | 7 |
| 女 | 24 | 16 | 8 | 13 | 11 | 10 | 14 | 12 | 12 |
| 年龄(岁) | |||||||||
| >55 | 32 | 24 | 8 | 18 | 14 | 17 | 15 | 21 | 11 |
| ≤55 | 16 | 9 | 7 | 9 | 7 | 5 | 11 | 8 | 8 |
| 部位 | |||||||||
| 左半结肠 | 32 | 23 | 9 | 18 | 14 | 14 | 18 | 21 | 11 |
| 右半结肠 | 16 | 10 | 6 | 9 | 7 | 8 | 8 | 8 | 8 |
| Duke分期 | |||||||||
| Dukes A-B期 | 27 | 18 | 9 | 15 | 12 | 12 | 15 | 18 | 9 |
| Dukes C-D期 | 21 | 15 | 6 | 12 | 9 | 10 | 11 | 11 | 10 |
| 淋巴转移 | |||||||||
| 是 | 21 | 15 | 6 | 12 | 9 | 10 | 11 | 11 | 10 |
| 否 | 27 | 18 | 9 | 15 | 12 | 12 | 15 | 18 | 9 |
| 远处转移 | |||||||||
| 是 | 7 | 5 | 2 | 4 | 3 | 3 | 4 | 4 | 3 |
| 否 | 41 | 28 | 13 | 23 | 18 | 19 | 22 | 25 | 16 |
48例CRC患者粪便标本中, Wnt拮抗基因检测的阳性率为81.3%, 相应标本的FOBT阳性率为56.3%, P = 0.008, 两者差异有统计学意义; 其中, 对于检测Dukes A期CRC, 两者差异有统计学意义(P = 0.031), 而检测Dukes B-D期CRC, 两者差异无统计学意义(P>0.05). Wnt拮抗基因甲基化对于腺瘤的检测率为65.7%, 而相应样本中FOBT阳性率仅为25.7%, 两者差异有统计学意义(P<0.001). 但两者在增生性息肉和正常对照的粪便标本的阳性率无统计学意义(表3).
| 分组 | n | 联合甲基化 | FOBT | P值 |
| CRC | 48 | 81.3 | 56.3 | 0.008 |
| Dukes A-B期 | 27 | 81.5 | 51.9 | 0.021 |
| Dukes A期 | 7 | 85.7 | 28.5 | 0.031 |
| Dukes B期 | 20 | 80.0 | 60.0 | 0.168 |
| Dukes C-D期 | 21 | 81.0 | 61.9 | 0.172 |
| Dukes C期 | 14 | 71.4 | 57.1 | 0.430 |
| Dukes D期 | 7 | 100.0 | 71.4 | 0.127 |
| 腺瘤 | 35 | 65.7 | 25.7 | <0.001 |
| 进展期 | 15 | 80.0 | 33.3 | 0.010 |
| 非进展期 | 20 | 55.0 | 20.0 | 0.022 |
| 增生性息肉 | 32 | 34.4 | 15.6 | 0.083 |
| 正常对照 | 30 | 6.7 | 3.3 | 0.554 |
大肠癌的发病是遗传性改变和表观遗传改变地不断地累积的结果[15], 涉及染色体不稳定性, 微卫星不稳定及基因甲基化的改变, 其中DNA甲基化是肿瘤发生机制中重要的分子机制[16]. 大肠癌表现出高频率的基因甲基化[17], 尤其在早期阶段, 表观遗传改变导致的基因沉默起着重要的调控作用. 研究证实, 启动子CpG岛的甲基化导致基因沉默是抑癌基因失表达的主要机制之一[17].
研究发现多种肿瘤SFRPs、WIF-1表达下调, 但尚未发现肿瘤中存在Wnt拮抗基因突变、缺失等遗传性改变, 90%以上的大肠癌存在Wnt信号转导通路的激活[9,18]. 而本研究发现联合4种基因诊断大肠肿瘤明显高于单个基因, 在大肠腺瘤和腺癌患者粪便中甲基化率分别为81.3%和65.7%, 而在早期肿瘤中甲基化阳性率高达81.8%, 提示Wnt拮抗基因在大肠肿瘤中存在高频率甲基化, 尤其是早期大肠肿瘤. 因此, SFRPs、WIF-1基因甲基化失活导致Wnt途径异常激活, 可能是大肠肿瘤发生中常见的早期事件, 可能是正常大肠黏膜发生恶变的基础.
根据Wnt拮抗剂不同的作用机制分为两类: 一类包括SFRPs、WIF-1和Cerberus, 主要是通过与Wnt蛋白结合从而改变Wnt与Wnt受体复合物结合的能力[19,20]; 另一类包括DKK家族中的某些成员, 通过结合低密度脂蛋白受体相关蛋白5/6(low-density liprotein receptor-related protein 5/6, LRP5/6)来抑制Wnt信号通路[21]. 细胞外拮抗物失活将导致Wnt途径异常激活. SFRPs阻止Wnt信号的转导机制可能为: 一是与Wnt蛋白直接作用阻止他们连接到Frizzled配体上; 二是与Frizzled一起形成无功能的复合体. 而WIF-1通过直接与Wnt蛋白相连, 阻断Wnt与Frizzled(Fz)受体及辅助受体LRP5/6的结合, 使细胞质中的β-catenin由于磷酸化而不能积累, 进而阻断Wnt信号的传导途径[22].
本研究显示, 在大肠肿瘤的粪便标本中SFRPs和WIF-1均具有高频甲基化, 并与其临床病例特征无明显相关性, 与前期研究一致[12,23]. 大肠腺瘤被认为是CRC最重要的癌前病变. 据统计, 在人的一生中大约有50%的人将发展为腺瘤, 但只要6%的腺瘤会转变为腺癌[24,25]. 本研究结果显示, 粪便基因甲基化对进展期腺瘤的阳性率(80.0%)明显高于非进展期腺瘤(55%), 而非进展期腺瘤和增生性息肉无统计学差异, 提示可能存在增生性息肉-腺瘤-腺癌的演变, 促进了大肠癌的组织学进展. Wnt拮抗基因甲基化对于Dukes A期大肠癌和进展期腺瘤的检测率分别为85.7%(6/7)和80.0%(12/15), 可见, 粪便Wnt拮抗基因甲基化诊断早期大肠肿瘤的敏感性达到81.8%, 特异性为93.3%. 正常对照中出现异常甲基化, 可能是正常对照的组织出现癌前隐窝病灶, 黏膜处于病变的早期, 且病变较小, 内镜下未发现. 因此, 粪便中Wnt拮抗基因出现异常甲基化的患者有可能是大肠癌的高危人群, 需要长期的临床跟踪和随访.
FOBT是目前应用最为广泛, 同时也是一种简单、快速的大肠肿瘤的筛查方法. FOBT作为CRC筛查的有效性已得到循证医学的证实[26]. 虽然FOBT能适当减低CRC的死亡率, 但对于CRC的发生率影响较小, 主要原因是对于癌前病变敏感性较低[27]. 本研究结果表明, 对于Dukes A期CRC和进展期腺瘤的阳性率, 粪便Wnt拮抗基因甲基化阳性率(81.8%)明显优于FOBT(31.8%), 差异有统计学意义(P<0.001). 推测原因可能为粪便中肿瘤细胞的脱落是一个持续的过程, 而早期肿瘤的出血是间断性[28,29]. 因此, 基因甲基化可以作为结肠镜的一种辅助检查降低医疗成本, 提高患者的依从性[30-32].
总之, 粪便Wnt拮抗基因甲基化检测将为大肠癌的筛查提供一种新的非侵入性筛查方法, 粪便SFRP1、SFRP2、SFRP5和WIF-1基因甲基化有可能作为早期筛查诊断大肠癌的有效生物学指标.
大肠癌(colorectal cancer, CRC)为消化系的常见恶性肿瘤. 在世界范围内, 其死亡率已位于恶性肿瘤第3位, 在美国已位于第2位, 我国也已上升至第5位. 尽管由于筛查的普及, 过去15年内, 美国CRC发生率每年下降2%-3%, 但早期大肠癌的发现率仍然不足5%, 探索早期大肠癌的筛查方法仍然是全世界肿瘤研究者共同努力的方向.
樊晓明, 教授,主任医师, 复旦大学附属金山医院消化科
表基因机制是一种可遗传的基因功能调控方式, 他不改变基因序列. DNA异常甲基化会引起基因表达紊乱, 导致肿瘤的发生, 并且出现在肿瘤发生的早期阶段, 有可能作为肿瘤早期诊断的标志. 分泌型卷曲相关蛋白家族(secreted frizzled-related protein, SFRPs)、Wnt抑制因子-1(Wnt inhibitory factor-1, WIF-1)是Wnt途径胞外拮抗物, 能通过不同的机制直接与Wnt反应, 或与Frizzled受体形成无作用的复合体, 抑制Wnt途径, 与人类多种肿瘤发生密切相关, 其中大肠癌尤其常见.
Wnt途径异常激活是大肠癌的早期事件, 与大肠癌细胞的生长、增殖和肿瘤细胞凋亡的抑制密切相关. 我们前期的研究显示, SFRPs和WIF-1基因启动子在正常大肠黏膜不存在甲基化, 而在早期大肠癌组织中具有高频甲基化.
采用甲基特异性PCR技术检测大肠癌和大肠良性病变患者粪便中Wnt拮抗基因甲基化的状况. 同时, 比较粪便异常基因甲基化和粪便潜血试验对于检测早期大肠癌的阳性率.
我们研究显示, 检测粪便中Wnt拮抗基因(SFRP1、SFRP2、SFRP5和WIF-1)甲基化有望成为早期筛查大肠癌的一种非侵入性的生物学标志.
Wnt拮抗基因分为两类: 一类包括SFRPs(SFRP1-5)、WIF-1和Cerberus, 主要是通过与Wnt蛋白结合从而改变Wnt与Wnt受体复合物结合的能力; 另一类包括DKK家族中的某些成员, 通过结合低密度脂蛋白受体相关蛋白5/6(low-density liprotein receptor-related protein 5/6, LRP5/6)来抑制Wnt信号通路.
本文探讨了粪便中Wnt拮抗基因启动子甲基化在早期筛查大肠癌中的意义. 结果提示组合四种Wnt拮抗基因甲基化阳性率明显优于粪便潜血试验, 表明粪便Wnt拮抗基因甲基化有望成为早期筛查大肠癌的一种非侵入性的生物学标志.
编辑 郭鹏 电编 闫晋利
| 1. | Bardhan K, Liu K. Epigenetics and colorectal cancer pathogenesis. Cancers (Basel). 2013;5:676-713. [PubMed] [DOI] |
| 2. | 赖 少清, 鞠 凤环, 王 贵齐, 贺 舜, 倪 晓光, 张 蕾, 于 桂香, 张 月明, 李 晓燕. 2004-2008年704例大肠癌临床流行特征. 中国肿瘤. 2010;19:111-113. |
| 3. | Kohler BA, Ward E, McCarthy BJ, Schymura MJ, Ries LA, Eheman C, Jemal A, Anderson RN, Ajani UA, Edwards BK. Annual report to the nation on the status of cancer, 1975-2007, featuring tumors of the brain and other nervous system. J Natl Cancer Inst. 2011;103:714-736. [PubMed] [DOI] |
| 4. | Fodde R, Smits R, Clevers H. APC, signal transduction and genetic instability in colorectal cancer. Nat Rev Cancer. 2001;1:55-67. [PubMed] [DOI] |
| 5. | Fendri A, Khabir A, Hadri-Guiga B, Sellami-Boudawara T, Daoud J, Frikha M, Ghorbel A, Gargouri A, Mokdad-Gargouri R. Epigenetic alteration of the Wnt inhibitory factor-1 promoter is common and occurs in advanced stage of Tunisian nasopharyngeal carcinoma. Cancer Invest. 2010;28:896-903. [PubMed] [DOI] |
| 6. | Wissmann C, Wild PJ, Kaiser S, Roepcke S, Stoehr R, Woenckhaus M, Kristiansen G, Hsieh JC, Hofstaedter F, Hartmann A. WIF1, a component of the Wnt pathway, is down-regulated in prostate, breast, lung, and bladder cancer. J Pathol. 2003;201:204-212. [PubMed] [DOI] |
| 7. | Voorham QJ, Janssen J, Tijssen M, Snellenberg S, Mongera S, van Grieken NC, Grabsch H, Kliment M, Rembacken BJ, Mulder CJ. Promoter methylation of Wnt-antagonists in polypoid and nonpolypoid colorectal adenomas. BMC Cancer. 2013;13:603. [PubMed] [DOI] |
| 8. | Qi J, Zhu YQ, Luo J, Tao WH. Hypermethylation and expression regulation of secreted frizzled-related protein genes in colorectal tumor. World J Gastroenterol. 2006;12:7113-7117. [PubMed] |
| 9. | Suzuki H, Watkins DN, Jair KW, Schuebel KE, Markowitz SD, Chen WD, Pretlow TP, Yang B, Akiyama Y, Van Engeland M. Epigenetic inactivation of SFRP genes allows constitutive WNT signaling in colorectal cancer. Nat Genet. 2004;36:417-422. [PubMed] [DOI] |
| 10. | Lee AY, He B, You L, Dadfarmay S, Xu Z, Mazieres J, Mikami I, McCormick F, Jablons DM. Expression of the secreted frizzled-related protein gene family is downregulated in human mesothelioma. Oncogene. 2004;23:6672-6676. [PubMed] [DOI] |
| 11. | Zou H, Molina JR, Harrington JJ, Osborn NK, Klatt KK, Romero Y, Burgart LJ, Ahlquist DA. Aberrant methylation of secreted frizzled-related protein genes in esophageal adenocarcinoma and Barrett's esophagus. Int J Cancer. 2005;116:584-591. [PubMed] [DOI] |
| 13. | Ahlquist DA, Zou H, Domanico M, Mahoney DW, Yab TC, Taylor WR, Butz ML, Thibodeau SN, Rabeneck L, Paszat LF. Next-generation stool DNA test accurately detects colorectal cancer and large adenomas. Gastroenterology. 2012;142:248-256; quiz e255-256. [PubMed] [DOI] |
| 14. | Herman JG, Graff JR, Myöhänen S, Nelkin BD, Baylin SB. Methylation-specific PCR: a novel PCR assay for methylation status of CpG islands. Proc Natl Acad Sci U S A. 1996;93:9821-9826. [PubMed] |
| 15. | Goel A, Boland CR. Epigenetics of colorectal cancer. Gastroenterology. 2012;143:1442-1460.e1. [PubMed] [DOI] |
| 16. | Akhavan-Niaki H, Samadani AA. DNA methylation and cancer development: molecular mechanism. Cell Biochem Biophys. 2013;67:501-513. [PubMed] [DOI] |
| 17. | Esteller M. Epigenetics in cancer. N Engl J Med. 2008;358:1148-1159. [PubMed] [DOI] |
| 18. | Esteller M, Corn PG, Baylin SB, Herman JG. A gene hypermethylation profile of human cancer. Cancer Res. 2001;61:3225-3229. [PubMed] |
| 19. | Jones SE, Jomary C. Secreted Frizzled-related proteins: searching for relationships and patterns. Bioessays. 2002;24:811-820. [PubMed] [DOI] |
| 20. | Hsieh JC, Kodjabachian L, Rebbert ML, Rattner A, Smallwood PM, Samos CH, Nusse R, Dawid IB, Nathans J. A new secreted protein that binds to Wnt proteins and inhibits their activities. Nature. 1999;398:431-436. [PubMed] [DOI] |
| 21. | Brott BK, Sokol SY. Regulation of Wnt/LRP signaling by distinct domains of Dickkopf proteins. Mol Cell Biol. 2002;22:6100-6110. [PubMed] |
| 22. | Kawano Y, Kypta R. Secreted antagonists of the Wnt signalling pathway. J Cell Sci. 2003;116:2627-2634. [PubMed] [DOI] |
| 23. | Qi J, Zhu YQ. Targeting the most upstream site of Wnt signaling pathway provides a strategic advantage for therapy in colorectal cancer. Curr Drug Targets. 2008;9:548-557. [PubMed] |
| 24. | Jemal A, Siegel R, Ward E, Hao Y, Xu J, Murray T, Thun MJ. Cancer statistics, 2008. CA Cancer J Clin. 2008;58:71-96. [PubMed] [DOI] |
| 25. | He B, Reguart N, You L, Mazieres J, Xu Z, Lee AY, Mikami I, McCormick F, Jablons DM. Blockade of Wnt-1 signaling induces apoptosis in human colorectal cancer cells containing downstream mutations. Oncogene. 2005;24:3054-3058. [PubMed] [DOI] |
| 26. | Hewitson P, Glasziou P, Irwig L, Towler B, Watson E. Screening for colorectal cancer using the faecal occult blood test, Hemoccult. Cochrane Database Syst Rev. 2007;CD001216. [PubMed] [DOI] |
| 27. | Tagore KS, Levin TR, Lawson MJ. The evolution to stool DNA testing for colorectal cancer. Aliment Pharmacol Ther. 2004;19:1225-1233. [PubMed] [DOI] |
| 28. | Ahlquist DA, Harrington JJ, Burgart LJ, Roche PC. Morphometric analysis of the "mucocellular layer" overlying colorectal cancer and normal mucosa: relevance to exfoliation and stool screening. Hum Pathol. 2000;31:51-57. [PubMed] |
| 29. | Ahlquist DA, Sargent DJ, Loprinzi CL, Levin TR, Rex DK, Ahnen DJ, Knigge K, Lance MP, Burgart LJ, Hamilton SR. Stool DNA and occult blood testing for screen detection of colorectal neoplasia. Ann Intern Med. 2008;149:441-450, W81. [PubMed] |
| 30. | Strul H, Kariv R, Leshno M, Halak A, Jakubowicz M, Santo M, Umansky M, Shirin H, Degani Y, Revivo M. The prevalence rate and anatomic location of colorectal adenoma and cancer detected by colonoscopy in average-risk individuals aged 40-80 years. Am J Gastroenterol. 2006;101:255-262. [PubMed] [DOI] |
| 31. | Rubenstein JH, Waljee AK, Jeter JM, Velayos FS, Ladabaum U, Higgins PD. Cost effectiveness of ulcerative colitis surveillance in the setting of 5-aminosalicylates. Am J Gastroenterol. 2009;104:2222-2232. [PubMed] [DOI] |
| 32. | Velayos FS, Liu L, Lewis JD, Allison JE, Flowers N, Hutfless S, Abramson O, Perry GS, Herrinton LJ. Prevalence of colorectal cancer surveillance for ulcerative colitis in an integrated health care delivery system. Gastroenterology. 2010;139:1511-1518. [PubMed] [DOI] |