修回日期: 2014-05-14
接受日期: 2014-05-21
在线出版日期: 2014-07-28
目的: 探讨白藜芦醇在酒精诱导的HepG2细胞凋亡中的调节能力, 揭示白藜芦醇抗酒精性肝损伤的作用机制.
方法: 白藜芦醇预处理HepG2细胞24 h后, 用酒精诱导凋亡的产生. MTT方法检测白藜芦醇处理组与非处理组HepG2细胞的细胞活力; 用ELISA试剂盒检测不同实验组的细胞内总超氧化物浓度(total superoxide)和细胞总抗氧化能力(oxygen radical antioxidant capacity, ORAC); 同时检测了含半胱氨酸的天冬氨酸蛋白水解酶3(cysteine-requiring aspartate protease, Caspase3)蛋白表达及应用荧光倒置显微镜观察了吖啶橙(acridine orange, AO)/碘化丙啶(propidium iodide, PI)染色的细胞形态学改变; 采用RT-PCR方法检测氧化应激调节凋亡通路中关键基因Caspase3, 细胞外调节蛋白激酶(extracellular regulated protein kinases, ERK), ERK激酶(mitogen-activated protein kinase kinase, MEK)和沉默信息调节因子1(silent mating type information regulation 1, SIRT-1) mRNA 的表达.
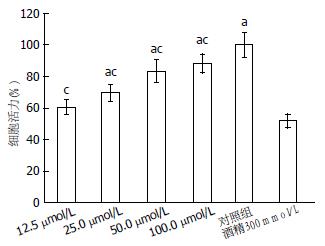
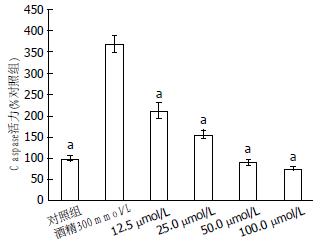
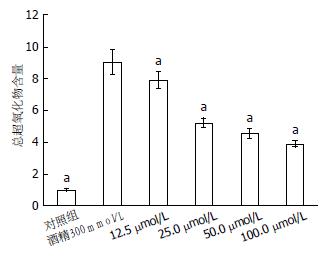
结果: MTT结果显示, 与对照组比较, 25-100 μmol/L白藜芦醇可有效对抗300 mmol/L酒精对HepG2引起的细胞不良反应使细胞保持较高的活力; AO/PI活细胞凋亡检测显示了酒精处理组有大量的橙色凋亡细胞, 而白藜芦醇预处理组橙色细胞明显减少; Caspase3结果显示不同浓度的白藜芦醇均可以降低被酒精激活的Caspase3的活性, 其Caspase3的活性降为2.12、1.46、0.90和0.75倍; 细胞内总超氧化物浓度结果显示预处理100、50、25 μmol/L白藜芦醇组含量明显低于酒精诱导组; 而未经白藜芦醇预处理的酒精诱导组ORAC(45.26±2.75)明显低于100、50、25 μmol/L白藜芦醇预处理组(65.74±1.64、68.14±6.06、70.81±6.35). RT-PCR结果显示, 与300 mmol/L酒精比较, 不同浓度白藜芦醇均可上调SIRT1与ERK mRNA表达量; 50 μmol/L和100 μmol/L白藜芦醇均可明显上调MEK mRNA表达量; 50 μmol/L和100 μmol/L白藜芦醇均可显著下调Caspase3基因mRNA 的表达量.
结论: 本研究提示酒精可诱导氧化应激相关的凋亡产生, 而白藜芦醇通过调节MEK/ERK-SIRT1通路中基因的表达发挥抗凋亡作用从而削弱酒精诱导的氧化应激及凋亡的损伤作用.
核心提示: 本课题采用HepG2细胞作为体外实验研究模型, 以白藜芦醇预处理24 h的方法研究其对酒精诱导细胞凋亡的保护作用, 结果发现白藜芦醇可以通过调节细胞外调节蛋白激酶(extracellular regulated protein kinases, ERK)/ERK激酶和沉默信息调节因子1(silent mating type information regulation 1)通路中基因的表达起到抗凋亡作用.
引文著录: 何培元, 高淑梅, 张聪, 侯志平, 马立新, 李炳庆. 白藜芦醇通过MEK/ERK-SIRT1通路的激活调节酒精诱导的HepG2细胞凋亡损伤. 世界华人消化杂志 2014; 22(21): 3011-3018
Revised: May 14, 2014
Accepted: May 21, 2014
Published online: July 28, 2014
AIM: To investigate the effects of resveratrol on alcohol induced apoptosis of HepG2 cells and to explore the possible mechanisms involved.
METHODS: HepG2 cells were pretreated with resveratrol for 24 h before treatment with alcohol to induce apoptosis. MTT assay was then performed to detect cell cytotoxicity and viability. Inverted fluorescence microscopy was used to detect cell morphologic changes after AO/PI staining. ELISA was performed to detect the presence of intracellular superoxide anion and oxygen radical antioxidant capacity levels. RT-PCR was performed to detect the mRNA expression of Caspase3, mitogen-activated protein kinase kinase (MEK), extracellular signal-regulated kinase (ERK) and silent mating type information regulation 2 homolog (SIRT1).
RESULTS: In comparison with control cells (non-treated with resveratrol), resveratrol at concentrations between 25-100 μmol/L exerted an antagonistic effect against cytotoxicity of 300 mmol/L alcohol to HepG2 cells. AO/PI apoptosis assay showed alcohol-treated cells contained many orange apoptotic cells, but resveratrol treated cells had less orange cells. Different concentrations of resveratrol could decrease the activity of activated Caspase3 in alcohol-treated cells by 2.12, 1.46, 0.90 and 0.75 times. Intracellular superoxide anion concentrations in cells treated with 100, 50 or 25 μmol/L resveratrol were obviously lower than those in alcohol-treated cells. However, the total oxygen radical antioxidant capacity was significantly higher in cells pre-treated with 100, 50, or 25 μmol/L resveratrol compared with alcohol-treated cells (65.74 ± 1.64, 68.14 ± 6.06, 70.81 ± 6.35 vs 45.26 ± 2.75). In addition, resveratrol increased the expression of SIRT1 and ERK mRNAs and decreased the expression of Caspase3 mRNA.
CONCLUSION: Alcohol induces oxidative stress related apoptosis of HepG2 cells, and resveratrol exerts anti-apoptosis effects by regulating the expression of genes involved in the MEK/ERK-SIRT1 pathway.
- Citation: He PY, Gao SM, Zhang C, Hou ZP, Ma LX, Li BQ. Resveratrol inhibits alcohol-induced apoptosis via MEK/ERK-SIRT1 signaling in human HepG2 cells. Shijie Huaren Xiaohua Zazhi 2014; 22(21): 3011-3018
- URL: https://www.wjgnet.com/1009-3079/full/v22/i21/3011.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i21.3011
凋亡是在基因调控下发生的一种程序性细胞死亡, 对胚胎发育、正常细胞群的稳定、肿瘤等其他疾病的发生进展起着重要作用[1]. 凋亡既可以在生理条件下产生, 也可以在病理刺激下发生[2]. 酒精是一种凋亡诱导剂[3], 在酒精性肝病的组织标本中可以观察到凋亡小体的存在[4]. 动物实验也证明, 酒精可以增加小鼠[5,6]、大鼠[7,8]及小型猪[9]肝细胞的细胞凋亡, 凋亡被认为是介导酒精性肝损伤的一个重要机制[10,11]. 白藜芦醇是一种多酚类植物抗毒素, 主要存在于葡萄皮、果实、籽和红葡萄酒中[12], 分子式为C14H12O3. 研究表明白藜芦醇具有抗炎、抗氧化、抗肿瘤、细胞周期调控等作用[13,14]. 酒精在体内代谢可产生大量自由基, 白藜芦醇主要通过减少自由基和抗氧化发挥治疗作用. 氧化损伤后细胞凋亡主要由Ras激活丝裂原活化蛋白激酶(mitogen-activated protein kinases, MAPKs)通路调节[15,16]. MAPK家族包含细胞外调节蛋白激酶(extracellular regulated protein kinases, ERK)、p38、c-jun氨基末端激酶(c-Jun N-terminal kinases, JNK)等多个成员, 不同成员生物学作用各不相同[17-20]. 有研究证明抗氧化剂通过Ras/ERK激酶(mitogen-activated protein kinase kinase, MEK)/ERK-沉默信息调节因子1(silent mating type information regulation 1, SIRT-1)这一通路发挥抗凋亡作用, Ras是整个通路的激活蛋白, MEK是用于激活ERK的激酶, SIRT-1是ERK下游的分子[21,22]. SIRT-1已被证明在血管内皮细胞中阻止氧化应激引起的坏死和凋亡[23,24]. 肝细胞癌细胞系(HepG2)被广泛用于肝细胞毒性、肝脂质代谢和体外代谢研究[25], 是研究酒精性肝病的良好体外模型. 目前, 还没有从凋亡角度探讨白藜芦醇对抗酒精性细胞损伤的研究. 本实验旨在揭示白藜芦醇在酒精诱导的HepG2细胞中抗凋亡能力及其作用机制.
人肝细胞癌HepG2细胞株购于美国ATCC公司; 酒精、二甲基亚砜(DMSO)购自天津化工厂; DMEM培养基、胎牛血清、MTT、吖啶橙(acridine orange, AO)/碘化丙啶(propidium iodide, PI)购自美国Sigma公司; ELISA试剂盒购自武汉华美生物工程有限公司和美国Cell Biolabs公司; 总RNA提取试剂盒、RT-PCR扩增试剂盒购自上海生物工程公司; 细胞培养箱(美国Thermo)、倒置显微镜为日本Olympus公司产品, 由承德医学院基础研究所提供.
1.2.1 细胞培养: 人肝细胞癌HepG2细胞, DMEM(Dulbecco's modified Eagle's medium)培养基, 包含10%(V/V)小牛血清和50 μg/mL庆大霉素, 37 ℃、5% CO2培养箱中培养. 细胞密度达到80%以上后种在96孔细胞培养板上, 密度为1×105个.
1.2.2 MTT细胞活力检测: 不同浓度的白藜芦醇预处理24 h的1×105 HepG2细胞, 根据预实验结果再用300 mmol/L酒精诱导24 h; 96孔板中加入20 μL MTT, 孵育4 h后, 弃去培养液, 加入100 μL DMSO, 摇床震荡15 min, 待紫色结晶充分溶解后, 酶标仪570 nm处读取吸光值.
1.2.3 荧光倒置显微镜观察AO/PI染色: 1×105的HepG2细胞种于12孔板, 白藜芦醇预处理24 h后300 mmol/L酒精诱导凋亡, 24 h后弃去培养液, AO/PI混合物(10 μL AO, 10 μL PI, 浓度均为1 mg/mL)染色. 立即置于荧光倒置显微镜(Olympus, 日本)上观察被染色的细胞, 并拍摄照片.
1.2.4 Caspase3的检测: 1×105的HepG2细胞种于96孔板, 白藜芦醇预处理24 h后300 mmol/L酒精诱导凋亡, 24 h后弃去培养液, 预冷的PBS(pH值7.2-7.4)清洗2次, 细胞裂解液裂解细胞膜, 4 ℃ 5000 g离心5 min, 收取上清液, 使用武汉华美生物工程有限公司的ELISA试剂盒检测Caspase3表达, 用荧光酶标仪在450 nm处读取吸光度值.
1.2.5 细胞内总超氧化物产物检测: 细胞种于96孔培养板后, 按如上处理, 使用碧云天超氧化物检测试剂盒检测细胞内总超氧化物产物, 并在450 nm处测定吸光度.
1.2.6 总抗化能力检测(oxygen radical antioxidant capacity, ORAC): HepG2细胞种于96孔板中, 密度为1×105细胞/孔, 白藜芦醇预处理24 h后300 mmol/L酒精诱导凋亡, 24 h后弃去培养液, 预冷PBS洗涤3次, 超声裂解细胞, 4 ℃ 10000 g离心10 min, 使用试剂盒(Cell Biolabs, INC)严格按照说明书进行操作, 37 ℃使用荧光酶标仪以激发波长480 nm, 发射波长520 nm处读取数值, 读取时间间隔为2 min, 共读取60 min.
1.2.7 RT-PCR检测细胞内ERK、MEK、SIRT-1和Caspase3 mRNA的表达: 使用生工生物工程(上海)股份有限公司总RNA提取试剂盒严格按照说明书提取HepG2细胞总RNA; 使用紫外分光光度计检测A260/230和A260/280以检测RNA纯度及计算RNA浓度. 引物设计参考文献[26,27]并在GenBank中比对, 由上海生物工程公司合成, 表1为相关基因上下游引物基本信息. 按反转录试剂盒说明书配制RT-PCR混合物. 反转录体系为: RNA 样本(50 ng/μL) 1 μL, 5×RT Buffer 4 μL, 反转录引物2 μL, 反转录酶1 μL, 双蒸水12 μL, 总共20 μL. 使用PCR仪48 ℃ 1 min, 42 ℃ 60 min, 95 ℃ 5 min进行反转录. PCR复合扩增体系为: 各基因cDNA 9.3 μL, 10.7 μL PCR反应混合物, 包含5×PCR Buffer、25 μmol/L MgCl2和上下游引物. 扩增条件: 95 ℃ 10 min, 94 ℃ 30 s, 57 ℃ 30 s, 72 ℃延长1 min, 34 个循环, 4 ℃保存. 内参基因为β-actin. 应用GeXP基因分析仪分析凋亡和氧化应激相关基因(ERK、MEK、SIRT-1和Caspase3) mRNA水平的变化.
| 基因名称 | GenBank 号 | 引物序列(斜体部分) | |
| 上游引物 | 下游引物 | ||
| ACTB | NM_001101 | AGGTGACACTATAGAATAGATCATTGCTCCTCCTGAGC | GTACGACTCACTATAGGGAAAAGCCATGCCAATCTCATC |
| ERK | NM_001040056.2 | AGGTGACACTATAGAATAGGAGCAGTATTACGACCCGA | GTACGACTCACTATAGGGAGATGTCTGAGCACGTCCAGT |
| MEK | NM_005921.1 | AGGTGACACTATAGAATA CAGAAGCTCCACCACCAAAGAT | GTACGACTCACTATAGGGA GCCATTGATCACTGCTGCAC |
| SIRT-1 | NM_001142498.1 | AGGTGACACTATAGAATA ATGTGTGTGGAGAGCGTCAACC | GTACGACTCACTATAGGGATGAGCAGAGTCTTCAGAGACAGCC |
| Caspase3 | NM_004346.3 | AGGTGACACTATAGAATA CAAGAATGGGGAGATCCTGA | AGGTGACACTATAGAATA GATAAACTTGGGGTCGGTCA |
统计学处理 采用SPSS20.1软件进行单因素方差分析, 统计结果以mean±SD表示, 计量资料采用方差分析, P<0.05为差异具有统计学意义.
图1显示了不同浓度的白藜芦醇减弱300 mmol/L酒精诱导的细胞毒性作用, 25、50和100 μmol/L的白藜芦醇与酒精组比较具有统计学意义(P<0.05).
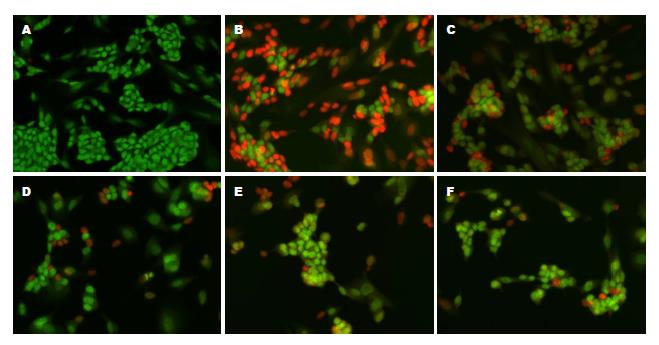
通过AO/PI染色用荧光倒置显微镜观察正常对照组、酒精诱导组和不同浓度白藜芦醇预处理组的形态学变化. AO可通过细胞膜使活细的细胞核着绿色; PI染料不能透过结构和功能正常的细胞膜, 细胞凋亡时细胞膜通透性增加, PI将细胞核被染成红色. 如图2所示, 未处理组细胞着绿色并显示了正常的形态结构; 酒精诱导组着红色, 且出现了核固缩等细胞形态变化, 标志着细胞凋亡的发生; 而白藜芦醇预处理组12.5、25、50和100 μmol/L, 大部分细胞被染成绿色, 显示了正常未受损伤细胞的形态.
图3显示, 与对照组细胞相比, 300 mmol/L精可以明显增加HepG2细胞的Caspase3活性; 而不同浓度的白藜芦醇均可以降低被酒精激活的Caspase3的活性, 其Caspase3的活性降为2.12、1.46、0.90和0.75倍, 且均有统计学差异(P<0.05).
图4显示, 与对照组比较, 酒精组细胞内总超氧化物水平明显升高. 与酒精组比较, 25、50及100 μmol/L组白藜芦醇组细胞内总超氧化物水平明显下降, 有统计学差异(P<0.05), 而最低浓度的12.5 μmol/L组总超氧化物浓度与酒精组比较无统计学差异(P>0.05).
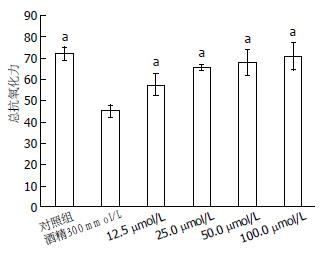
HepG2细胞经过酒精及白藜芦醇处理后抗氧化能力表现出了差异, 与对照组(72.13±3.19)比较, 酒精处理(45.26±2.75)组总抗氧化能力下降; 与酒精组比较, 白藜芦醇预处理组总抗氧化能力有不同程度升高: 12.5 μmol/L总抗氧化能力为57.54±5.24, 25 μmol/L为65.74±1.64, 50 μmol/L为68.14±6.06, 100 μmol/L为70.81±6.35. 25、50及100 μmol/L白藜芦醇预处理组与酒精处理组具有统计学差异(P<0.05)(图5).
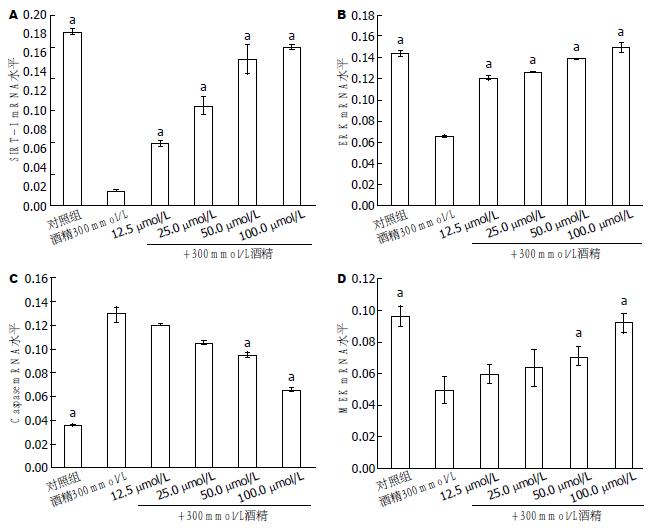
应用GeXP基因分析仪分析凋亡相关基因(ERK、MEK、SIRT-1和Caspase3) mRNA表达变化, β-actin为管家基因. 图6显示经不同浓度白藜芦醇预处理再以300 mmol/L酒精诱导后HepG2细胞内的基因表达情况. 300 mmol/L酒精明显下调SIRT-1基因mRNA水平, 而应用不同浓度白藜芦醇预处理细胞可对抗酒精的下调作用, 与酒精组比均具有统计学意义(P<0.05). MEK mRNA水平: 与对照组比较酒精组MEK mRNA水平明显下降; 与酒精组比较各不同浓度的白藜芦醇预处理组MEK mRNA水平均有所升高, 其中12.5 μmol/L和25 μmol/L组升高幅度较小无统计学差异(P>0.05), 其他两个高浓度组均有统计学差异(P<0.05). ERK mRNA水平: 用不同白藜芦醇预处理细胞, 均可对抗酒精的下调作用, 与酒精组比均具有统计学意义(P<0.05). Caspase3 mRNA水平: 300 mmol/L酒精明显上调Caspase3基因mRNA水平, 白藜芦醇可对抗酒精的上调作用, 其中12.5 μmol/L和25 μmol/L组下降幅度较小与酒精组比较无统计学差异(P>0.05), 其他两个高浓度组均有统计学差异(P<0.05).
酒精性肝损伤和非酒精性肝损伤引起的肝功能障碍都与氧化应激反应有密切关系, 应用抗氧化剂改善氧化应激程度和减轻酒精引起的肝毒性成为一种有效方式. 很多研究结果也已证明氧化应激作为核心机制可以引起肝细胞功能紊乱和凋亡[28]. 20世纪40年代发现的白藜芦醇具有多种生物学活性, 包括抗氧化、抗炎和化学防癌等功能[29,30], 但是对其调节凋亡的机制还并不是很清楚. 对白藜芦醇调节凋亡的机制很多报道都是相互矛盾的[31]. 本研究使用酒精诱导的氧化应激模型是在体外研究中被广泛使用的肝细胞损伤模型[32], 在这个模型中我们集中研究了与氧化应激相关的调节凋亡的信号通路和相关分子. 本文通过检测细胞内总超氧的产生、细胞凋亡、细胞活力、总抗氧化能力及相关基因mRNA的表达, 证明了不同浓度白藜芦醇预处理的HepG2细胞可以下调酒精诱导的细胞损伤.
Caspase是一个在细胞凋亡过程中起重要作用的蛋白酶家族. Caspase3的激活是经典的细胞凋亡途径的生物化学基础, 也是细胞凋亡过程中的一个关键酶; 另外, Caspase3在细胞核凋亡过程中也起到了关键作用, 包括染色质固缩、DNA片段化等. 文献也报道了白藜芦醇调节细胞凋亡主要通过激活Caspase3发生作用[33], 但是这种作用尚未在肝细胞中被证实. 本实验证实了300 mmol/L酒精可以明显增加HepG2细胞的Caspase3活性; 而不同浓度的白藜芦醇均可以降低被酒精激活的Caspase3的活性, 且均具有统计学意义. AO/PI活细胞凋亡检测显示了酒精处理组有大量的橙色显示凋亡的细胞, 而白藜芦醇预处理组橙色凋亡细胞明显减少.
氧化应激的产生取决于氧自由基的产生水平及抗氧化能力间的平衡. 如果氧自由基产生过多或抗氧化能力减弱就会引起氧化应激的产生. 超氧化物是最常见的活性氧自由基, 能引发体内脂质过氧化, 加快机体的衰老过程, 并可诱发癌症、心血管疾病等, 严重危害人体健康. 机体中存在多种抗氧化物, 包括抗氧化大分子、抗氧化小分子和酶等, 可以清除体内产生的各种活性氧, 以阻止活性氧诱导的氧化应激的产生, 这种总体水平体现了总抗氧化能力. 为了研究白藜芦醇抗氧化损伤的作用靶点, 本课题检测了细胞内超氧自由基水平和总抗氧化能力, 结果表明: 酒精诱导可致使细胞内活性氧水平升高而总抗氧化能力降低; 而白藜芦醇预处理细胞可以使细胞内活性氧明显减少的同时提高总抗氧化能力.
实际上, 我们已经证明了ERK的活性在白藜芦醇预处理的酒精诱导的HepG2细胞中更高更持久. 为了辨别ERK下游的靶基因, 我们研究了可能涉及的SIRT-1基因. SIRT-1是长效蛋白质-去乙酰化酶(sirtuin)家庭一员, 其在人类中的功能仍在研究中; 但是在酵母中有调节表观遗传和抑制rDNA重组的功能. 已被证明SIRT-1参与了很多生理功能的调节, 包括糖代谢、DNA修复及细胞凋亡[34]; SIRT-1也可以调节许多氧化应激因子, 比如p53、核转录因子-κB(nuclear factor kappa B, NF-κB)及转录因子[35]. 有文献报道, 在脑损伤后引起的神经细胞凋亡中, ERKs/SIRT-1间的内部关系起到了神经保护作用[36]; 也有研究表明在上皮细胞中可以通过调节ERK而发挥了SIRT-1保护作用[37]; ERK可以激活SIRT-1来阻止细胞衰老和氧化应激引起的坏死[20], 同时也有报道证明白藜芦醇可以通过激活SIRT-1而阻止代谢性疾病的发生[38].
我们已经证明酒精诱导的肝细胞中也有MEK/ERK的表达, 并且白藜芦醇预处理后会引起其表达增加. 为了更准确地找到SIRT-1表达与ERK间的关系, 在将来的研究中可以使用MEKs/ERKs抑制剂和ERK siRNA沉默子进行研究两者间的准确关系. Caspase3可以激活由外源性的死亡配体介导的细胞凋亡, 同时也可以介导内源性的线粒体和内质网相关的细胞凋亡; 但是目前研究凋亡还具有第三条途径就是通过凋亡诱导因子来实现的, 这条通路是不依赖于Caspase的, 还有待研究者们为临床根治酒精性肝病继续努力.
酒精性肝病一直是西方发达国家肝病的首要病因, 近年来我国的发病率也迅速攀升, 是全世界共同面临的健康挑战. 国内外有很多的研究者都致力于酒精性肝病发病机制及防治方法的研究, 以期能深入了解其病理生理过程并制定有效的预防和治疗方案.
王蒙, 副教授, 第二军医大学附属东方肝胆外科医院肝外综合治疗一科
在酒精性肝病的发病过程中凋亡的作用已在多项研究中被证实. 细胞内外的多条通路及其多种关键酶及其他生物学分子共同构成了调节细胞凋亡的复杂网络. 各种分子在不同疾病中所起的作用一直是近年来研究的热点. 如何把发病过程中起作用的环节作为干预的靶点应用于临床实践是研究的重点.
凋亡这种程序性细胞死亡在人体各个系统中普遍存在, 参与调控胚胎发育、肿瘤等各种病理生理过程, 近年来一直是生物学和医学研究领域的热点. 线粒体通路、内质网通路和死亡受体通路是三条经典凋亡信号传导通路, 近年来随着研究的不断深入又发现了长非编码RNA(long non-coding RNA, lncRNA)、小分子RNA(micro-RNA)等新的凋亡调控因子, 为凋亡的研究打开了新的领域.
在酒精性肝病研究领域中, 目前尚无对白藜芦醇抗肝细胞凋亡作用的相关报道.
本研究从氧化应激的角度探讨了白藜芦醇在酒精性肝病发病过程中的抗凋亡作用, 为今后的临床应用提供了可能的治疗靶点及理论依据.
吖啶橙(acridine orange, AO)/碘化丙啶(propidium iodide, PI)染色: 这是一种用于观察细胞凋亡情况的染色方法, AO这种染料可以透过结构完整功能正常的细胞膜将细胞核中的DNA染成绿色, 而PI只能通过结构及功能异常, 通透性增加的细胞膜, 最终将DNA染成红色.
本研究从观察细胞活力入手, 之后进一步检测氧化应激及凋亡情况, 最终深入到基因表达水平揭示作用机制, 研究的思维很好.
编辑 郭鹏 电编 都珍珍
| 2. | Thompson CB. Apoptosis in the pathogenesis and treatment of disease. Science. 1995;267:1456-1462. [PubMed] |
| 3. | Nanji AA. Apoptosis and alcoholic liver disease. Semin Liver Dis. 1998;18:187-190. [PubMed] [DOI] |
| 4. | Carrizzo A, Forte M, Damato A, Trimarco V, Salzano F, Bartolo M, Maciag A, Puca AA, Vecchione C. Antioxidant effects of resveratrol in cardiovascular, cerebral and metabolic diseases. Food Chem Toxicol. 2013;61:215-226. [PubMed] [DOI] |
| 5. | Song Z, Deaciuc I, Song M, Lee DY, Liu Y, Ji X, McClain C. Silymarin protects against acute ethanol-induced hepatotoxicity in mice. Alcohol Clin Exp Res. 2006;30:407-413. [PubMed] [DOI] |
| 6. | Goldin RD, Hunt NC, Clark J, Wickramasinghe SN. Apoptotic bodies in a murine model of alcoholic liver disease: reversibility of ethanol-induced changes. J Pathol. 1993;171:73-76. [PubMed] [DOI] |
| 7. | Kurose I, Higuchi H, Miura S, Saito H, Watanabe N, Hokari R, Hirokawa M, Takaishi M, Zeki S, Nakamura T. Oxidative stress-mediated apoptosis of hepatocytes exposed to acute ethanol intoxication. Hepatology. 1997;25:368-378. [PubMed] [DOI] |
| 8. | Slomiany A, Piotrowski E, Grabska M, Piotrowski J, Slomiany BL. Chronic ethanol-initiated apoptosis in hepatocytes is induced by changes in membrane biogenesis and intracellular transport. Alcohol Clin Exp Res. 1999;23:334-343. [PubMed] |
| 9. | Halsted CH, Villanueva J, Chandler CJ, Stabler SP, Allen RH, Muskhelishvili L, James SJ, Poirier L. Ethanol feeding of micropigs alters methionine metabolism and increases hepatocellular apoptosis and proliferation. Hepatology. 1996;23:497-505. [PubMed] |
| 10. | Diehl AM. Cytokines and the molecular mechanisms of alcoholic liver disease. Alcohol Clin Exp Res. 1999;23:1419-1424. [PubMed] [DOI] |
| 11. | Yacoub LK, Fogt F, Griniuviene B, Nanji AA. Apoptosis and bcl-2 protein expression in experimental alcoholic liver disease in the rat. Alcohol Clin Exp Res. 1995;19:854-859. [PubMed] |
| 12. | Renaud S, de Lorgeril M. Wine, alcohol, platelets, and the French paradox for coronary heart disease. Lancet. 1992;339:1523-1526. [PubMed] |
| 13. | Singh CK, Kumar A, Lavoie HA, Dipette DJ, Singh US. Diabetic complications in pregnancy: is resveratrol a solution? Exp Biol Med (Maywood). 2013;238:482-490. [PubMed] [DOI] |
| 14. | Polycarpou E, Meira LB, Carrington S, Tyrrell E, Modjtahedi H, Carew MA. Resveratrol 3-O-D-glucuronide and resveratrol 4'-O-D-glucuronide inhibit colon cancer cell growth: evidence for a role of A3 adenosine receptors, cyclin D1 depletion, and G1 cell cycle arrest. Mol Nutr Food Res. 2013;57:1708-1717. [PubMed] [DOI] |
| 16. | Lander HM, Milbank AJ, Tauras JM, Hajjar DP, Hempstead BL, Schwartz GD, Kraemer RT, Mirza UA, Chait BT, Burk SC. Redox regulation of cell signalling. Nature. 1996;381:380-381. [PubMed] |
| 17. | Maekawa Y, Ohishi M, Ikushima M, Yamamoto K, Yasuda O, Oguro R, Yamamoto-Hanasaki H, Tatara Y, Takeya Y, Rakugi H. Klotho protein diminishes endothelial apoptosis and senescence via a mitogen-activated kinase pathway. Geriatr Gerontol Int. 2011;11:510-516. [PubMed] [DOI] |
| 18. | Joshi MB, Philippova M, Ivanov D, Allenspach R, Erne P, Resink TJ. T-cadherin protects endothelial cells from oxidative stress-induced apoptosis. FASEB J. 2005;19:1737-1739. [PubMed] |
| 19. | van Gorp RM, Heeneman S, Broers JL, Bronnenberg NM, van Dam-Mieras MC, Heemskerk JW. Glutathione oxidation in calcium- and p38 MAPK-dependent membrane blebbing of endothelial cells. Biochim Biophys Acta. 2002;1591:129-138. [PubMed] |
| 20. | Bouloumie A, Marumo T, Lafontan M, Busse R. Leptin induces oxidative stress in human endothelial cells. FASEB J. 1999;13:1231-1238. [PubMed] |
| 21. | Runchel C, Matsuzawa A, Ichijo H. Mitogen-activated protein kinases in mammalian oxidative stress responses. Antioxid Redox Signal. 2011;15:205-218. [PubMed] [DOI] |
| 22. | Passariello CL, Zini M, Nassi PA, Pignatti C, Stefanelli C. Upregulation of SIRT1 deacetylase in phenylephrine-treated cardiomyoblasts. Biochem Biophys Res Commun. 2011;407:512-516. [PubMed] [DOI] |
| 23. | Kao CL, Chen LK, Chang YL, Yung MC, Hsu CC, Chen YC, Lo WL, Chen SJ, Ku HH, Hwang SJ. Resveratrol protects human endothelium from H(2)O(2)-induced oxidative stress and senescence via SirT1 activation. J Atheroscler Thromb. 2010;17:970-979. [PubMed] |
| 24. | Ota H, Akishita M, Eto M, Iijima K, Kaneki M, Ouchi Y. Sirt1 modulates premature senescence-like phenotype in human endothelial cells. J Mol Cell Cardiol. 2007;43:571-579. [PubMed] |
| 25. | Rivière C, Richard T, Quentin L, Krisa S, Mérillon JM, Monti JP. Inhibitory activity of stilbenes on Alzheimer's beta-amyloid fibrils in vitro. Bioorg Med Chem. 2007;15:1160-1167. [PubMed] [DOI] |
| 26. | Azmi NH, Ismail N, Imam MU, Ismail M. Ethyl acetate extract of germinated brown rice attenuates hydrogen peroxide-induced oxidative stress in human SH-SY5Y neuroblastoma cells: role of anti-apoptotic, pro-survival and antioxidant genes. BMC Complement Altern Med. 2013;13:177. [PubMed] [DOI] |
| 27. | Ismail N, Ismail M, Fathy SF, Musa SN, Imam MU, Foo JB, Iqbal S. Neuroprotective Effects of Germinated Brown Rice against Hydrogen Peroxide Induced Cell Death in Human SH-SY5Y Cells. Int J Mol Sci. 2012;13:9692-9708. [PubMed] [DOI] |
| 28. | Cesaratto L, Vascotto C, Calligaris S, Tell G. The importance of redox state in liver damage. Ann Hepatol. 2004;3:86-92. [PubMed] |
| 29. | Jang M, Cai L, Udeani GO, Slowing KV, Thomas CF, Beecher CW, Fong HH, Farnsworth NR, Kinghorn AD, Mehta RG. Cancer chemopreventive activity of resveratrol, a natural product derived from grapes. Science. 1997;275:218-220. [PubMed] |
| 30. | Cerqueira AM, Khaper N, Lees SJ, Ulanova M. The antioxidant resveratrol down-regulates inflammation in an in-vitro model of Pseudomonas aeruginosa infection of lung epithelial cells. Can J Physiol Pharmacol. 2013;91:248-255. [PubMed] [DOI] |
| 31. | Tedesco I, Russo M, Bilotto S, Spagnuolo C, Scognamiglio A, Palumbo R, Nappo A, Iacomino G, Moio L, Russo GL. Dealcoholated red wine induces autophagic and apoptotic cell death in an osteosarcoma cell line. Food Chem Toxicol. 2013;60:377-384. [PubMed] [DOI] |
| 32. | Albano E. Oxidative mechanisms in the pathogenesis of alcoholic liver disease. Mol Aspects Med. 2008;29:9-16. [PubMed] [DOI] |
| 33. | Marimuthu P, Kaur K, Kandalam U, Jasani V, Bukhari N, Nguyen M, Abdul A, Pervez FF, Rathinavelu A. Treatment of ovarian cancer cells with nutlin-3 and resveratrol combination leads to apoptosis via caspase activation. J Med Food. 2011;14:46-52. [PubMed] [DOI] |
| 34. | Rahman S, Islam R. Mammalian Sirt1: insights on its biological functions. Cell Commun Signal. 2011;9:11. [PubMed] [DOI] |
| 35. | Brunet A, Sweeney LB, Sturgill JF, Chua KF, Greer PL, Lin Y, Tran H, Ross SE, Mostoslavsky R, Cohen HY. Stress-dependent regulation of FOXO transcription factors by the SIRT1 deacetylase. Science. 2004;303:2011-2015. [PubMed] [DOI] |
| 36. | Zhao Y, Luo P, Guo Q, Li S, Zhang L, Zhao M, Xu H, Yang Y, Poon W, Fei Z. Interactions between SIRT1 and MAPK/ERK regulate neuronal apoptosis induced by traumatic brain injury in vitro and in vivo. Exp Neurol. 2012;237:489-498. [PubMed] [DOI] |
| 37. | Polidoro L, Properzi G, Marampon F, Gravina GL, Festuccia C, Di Cesare E, Scarsella L, Ciccarelli C, Zani BM, Ferri C. Vitamin D protects human endothelial cells from H2O2 oxidant injury through the Mek/Erk-Sirt1 axis activation. J Cardiovasc Transl Res. 2013;6:221-231. [PubMed] [DOI] |