修回日期: 2014-05-11
接受日期: 2014-05-19
在线出版日期: 2014-07-18
目的: 探讨白介素-28B(interleukin-28B, IL-28B)基因多态性与慢性乙型肝炎(chronic hepatitis B, CHB)病程进展的相关性.
方法: 本院门诊就诊患者分为如下组: 无症状携带者组41例, 进展性肝病组共65例; 其中CHB组46例、肝硬化组19例. 提取全基因组DNA, 并扩增IL-28B基因. 单核苷酸多态性(single nucleotide polymorphism, SNP) rs8099917及SNP rs12979860用限制性片段长度多态性法分型; 对分型结果进行统计学分析.
结果: SNP rs12979860位点CC、CT、TT 3个基因型, 组成C、T两个等位基因. 等位基因T的比例在无症状携带组、CHB组和肝硬化组中的比例分别为2.4%、8.7%和13.2%; 差异有显著性意义(χ2 = 5.47, P<0.05). SNP rs8099917位点TT、TG、GG 3个基因型, 组成T、G两个等位基因. 等位基因G的比例在无症状携带组、CHB组和肝硬化组中的比例分别为8.5%、7.6%和7.9%; 差异无统计学意义.
结论: IL-28B基因多态性可能与乙型肝炎病毒(hepatitis B virus, HBV)感染后不同免疫状态相关并影响患者病情进展加重. SNP rs12979860的等位基因T可能是预示HBV感染后病情进展的影响因素.
核心提示: 白介素-28B(interleukin-28B)基因多态性可能与乙型肝炎病毒(hepatitis B virus, HBV)感染后不同免疫状态相关并影响患者病情进展加重. 单核苷酸多态性(single nucleotide polymorphism, SNP) rs12979860的等位基因T可能是预示HBV感染后病情进展的影响因素.
引文著录: 哈明昊, 佘会元, 沈文娟, 黄钟鸣, 陈晓兰, 吴建秋, 单文艳, 何慧芳. IL-28B基因多态性与慢性乙型肝炎病程进展的相关性. 世界华人消化杂志 2014; 22(20): 2928-2932
Revised: May 11, 2014
Accepted: May 19, 2014
Published online: July 18, 2014
AIM: To determine the relationship between the interleukin-28B (IL-28B) single nucleotide polymorphisms (SNPs) rs12979860 and rs8099917 and progression of chronic hepatitis B (CHB).
METHODS: Peripheral blood samples were collected from 106 patients with chronic hepatitis B, including 41 asymptotic HBV carriers (ASC), 46 with CHB and 19 with HBV related liver cirrhosis (LC). The IL-28B gene was amplified from the chromosomal DNA and the rs8099917 SNP or rs12979860 SNP was genotyped by PCR-RLFP.
RESULTS: The distribution frequencies of T allele in the rs12979860 SNP were 2.4%, 8.7%, 13.2% in the Asc, CHB and LC groups, respectively, which showed significant differences between the three groups of patients. The distribution frequencies of G allele in the rs8099917 SNP showed no differences between the three groups of patients.
CONCLUSION: The results suggest that the rs12979860 SNP and T allele may be associated with susceptibility to chronic HBV infection. The T allele may be related with the progression of CHB.
- Citation: Ha MH, She HY, Shen WJ, Huang ZM, Chen XL, Wu JQ, Shan WY, He HF. Relationship between IL-28B single nucleotide polymorphisms and progression of chronic hepatitis B. Shijie Huaren Xiaohua Zazhi 2014; 22(20): 2928-2932
- URL: https://www.wjgnet.com/1009-3079/full/v22/i20/2928.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i20.2928
机体清除乙型肝炎病毒(hepatitis B virus, HBV)需要先天性和后天性细胞免疫和体液免疫反应的共同参与, 在这个过程中细胞因子起着非常重要的作用[1]. 干扰素(interferon, IFN)是一种人类和动物细胞在对各种病毒等因素刺激的应答中产生的具有多种功能的一类蛋白或糖蛋白, 是细胞因子家族中的重要成员, 具有抗HBV及免疫调节作用[2,3]. IFN-λ3[白介素-28B(interleukin-28B, IL-28B)]抗病毒活性与IFN-α相似, 但其表达具有组织特异性, 因此与IFN-α相比, IFN-λs用于抗病毒治疗可能产生的不良反应较少[4,5].
最近多项全基因组关联研究证实, IL-28B基因多态性与慢性乙型肝炎(chronic hepatitis B, CHB)患者IFN应答及丙型肝炎病毒(hepatitis C virus, HCV)的自发清除高度相关[6-8]. 但IL-28B基因多态性与CHB患者病情进展的相关性的研究尚不多见. 本研究拟对位于IL-28B基因上游的两个关键单核苷酸多态性(single nucleotide polymorphism, SNP)位点rs12979860和rs8099917进行检测, 探讨其与CHB患者病情进展的相关性, 分析其作为HBV感染后病程发展的预测指标的可行性.
选择2011-06/2013-06上海市第七人民医院门诊就诊患者. 严格按照中华医学会肝病学分会和感染病学分会2010年制定的《慢性乙型肝炎防治指南》进行疾病的规范化诊断, 并分为如下组: (1)无症状携带者(AsC)组, 共41例; (2)进展性肝病组: 共65例, 包括其中CHB组46例、肝硬化(cirrhosis of liver, LC)组19例. 所有研究对象均为无亲缘关系的汉族人, 均无原发性心、肺、肾及高血压等病史, 排除其他慢性肝病的致病因素存在, 如非HBV感染、自身免疫性肝炎、酒精性肝炎、脂肪肝等.
1.2.1 血液基因组DNA提取: 取5 mL EDTA抗凝血, 3000 r/min离心10 min, 将上述血细胞样品转移至一50 mL的离心管中, 加入红细胞裂解液30 mL, 37 ℃恒温水浴15-30 min. 4500 r/min离心10 min, 去除上清液, 保留白细胞沉淀. 再加入10 mL红细胞裂解液重复上述步骤1次, 以充分去除红细胞. 在振荡器上充分振荡至底部沉淀消失. 加蛋白酶K 50 μL. 再加入10 mL白细胞裂解液, 37 ℃水浴15-30 min. 放入-20 ℃冰箱或冰浴5 min, 加入冷却的蛋白沉淀剂3.3 mL, 高速振荡1 min, 4500 r/min离心10 min. 另取一干净50 mL离心管, 加入10 mL异丙醇, 将上述上清液转移至其中, 轻轻摇动, 即可见或多或少的云絮状DNA漂浮物. 4500 r/min离心15 min, 小心弃去上清, 加2 mL 750 mL/L乙醇, 4500 r/min离心15 min, 保留沉淀. 室温下干燥DNA, 加1 mL TE溶解DNA, 放在4 ℃恒温摇床中中速振摇24 h. 提取的DNA置于-20 ℃保存备用.
1.2.2 引物设计与合成: 扩增SNP rs12979860、rs8099917所用引物, 均由Primer Premier软件自行设计. 所有引物均由Invitrogen公司合成. 本研究使用的引物序列如表1.
| 引物名称 | 引物序列 |
| rs12979860 P1F | AGCAGGACAGATTGGCAAAG |
| rs12979860 P1R | CACAATTCCCACCACGAGAC |
| rs8099917 P2F | CTGGAACAAATCGTCCCAAT |
| rs8099917 P2R | TTCCTTTAGGCCTGTGGATG |
1.2.3 聚合酶链反应(PCR)条件: 反应体系均为20 μL, 10×PCR Buffer(含镁离子)1.5 μL, 25 mmol/L dNTP 0.5 μL, 目的引物各10 μmoL/L 0.5 μL, 模板DNA 100 ng/μL 0.5 μL, Taq DNA聚合酶1 U/μL 0.5 μL, 加去离子水至20 μL. 把PCR反应管置PCR仪中, 95 ℃预变性5 min后进入循环扩增, 即先95 ℃变性30 s, 58 ℃退火30 s, 68 ℃延伸1 min, 重复32个循环后, 于68 ℃再延伸10 min.
1.2.4 扩增产物的酶切鉴定分析: 以Hpy8I(MBI) 限制性酶切技术对IFN-λ3 rs12979860位点进行SNP检测. 以BsrDI(MBI)酶切限制性酶切技术对IFN-λ3 rs8099917位点进行SNP检测. 酶切后根据电泳图进行酶切分型.
统计学处理 采用SPSS10.0软件进行分析. 基因频率采用直接计数法, 组间率的比较采用χ2检验. P<0.05为差异有统计学意义.
本研究入组106例CHB患者, 无症状携带者组41例, 活动性CHB组65例, 包括CHB组46例、肝硬化组19例. 以男性为主, 各组间性别、年龄、HBV DNA水平、HBeAg及谷丙转氨酶、谷草转氨酶水平的分布差异均无统计学意义(表2).
| 临床资料 | 无症状携带组 | 慢性乙型肝炎组 | 肝硬化组 | P值 |
| n | 41 | 46 | 19 | |
| 年龄(岁) | 28.43±6.26 | 32.19±5.94 | 37.19±7.44 | 0.763 |
| 性别(男/女) | 27/14 | 30/16 | 11/8 | 0.646 |
| HBeAg(%) | 52.1 | 68.3 | 63.7 | 0.194 |
| 乙型肝炎病毒DNA(lg copies/mL) | 5.93±1.25 | 6.82±1.07 | 6.08±1.73 | 0.198 |
| 谷丙转氨酶 | 18.7±13.8 | 243.5±187.9 | 174.2±163.5 | 0.064 |
| 谷草转氨酶 | 15.4±9.8 | 189.2±83.8 | 134.7±61.8 | 0.077 |
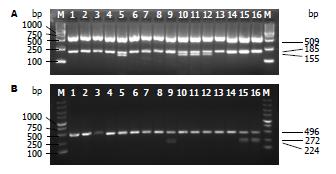
此位点CC、CT、TT 3个基因型, 组成C、T两个等位基因(图1A), 分布频率如表3. 等位基因T的比例在无症状携带组、CHB组和肝硬化组中的比例分别为2.4%、8.7%和13.2%; 差异有显著性意义(χ2 = 5.47, P<0.05). IL-28B SNP rs12979860的T等位基因可能与乙型肝炎病情进展性加重相关, T等位基因对于预测CHB感染者进展至肝硬化期有提示意义.
| 分组 | n | 基因型频率 | 等位基因 | ||
| CC | CT+TT | C | T | ||
| 无症状携带组 | 41 | 39(95.1) | 2(4.9)+0(0) | 80(97.6) | 2(2.4) |
| 慢性乙型肝炎组 | 46 | 38(82.6) | 8(17.4)+0(0) | 84(91.3) | 8(8.7) |
| 肝硬化组 | 19 | 14(73.7) | 5(26.3)+0(0) | 33(86.8) | 5(13.2) |
此位点TT、TG、GG 3个基因型, 组成T、G两个等位基因(图1B), 分布频率如表4. 等位基因G的比例在无症状携带组、CHB组和肝硬化组中的比例分别为8.5%、7.6%和7.9%; 差异无显著性意义(χ2 = 1.06, P>0.05).
| 分组 | n | 基因型频率 | 等位基因 | ||
| TT | TG+GG | T | G | ||
| 无症状携带组 | 41 | 34(82.9) | 7(17.1)+0(0) | 75(91.5) | 7(8.5) |
| 慢性乙型肝炎组 | 46 | 39(84.8) | 7(15.2)+0(0) | 85(92.4) | 7(7.6) |
| 肝硬化组 | 19 | 16(84.2) | 3(15.8)+0(0) | 35(92.1) | 3(7.9) |
HBV感染呈世界性流行, 但不同地区HBV感染的流行强度差异很大. 据世界卫生组织报道, 全球约20亿人曾感染过HBV, 其中3.5亿人为慢性HBV感染者, 每年约有100万人死于HBV感染所致的肝衰竭、肝硬化和原发性肝癌[9,10]. HBV感染人体有不同临床转归, 其临床表现各异, 机制尚不完全清楚. 目前倾向于与HBV本身(病毒含量、病毒变异、病毒基因型等)、环境因素、肝脏有关外, 宿主机体的免疫状况等具有非常重要的影响作用[11,12].
IFN根据其产生、细胞受体、应答途径和效应的不同而分为3大类型, 即Ⅰ型IFN、Ⅱ型IFN和Ⅲ型IFN. Ⅲ型IFN于2003年被发现, 包括IFN-λ1、IFN-λ2、IFN-λ3 3个亚型. 同时被国际人类基因组组织(HUGO)分别命名为IL-29 (IFN-λ1)、IL-28A(IFN-λ2)、IL-28B(IFN-λ3). IFN-λs不仅能够诱导相关基因表达多种抗病毒蛋白发挥直接抗病毒作用, 如: 2',5'-寡聚腺苷酸合成酶、MxA蛋白、PKR(依赖dsRNA的蛋白激酶)等, 而且能够通过调节DC、T细胞等的免疫功能发挥间接的抗病毒效应[13-15].
多项研究表明: 不同IL-28B基因型的CHC患者的自身免疫相关分子的表达水平存在差异, 这可能是IL-28B基因多态性决定IFN抗HCV疗效及HCV的自发清除的根本原因. 同时, 有学者的研究表明, IL-28B基因多态性同样具有预测干扰素抗HBV疗效的价值[16,17]. 但是, 对于IL-28B基因多态性是否与HBV感染后病情进展相关的研究尚不多见. 在本项研究中发现, SNP rs12979860的CT+TT基因型频率和等位基因T的频率在无症状携带组、CHB组和肝硬化组中存在显著差异. 这与其他研究者的报道一致: Al-Qahtani等[13]报道, SNP rs12979860基因多态性与HBV的自发清除密切关联, 提示等位基因C能抑制HBV的复制. 我们此项研究有助于阐明: IL-28B SNP rs12979860的T等位基因可能与乙型肝炎病情进展性加重相关, T等位基因对于预测CHB感染者进展至肝硬化期有提示意义.
在SNP rs8099917, 并未观察到各组间有显著性差异, 但有文献表明该位点等位基因G可能参与HBV复制调控. 考虑到本研究样本量较小, 增大样本量或者能观察到有意义的统计学差异.
总之, IL-28B基因多态性可能与HBV感染后不同免疫状态相关并影响患者病情进展加重. SNP rs12979860的等位基因T可能是预示HBV感染后病情进展的影响因素. 下一步的工作是通过扩大样本量来验证其预测作用的大小.
干扰素(interferon, IFN)是细胞因子家族中的重要成员, 具有抗乙型肝炎病毒(hepatitis B virus, HBV)及免疫调节作用. IFN-λ3[白介素-28B(inter-leukin-28B, IL-28B)]抗病毒活性与IFN-α相似, 但其表达具有组织特异性, 因此与IFN-α相比, IFN-λs用于抗病毒治疗可能产生的不良反应较少, 因此可能具有较广阔的使用前景.
周陶友, 副教授, 四川大学华西医院感染性疾病中心
最近多项全基因组关联研究证实, IL-28B基因多态性与慢性丙型肝炎(chronic hepatitis C, CHC)患者IFN应答及丙型肝炎病毒(hepatitis C virus, HCV)的自发清除高度相关. 但IL-28B基因多态性与慢性乙型肝炎(chronic hepatitis B, CHB)患者病情进展的相关性的研究尚不多见.
Al-Qahtani等报道, SNP rs12979860基因多态性与HBV的自发清除密切关联, 提示等位基因C能抑制HBV的复制.
在本研究中发现, SNP rs12979860的CT+TT基因型频率和等位基因T的频率在无症状携带组、CHC组和肝硬化组中存在显著差异.
IL-28B SNP rs12979860的T等位基因可能与乙型肝炎病情进展性加重相关, T等位基因对于预测慢乙肝感染者进展至肝硬化期有提示意义.
本文紧密结合临床, 有一定的参考价值.
编辑 田滢 电编 都珍珍
| 1. | Ganem D, Prince AM. Hepatitis B virus infection--natural history and clinical consequences. N Engl J Med. 2004;350:1118-1129. [PubMed] [DOI] |
| 2. | Balgoma D, Montero O, Balboa MA, Balsinde J. Calcium-independent phospholipase A2-mediated formation of 1,2-diarachidonoyl-glycerophosphoinositol in monocytes. FEBS J. 2008;275:6180-6191. [PubMed] [DOI] |
| 3. | Liang X, Bi S, Yang W, Wang L, Cui G, Cui F, Zhang Y, Liu J, Gong X, Chen Y. Epidemiological serosurvey of hepatitis B in China--declining HBV prevalence due to hepatitis B vaccination. Vaccine. 2009;27:6550-6557. [PubMed] [DOI] |
| 4. | Liang X, Bi S, Yang W, Wang L, Cui G, Cui F, Zhang Y, Liu J, Gong X, Chen Y. Evaluation of the impact of hepatitis B vaccination among children born during 1992-2005 in China. J Infect Dis. 2009;200:39-47. [PubMed] [DOI] |
| 5. | Lu FM, Zhuang H. Management of hepatitis B in China. Chin Med J (Engl). 2009;122:3-4. [PubMed] |
| 7. | Kotenko SV, Gallagher G, Baurin VV, Lewis-Antes A, Shen M, Shah NK, Langer JA, Sheikh F, Dickensheets H, Donnelly RP. IFN-lambdas mediate antiviral protection through a distinct class II cytokine receptor complex. Nat Immunol. 2003;4:69-77. [PubMed] [DOI] |
| 8. | Uzé G, Monneron D. IL-28 and IL-29: newcomers to the interferon family. Biochimie. 2007;89:729-734. [PubMed] [DOI] |
| 9. | Ank N, West H, Paludan SR. IFN-lambda: novel antiviral cytokines. J Interferon Cytokine Res. 2006;26:373-379. [PubMed] [DOI] |
| 10. | Thomas DL, Thio CL, Martin MP, Qi Y, Ge D, O'Huigin C, Kidd J, Kidd K, Khakoo SI, Alexander G. Genetic variation in IL28B and spontaneous clearance of hepatitis C virus. Nature. 2009;461:798-801. [PubMed] [DOI] |
| 11. | Ge D, Fellay J, Thompson AJ, Simon JS, Shianna KV, Urban TJ, Heinzen EL, Qiu P, Bertelsen AH, Muir AJ. Genetic variation in IL28B predicts hepatitis C treatment-induced viral clearance. Nature. 2009;461:399-401. [PubMed] [DOI] |
| 12. | Rauch A, Kutalik Z, Descombes P, Cai T, Di Iulio J, Mueller T, Bochud M, Battegay M, Bernasconi E, Borovicka J. Genetic variation in IL28B is associated with chronic hepatitis C and treatment failure: a genome-wide association study. Gastroenterology. 2010;138:1338-145, 1338-145. [PubMed] |
| 13. | Al-Qahtani AA, Al-Anazi MR, Abdo AA, Sanai FM, Al-Hamoudi WK, Alswat KA, Al-Ashgar HI, Khalaf NZ, Viswan NA, Al Ahdal MN. Genetic variation in interleukin 28B and correlation with chronic hepatitis B virus infection in Saudi Arabian patients. Liver Int. 2013; Oct 7. [Epub ahead of print]. [PubMed] [DOI] |
| 14. | Cheng L, Sun X, Tan S, Tan W, Dan Y, Zhou Y, Mao Q, Deng G. Effect of HLA-DP and IL28B gene polymorphisms on response to interferon treatment in hepatitis B e-antigen seropositive chronic hepatitis B patients. Hepatol Res. 2013; Dec 2. [Epub ahead of print]. [PubMed] |
| 15. | Zhang Q, Lapalus M, Asselah T, Laouénan C, Moucari R, Martinot-Peignoux M, Bieche I, Estrabaud E, De Muynck S, Boyer N. IFNL3 (IL28B) polymorphism does not predict long-term response to interferon therapy in HBeAg-positive chronic hepatitis B patients. J Viral Hepat. 2013; Oct 10. [Epub ahead of print]. [PubMed] [DOI] |