修回日期: 2014-04-14
接受日期: 2014-04-28
在线出版日期: 2014-07-18
目的: 探讨抗氧化剂α-硫辛酸(α-lipoic acid, ALA)对大鼠急性胰腺炎(acute pancreatitis, AP)的治疗作用以及抗氧化机制.
方法: 3.5%牛磺胆酸钠逆行胰胆管注射制备AP大鼠模型, 随机分为4组: (1)假手术组(SO组); (2)AP组(AP组); (3)AP+生理盐水组(AP+NS组); (4)AP+α-硫辛酸治疗组(AP+ALA组), 于造模后腹腔内注射α-硫辛酸(1 mg/kg). 各组以不同时间点1、3、6、9、12 h分别检测血清淀粉酶水平、观察胰腺病理学改变, 测定胰腺组织超氧化物歧化酶(superoxide dismutase, SOD)活力、丙二醛(malondialdehyde, MDA)含量和血清肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)、细胞间黏附分子-1(intercellular adhesion molecule-1, ICAM-1)水平及环氧合酶-2(cyclooxygenase-2, COX-2)的表达情况.
结果: 与SO组比较, 在AP组、AP+NS组血清淀粉酶明显升高、随着不同时间点的延长, 病理学可见胰腺水肿、黏连、坏死, 腹腔内可见血性腹水, 胰腺组织SOD降低, 而MDA含量升高, 血清TNF-α、ICAM-1水平均显著升高, COX-2在胰腺腺泡细胞、导管细胞、胰岛细胞有较强的表达. AP+ALA组与AP组相比, 血清淀粉酶降低, 胰腺组织学改善, SOD升高, 而MDA含量降低, 血清TNF-α、ICAM-1水平明显降低, COX-2的表达减弱.
结论: 氧化应激在AP的发病中起着重要的作用, 抗氧化剂α-硫辛酸对AP大鼠具有较好的治疗作用, 其作用可能与抑制TNF-α、ICAM-1活性以及抑制COX-2表达有关.
核心提示: α-硫辛酸(α-lipoic acid)对大鼠急性胰腺炎(acute pancreatitis, AP)大鼠具有治疗作用, 其机制与抑制氧化应激和减轻细胞因子损伤有关, 为临床上治疗AP提供了一个新的思路.
引文著录: 王艳红. 抗氧化剂α-硫辛酸对大鼠急性胰腺炎的治疗作用. 世界华人消化杂志 2014; 22(20): 2887-2892
Revised: April 14, 2014
Accepted: April 28, 2014
Published online: July 18, 2014
AIM: To investigate the protective effects of α-lipoic acid (ALA) against acute pancreatitis (AP) in rats and the underlying mechanism.
METHODS: A rat AP model was induced by injecting 3.5% sodium taurocholate solution into the pancreato-biliary duct. Wistar rats were randomly divided into four groups: a sham-operation (SO) group, an AP group, an AP-normal saline (AP-NS) group and an AP-ALA group (intraperitoneal injection of ALA, 1 mg/kg). The levels of serum amylase, tumor necrosis factor-α (TNF-α), intercellular adhesion molecule-1 (ICAM-1), pancreatic superoxide dismutase (SOD), malondialdehyde (MDA), and the expression of cyclooxygenase 2 (COX-2) were measured at 1, 3, 6, 9 and 12 h after operation. Pancreatic histological changes were observed.
RESULTS: In the AP and AP-NS groups, the levels of serum amylase, TNF-α, ICAM-1, pancreatic SOD, and the expression of COX-2 were significantly increased, and pancreatic MDA level was decreased compared with the SO group. Optical microscopy revealed pancreatic edema, adhesion, necrosis, and bloody ascites at different time points in the SO AP and AP-NS groups. ALA could decrease the levels of serum amylase and pancreatic MDA, improve the pathological changes in the pancreas and inhibit the release of serum TNF-α, ICAM-1 and COX-2.
CONCLUSION: α-lipoic acid as an antioxidant plays a protective role in AP by restraining the production of TNF-α, ICAM-1 and COX-2.
- Citation: Wang YH. Therapeutic effect of α-lipoic acid against acute pancreatitis in rats. Shijie Huaren Xiaohua Zazhi 2014; 22(20): 2887-2892
- URL: https://www.wjgnet.com/1009-3079/full/v22/i20/2887.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i20.2887
急性胰腺炎(acute pancreatitis, AP)是多种原因引起的胰腺自身消化性疾病, 是一种炎症反应所致的胰腺腺泡细胞损伤、间质水肿和出血, 易并发多脏器功能衰竭, 而危及患者的生命[1]. 在AP发病机制中, 氧化应激直接或间接通过信号转导通路引起细胞的损伤[2], 在AP发病中发挥着重要作用, 并与诱发和加重AP胰腺外器官损伤联系密切[3]. α-硫辛酸(α-lipoic acid, ALA)是一种抗氧化剂, 具有较强的抗氧化活性, 本研究旨在探讨ALA对AP的抗氧化治疗作用及作用机制.
♂Wistar大鼠120只, 体质量250 g±20 g, 购自河北医科大学实验动物中心(合格证编号: 607046), 在标准饲养条件下进行饲养. 牛磺胆酸钠及ALA购自Sigma公司. 氧化物歧化酶(superoxide dismutase, SOD)活力及丙二醛(malondialdehyde, MDA)含量测试盒购于南京建成生物工程研究所; 肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)及细胞间黏附分子-1(intercellular adhesion molecule-1, ICAM-1)ELISA测试盒购于上海森雄生物有限公司; 兔抗环氧合酶-2(cyclooxygenase-2, COX-2)多克隆抗体、辣根过氧化酶标记的山羊抗兔IgG、APES、SP试剂盒及DAB显色试剂盒均购于北京中山生物技术公司.
1.2.1 动物模型的制备: 选取♂Wistar大鼠, 以10%水合氯醛腹腔内注射麻醉, 于上腹正中作切口进入腹腔, 用4号加工钝头头皮静脉针于十二指肠乳头附近逆行插入胰胆管, 以0.2 mL/min速度注入3.5%牛磺胆酸钠(0.1 mL/100 g), 注射后用无创血管夹将胰胆管入十二指肠处夹住, 观察10 min后, 去除血管夹, 关腹.
1.2.2 分组: 将♂Wistar大鼠120只, 随机分为4组: (1)假手术组(SO组, n = 30); (2)急性胰腺炎模型组(AP组, n = 30); (3)急性胰腺炎+生理盐水对照组(AP+NS组, n = 30), 于造模后不同时间点腹腔内注射生理盐水(5 mL/mg); (4)急性胰腺炎+α-硫辛酸治疗组(AP+ALA组, n = 30), 于造模后不同时间点腹腔内注射ALA(1 mg/kg). 各组以不同时间点1、3、6、9、12 h随机分为5个亚组, 每个亚组6只大鼠.
1.2.3 测定指标: (1)血淀粉酶测定: 采用全自动生化分析仪进行检测; (2)胰腺组织学检查: 采用石蜡包埋、切片, HE染色; (3)SOD活力及MDA含量测定: 取胰腺组织制成组织匀浆, 用化学比色法测定, 测试盒购自南京建成生物工程研究所; (4)细胞因子测定: 采用ELISA方法测定血清中TNF-α及ICAM-1水平, 测试盒购自上海森雄生物有限公司; (5)COX-2免疫组织化学染色: 采用石蜡包埋, 抗原修复, 抗体封闭, DAB显色, 苏木素复染.
统计学处理 数据用mean±SD表示, 用SPSS10.0软件对各组均数进行单因素方差分析(one-way ANOVA), 两组之间比较用q检验. P<0.05为差异有统计学意义.
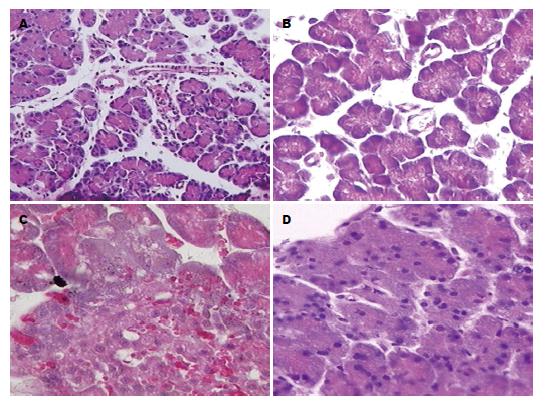
肉眼可见: SO组胰腺及周围组织结构大致正常. AP组和AP+NS组胰腺局部水肿, 颜色变暗, 并逐渐扩展、加深, 随着时间延长, 腹腔内出现血性腹水, 胰腺与周围组织黏连, 水肿加重, 色泽更差, 表面呈灰褐色并可见坏死灶及皂化斑, 而AP+ALA组较AP组的大体结构破坏明显减轻. 光镜下所见: SO组胰腺及周围组织学结构基本正常; AP组和AP+NS组随着时间的推移, 胰腺及周围组织水肿、出血程度逐渐加重, 坏死面积逐渐扩大; 而AP+ALA组较AP组的组织结构破坏明显较轻(图1).
随时间点变化, SO组血清淀粉酶水平无明显变化, AP组、AP+NS组及AP+ALA组与SO组比较均明显升高(P<0.01), 且随时间点的延长, 血清淀粉酶逐渐升高. AP+ALA组较AP组相比血清淀粉酶水平明显降低(P<0.01)(表1).
| 分组 | 血清淀粉酶 | ||||
| 1 h | 3 h | 6 h | 9 h | 12 h | |
| SO组 | 127.00±30.25 | 134.67±37.46 | 160.17±23.13 | 162.83±36.95 | 159.67±31.97 |
| AP组 | 1148.83±274.22b | 1525.17±370.04b | 2211.00±547.36b | 2484.17±365.17b | 2994.50±354.38b |
| AP+NS组 | 1172.67±318.86b | 1651.00±372.63b | 2334.50±417.26b | 2633.00±391.94b | 3125.67±412.45b |
| AP+ALA组 | 831.67±298.34bd | 1142.67±342.10bd | 1477.67±641.72bd | 2014.67±487.76bd | 2545.17±413.32bd |
SO组SOD活力在各时间点无明显变化. 与SO组相比, AP组、AP+NS组在3、6、9和12 h点SOD活力明显下降(P<0.05或P<0.01). 与AP组相比, AP+ALA组在3、6、9和12 h点SOD活力明显增加(P<0.05或P<0.01). 在SO组MDA含量在各时间点无明显变化. 与SO组相比, 在AP组及AP+NS组, 各个时间点MDA均显著升高(P<0.01). 与AP组相比, AP+ALA组MDA值在各时间点均明显降低(P<0.05或P<0.01)(表2).
| 时间点 | 分组 | SOD活力(U/mgprot) | MDA含量(U/mgprot) | TNF-α水平(ng/mL) | ICAM-1水平(ng/mL) |
| 1 h | 假手术组 | 59.48±6.91 | 15.15±3.15 | 6.30±1.40 | 10.81±2.81 |
| AP组 | 50.02±7.15 | 26.68±6.45b | 52.41±7.83b | 30.69±6.89b | |
| AP+NS组 | 48.44±7.44 | 27.14±6.27b | 59.27±5.85b | 31.32±5.27b | |
| AP+ALA组 | 51.40±8.70 | 19.72±3.62c | 44.40±6.39bc | 23.27±3.72b | |
| 3 h | 假手术组 | 58.87±7.81 | 14.37±4.16 | 6.90±1.27 | 10.10±1.94 |
| AP组 | 42.94±6.65a | 27.53±5.68b | 122.15±13.30b | 41.05±7.40b | |
| AP+NS组 | 40.97±6.50b | 31.27±7.09b | 124.11±13.98b | 41.81±8.08b | |
| AP+ALA组 | 52.64±10.02c | 19.85±8.02c | 102.81±4.78bc | 32.20±6.00bc | |
| 6 h | 假手术组 | 56.65±6.62 | 16.21±3.23 | 6.52±1.08 | 13.90±3.43 |
| AP组 | 38.48±9.46b | 32.23±5.86b | 174.84±7.87b | 49.32±8.02b | |
| AP+NS组 | 34.69±6.68b | 33.86±6.26b | 179.56±6.79b | 49.01±9.37b | |
| AP+ALA组 | 65.96±8.62d | 20.19±8.42d | 164.81±6.22bc | 37.54±3.92bc | |
| 9 h | 假手术组 | 56.65±9.44 | 16.05±8.21 | 5.59±0.87 | 13.95±3.41 |
| AP组 | 35.89±6.40b | 36.86±7.87b | 164.38±8.98b | 62.29±8.86b | |
| AP+NS组 | 33.89±7.16b | 39.05±9.52b | 169.71±7.55b | 64.18±10.67b | |
| AP+ALA组 | 66.50±7.64d | 25.09±9.64d | 155.68±6.02bc | 49.03±8.07bc | |
| 12 h | 假手术组 | 6.12±1.13 | 17.21±10.21 | 6.12±1.13 | 14.51±3.66 |
| AP组 | 112.86±9.29a | 38.07±10.38b | 112.86±9.29b | 70.45±9.17b | |
| AP+NS组 | 111.82±7.96a | 43.07±11.21b | 111.82±7.96b | 73.69±9.02b | |
| AP+ALA组 | 97.23±4.55ac | 30.20±7.09c | 97.23±4.55bc | 58.02±8.91bc |
于各时间点, 血清TNF-α水平在SO组 无明显变化. 与SO组比较, 血清TNF-α水平在AP组、AP+NS组均显著升高(P<0.01), 并于6 h点达高峰. 与AP组相比, AP+ALA组血清TNF-α水平降低(P<0.05). 血清ICAM-1水平于各时间点, 在SO组无明显变化. 与SO组比较, AP组、AP+NS组血清ICAM-1水平均显著升高(P<0.01), 且随时间点的延长呈逐渐上升. 较AP组相比, 血清ICAM-1水平在AP+ALA组降低(P<0.05)(表2).
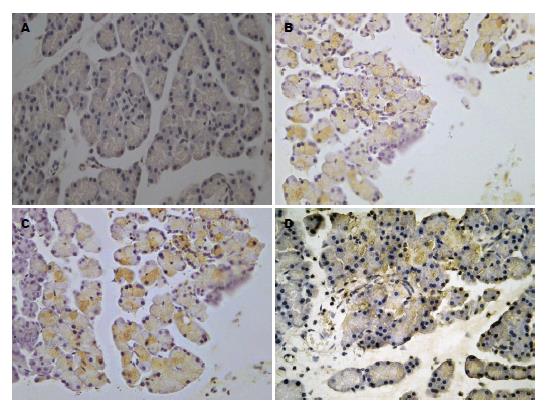
SO组胰腺组织中COX-2几乎没有表达. AP组及AP+NS组, 胰腺腺泡细胞、导管细胞、胰岛细胞有较强的表达,呈棕黄色颗粒. AP+ALA组在胰腺腺泡细胞、导管细胞、胰岛细胞表达减弱, 呈弱阳性(图2).
在AP发展中, 氧化应激是AP严重性的重要决定因素[4], 氧自由基(oxygen free radicals, OFRs)及其衍生物作为分子起源在胰腺损害中发挥重要作用, 其中过氧化氢、超氧化物、羟基及单态氧是造成细胞损害的主要因素, 这些高度活化物质可通过脂肪酸过氧化作用造成类脂膜的破坏及溶酶体的破坏. OFRs可以激活补体, 促进白细胞黏附、活化和迁移[5], 损伤内皮细胞的完整性, 增加毛细血管的通透性, 造成循环血量的丢失, 引起微循环障碍, 加重胰腺损伤[1,6]. 在AP的炎症应答过程中, 致炎因子和氧化应激发挥协同作用, 导致炎症的级联扩增[1]. 本研究发现, 在大鼠AP中胰腺损伤伴随着组织中MDA水平增加, 以及过氧化氢酶、SOD、谷胱甘肽过氧化物酶(glutathione peroxidase, GPx)活力和谷胱甘肽(glutathione, GSH)水平下降[7]. 本实验研究显示, 与SO组相比, 在急性胰腺炎组各时间点SOD均显著降低, 而MDA显著升高, 表明氧化应激对AP发病有重要影响[4], 通过测定血清氧化应激指标可以反映AP的严重程度[2].
AP的发病与细胞因子有关已成为共识, 认为TNF-α是导致胰腺炎时胰腺及胰外器官组织损伤的主要细胞因子. AP时TNF-α大量释放, 其水平与疾病的严重程度、病死率和预后呈正相关[8]. Ramudo等[9]研究显示, 于胰胆管阻塞后6 h腺泡细胞产生TNF-α, 此时胰腺发生的氧化应激反应最强烈. 本实验研究显示, 与SO组相比, 在AP组血清TNF-α水平明显升高, 并且在AP发生6 h后达高峰, 因此我们认为TNF-α是AP早期增加的细胞因子, 能促进炎症部位白细胞聚集和活化, 活化的白细胞又可产生大量OFRs. 致炎因子特别是TNF-α和氧化应激在AP中的相互作用形成了一个恶性循环[1]. ICAM-1是一种主要表达于内皮细胞表面的蛋白质, 能介导白细胞黏附和穿越内皮细胞, 是白细胞黏附于内皮细胞的关键所在, 由此促使白细胞通过血管内皮屏障迁移至炎性区域, 在炎症区域募集[10], 引起组织的过度炎症反应[11,12]. TNF-α可能与ICAM-1早期大量表达有关. Frossard等[13]研究发现, 在AP存在器官灌注急剧减少及ICAM-1表达增加. 本实验研究显示, 与SO组相比, 在急性胰腺炎组ICAM-1明显升高, 并且呈逐步增高的趋势, 血清ICAM-1的上调是导致AP发生与发展的重要因素之一.
COX-2是前列腺合成过程中的关键限速酶, 其表达首先在炎症性疾病过程中被发现, COX-2可在内皮细胞、巨噬细胞和成纤维细胞中被炎症因子所诱导[14], 是炎症过程中的一个重要的诱导酶, 呈高表达状态. 近来研究表明, AP时, 胰腺组织内COX-2表达增加部分地受促炎性转录因子核因子-kB(nuclear factor-kappa B, NF-kB)调节[15], 并且受影响胰腺炎病程的多种因素的调节, 在胰腺炎的发生和发展中起一定作用[16], 给予COX-2抑制剂可能可以预防胰腺炎及胰腺炎肺损伤的发生或减轻胰腺炎及胰腺炎肺损伤的程度[16,17]. Schlosser等[18]近来发现, 在慢性胰腺炎患者胰腺组织中COX-2呈过度表达, 而且COX-2的表达与患者既往胰腺炎急性发作的次数成正相关关系. 本实验研究结果显示, SO组胰腺组织中COX-2几乎没有表达. AP组及AP+NS组, 胰腺腺泡细胞、导管细胞、胰岛细胞有较强的表达,呈棕黄色颗粒. AP+ALA组在胰腺腺泡细胞、导管细胞、胰岛细胞表达减弱, 呈弱阳性.
硫辛酸属于维生素B类化合物, 在丙酮酸脱氢酶、a-酮戊二酸脱氢酶、氨基己酸脱羧酶等多酶复合体中作为辅酶作用, 具有氧化型(ALA)和还原型(dihy-drolipoic acid, DHLA). 硫辛酸具有强效的抗氧化作用, 可以直接清除OFRs, 阻断脂质过氧化, 诱导GSH的合成, 恢复细胞氧化还原稳态, 减少细胞氧化损伤[19]. ALA可使氧化还原敏感性转录因子NF-kB失活, 从而改善内皮细胞功能, 并可通过减少活性氧(reactive oxygen species, ROS), 抑制许多氧化还原敏感信号通路和发挥强有力的抗炎作用. Park等[20]实验研究表明, 在腹腔内注射雨蛙肽诱导大鼠AP模型中, 给予ALA(1 mg/kg)腹腔注射后, 能够明显减轻血清脂肪酶和淀粉酶水平. 本研究显示, 与急性胰腺炎组相比, AP+ALA组血清中淀粉酶活性明显降低、胰腺病理学损伤改善, 胰腺组织中MDA含量减少, SOD活力增加, 表明ALA通过抗氧化作用对AP大鼠起到较好的治疗效果. 另外, ALA能够降低AP大鼠血清TNF-a、ICAM-1和COX-2水平. 由此推测ALA的对AP的治疗作用可能与抑制细胞因子TNF-a、ICAM-1活性及COC-2的表达有关.
总之, ALA对AP大鼠具有治疗作用, 其机制与抑制氧化应激和减轻细胞因子损伤有关, 为临床上治疗AP提供了一个新的思路.
氧化应激在急性胰腺炎(acute pancreatitis, AP)的发病中起着重要的作用, α-硫辛酸(α-lipoic acid, ALA)具有强效的抗氧化作用, 能抑制肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)、细胞间黏附分子-1(intercellular adhesion molecule-1, ICAM-1)活性以及抑制环氧合酶-2(cyclooxygenase 2, COX-2)表达有关, 对AP大鼠具有较好的治疗作用.
李国威, 教授, 西安交通大学医学院第二附属医院普通外科
在不同时间点对AP大鼠注射ALA后, 与急性胰腺炎组相比, 血清淀粉酶降低, 胰腺组织学改善, 超氧化物歧化酶(superoxide dismutase, SOD)升高, 而丙二醛(malondialdehyde, MDA)含量降低, 血清TNF-α、ICAM-1水平明显降低, COX-2的表达减弱.
氧化应激是AP严重性的重要决定因素, 氧自由基及其衍生物作为分子起源在胰腺损害中发挥重要作用, ALA具有强效的抗氧化作用, 可以直接清除氧自由基, 阻断脂质过氧化, 诱导谷胱甘肽的合成, 恢复细胞氧化还原稳态, 减少细胞氧化损伤, 并可通过减少活性氧, 抑制许多氧化还原敏感信号通路和发挥强有力的抗炎作用.
本文具有一定的临床及理论参考价值.
编辑 田滢 电编 鲁亚静
| 1. | Petrov MS. Therapeutic implications of oxidative stress in acute and chronic pancreatitis. Curr Opin Clin Nutr Metab Care. 2010;13:562-568. [PubMed] [DOI] |
| 2. | Eşrefoğlu M, Gül M, Ates B, Batçioğlu K, Selimoğlu MA. Antioxidative effect of melatonin, ascorbic acid and N-acetylcysteine on caerulein-induced pancreatitis and associated liver injury in rats. World J Gastroenterol. 2006;12:259-264. [PubMed] |
| 3. | Telek G, Regöly-Mérei J, Kovács GC, Simon L, Nagy Z, Hamar J, Jakab F. The first histological demonstration of pancreatic oxidative stress in human acute pancreatitis. Hepatogastroenterology. 2001;48:1252-1258. [PubMed] |
| 4. | Criddle DN, Gillies S, Baumgartner-Wilson HK, Jaffar M, Chinje EC, Passmore S, Chvanov M, Barrow S, Gerasimenko OV, Tepikin AV. Menadione-induced reactive oxygen species generation via redox cycling promotes apoptosis of murine pancreatic acinar cells. J Biol Chem. 2006;281:40485-40492. [PubMed] [DOI] |
| 5. | Tadao M, Yuji O. [Role of free radicals in the development of severe acute pancreatitis]. Nihon Rinsho. 2004;62:2015-2020. [PubMed] |
| 7. | Eşrefoğlu M, Gül M, Ateş B, Yilmaz I. Ultrastructural clues for the protective effect of ascorbic acid and N-acetylcysteine against oxidative damage on caerulein-induced pancreatitis. Pancreatology. 2006;6:477-485. [PubMed] |
| 8. | Norman J. The role of cytokines in the pathogenesis of acute pancreatitis. Am J Surg. 1998;175:76-83. [PubMed] [DOI] |
| 9. | Ramudo L, Manso MA, Sevillano S, de Dios I. Kinetic study of TNF-alpha production and its regulatory mechanisms in acinar cells during acute pancreatitis induced by bile-pancreatic duct obstruction. J Pathol. 2005;206:9-16. [PubMed] |
| 10. | 万 涛, 朱 冠保. NF-κB、ICAM-1和炎症细胞因子在急性胰腺炎肝损伤中的作用. 国外医学临床生物化学与检验学分册. 2005;26:913-915. |
| 13. | Frossard JL, Saluja A, Bhagat L, Lee HS, Bhatia M, Hofbauer B, Steer ML. The role of intercellular adhesion molecule 1 and neutrophils in acute pancreatitis and pancreatitis-associated lung injury. Gastroenterology. 1999;116:694-701. [PubMed] |
| 14. | 左 怡沁, 朴 善琰. 环氧化酶与肾脏研究进展. 国外医学泌尿系统分册. 2001;1:27-29. |
| 15. | Newton R, Kuitert LM, Bergmann M, Adcock IM, Barnes PJ. Evidence for involvement of NF-kappaB in the transcriptional control of COX-2 gene expression by IL-1beta. Biochem Biophys Res Commun. 1997;237:28-32. [PubMed] [DOI] |
| 16. | Ethridge RT, Chung DH, Slogoff M, Ehlers RA, Hellmich MR, Rajaraman S, Saito H, Uchida T, Evers BM. Cyclooxygenase-2 gene disruption attenuates the severity of acute pancreatitis and pancreatitis-associated lung injury. Gastroenterology. 2002;123:1311-1322. [PubMed] [DOI] |
| 17. | Song AM, Bhagat L, Singh VP, Van Acker GG, Steer ML, Saluja AK. Inhibition of cyclooxygenase-2 ameliorates the severity of pancreatitis and associated lung injury. Am J Physiol Gastrointest Liver Physiol. 2002;283:G1166-G1174. [PubMed] |
| 18. | Schlosser W, Schlosser S, Ramadani M, Gansauge F, Gansauge S, Beger HG. Cyclooxygenase-2 is overexpressed in chronic pancreatitis. Pancreas. 2002;25:26-30. [PubMed] |
| 19. | Maritim AC, Sanders RA, Watkins JB. Effects of alpha-lipoic acid on biomarkers of oxidative stress in streptozotocin-induced diabetic rats. J Nutr Biochem. 2003;14:288-294. [PubMed] [DOI] |
| 20. | Park SJ, Seo SW, Choi OS, Park CS. Alpha-lipoic acid protects against cholecystokinin-induced acute pancreatitis in rats. World J Gastroenterol. 2005;11:4883-4885. [PubMed] |