修回日期: 2014-04-28
接受日期: 2014-05-12
在线出版日期: 2014-07-18
目的: 探讨人肝癌细胞(MHCC-97H)和人胆管癌细胞(human bile duct carcinoma cell, RBE)中酪氨酸激酶受体c-Met前体(pro-Met)的N-糖基化修饰对c-Met功能的影响.
方法: 分别用N-糖基化抑制剂衣霉素、蛋白酶体抑制剂MG132、蛋白合成抑制剂放线菌酮及c-Met抑制剂PF-2341066处理MHCC-97H 细胞和RBE细胞, 采用Western blot、免疫荧光及激光共聚焦显微镜等方法分析pro-Met的N-糖基化修饰对c-Met功能的影响.
结果: MHCC-97H细胞和RBE细胞中磷脂酰肌醇3-激酶(phosphatidy linositol 3 kinase/Akt, PI3K/Akt)以及有丝分裂原活化蛋白激酶/细胞外信号调节激酶(mitogen-activated protein kinase/extracellular signal-regulated kinase, MEK/ERK)是c-Met下游信号通路. c-Met是一种N-糖基化修饰的蛋白分子. c-Met的N-糖基化修饰源于pro-Met的N-糖基化. 非糖基化pro-Met虽然能够发生磷酸化修饰, 但不能有效激活c-Met下游信号通路. c-Met的成熟和膜定位需要其糖基化修饰.
结论: c-Met的N-糖基化修饰是维持其功能所必需的.
核心提示: 该实验发现c-Met具有N-糖基化修饰而非O-糖基化修饰. c-Met的糖基化源于pro-Met的N-糖基化修饰, 抑制pro-Met的N-糖基化修饰导致pro-Met的磷酸化修饰. 此外, 由于未糖基化的pro-Met不能定位于细胞膜, 因而磷酸化的pro-Met不能有效激活c-Met下游的信号途径. c-Met的N-糖基化修饰是维持其功能所必需的.
引文著录: 段春燕, 陈绍坤, 张春燕, 冯春红, 刘友平, 夏先明, 余文静, 代荣阳, 李洪. pro-Met的N-糖基化修饰对c-Met功能的影响. 世界华人消化杂志 2014; 22(20): 2826-2838
Revised: April 28, 2014
Accepted: May 12, 2014
Published online: July 18, 2014
AIM: To investigate the effect of N-linked glycosylation modification of pro-Met on the function of c-Met in human hepatocellular carcinoma (HCC) cell line MHCC-97H and human cholangiocarcinoma cell line RBE.
METHODS: Tunicamycin (Tun), an inhibitor of N-glycosylation, MG132, a proteasome inhibitor, cycloheximide (CHX), a protein synthesis inhibitor, and PF-2341066, a c-Met inhibitor, were used in this study. The effect of N-linked glycosylation modification of pro-Met on c-Met function in MHCC-97H and RBE cells were determined by Western blot, immunofluorescence and confocal microscopy.
RESULTS: We found that both phosphatidylinositol 3 kinase/Akt (PI3K/Akt) and mitogen-activated protein kinase /extracellular signal-regulated kinase (MEK/ERK) were downstream to c-Met. Furthermore, c-Met was an N-linked glycosylated protein. N-glycosylation modification of p145Met was from pro-Met, but not due to the further modification of pro-Met. Importantly, blocking the N-glycosylation of pro-Met targeted pro-Met to the cytoplasm and initiated its phosphorylation independent of hepatocyte growth factor (HGF) engagement. Nonglycosylated pro-Met, which was phosphorylated, only in part activated c-Met downstream signals.
CONCLUSION: N-glycosylation is required for c-Met function.
- Citation: Duan CY, Chen SK, Zhang CY, Feng CH, Liu YP, Xia XM, Yu WJ, Dai RY, Li H. Effect of N-linked glycosylation modification of pro-Met on function of c-Met. Shijie Huaren Xiaohua Zazhi 2014; 22(20): 2826-2838
- URL: https://www.wjgnet.com/1009-3079/full/v22/i20/2826.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i20.2826
c-Met是一种具有酪氨酸激酶活性的跨膜受体, 是肝细胞生长因子(hepatocyte growth factor, HGF)的天然受体. 酪氨酸1234和1235(Tyr-1234/1235)位点的磷酸化调控决定了c-Met的活性, 除了HGF外, Tyr-1349/1356的磷酸化还受到多种因素的调控[1-3]. HGF与c-Met的Tyr-1234/1235具有催化活性的结构域结合, 并使其发生磷酸化, 从而引起c-Met活化. 当c-Met激活后, 会引起下游多条信号通路活化, 如磷脂酰肌醇3-激酶(phosphatidylinositol 3 kinase, PI3K)/Akt以及有丝分裂原活化蛋白激酶/细胞外信号调节激酶(mitogen-activated protein kinase/extracellular signal-regulated kinase, MEK/ERK)等[4-6], 通过这些信号通路, HGF/c-Met通路调控着细胞的增殖、分化和迁移. 多种肿瘤的发生、发展都与HGF/c-Met信号通路异常活化有关. c-Met的表达受到转录及翻译后水平的调控, 并在细胞外基质信号转导中发挥着作用. 研究发现[7-10], 当HGF与受体c-Met未结合时, 活性异常的c-Met与其过度表达有直接的关系. c-Met前体(pre-Met)经过翻译后加工修饰, 包括糖基化、二硫键的形成及蛋白酶的裂解形成成熟的c-Met. c-Met的合成首先是在内质网上对单链前体进行糖基化, 形成pro-Met, 后者再经过二硫键的形成、翻译后的糖基化修饰、蛋白酶裂解等加工修饰, 形成一种具有两个亚基的异二聚体形式c-Met(p190Metαβ). p190Metαβ包括两个亚基: α亚基(p50Met)和β亚基(p145Met), 他们之间由二硫键连接. α亚基在细胞外, 而β亚基则是跨膜部分并且包含了酪氨酸激酶的催化结构域[11-16].
c-Met的糖基化修饰与其功能之间的关系还不十分清楚, 本实验采用Western blot、免疫荧光等方法对人肝癌细胞和人胆管癌细胞中pro-Met的N-糖基化修饰对c-Met功能的影响进行了研究.
N-糖基化抑制剂衣霉素(tunicamycin, Tun)、N-糖苷酶、O-糖苷酶、蛋白酶抑制剂MG132及蛋白合成抑制剂放线菌酮(cycloheximide, CHX)均购自Sigma公司; c-Met抑制剂PF-2341066购自Selleck公司; 抗c-Met、GRP78及β-actin一抗购自Santa Cruz公司; 抗p-Akt (Ser-473)、p-ERK(Thr-202/Tyr204)、p-Met (Tyr-1234/1235/1349)、Akt及ERK一抗购自Cell Signaling公司; 二抗购自Santa Cruz公司.
1.2.1 细胞培养及处理: 分别将人肝癌细胞系(MHCC-97H)及人胆管癌细胞系(RBE)以10%胎牛血清DMEM培养基培养, 置于CO2培养箱中(5%CO2、95%空气、37 ℃), 视情况换液. 培养细胞分别用Tun(2.5 μg/mL)、PF-2341066(100 nmol/L)、MG132(20 μmol/L)及CHX(10 μmol/L)处理, 并按在对应时间点收集细胞.
1.2.2 Western blot检测: 提取各组细胞蛋白质, SDS-PAGE电泳分离. 利用半干式电转移仪将凝胶中的蛋白转移至PVDF膜, 120 min. 转膜结束后将PVDF膜加入5%牛血清白蛋白进行封闭, 室温1 h. 封闭结束后, 将印迹有目的蛋白的PVDF膜与其抗体稀释液置于4 ℃孵育过夜. 用1×TBST洗膜3次(5 min/次), 印迹有目的蛋白的PVDF膜与二抗稀释液室温振摇孵育1 h. 用1×TBST洗膜3次(5 min/次). 最后将化学发光剂浸透PVDF膜, 并置于凝胶成像系统, 放射自显影5 min, 即得到目的蛋白的免疫印迹图谱.
1.2.3 免疫荧光定位及激光共聚焦显微镜检测: 当细胞生长密度为60%时, 多聚甲醛固定细胞, p-Met及Met一抗4 ℃孵育过夜, CY3标记的荧光二抗室温1 h孵育, 进行免疫荧光及激光共聚焦显微镜检测.
统计学处理 免疫印迹图谱用Quantity One分析软件, 对获得的印迹条带进行灰度测定, 用每个目的蛋白条带的灰度扫描值对比相应的内参条带的灰度值, 即得到目的蛋白灰度的标化值. 数据资料用mean±SD表示, 采用SPSS16.0软件进行作图和统计分析, P<0.05为差异具有统计学意义.
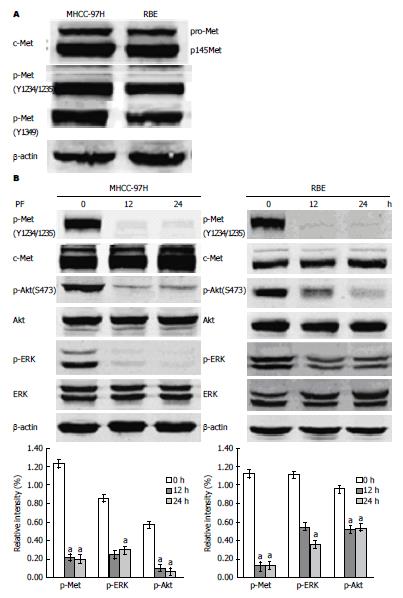
首先检测MHCC-97H和RBE细胞中磷酸化和非磷酸化c-Met表达情况. 如A显示, MHCC-97H和RBE细胞中磷酸化和非磷酸化c-Met表达均较强. 有研究表明PI3K/Akt和MEK/ERK是两条典型的c-Met下游信号通路[1,3]. 为了明确MHCC-97H和RBE细胞中Akt和ERK的磷酸化是否对c-Met的活化存在依赖性, 采用c-Met抑制剂PF-2341066(PF, 100 nmol/L)分别处理MHCC-97H和RBE细胞. Western blot图谱显示, c-Met抑制剂PF-2341066能明显地降低有效激活c-Met下游信号通路p-Akt和p-ERK的表达(图1B). 结果证实MHCC-97H和RBE细胞中PI3K/Akt和MEK/ERK是c-Met下游信号通路.
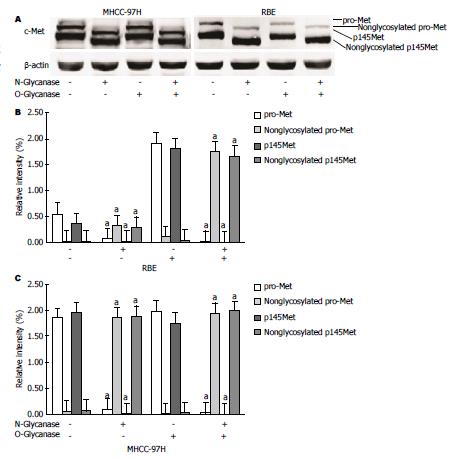
细胞经过N-糖苷酶处理后, 发现pro-Met和p145Met的分子量和他们在SDS凝胶上的迁移率发生了变化(图2). 然而, 经过O-糖苷酶处理后, pro-Met和p145Met均没有出现迁移率的改变(图2). 结果表明c-Met是一种进行N-糖基化修饰而非O-糖基化修饰的蛋白分子.
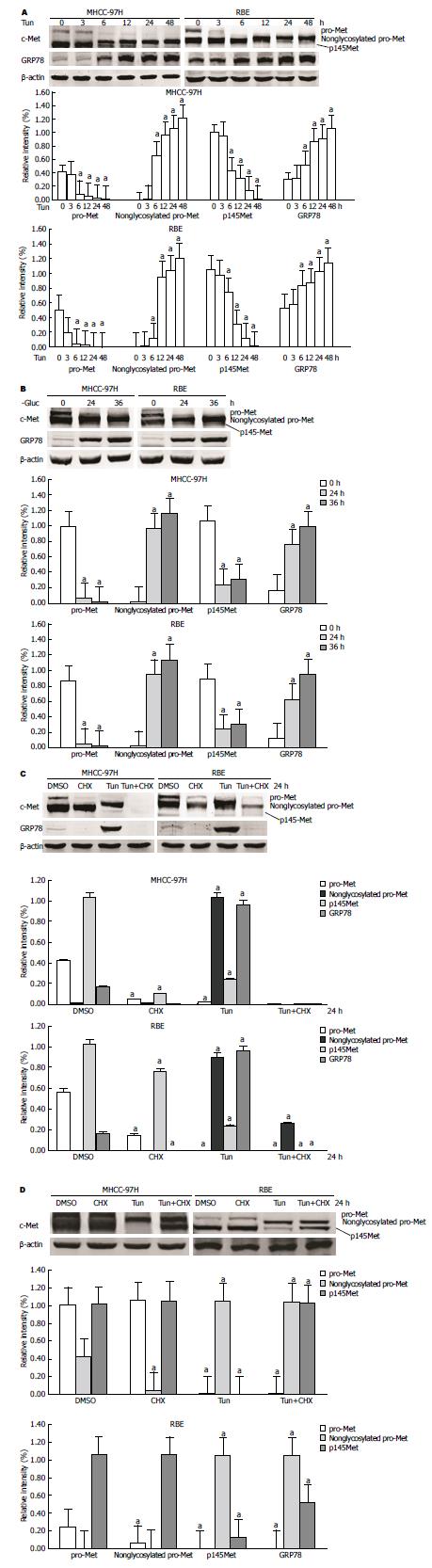
经用N-糖基化抑制剂Tun(2.5 μg/mL)分别作用MHCC-97H及RBE细胞, 显示Tun作用3 h后pro-Met分子量逐渐发生改变(图3A), 但Tun作用后并没有降低p145Met的分子量(图3A), 提示c-Met的糖基化发生在pro-Met上, p145Met糖基化来自pro-Met, 其自身并没有发生进一步的糖基化. 更换无糖培养基对细胞分别进行培养24和36 h后收集细胞, Western blot分析显示, pro-Met的分子量出现改变, 而p145Met分子量没有变化(图3B), 进一步说明c-Met的糖基化源于pro-Met的糖基化修饰. 我们进一步用蛋白质合成抑制剂CHX(10 μmol/L)、Tun(2.5 μg/mL)和CHX+Tun分别处理细胞24 h, 结果证实, pro-Met的合成导致了c-Met的翻译后N-糖基化修饰(图3C). 此外, Tun处理后细胞pro-Met糖基化修饰受到抑制, p145Met表达水平也呈时间依赖性显著减低(图3A, B). 图3A、C显示葡萄糖调节蛋白78(glucose regulated protein 78, GRP78)表达量增加, 表明Tun处理MHCC-97H和RBE细胞能够诱发内质网应激.
既然Tun可通过抑制N-糖基化修饰诱导内质网应激, 那么Tun则可以通过与内质网应激相关联的降解来促进p145Met的降解. 实验同时也证实了蛋白酶抑制剂MG132(20 μmol/L)抑制了Tun诱导的p145Met的降解(图3D).
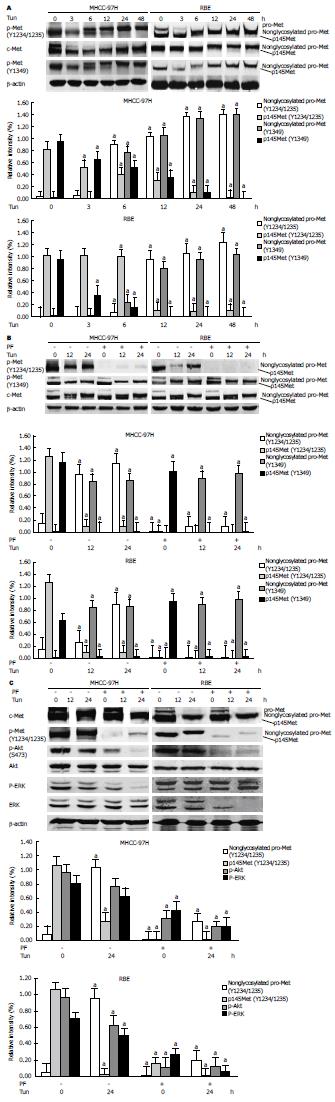
从图4A可以看到, 抗c-Met磷酸化抗体不能检测到pro-Met, 表明在MHCC-97H和RBE细胞中pro-Met没有被磷酸化修饰. 但是, Tun诱导的非糖基化pro-Met则可被磷酸化修饰. 另外, 非糖基化pro-Met的磷酸化修饰可以被c-Met抑制剂PF-2341066所抑制(图4B). 为了研究非糖基化pro-Met的功能, 我们分析了其N-糖基化修饰对c-Met下游信号通路的抑制作用. 如图4C所示, 经过Tun处理后的MHCC-97H和RBE细胞中Akt及ERK磷酸化水平降低. 更为重要的是, c-Met抑制剂PF-2341066不仅能抑制非糖基化pro-Met的磷酸化, 而且还能进一步降低经Tun处理后MHCC-97H和RBE细胞中Akt和ERK的磷酸化水平. 这些结果表明非糖基化pro-Met能够部分激活c-Met下游信号通路.
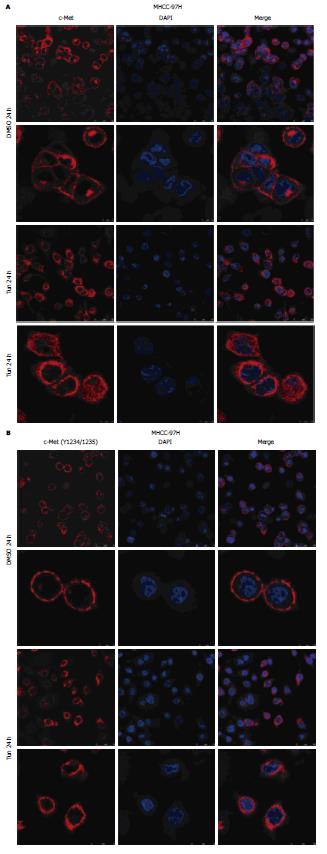
实验通过免疫荧光和激光共聚焦显微镜观察了在Tun处理 MHCC-97H细胞后c-Met的细胞定位情况. 如图5A、B所示, 用二甲亚砜对MHCC-97H细胞24 h处理后, 磷酸化及非磷酸化c-Met在细胞膜上定位; 而在Tun处理MHCC-97H细胞24 h后, 磷酸化和非磷酸化pro-Met则富集在胞浆中. 因此, c-Met的膜转移定位需要其糖基化修饰.
糖基化修饰是大多数蛋白质成熟加工一个重要环节. 糖蛋白的N-糖基化修饰在其折叠、细胞内转运、分泌及功能方面都起到重要作用[17-21]. 本实验研究了c-Met的糖基化修饰对其功能的影响.
鉴于pro-Met和p145Met都是N-糖基化修饰的蛋白质, 实验分析了糖基化的pro-Met是否需要进一步糖基化生成p145Met. 结果显示, c-Met的糖基化发生在pro-Met上, 糖基化的p145Met来自pro-Met, 而p145Met没有发生进一步的糖基化. 因此生理条件下在内质网上c-Met的mRNA直接翻译成N-糖基化的pro-Met, pro-Met由链内二硫键连接、折叠成具有稳定结构的c-Met蛋白分子[1,22-24].
在没有HGF作用和基因突变的情况下, MHCC-97H和RBE细胞中磷酸化c-Met表达异常增加[25-27]. 本实验发现, 在MHCC-97H和RBE细胞中糖基化的pro-Met不能磷酸化. 鉴于在没有HGF作用时, 非糖基化pro-Met在Tyr-1234/1235/1349发生磷酸化, 那么很有必要进一步探讨非糖基化pro-Met的功能. 既然MHCC-97H和RBE细胞中PI3K/Akt和MEK/ERK两条信号通路对c-Met的活性具有依懒性, 故通过非糖基化pro-Met对PI3K/Akt和MEK/ERK信号通路的影响则可研究分析出非糖基化pro-Met的功能. 在Tun处理的MHCC-97H和RBE细胞中发现, 使用c-Met抑制剂PF-2341066后非糖基化pro-Met的磷酸化被抑制同时Akt和ERK的磷酸化也受到抑制. 结果表明MHCC-97H和RBE细胞中非糖基化pro-Met在一定程度上维持着c-Met下游信号通路的活性, 如PI3K/Akt和MEK/ERK信号通路等.
那么, 为什么是非糖基化的pro-Met被磷酸化而不是糖基化pro-Met呢? 生理条件下, 在细胞内质网上c-Met的mRNA翻译为N-糖基化pro-Met, 几分钟内N-糖基化的pro-Met进行折叠并形成了链内的二硫键, 进而细胞内蛋白酶裂解pro-Met启动了c-Met的膜定位. 在形成成熟的c-Met的过程中pro-Met是定位在细胞内质网上, 由此可见内质网上的pro-Met不能进行磷酸化修饰. 然而, 去除pro-Met的N-糖基化修饰能抑制其后续c-Met的成熟过程. 据研究发现, 未折叠的蛋白质将被运输到细胞液并随后被泛素系统所降解[28-30]. 这与我们实验相一致, 非糖基化pro-Met被运输到了细胞液中. 因此, 可以推测非糖基化pro-Met在细胞液中的定位导致了其磷酸化修饰. 鉴于c-Met在细胞膜上的定位对于下游信号通路活性的重要作用, 我们推测非糖基化pro-Met不能有效的引起c-Met下游信号通路的激活是由于非糖基化pro-Met位于细胞液中.
总之, 该实验发现c-Met具有N-糖基化修饰而非O-糖基化修饰. c-Met的糖基化源于pro-Met的N-糖基化修饰, 抑制pro-Met的N-糖基化修饰导致pro-Met的磷酸化修饰. 此外, 由于未糖基化的pro-Met不能定位于细胞膜, 因而磷酸化的pro-Met不能有效激活c-Met下游的信号途径. c-Met的N-糖基化修饰是维持其功能必需的.
c-Met是一种具有酪氨酸激酶活性的跨膜受体, 是肝细胞生长因子(hepatocyte growth factor, HGF)的天然受体. HGF与c-Met的Tyr-1234/1235具有催化活性的结构域结合, 并使其发生磷酸化, 从而引起c-Met活化. 当c-Met激活后, 会引起下游多条信号通路活化, 如PI3K/Akt和MEK/ERK等, 通过这些信号通路, HGF/c-Met通路调控着细胞的增殖、分化和迁移. 多种肿瘤的发生、发展都与HGF/c-Met信号通路异常活化有关.
秦建民, 主任医师, 上海中医药大学附属普陀医院普外科
糖基化修饰是大多数蛋白质成熟加工一个重要环节. 糖蛋白的N-糖基化修饰在其折叠、细胞内转运、分泌及功能方面都起到重要作用. 本研究c-Met的糖基化修饰对其功能的影响.
c-Met是一种具有酪氨酸激酶活性的跨膜受体, 是肝细胞生长因子的天然受体. 酪氨酸1234和1235位点的磷酸化调控决定了c-Met的活性, 除了HGF外, Tyr-1349/1356的磷酸化还受到多种因素的调控.
本研究在MHCC-97H和RBE 细胞中c-Met的糖基化修饰对其功能的影响以及细胞定位.
本研究对于阐明HGF/c-Met信号通路在肿瘤发生、发展中确切机制及其分子靶向治疗方面具有重要的理论研究价值.
成熟的c-Met: c-Met前体(pre-Met)经过翻译后加工修饰, 包括糖基化、二硫键的形成及蛋白酶的裂解形成成熟的c-Met.
本研究内容丰富、结果详实, 初步揭示了pro-Met的N-糖基化修饰在肿瘤细胞HGF/c-Met信号通路中对c-Met功能的影响, 从而对c-Met下游PI3K/Akt和 MEK/ERK两条信号通路影响, 导致肿瘤细胞增殖、分化和迁移等生物学行为的改变. 研究对于阐明HGF/c-Met信号通路在肿瘤发生、发展中确切机制及其分子靶向治疗方面具有重要的理论研究价值.
编辑 郭鹏 电编 鲁亚静
| 1. | Dai R, Li J, Fu J, Chen Y, Yu L, Zhao X, Qian Y, Zhang H, Chen H, Ren Y. Disturbance of Ca2+ homeostasis converts pro-Met into non-canonical tyrosine kinase p190MetNC in response to endoplasmic reticulum stress in MHCC97 cells. J Biol Chem. 2012;287:14586-14597. [PubMed] [DOI] |
| 2. | Ferracini R, Longati P, Naldini L, Vigna E, Comoglio PM. Identification of the major autophosphorylation site of the Met/hepatocyte growth factor receptor tyrosine kinase. J Biol Chem. 1991;266:19558-19564. [PubMed] |
| 3. | Crider SE, Holbrook RJ, Franz KJ. Coordination of platinum therapeutic agents to met-rich motifs of human copper transport protein1. Metallomics. 2010;2:74-83. [PubMed] [DOI] |
| 5. | Dai RY, Chen Y, Fu J, Dong LW, Ren YB, Yang GZ, Qian YW, Cao J, Tang SH, Yang SL. p28GANK inhibits endoplasmic reticulum stress-induced cell death via enhancement of the endoplasmic reticulum adaptive capacity. Cell Res. 2009;19:1243-1257. [PubMed] [DOI] |
| 7. | Pant S, Saleh M, Bendell J, Infante JR, Jones S, Kurkjian CD, Moore KM, Kazakin J, Abbadessa G, Wang Y. A Phase I Dose Escalation Study of Oral c-MET Inhibitor Tivantinib (ARQ 197) in Combination with Gemcitabine in Patients with Solid Tumors. Ann Oncol. 2014; Apr 15. [Epub ahead of print]. [PubMed] |
| 8. | Li H, Hu H, Wang R, Pan Y, Wang L, Li Y, Zhang Y, Ye T, Zhang Y, Li B. Primary concomitant EGFR T790M mutation predicted worse prognosis in non-small cell lung cancer patients. Onco Targets Ther. 2014;7:513-524. [PubMed] [DOI] |
| 9. | Leung KK, Hause RJ Jr, Barkinge JL, Ciaccio MF, Chuu CP, Jones RB. Enhanced prediction of SH2 domain binding potentials using a fluorescence polarization-derived c-Met, c-Kit, ErbB, and androgen receptor interactome. Mol Cell Proteomics. 2014; Apr 12. [Epub ahead of print]. [PubMed] |
| 10. | Zhang W, Ai J, Shi D, Peng X, Ji Y, Liu J, Geng M, Li Y. Discovery of novel c-Met inhibitors bearing a 3-carboxyl piperidin-2-one scaffold. Molecules. 2014;19:2655-2673. [PubMed] [DOI] |
| 11. | You H, Ding W, Dang H, Jiang Y, Rountree CB. c-Met represents a potential therapeutic target for personalized treatment in hepatocellular carcinoma. Hepatology. 2011;54:879-889. [PubMed] [DOI] |
| 13. | Pandit VU, Arbuj SS, Mulik UP, Kale BB. Novel functionality of organic 6,13-Pentacenequinone as a photocatalyst for hydrogen production under solar light. Environ Sci Technol. 2014;48:4178-4183. [PubMed] [DOI] |
| 14. | Kwon Y, Smith BD, Zhou Y, Kaufman MD, Godwin AK. Effective inhibition of c-MET-mediated signaling, growth and migration of ovarian cancer cells is influenced by the ovarian tissue microenvironment. Oncogene. 2013; Dec 23. [Epub ahead of print]. [PubMed] [DOI] |
| 15. | Salvi A, Conde I, Abeni E, Arici B, Grossi I, Specchia C, Portolani N, Barlati S, De Petro G. Effects of miR-193a and sorafenib on hepatocellular carcinoma cells. Mol Cancer. 2013;12:162. [PubMed] [DOI] |
| 16. | Giordano S, Di Renzo MF, Narsimhan RP, Cooper CS, Rosa C, Comoglio PM. Biosynthesis of the protein encoded by the c-met proto-oncogene. Oncogene. 1989;4:1383-1388. [PubMed] |
| 17. | Ambasta RK, Ai X, Emerson CP. Quail Sulf1 function requires asparagine-linked glycosylation. J Biol Chem. 2007;282:34492-34499. [PubMed] |
| 18. | Branza-Nichita N, Lazar C, Dwek RA, Zitzmann N. Role of N-glycan trimming in the folding and secretion of the pestivirus protein E(rns). Biochem Biophys Res Commun. 2004;319:655-662. [PubMed] |
| 19. | Voolstra O, Huber A. Post-Translational Modifications of TRP Channels. Cells. 2014;3:258-287. [PubMed] [DOI] |
| 20. | Eichler J, Arbiv A, Cohen-Rosenzweig C, Kaminski L, Kandiba L, Konrad Z. N-glycosylation in Haloferax volcanii: adjusting the sweetness. Front Microbiol. 2013;4:403. [PubMed] [DOI] |
| 21. | Srivastava A, Somvanshi P, Mishra BN. Reconstruction and visualization of carbohydrate, N-glycosylation pathways in Pichia pastoris CBS7435 using computational and system biology approaches. Syst Synth Biol. 2013;7:7-22. [PubMed] [DOI] |
| 22. | Pisarenko OI, Bespalova ZhD, Lankin VZ, Timoshin AA, Serebriakova LI, Shul'zhenko VS, Pelogeĭkina IuA, Studneva IM, Tskitishvili OV, Az'muko AA, Sidorova MV, Pal'keeva ME, Konovalova GG, Chazov EI. [Antioxidant properties of apelin-12 and its structural analogue in experimental ischemia and reperfusion]. Kardiologiia. 2013;53:61-67. [PubMed] |
| 23. | Yang MC, Chen NC, Chen CJ, Wu CY, Mao SJ. Evidence for beta-lactoglobulin involvement in vitamin D transport in vivo--role of the gamma-turn (Leu-Pro-Met) of beta-lactoglobulin in vitamin D binding. FEBS J. 2009;276:2251-2265. [PubMed] [DOI] |
| 24. | Pina AS, Roque AC. Studies on the molecular recognition between bioactive peptides and angiotensin-converting enzyme. J Mol Recognit. 2009;22:162-168. [PubMed] [DOI] |
| 25. | Usatyuk PV, Fu P, Mohan V, Epshtein Y, Jacobson JR, Gomez-Cambronero J, Wary KK, Bindokas V, Dudek SM, Salgia R. Role of c-Met/phosphatidylinositol 3-kinase (PI3k)/Akt signaling in hepatocyte growth factor (HGF)-mediated lamellipodia formation, reactive oxygen species (ROS) generation, and motility of lung endothelial cells. J Biol Chem. 2014;289:13476-13491. [PubMed] |
| 26. | Koivumäki T, Gürbüz G, Poutanen M, Heinonen M. A novel LC-MS application to investigate oxidation of peptides isolated from β-lactoglobulin. J Agric Food Chem. 2012;60:6799-6805. [PubMed] [DOI] |
| 27. | Kawada I, Hasina R, Arif Q, Mueller J, Smithberger E, Husain AN, Vokes EE, Salgia R. Dramatic antitumor effects of the dual MET/RON small-molecule inhibitor LY2801653 in non-small cell lung cancer. Cancer Res. 2014;74:884-895. [PubMed] [DOI] |
| 28. | Eisele F, Wolf DH. Degradation of misfolded protein in the cytoplasm is mediated by the ubiquitin ligase Ubr1. FEBS Lett. 2008;582:4143-4146. [PubMed] [DOI] |
| 29. | Heck JW, Cheung SK, Hampton RY. Cytoplasmic protein quality control degradation mediated by parallel actions of the E3 ubiquitin ligases Ubr1 and San1. Proc Natl Acad Sci U S A. 2010;107:1106-1111. [PubMed] [DOI] |
| 30. | Guerriero CJ, Weiberth KF, Brodsky JL. Hsp70 targets a cytoplasmic quality control substrate to the San1p ubiquitin ligase. J Biol Chem. 2013;288:18506-18520. [PubMed] [DOI] |