修回日期: 2013-11-11
接受日期: 2013-12-04
在线出版日期: 2014-01-18
目的: 探讨DNA修复蛋白RAD52在胃癌及癌旁组织中的表达, 以及其表达水平与胃癌临床病理特征的关系.
方法: 应用免疫组织化学法和蛋白免疫印迹法分别检测RAD52蛋白在胃癌组织及其癌旁组织的表达情况, 并分析RAD52蛋白的表达与胃癌患者临床资料之间的相关性.
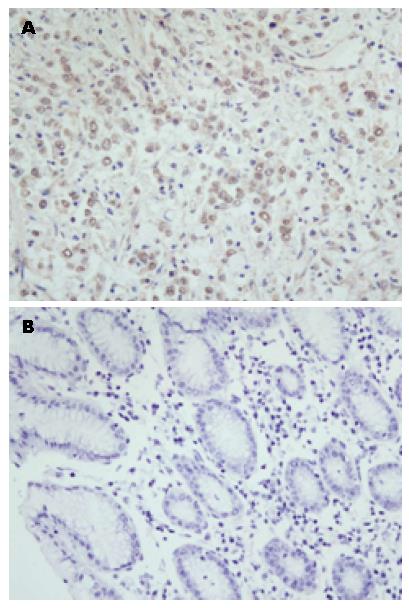
结果: 免疫组织化学结果显示RAD52主要表达于细胞核, 胃癌组织中RAD52的表达阳性率明显高于癌旁组织, 分别为76.67%(46/60)和6.67%(4/60), 差异有显著性(P<0.01), 蛋白免疫印迹的结果与免疫组织化学的结果一致. 此外, RAD52表达与患者的年龄、性别、淋巴结转移及肿瘤大小无关(P>0.05); 但其表达与临床分期相关, Ⅲ、Ⅳ期患者的阳性率高于Ⅰ、Ⅱ期患者(P<0.05).
结论: RAD52在胃癌的发生、发展中可能起重要作用, 他可能成为临床诊断和治疗胃癌的一个潜在靶点.
核心提示: RAD52蛋白在维持基因组稳定性、抑制肿瘤发生等方面具有重要作用. 本研究从组织水平观察了RAD52在胃癌及其对应癌旁组织中的表达情况, 分析其与临床病理特征的关系, 初步探讨其临床意义, 为胃癌的临床诊断提供新思路.
引文著录: 刘坤, 杨小丽, 窦东伟, 吕文鑫, 李萍, 吴华, 吕小平, 何敏. DNA修复蛋白RAD52在胃癌中的表达及意义. 世界华人消化杂志 2014; 22(2): 239-243
Revised: November 11, 2013
Accepted: December 4, 2013
Published online: January 18, 2014
AIM: To investigate the expression of RAD52 in human gastric cancer (GC) and adjacent gastric tissues, and to explore the correlation between expression of RAD52 and clinicopathological characteristics of GC.
METHODS: Immunohistochemistry and Western blot were employed to examine the expression of RAD52 in GC and adjacent non-cancerous tissues obtained from surgical specimens of GC patients who underwent gastric resections at our hospital. The correlation between expression of RAD52 and clinicopathologic features of GC was analyzed.
RESULTS: RAD52 was mainly located in the nucleus, and the positive rate of RAD52 expression was significantly higher in GC tissues than in adjacent non-cancerous tissues (76.67% vs 6.67%, P < 0.01). Similar results were obtained in Western blot analysis. RAD52 expression was significantly correlated with clinical stage, but not with gender, age, lymph node metastasis or tumor size (P > 0.05 for all). The positive rate of RAD52 expression in stage I-II GC was significantly lower than that in stage III-ⅣGC (50% vs 85%, P < 0.05).
CONCLUSION: RAD52 may play a critical role in tumor genesis of GC. RAD52 may be a potential marker for clinical diagnosis and treatment of GC.
- Citation: Liu K, Yang XL, Dou DW, lv WX, Li P, Wu H, Lv XP, He M. Clinical significance of expression of RAD52 in gastric cancer. Shijie Huaren Xiaohua Zazhi 2014; 22(2): 239-243
- URL: https://www.wjgnet.com/1009-3079/full/v22/i2/239.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i2.239
DNA双链断裂(DNA double-strand breaks, DSBs)是真核生物最严重的DNA损伤之一[1]. 如果DSBs不能及时准确地修复, 将导致细胞凋亡、死亡及肿瘤的发生[2]. RAD52蛋白是DSBs修复的一个重要因子, 其在维持基因组稳定性、抑制肿瘤发生等方面具有重要作用[3]. 已有研究表明RAD52在多种肿瘤中异常表达, 但胃癌中未见相关报道. 本研究从组织水平观察了RAD52在胃癌的表达情况, 并初步探讨其临床意义.
收集2008-01/2011-03于广西医科大学胃肠腺体外科进行手术切除的胃癌组织标本60例, 所取得标本均通过了广西医科大学第一附属医院伦理委员会的批准, 全部患者均知情同意. 其中男34例, 女26例; 年龄45-76岁, 平均年龄为55.85岁±7.24岁. 所有患者术前未接受化疗、放疗、免疫治疗以及其他针对肿瘤的治疗. 按照国际抗癌联盟2002年TNM分期标准进行肿瘤分期.
1.2.1 HE染色: 同一个体标本分别于癌及距癌组织边缘5 cm取材, 经40 g/L甲醛固定, 石蜡包埋, 5 μm连续切片, 常规HE染色.
1.2.2 免疫组织化学染色: 采用SP法检测RAD52的表达. 鼠RAD52单克隆抗体购自美国Genetex公司(工作浓度1:500), SP即用型试剂盒购自北京中杉生物公司, 检测方法按试剂盒说明书进行. 每批染色均设已知阳性切片作阳性对照, 用磷酸盐缓冲液(phosphatic buffered saline, PBS)代替一抗作阴性对照.
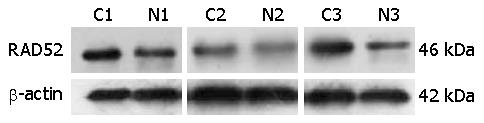
1.2.3 蛋白免疫印迹分析: 分别提取胃癌组织及其对应癌旁组织的总蛋白, 定量, 聚丙烯酰胺凝胶电泳. 蛋白分离后, 电转到PVDF膜. 5%脱脂奶粉的TBS室温封闭1 h, 一抗(1:1000)4 ℃摇床孵育过夜; TBS洗膜后二抗(1:5000)室温1 h; 再次洗膜, 化学发光, 显影, 定影.
1.2.4 结果判定: 每张切片由2名病理医师双盲随机观察. 100倍镜头下随意选取10个视野, 400倍镜头下在每一视野中连续计数100个癌细胞, 记录其中阳性细胞数, 计算阳性细胞百分数, 取平均数. 根据样本阳性细胞百分比和染色强度综合评分, 10个随机高倍镜视野下, 无阳性细胞计0分, <25%计1分, 25%-50%计2分, 51%-75%计3分, >75%计4分. 染色强度计分: 未着色0分, 淡黄色1分, 棕黄色2分, 棕褐色3分. 根据样本阳性细胞百分比和染色强度计分之和的结果分为: 0-3分为阴性, ≥4分为阳性.
统计学处理 采用SPSS19.0统计软件对实验数据进行统计分析. 比较组间差异的显著性采用Wilcoxon秩和检验及配对t检验; 免疫组织化学结果与临床病理特征比较采用四格表χ2检验. 统计分析检验水准为α = 0.05, P<0.05为差异有统计学意义.
胃癌Ⅰ期2例, Ⅱ期18例, Ⅱ-Ⅲ期3例, Ⅲ期37例, 均符合原病理诊断.
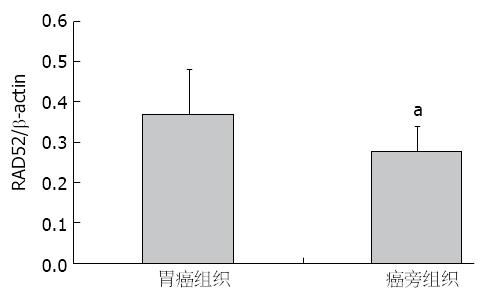
RAD52蛋白主要在胞核中表达, 在60例胃癌中的阳性率为76.67%(46/60), 在其对应的癌旁组织中的阳性率为6.67%(4/60), 表达具有显著差异(P<0.01)(表1, 图1). 蛋白免疫印迹(图2)的灰度值分析显示, RAD52与β-actin的比值在胃癌及其癌旁细胞分别为0.37±0.11、0.28±0.06 (P<0.01)(图3).
RAD52表达与患者的年龄、性别、淋巴结转移及肿瘤大小无关(P>0.05); Ⅰ、Ⅱ期胃癌组织中RAD52蛋白的阳性表达率和表达水平明显低于Ⅲ、Ⅳ期, 差异有统计学意义(P<0.05)(表2).
胃癌是世界范围内最常见的恶性肿瘤之一, 严重危害人们生命健康. 其发生发展是一个多因素、多阶段和多基因变异累及的复杂过程, 发病机制尚不清楚. 深入研究胃癌的发生机制, 探索新的药物治疗靶点对胃癌治疗具有重要意义.
DSBs损伤修复失败被认为是发生肿瘤的一个重要原因, 哺乳动物中主要通过同源重组(homologous recombination, HR)和非同源末端连接(non-homologous end joining, NHEJ)修复DSBs[4,5]. RAD52是同源重组修复途径中的一个关键蛋白, 最初是从对放射线极度敏感的突变酵母菌株分离鉴定的, 包含471个氨基酸[6]. 他在真核细胞中基因序列差别不大; 但在原核细胞中基因序列差别较大[7]. RAD52在体内通过形成多聚体的环, 既可以连接DNA链末端又可以促进互补链的退火[8]. 酵母的RAD52蛋白形成寡聚体, 结合到ssDNA, 通过RAD51介导的链入侵反应DSBs发挥作用[9,10]. 在这些过程中, 多种蛋白涉及了这一调节过程, 如RAD51、RAD54、RAD55、53BP1和KU70等, 协助其功能的完成[11,12]. 人的RAD52同源物也已经被鉴定, 与酵母的RAD52有30%相同, 58%的同源性; 功能基本与酵母中的相同[13]. RAD52在多细胞的真核生物中高度保守. 目前发现RAD52表达异常与肿瘤相关, 在乳腺癌、卵巢癌、白血病、肺癌等肿瘤中检测到RAD52表达异常[14-16]. RAD52已成为某些肿瘤潜在的治疗靶点[3,14].
本实验结果显示, RAD52在胃癌组织中异常表达, 其阳性表达率高于对应的癌旁组织; 提示胃癌组织中DSBs增加, 与RAD52相关的DNA修复机制活跃. 增加的RAD52帮助癌细胞修复更多的DNA损伤, 使本应在正常生理状态下出现的凋亡或者坏死的癌细胞得以保存; 同时, NA修复能力增强后, 使因DNA损伤造成的癌细胞凋亡减少; 同时由于保真性较差的DNA修复方式活跃, 而促使DNA突变产生及保留下来的概率增加. 强大的DNA修复能力无疑是癌细胞难以消灭的原因之一. 进一步的实验发现, RAD52的阳性率与胃癌的分期成正相关, 即随着癌的进展, RAD52在细胞中的阳性表达率增加. 此结果表明, RAD52的高表达与胃癌的发生、发展密切相关, 通过检测胃癌组织中RAD52的表达情况, 可能对肿瘤发生作出预警, 也可能对肿瘤的进展进行判断和预测.
总之, 本研究显示RAD52在胃癌中高表达, 并与胃癌的进展密切相关, 提示RAD52与胃癌发生有关, 可能是胃癌的一个早期诊断的参考指标. 但肿瘤的发生、发展过程受多种因素的影响, 是多种蛋白相互协调、相互作用的结果. 对于RAD52的具体作用机制, 仍有待于深入研究.
RAD52蛋白是DNA双链断裂(DNA double-strand breaks, DSBs)修复的一个重要因子, 在维持基因组稳定性、抑制肿瘤发生等方面具有重要作用. RAD52蛋白在人类的许多肿瘤中异常表达, 而在胃癌中的研究, 国内外尚未见文献报道.
陈洪, 医学博士, 主任医师, 副教授, 硕士研究生导师, 东南大学附属中大医院消化科
本文通过研究RAD52在胃癌及其对应癌旁组织中的表达水平, 寻找RAD52与胃癌发生、发展的关系, 为早期胃癌的诊疗提供新思路.
有研究报道RAD52在乳腺癌、卵巢癌、白血病及肺癌中异常表达.
本研究采用免疫组织化学法及蛋白免疫印迹法检测RAD52在胃癌及其对应癌旁组织中的表达, 分析其与临床病理特征的关系, 以期为胃癌的诊断提供参考依据.
通过理解RAD52与胃癌的关系, 未来临床可采用检测RAD52的水平来筛查是否有胃癌的发生. 了解其动态水平的变化, 可采取相应的辅助检查手段, 协助疾病的诊断.
本文研究DNA修复蛋白RAD52在胃癌及癌旁组织中的表达, 并分析其表达水平与胃癌临床病理特征之间的关系, 对胃癌临床诊断和治疗具有一定价值.
编辑: 郭鹏 电编:闫晋利
| 1. | Davis AJ, Chen DJ. DNA double strand break repair via non-homologous end-joining. Transl Cancer Res. 2013;2:130-143. [PubMed] [DOI] |
| 2. | Goodarzi AA, Jeggo PA. The repair and signaling responses to DNA double-strand breaks. Adv Genet. 2013;82:1-45. [PubMed] [DOI] |
| 3. | Allen C, Ashley AK, Hromas R, Nickoloff JA. More forks on the road to replication stress recovery. J Mol Cell Biol. 2011;3:4-12. [PubMed] [DOI] |
| 4. | Metzger MJ, Stoddard BL, Monnat RJ. PARP-mediated repair, homologous recombination, and back-up non-homologous end joining-like repair of single-strand nicks. DNA Repair (Amst). 2013;12:529-534. [PubMed] [DOI] |
| 5. | Yang X, Zou P, Yao J, Yun D, Bao H, Du R, Long J, Chen X. Proteomic dissection of cell type-specific H2AX-interacting protein complex associated with hepatocellular carcinoma. J Proteome Res. 2010;9:1402-1415. [PubMed] [DOI] |
| 6. | Mortensen UH, Erdeniz N, Feng Q, Rothstein R. A molecular genetic dissection of the evolutionarily conserved N terminus of yeast Rad52. Genetics. 2002;161:549-562. [PubMed] |
| 7. | Spies M. There and back again: new single-molecule insights in the motion of DNA repair proteins. Curr Opin Struct Biol. 2013;23:154-160. [PubMed] [DOI] |
| 8. | Eckert-Boulet N, Lisby M. Regulation of rDNA stability by sumoylation. DNA Repair (Amst). 2009;8:507-516. [PubMed] [DOI] |
| 9. | Lok BH, Powell SN. Molecular pathways: understanding the role of Rad52 in homologous recombination for therapeutic advancement. Clin Cancer Res. 2012;18:6400-6406. [PubMed] [DOI] |
| 10. | Lok BH, Carley AC, Tchang B, Powell SN. RAD52 inactivation is synthetically lethal with deficiencies in BRCA1 and PALB2 in addition to BRCA2 through RAD51-mediated homologous recombination. Oncogene. 2013;32:3552-3558. [PubMed] [DOI] |
| 11. | Krogh BO, Symington LS. Recombination proteins in yeast. Annu Rev Genet. 2004;38:233-271. [PubMed] [DOI] |
| 12. | Henrique Barreta M, Garziera Gasperin B, Braga Rissi V, de Cesaro MP, Ferreira R, de Oliveira JF, Gonçalves PB, Bordignon V. Homologous recombination and non-homologous end-joining repair pathways in bovine embryos with different developmental competence. Exp Cell Res. 2012;318:2049-2058. [PubMed] [DOI] |
| 14. | Powell SN, Kachnic LA. Therapeutic exploitation of tumor cell defects in homologous recombination. Anticancer Agents Med Chem. 2008;8:448-460. [PubMed] [DOI] |