修回日期: 2014-05-20
接受日期: 2014-05-29
在线出版日期: 2014-07-08
目的: 研究siRNA基因沉默成纤维细胞生长因子受体(fibroblast growth factor receptor, FGFR)促进胃癌化疗的效果及其作用机制.
方法: 流式细胞仪检测人正常细胞MRC-5和胃癌细胞MGC80-3中FGFR的表达量. 设计合成FGFR特异性siRNA序列, LipofectamineTM 2000转入BGC-823细胞中. 将实验分为对照组、顺铂组、顺铂+siRNA组及siRNA组, 通过MTT法及流式细胞仪检测BGC-823细胞的增值及凋亡, Western blot检测FGFR沉默后相关蛋白表达情况. 建立胃癌裸鼠模型, 转染siRNA后通过荧光定量PCR检测FGFR mRNA表达量, 测量不同分组(模型组、顺铂组和顺铂+siRNA组)瘤体的大小以检测治疗的效果.
结果: 胃癌细胞MGC80-3中FGFR的表达量明显高于人正常细胞MRC-5(P<0.05). 转染siRNA后, 与顺铂组及siRNA组相比, 顺铂+siRNA组显著抑制细胞增殖及促进细胞凋亡(P<0.05), 并且FGFR基因沉默后, 细胞表面FGFR表达量减少, 细胞内Caspase3及Bax表达量提高. 胃癌裸鼠的瘤体在转染siRNA后, FGFR mRNA的表达量明显降低(P<0.05), 且瘤体体积减小, 瘤体衰退率提高(P<0.05).
结论: FGFR特异性siRNA与顺铂联合使用可促进胃癌的治疗效果, 为探索胃癌治疗的新方法奠定了基础.
核心提示: 顺铂与siRNA联合治疗可促进胃癌治疗的效果, 为化疗联合基因治疗的方法奠定了应用基础, 也为未来胃癌治疗提供了一个新的研究方向.
引文著录: 杨雪梅. SiRNA技术沉默成纤维细胞生长因子受体基因促进胃癌化疗的效果及其机制. 世界华人消化杂志 2014; 22(19): 2728-2733
Revised: May 20, 2014
Accepted: May 29, 2014
Published online: July 8, 2014
AIM: To investigate the effect of siRNA-mediated gene silencing of fibroblast growth factor receptor (FGFR) on the chemotherapy effect in a xenograft mouse model of gastric cancer and to explore the possible mechanism.
METHODS: The expression of FGFR in MRC-5 cells and MGC80-3 cells was detected by flow cytometry. The siRNA against FGFR was constructed and transfected into BGC-823 cells via LipofectamineTM 2000. The reduced rate of cell proliferation was assessed by MTT assay, and apoptosis rate was detected by flow cytometry. Western blot was used to detect the protein expression of FGFR, Caspase3 and Bax after gene silencing. A xenograft nude mouse model of gastric cancer was established, and fluorescence quantitative PCR was used to detect FGFR mRNA expression levels after transfection with siRNA. Tumor size was measured to assess the effects of treatment in different groups (model group, cisplatin group, and cisplatin + siRNA group).
RESULTS: The expression of FGFR in MGC80-3 cells was higher than that in MRC-5 cells (P < 0.05). After transfection with siRNA, compared with the cisplatin group and model group, the cisplatin + siRNA group showed significantly inhibited cell proliferation and promoted apoptosis (P < 0.05). After FGFR gene silencing, the expression of FGFR on cell surface decreased and the expression levels of intracellular Caspase3 and Bax improved (P < 0.05). The level of FGFR mRNA expression significantly decreased in tumor-bearing nude mice after siRNA transfection (P < 0.05). Besides, tumor volume decreased and tumor recession rate increased (P < 0.05).
CONCLUSION: SiRNA-mediated FGFR inhibition promotes the therapeutic effect of cisplatin against gastric cancer.
- Citation: Yang XM. SiRNA-mediated silencing of fibroblast growth factor receptor improves chemotherapy effect in a xenograft mouse model of gastric cancer. Shijie Huaren Xiaohua Zazhi 2014; 22(19): 2728-2733
- URL: https://www.wjgnet.com/1009-3079/full/v22/i19/2728.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i19.2728
胃癌是最常见的恶性肿瘤之一, 其死亡率在世界范围之内一直居高不下[1]. 传统的治疗手段除了手术之外, 还有放化疗. 但由于手术切除率低, 放化疗不良反应大, 肿瘤多药耐药等缺点, 使得当前传统胃癌治疗的疗效仍难以令人满意. 因此, 寻找一种新的胃癌治疗方法成为目前胃癌研究中的一个重要课题.
成纤维细胞生长因子受体(fibroblast growth factor receptor, FGFR)是免疫球蛋白基因超家族成员, 其通过与FGFs结合而产生多种生物学效应[2]. 研究表明, FGFRs基因在胃癌、乳腺癌、前列腺癌、胰腺癌等组织中表达过度, 其可能与多种恶性肿瘤的发生、发展有密切关系[3-8].
干扰RNA技术是一种由双链RNA所引起的序列特异性基因沉默技术. 目前, 该技术作为一种抗癌新疗法, 被广泛应用于各种肿瘤研究[9,10]. 在胃癌治疗方面, 其不仅可以直接作用于胃癌的靶向基因, 而且可以通过抑制肿瘤血管的新生间接地治疗胃癌, 并且对胃癌化疗多药耐药也起到了一定作用[11].
本研究将胃癌BGC-823细胞进行顺铂化疗处理及FGFR特异性siRNA转染处理, 分析siRNA基因沉默FGFR及顺铂化疗对BGC-823细胞的增殖、凋亡及相关蛋白表达的影响, 并通过建立胃癌裸鼠模型, 证明siRNA基因沉默FGFR与顺铂联用对胃癌瘤体的衰退有促进作用.
♂Balb(nu/nu)无胸腺裸鼠60只, 4-6周龄, 体质量18 g±2 g, 由国家医药管理局上海医药工业研究所提供. 实验鼠在SPF条件下繁殖、饲养. 人正常细胞MRC-5和胃癌细胞MGC80-3购自中国科学院上海细胞究所. siRNA基因片段由珠海英平生物技术有限公司合成. RPMI 1640培养液、胎牛血清(美国Gibco公司); LipofectamineTM 2000脂质体转染试剂(美国Invitrogen公司); 顺铂(江苏瑞安医药公司); MTT试剂、DMSO试剂、AnnexinV试剂及PI试剂(Sigma公司); 抗体(上海优宁维公司). 流式细胞仪(美国Coulter公司); 酶标仪(Thermo公司).
1.2.1 细胞培养: 将人正常细胞MRC-5和胃癌细胞MGC80-3培养在含有10%胎牛血清的RPMI 1640培养液中, 放置在饱和湿度5%CO2, 37 ℃恒温培养箱中培养, 每2 d传代1次.
1.2.2 流式细胞仪检测细胞表面FGFR表达量: MRC-5细胞和MGC80-3细胞培养至48 h时, 收集细胞, 制成单细胞悬液, 调节密度至约1×106 cells/管. 用PBS液洗细胞两遍, 加15%小牛血清200 μL孵育30 min以封闭非特异性抗体. PBS洗两遍, 加FGFR-单克隆抗体200 μL(0.5 mg/mL), 室温孵育1.5 h. 加IgG-FITC 200 μL(0.5 mg/mL), 室温孵育45 min, 洗涤后流式细胞仪上机检测, 实验重复3次.
1.2.3 siRNA设计、合成及转染: 根据Genbank中提供的FGFR相关信息, 应用相应计算机软件设计靶向FGFR mRNA序列的21个碱基组成的核苷酸链, 序列为: 5'-AAGTCGGACGCAACAGAGAAA-3', 同时合成互补链, 经退火形成双链RNA, 即特异性siRNA分子. 阴性对照siRNA序列为: 5'-CGAACGCGGUAUACUUCGADTDT-3', 此序列不与人类任何基因序列同源. 实验时取对数生长期MGC80-3细胞, 以2×105 cells/孔的密度接种于24孔板中, 当细胞密度达70%时, 按LipofectamineTM 2000试剂盒的说明书, 以脂质体法进行转染. 实验组分为四组: (1)MGC80-3细胞对照组; (2)MGC80-3+顺铂化疗组; (3)MGC80-3+顺铂+siRNA组; (4)MGC80-3+siRNA组. 其中顺铂的浓度为2 μg/L.
1.2.4 MTT法测定细胞增殖: 取各实验组中处于对数生长期的细胞, 以5×104个/mL的细胞密度接种于96孔培养板中. 各组在培养48 h后, 每孔加入20 μL的MTT溶液, 置于37 ℃条件下培养4 h. 吸出上清液后, 每孔加入200 μL DMSO溶液中止反应, 待紫色结晶完全溶解后, 用酶标仪在492 nm处测定每孔的A值, 从而计算增殖抑制率, 增值抑制率(%) = (1-实验组A值/对照组A值)×100%.
1.2.5 流式细胞仪测定细胞凋亡: 取各实验组中处于对数生长期的细胞, PBS洗涤两次后, 加入100 μL AnnexinV Binding Buffer轻轻重悬细胞, 后将5 μL AnnexinV加入到95 μL AnnexinV Binding Buffer中, 轻轻混匀. 室温避光孵育15 min后离心弃上清, 加入100 μL AnnexinV Binding Buffer轻轻重悬细胞. 将10 μL PI染色液加入到90 μL AnnexinV Binding Buffer中, 混匀后冰上避光孵育5 min, 用流式细胞仪在488 nm处检测, 软件分析细胞凋亡率, 细胞凋亡率为早期凋亡细胞和中晚期凋亡细胞之和. 重复检测3次.
1.2.6 Western blot法检测细胞内蛋白表达: 提取各实验组细胞总蛋白, 测定蛋白含量定量后, 于100 ℃水浴5 min使蛋白变性, 进行8%SDS-PAGE电泳. 电泳后蛋白转移至PVDF膜上, 5%脱脂牛奶室温封闭1 h, 加入相关蛋白一抗, 于4 ℃孵育过夜. 次日用TBST洗涤膜3次, 后加入相关蛋白二抗, 于37 ℃孵育45 min, TBST洗涤3次后, 在暗室中压片、显影、定影. 图像应用Alpha Imager 2200软件进行分析.
1.2.7 胃癌裸鼠肿瘤模型的建立及瘤体体积测定: 取对数生长期细胞MGC80-3, 以2×107 cells/只的细胞密度接种于Balb(nu/nu)裸鼠腋下皮下, 建立移植瘤模型. 待裸鼠瘤体长至1 cm时, 将裸鼠分为3组, 每组20只, 分别为: (1)模型组, 每只老鼠注射200 μL的RPMI 1640培养液; (2)顺铂组, 每只老鼠注射100 μL(2 μg/L)顺铂和100 μL RPMI 1640培养液; (3)顺铂+siRNA组, 每只老鼠注射100 μL(2 μg/L)和100 μL siRNA脂质体混合物. 注射3 d后将裸鼠处死, 测量瘤体体积并计算瘤体衰退率, 衰退率 = (1-实验组/模型组)×100%.
1.2.8 荧光定量PCR检测瘤体中FGFR mRNA的表达量: 转染24 h后, 各实验组处死10只裸鼠, 取移植瘤组织. 用TRIzol法提取总RNA, 然后用逆转录试剂盒转录形成cDNA进行荧光定量 PCR扩增FGFR和内参GAPDH, 反应体系为: 2×PCR buffer 25 μL, Primers(25 μmol/L)1.2 μL, 2×SYBR Green I 0.3 μL, DNA模板1 μL, dH2O 22.5 μL; 扩增条件: 94 ℃ 4 min, 94 ℃ 20 s, 60 ℃ 30 s, 72 ℃ 30 s循环35次, 72 ℃检测信号. FGFR引物序列: 正义5'-GCTTAGCTGCTGTGGCAATG-3', 反义5'-CCCACTTTGGGTCTGTGTCA-3', 扩增片断长度386 bp; GAPDH: 正义5'-GCACCGTCAAGGCTGAGAAC-3', 反义5'-ATGGTGGTGAAGACGCCAGT-3', 扩增片断长度142 bp.
统计学处理 采用SPSS11.0统计软件处理数据, 数据用mean±SD表示, 结果比较用t检验. P<0.05为差异有统计学意义.
通过流式细胞仪检测发现, 细胞MGC80-3中FGFR的荧光强度较高, gate值为35.76%±1.28%, 细胞MRC-5的荧光强度较高较低, gate值为13.69%±2.15%, 表明胃癌细胞MGC80-3中FGFR的表达量高于人正常细胞中FGFR的表达量(P<0.05).
如表1所示, 与对照组相比, 顺铂组、顺铂+siRNA组及siRNA组的增殖抑制率均显著增高(P<0.05). 其中, 顺铂+siRNA组对细胞BGC-823增殖抑制率最高, 而顺铂组增殖抑制率又略高于siRNA组的增殖抑制率. 由此可知, 顺铂+siRNA联合使用可明显抑制细胞BGC-823的增殖, 而单独使用化疗药物顺铂的增殖抑制率又优于单独使用siRNA.
如表2所示, 顺铂组、顺铂+siRNA组及siRNA组中细胞BGC-823的凋亡率均显著高于对照组(P<0.05). 顺铂组细胞BGC-823凋亡率仅为顺铂+siRNA组的64.5%, 而顺铂组的细胞凋亡率又是siRNA组的1倍. 由此可知, 顺铂+siRNA联合使用可显著促进细胞BGC-823的凋亡, 而顺铂组的凋亡率又优于siRNA组.
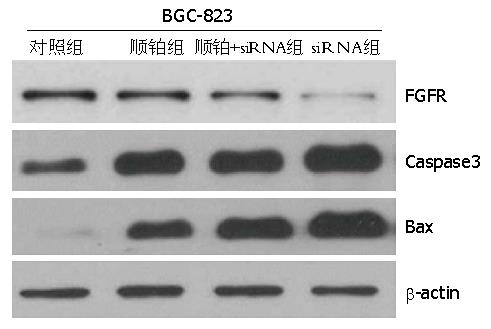
通过Western blot检测FGFR与相关凋亡相关蛋白Caspase3、Bax的表达发现, 与对照组相比, 各实验组中FGFR的表达均下调, 而Caspase3、Bax的表达均上调, 其中顺铂+siRNA组的差异性最明显(P<0.05). 与顺铂组相比, siRNA组的FGFR表达量较低, 但Caspase3表达量较高(P<0.05). 说明与化疗相比, FGFR特异性siRNA可明显沉默FGFR的表达, 激活死亡受体途径相关蛋白表达, 从而诱导细胞凋亡(图1).
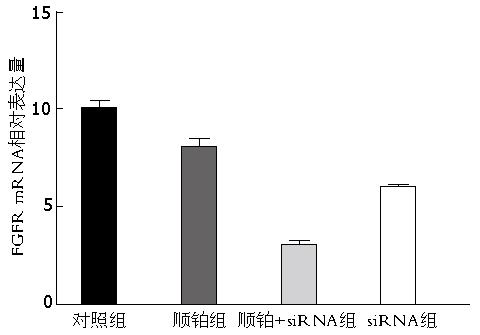
经荧光定量PCR可知, 顺铂组和顺铂+siRNA组裸鼠瘤体中FGFR mRNA的相对表达量均低于模型组, 其中顺铂+siRNA组的FGFR mRNA相对表达量最低, 仅为对照组的一半(P<0.05), 而顺铂组的FGFR mRNA的相对表达量仅略低于模型组(P>0.05). 表明, FGFR特异性siRNA在实体瘤中的转染效率高, 24 h内即可明显降低FGFR mRNA的表达量(图2).
目前, 针对胃癌这种高发性癌症疾病, 主要的治疗手段除了手术以外, 还有化疗. 虽然当前化疗药物众多, 但多数效率低. 顺铂就是胃癌化疗方案中的常用药之一, 他可以使DNA损伤, 破坏DNA复制, 具有抗肿瘤活性. 但临床所使用的化疗药物除了诱导肿瘤细胞凋亡以外, 还同时杀伤正常细胞, 严重影响了化疗的耐受性和依从性. 因此, 根据患者的基因分型而制定的胃癌用药治疗将是未来努力的方向[12], 而RNA干扰技术所具有的基因高度特异性特点, 为他在未来肿瘤化疗中的应用奠定了基础. 研究表明, 干扰RNA技术可特异性地抑制原癌基因、癌症相关基因或突变基因的过度表达, 从而抑制肿瘤的发生、发展[13]. 此外, siRNA化学性质的高度稳定性, 抑制作用的迅速性和无药物抑制剂毒副作用等优点, 使其在基因治疗领域中逐渐成为了重要的治疗手段[14].
体内几乎所有组织的细胞表面都含有FGFR, 而恶性肿瘤细胞中FGFR的含量明显增多, 他们可以通过胞外配体结构域与配体成纤维细胞生长因子FGF结合, 刺激细胞的分裂增殖, 从而发挥生物学效应. 本研究根据干扰RNA技术的原理, 合成针对纤维细胞生长因子受体FGFR特定基因序列的小干扰siRNA, 使其与细胞内FGFR mRNA的特定序列结合, 沉默FGFR表达, 使其不能与FGF结合, 从而不能发挥生物学效应, 起到抗癌的作用.
本研究中, 在细胞水平上首先通过流式细胞仪检测人正常细胞MRC-5和胃癌细胞MGC80-3中FGFR的表达量, 证明胃癌细胞中的FGFR表达量高于人正常细胞. 然后根据FGFR基因序列制备特异性siRNA, 通过脂质体转染法将siRNA转入胃癌细胞BGC-823中, 观察顺铂组、siRNA组及顺铂+siRNA组中胃癌细胞的增值及凋亡情况. MTT法与流式细胞仪检测发现, 各实验组中, 顺铂+siRNA组的细胞增殖抑制率及凋亡率最高, 其次是顺铂组, 最后才是siRNA组(P<0.05). 表明, 顺铂化疗比siRNA治疗胃癌的效果好, 但是两者的联合作用可以达到更好的疗效. 通过Western blot检测发现, FGFR作为一种促进肿瘤生长和转移所必需的受体, 在胃癌治疗中也起着关键作用[15]. 在FGFR被siRNA基因沉默后, 其表达量也减少了, 促进抑癌作用的发挥. 此外, 对胃癌细胞的死亡受体相关蛋白Caspase3, Bax的检测发现, 顺铂+siRNA组中他们的表达量也明显增多. 但与顺铂组相比, siRNA组的FGFR表达量较低, Caspase3表达量却较高(P<0.05), 这说明与化疗相比, FGFR特异性siRNA不仅可明显沉默FGFR的表达, 还可以下调FGFR的表达, 激活死亡受体途径相关蛋白表达, 从而诱导细胞凋亡. 在动物中, 本研究将siRNA转入了胃癌裸鼠的实体瘤中, 通过荧光定量PCR测定FGFR mRNA的表达量发现, 向实体瘤中转染FGFR特异性siRNA可明显降低FGFR mRNA 的表达量(P<0.05). 通过对模型组、顺铂组和顺铂+siRNA组裸鼠的瘤体体积的测量, 发现顺铂+siRNA组可以明显减小瘤体体积的大小, 使瘤体衰退率高达75.3%, 比单独使用顺铂化疗组高23.4%(P<0.05), 从而证明相比单独使用顺铂化疗治疗胃癌, 顺铂与siRNA联合治疗可促进胃癌治疗的效果, 为化疗联合基因治疗的方法奠定了应用基础, 也为未来胃癌治疗提供了一个新的研究方向.
胃癌是最常见的恶性肿瘤之一, 其死亡率在世界范围之内一直居高不下. 传统的治疗手段除了手术之外, 还有放化疗. 但由于手术切除率低, 放化疗不良反应大, 肿瘤多药耐药等缺点, 使得当前传统胃癌治疗的疗效仍难以令人满意. 因此, 寻找一种新的胃癌治疗方法成为目前胃癌研究中的一个重要课题.
王小众, 教授, 福建医科大学附属协和医院消化内科
干扰RNA技术是一种由双链RNA所引起的序列特异性基因沉默技术. 目前, 该技术作为一种抗癌新疗法, 被广泛应用于各种肿瘤研究. 在胃癌治疗方面, 其不仅可以直接作用于胃癌的靶向基因, 而且可以通过抑制肿瘤血管的新生间接地治疗胃癌, 并且对胃癌化疗多药耐药也起到了一定作用.
本研究将胃癌BGC-823细胞进行顺铂化疗处理及成纤维细胞生长因子受体(fibroblast growth factor receptor, FGFR)特异性siRNA转染处理, 分析siRNA基因沉默FGFR及顺铂化疗对BGC-823细胞的增殖、凋亡及相关蛋白表达的影响, 并通过建立胃癌裸鼠模型, 证明siRNA基因沉默FGFR与顺铂联用对胃癌瘤体的衰退有促进作用.
因此, 根据患者的基因分型而制定的胃癌用药治疗将是未来努力的方向, 而干扰RNA技术所具有的基因高度特异性特点, 为他在未来肿瘤化疗中的应用奠定了基础.
本文通过siRNA技术沉默FGFR, 探讨胃癌细胞化疗的治疗效果, 有一定科学性与临床意义.
编辑: 田滢 电编:鲁亚静
| 1. | Crew KD, Neugut AI. Epidemiology of gastric cancer. World J Gastroenterol. 2006;12:354-362. [PubMed] [DOI] |
| 2. | Itoh N, Ornitz DM. Fibroblast growth factors: from molecular evolution to roles in development, metabolism and disease. J Biochem. 2011;149:121-130. [PubMed] [DOI] |
| 3. | Roidl A, Foo P, Wong W, Mann C, Bechtold S, Berger HJ, Streit S, Ruhe JE, Hart S, Ullrich A. The FGFR4 Y367C mutant is a dominant oncogene in MDA-MB453 breast cancer cells. Oncogene. 2010;29:1543-1552. [PubMed] [DOI] |
| 4. | Marmé F, Werft W, Benner A, Burwinkel B, Sinn P, Sohn C, Lichter P, Hahn M, Schneeweiss A. FGFR4 Arg388 genotype is associated with pathological complete response to neoadjuvant chemotherapy for primary breast cancer. Ann Oncol. 2010;21:1636-1642. [PubMed] [DOI] |
| 5. | Nan H, Qureshi AA, Hunter DJ, Han J. Genetic variants in FGFR2 and FGFR4 genes and skin cancer risk in the Nurses' Health Study. BMC Cancer. 2009;9:172. [PubMed] [DOI] |
| 6. | Matsumoto K, Arao T, Hamaguchi T, Shimada Y, Kato K, Oda I, Taniguchi H, Koizumi F, Yanagihara K, Sasaki H. FGFR2 gene amplification and clinicopathological features in gastric cancer. Br J Cancer. 2012;106:727-732. [PubMed] [DOI] |
| 7. | Yang F, Zhang Y, Ressler SJ, Ittmann MM, Ayala GE, Dang TD, Wang F, Rowley DR. FGFR1 is essential for prostate cancer progression and metastasis. Cancer Res. 2013;73:3716-3724. [PubMed] [DOI] |
| 8. | Coleman SJ, Chioni AM, Ghallab M, Anderson RK, Lemoine NR, Kocher HM, Grose RP. Nuclear translocation of FGFR1 and FGF2 in pancreatic stellate cells facilitates pancreatic cancer cell invasion. EMBO Mol Med. 2014;6:467-481. [PubMed] [DOI] |
| 9. | Xiong Y, Guo W, Li T, Li K. Influence of survivin-targeted siRNA on the biological features of colorectal carcinoma cells. Front Med China. 2007;1:304-307. [PubMed] [DOI] |
| 10. | Zuo Q, Shi M, Li L, Chen J, Luo R. Development of cetuximab-resistant human nasopharyngeal carcinoma cell lines and mechanisms of drug resistance. Biomed Pharmacother. 2010;64:550-558. [PubMed] [DOI] |
| 11. | Turner N, Grose R. Fibroblast growth factor signalling: from development to cancer. Nat Rev Cancer. 2010;10:116-129. [PubMed] [DOI] |
| 12. | Katoh M, Katoh M. Pharmacogenomics on gastric cancer. Cancer Biol Ther. 2004;3:566-567. [PubMed] |
| 13. | Brummelkamp TR, Nijman SM, Dirac AM, Bernards R. Loss of the cylindromatosis tumour suppressor inhibits apoptosis by activating NF-kappaB. Nature. 2003;424:797-801. [PubMed] [DOI] |
| 15. | 朱 元增, 孙 培春, 吴 刚. 血管内皮生长因子-C在胃癌中表达情况及对淋巴结转移作用. 中华实用诊断与治疗杂志. 2010;24:433-437. |